Аппендицит и COVID-19: новые задачи в эпоху пандемии
Коронавирусную инфекцию COVID-19 характеризует разнообразная клиническая симптоматика, обусловленная поражением не только дыхательной системы, но и других органов. Трудности установления диагноза COVID-19 объясняются отсутствием патогномоничных проявлений, в том числе со стороны респираторного тракта. Сложности диагностики возрастают в случаях течения данной инфекции с абдоминальным болевым синдромом, симулирующим острый аппендицит. В статье представлены данные литературы об особенностях клинической картины COVID-19 при поражении желудочно-кишечного тракта (ЖКТ). Описаны особенности патогенеза коронавирусной инфекции, которые могут объяснять регистрируемые изменения и симптомы; доказательства прямого повреждения эпителиоцитов ЖКТ. Особое внимание уделено возможной дополнительной роли изменений микробиоты в развитии диареи у пациентов с COVID-19 за счет ослабления колонизационной резистентности, снижения продукции полезных бактериальных метаболитов и запуска локальной иммунной перестройки. Представлено клиническое наблюдение пациента, больного коронавирусной инфекцией (выявленной при лабораторном обследовании) без дыхательной недостаточности и признаков респираторного заболевания с флегмонозным аппендицитом, гладким течением при своевременно и адекватно проведенном лечении.
Ключевые слова: коронавирусная инфекция, COVID-19, дети, аппендицит, острый абдоминальный синдром.
Для цитирования: Феклисова Л.В., Ольхова Е.Б., Николаева С.В., Каннер Е.В., Аллахвердиев И.С. Аппендицит и COVID-19: новые задачи в эпоху пандемии. РМЖ. Медицинское обозрение. 2022;30(5):12-16.
Appendicitis and COVID-19: new challenges in a pandemic era
L.V. Feklisova1, E.B. Olkhova2,3, S.V. Nikolaeva4, E.V. Kanner4, I.S. Allakhverdiyev3 1M.F. Vladimirskiy Moscow Regional Research and Clinical Institute, Moscow
2A.I. Yevdokimov Moscow State University of Medicine and Dentistry, Moscow
3St. Vladimir Children’s City Clinical Hospital, Moscow
4Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer
Rights Protection and Human Well-Being, Moscow A variety of clinical symptoms caused by damage both to the respiratory system and other organs characterizes COVID-19. Difficulties in establishing the diagnosis of COVID-19 are explained by the absence of pathognomonic manifestations, including those of the respiratory tract. Difficulties in diagnosis increase in cases of this infection with abdominal pain syndrome, simulating acute appendicitis. The article presents literature data on the clinical picture of COVID-19 in gastrointestinal tract (GIT) disorder. The article also describes the pathogenetic patterns of COVID-19, which can explain the recorded changes and symptoms; evidence of direct damage to intestinal epithelial cells. Particular attention is paid to the possible additional role of microbiota changes in the diarrhea development in patients with COVID-19 (by reduction of colonization resistance, production decrease of beneficial microbial metabolites, and trigger of local immune restructuring). A clinical case of a male patient with COVID-19 (detected during laboratory examination) is presented without respiratory failure and signs of respiratory disease with phlegmonous appendicitis, with mild course because of the timely and adequate treatment.
Keywords: coronavirus infection, COVID-19, children, appendicitis, acute abdominal syndrome.
For citation: Feklisova L.V., Olkhova E.B., Nikolaeva S.V. et al. Appendicitis and COVID-19: new challenges in a pandemic era. RMJ. 2022;5:12–16.
Введение
COVID-19 характеризуется разнообразной клинической картиной, однако наиболее частыми клиническими проявлениями в дебюте болезни являются симптомы поражения респираторного тракта (кашель, катаральные явления), а также лихорадка, потеря обоняния/вкуса [1]. Помимо вышеперечисленных симптомов, нередко выявляются симптомы поражения желудочно-кишечного тракта (ЖКТ): анорексия, рвота, диарея, боль в животе [2–8], причем самым распространенным из них является диарея. По данным различных исследований, распространенность диареи может варьироваться от 2% до 49,5% [9, 10]. По нашим данным, при госпитализации в многопрофильный стационар, не предназначенный для госпитализации больных с SARS-CoV-2-инфекцией, диарея выявлялась в 7,8% случаев (у пациентов жидкий стул наблюдался с поступления, был учащенным до 2–4 раз в сутки, без патологических примесей; бактериальные и вирусные патогены не обнаруживались) [11].
Диарея, связанная с COVID-19, обычно протекает в легкой форме и может быть единственным симптомом болезни. Частота дефекации составляет в среднем 3,3–4,3 раза в сутки, а продолжительность диареи — 3,0–5,4 дня. Однако в некоторых случаях болезнь протекает более тяжело, с частотой дефекации, достигающей 18–30 раз в день [12–15].
Патогенетические механизмы диареи, ассоциированной с COVID-19, можно описать следующим образом. Вирус SARS-CoV-2 может инфицировать и размножаться в клетках пищевода и энтероцитах, что приводит к прямому повреждению эпителия кишечника. Процесс проникновения SARS-CoV-2 в клетки-мишени обеспечивается наличием рецепторов ангиотензинпревращающего фермента 2 (АПФ2), которые экспрессированы на клетках эпителия верхних дыхательных путей, энтероцитах тонкого кишечника, эндотелии сосудов, макрофагах. Проникновение коронавируса в клетки-мишени хозяина зависит от связывания S-белка с клеточным рецептором, где он затем праймируется для проникновения протеазами мембраны клетки-хозяина [16]. SARS-CoV-2 использует рецептор AПФ2 для интернализации и рецептор TMPRSS2 для праймирования S-белка. Также интересно отметить, что белок S SARS-CoV-2 проявляет в 10–20 раз более высокую аффинность к рецепторам по сравнению с белком SARS-CoV. После проникновения вирусная геномная РНК (гРНК) выводится в цитоплазму. После трансляции образуются полипептиды pp1a и pp1ab, которые затем расщепляются вирусными протеазами с образованием неструктурных белков, РНК-зависимой РНК-полимеразы и геликазы, которые образуют комплекс репликаза-транскриптаза с вирусной гРНК. Этот комплекс локализуется во внутриклеточных удвоенных мембранных везикулах, где он опосредует производство (-) смысловой РНК посредством репликации и транскрипции. Во время репликации образуются полноразмерные (-) РНК-копии генома, которые используются в качестве шаблонов для полноразмерных (+) РНК. Субгеномные РНК образуются в результате транскрипции и транслируются в структурные белки, нуклеокапсид, шип, мембрану и оболочку. Белки шипа, мембраны и оболочки поступают в эндоплазматический ретикулум, а нуклео-капсид образует нуклеопротеиновый комплекс с вновь синтезированной (+) гРНК. Они собираются в вирусную частицу в промежуточном отсеке Гольджи эндоплазматического ретикулума, выводятся через аппарат Гольджи и, наконец, высвобождаются путем экзоцитоза в небольших везикулах [16].
Несмотря на то, что основной мишенью SARS-CoV-2 являются альвеолярные клетки II типа и это определяет основные клинические проявления заболевания, наличие рецепторов АПФ2 на мембранах эпителия желудка и энтероцитов предполагает развитие катарального гастроэнтероколита, обусловливающего появление соответствующих симптомов, влияющих на течение COVID-19 [17–20]. В легких вирус вызывает активацию иммунной системы, характеризующуюся выработкой провоспалительных цитокинов и рекрутированием иммунных клеток. Если вирусный клиренс недостаточен, иммунный ответ прогрессирует в направлении развития «цитокинового шторма». В кишечнике вирус вызывает аналогичный иммунный ответ, хотя еще не ясно, достигает ли величина воспалительного ответа того же уровня, что и в легких.
Вирус инфицирует эпителиальные клетки кишечника, вызывая высвобождение цитокинов и хемокинов, провоцируя острое кишечное воспаление, характеризующееся инфильтрацией нейтрофилов, макрофагов и Т-клеток. У пациентов, инфицированных SARS-CoV-2, наблюдается диарея, что может косвенно подтверждать этот тезис. M. Effenberger et al. [21] доказали, что SARS-CoV-2 у пациентов действительно вызывает воспалительный ответ в кишечнике, о чем свидетельствуют повышенный уровень фекального кальпротектина (фекальный биомаркер кишечного воспаления, в значительной степени продуцируемый нейтрофильными гранулоцитами) и системный ответ c повышением содержания IL-6. У пациентов с тяжелой формой COVID-19 с симптомами желчнокаменной болезни, помимо гистологических изменений в кишечнике, также регистрировались пищеводные кровотечения с эрозиями и язвами [22, 23]. Более того, у 73 госпитализированных пациентов с COVID-19 в кале была обнаружена РНК SARS-CoV-2, а в слизистой оболочке ЖКТ — интерстициальный отек, многочисленные инфильтрирующие плазматические клетки и лимфоциты. Кроме того, определялось положительное окрашивание ACE2 и SARS-CoV-2 в эпителии ЖКТ [20]. Было установлено, что человеческий дефенсин 5 (HD5), наиболее распространенный α-дефенсин, специфически секретируемый кишечными клетками Панета, играет важную роль в реализации инфекционного процесса, обусловленного SARS-CoV-2 [24].
Одним из последствий развития иммунного ответа может стать дисбактериоз с распространением провоспалительного состояния. Антигенпрезентирующие клетки участвуют в активации иммунной системы в ответ на различные экзогенные триггеры вируса: SARS-CoV-2 может активировать воспалительные пути, которые имеют сходство с некоторыми иммуноопосредованными заболеваниями, такими как воспалительные заболевания кишечника или ревматоидный артрит [25]. Активность SARS-CoV-2 может вызывать модификации АПФ2 в кишечнике, которые повышают восприимчивость к воспалению кишечника и диарее. АПФ2 оказывает значительное влияние на состав кишечной микробиоты. Первичные воспалительные стимулы способствуют высвобождению в систему кровообращения микробных продуктов и цитокинов, которые могут вызвать микробный дисбиоз и воспалительную реакцию. Изменения микробиоты кишечника могут быть связаны с изменениями в иммунной системе и предрасположенностью к более серьезным последствиям COVID-19. Микробиом человека меняется с возрастом: в первые несколько лет жизни микробиота малоразнообразна и нестабильна, во взрослом возрасте — стабильна и разнообразна, а в пожилом возрасте разнообразие микробиоты уменьшается, и именно это может служить фактором риска заражения COVID-19 для пожилых людей. Установлено, что состав микробиоты кишечника у пациентов с COVID-19 сильно изменен: разнообразие значительно снижено, доля комменсальных бактерий уменьшена, а условно-патогенных микроорганизмов, напротив, увеличена по сравнению с таковой у здоровых людей [26, 27].
В исследовании, проведенном в Гонконге, показано, что преобладание Coprobacillus, Clostridium ramosum и Clostridium hathewayi коррелировало с тяжестью COVID-19, а присутствие Faecalibacterium prausnitzii (противовоспалительной бактерии) показало обратную корреляцию. Bacteroides dorei, Bacteroides thetaiotaomicron, Bacteroides massiliensis и Bacteroides ovatus были связаны с низкой фекальной вирусной нагрузкой SARS-CoV-2 [28].
Согласно метаанализу данных гонконгской группы пациентов, опубликованному в 2020 г., 17,6% пациентов с COVID-19 имеют желудочно-кишечные симптомы, а 48,1% образцов фекалий от пациентов с COVID-19 дали положительный результат на вирусную РНК. В связи с этим следует внимательно относиться к потенциальной желудочно-кишечной инфекции и фекально-оральной передаче вируса [29, 30].
Было обнаружено, что вирусная нагрузка в образцах стула достигает пика позже, обычно через 2–3 нед. после появления симптомов [30]. Нагрузка вирусной РНК в образцах стула, по-видимому, соответствовала уровню в мокроте в 86% (6 из 7) случаев в исследовании, проведенном в Германии [30, 31]. Однако у некоторых пациентов образцы фекалий оставались положительными на наличие вируса даже после того, как в образцах дыхательных путей и/или мокроты вирус не обнаруживался. В некоторых случаях вирусная нагрузка в фекалиях достигала 107 KOE/г [31], что было выше, чем в глоточных мазках. Наличие и персистенцию такого большого количества вирусной РНК в фекалиях вряд ли можно объяснить только проглатыванием вирусных частиц, реплицирующихся в горле, скорее можно предположить кишечную инфекцию SARS-CoV-2.
Детальная характеристика микробиома кишечника может быть полезна для прогнозирования тяжести заболе-вания при COVID-19, и для дальнейшего изучения этого аспекта необходимы крупные проспективные исследования. Использование пробиотиков или пребиотиков может помочь восстановить микробиоту кишечника. Адекватное потребление высококачественных белков, витамина А и жирных кислот с разветвленной цепью может увеличить выработку антител. Потребление диетических компонентов с известными противовоспалительными и антиоксидантными свойствами (омега-3, витамины С, Е и фитохимические вещества, такие как каротиноиды и полифенолы) может помочь ослабить чрезмерную воспалительную реакцию и тем самым предотвратить дисрегулированное иммуноопосредованное повреждение. Низкий уровень витамина D повышает восприимчивость к тяжелым заболеваниям и риск летального исхода. Достаточное потребление клетчатки снижает относительный риск смертности от инфекционных и респираторных заболеваний на 20–40% и связано с более низким риском развития хронической обструктивной болезни легких [32].
Таким образом, измененная микробиота, наблюдаемая у пациентов с COVID-19, может быть дополнительным фактором, способствующим развитию диареи за счет ослабления колонизационной резистентности, снижения продукции полезных бактериальных метаболитов и запуска локальной иммунной перестройки. Резюмируя вышеизложенное, можно выделить вероятные механизмы развития нарушений со стороны ЖКТ при развитии СOVID-19: нарушение кишечного барьера из-за местного воспаления или репликации вируса; нарушение регуляции АПФ2, дефицит которого повышает восприимчивость кишечника к развитию воспаления; изменение состава и функции микробиоты ЖКТ.
Как было отмечено выше, помимо диареи при коронавирусной инфекции могут возникать и другие гастроинтестинальные симптомы: тошнота и рвота — в 7% случаев, диарея — в 8% случаев, анорексия — в 17% случаев. Боль в животе, которая также является одним из симптомов поражения ЖКТ при COVID-19, регистрируется в 3–3,6% случаев [33–37]; по нашим данным, болевой абдоминальный синдром встречается у 3,1% детей с COVID-19 [11]. Боль в животе является одной из наиболее частых причин госпитализации ребенка в хирургическое отделение многопрофильного стационара, и в 15–20% случаев она возникает в результате патологии аппендикса — острого аппендицита (ОА) [38]. Имеются единичные публикации о случаях ОА у детей с COVID-19 [39], однако в настоящее время не накоплено достаточно данных, указывающих на вероятность ОА как осложнения инфекции, вызванной SARS-CoV-2. В исследование было включено 1010 детей с подтвержденной SARS-CoV-2-инфекцией или мультисистемным воспалительным синдромом (МВС). У 42 (4,2%) детей был установлен клинический диагноз ОА. Четыре (9,5%) ребенка с МВС не подвергались хирургическому вмешательству, 38 (3,8%) детей были оперированы по поводу подозрения на аппендицит, при этом у 34 (89,7%) из них интраоперационно был установлен диагноз ОА. У 4 детей при проведении операции не обнаружили хирургических причин болей в животе, что позволило исследователям предположить возможность COVID-19 и МВС проявляться как острым животом, так и симулировать аппендицит [40].
Причины, по которым симптомы поражения ЖКТ возникают только у части пациентов с COVID-19, в настоящее время не известны. Данных за влияние демографических показателей и/или наличие коморбидной патологии (новообразования, хроническая болезнь почек, хроническая обструктивная болезнь легких) также не получено. Раннее выявление симптомов поражения ЖКТ имеет большое значение, поскольку у некоторых пациентов могут быть только желудочно-кишечные проявления при отсутствии легочных симптомов, что затрудняет диагностику. В тех случаях, когда SАRS-CoV-2-инфекция протекает с абдоминальным болевым синдромом, симулирующим аппендицит, сложности диагностики возрастают.
В качестве иллюстрации приводим наблюдение пациента, у которого уточнение диагноза проводилось поэтапно.
Клиническое наблюдение
Семнадцатилетний подросток доставлен по экстренным показаниям машиной СМП в ГБУЗ «ДГКБ св. Владимира ДЗМ» 30.11.2021 в 02:40 с жалобами на остро появившиеся (в 01:30) боли в животе и подозрением на аппендицит. Из анамнеза жизни известно, что наследственность не отягощена; хронические заболевания и перенесенные ранее операции отрицает. Развитие в соответствии с возрастом, рост 175 см, масса тела 73 кг, нормостеник. Контакты с инфекционными больными или носителями отрицал.
При поступлении в приемное отделение в сознании, температура 36,6 °С, ЧСС 90 в 1 мин, жалобы на боли в животе. Насморка, кашля, рвоты нет. Стул был накануне, оформленный. При осмотре: кожа без сыпи; слизистые, доступные осмотру, чистые, влажные; лимфоузлы не увеличены, безболезненные; язык влажный, с белым налетом. Живот не вздут, симметричен, участвует в акте дыхания, мягкий, доступен глубокой пальпации; локально определяется болезненность в правой подвздошной области, сомнительные перитонеальные знаки. Диурез не нарушен. Было принято решение о госпитализации в хирургическое отделение с диагнозом «Острый аппендицит?» для наблюдения и обследования. Взят мазок из носа и ротовой полости на SARS-CoV-2 в соответствии с обязательным обследованием в приемном отделении.
В хирургическом отделении в 03:20: боль в животе сохраняется, рвоты и стула не было. Живот мягкий, участвует в акте дыхания; отмечается болезненность живота в нижних отделах; симптомы раздражения брюшины отрицательные. В общем анализе крови (ОАК) (02:53) при отсутствии лейкоцитоза (8,5×109/л) доля нейтрофилов повышена (76,3%). Заключение хирурга: на момент осмотра диагноз не ясен; целесообразно продолжить наблюдение в динамике, проводить дообследование. При последующих осмотрах хирургом болезненность в правой подвздошной области сохраняется, перитонеальные симптомы отрицательные. Пациент нуждается в дообследовании.
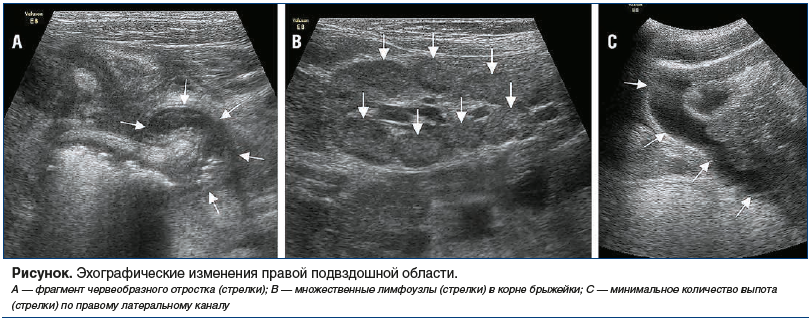
В 08:30 при УЗИ органов брюшной полости выявлены воспалительные изменения визуализируемого фрагмента червеобразного отростка (утолщен до 9 мм, протяженностью до 38 мм). Фрагменты кишечных петель около аппендикса с утолщенной до 3 мм стенкой практически не перистальтируют (локальный кишечный стаз). В правой подвздошной области и по ходу корня брыжейки определялись гипоэхогенные овальной формы лимфоузлы до 9–11 мм в диаметре. Также выявлены эхо-признаки ренальных дисметаболических нарушений, реактивных изменений паренхимы поджелудочной железы и стенок желчного пузыря, минимальное количество выпота в брюшной полости (см. рисунок).
На совместном консилиуме хирургов (заведующий отделением, лечащий врач, дежурный хирург) с учетом результатов клинического наблюдения (сохранение болевого синдрома) и наличием эхографических проявлений ОА принято решение о необходимости лапароскопии. Аппенд-эктомия выполнена лапароскопически с использованием видеоэндоскопических технологий под ингаляционным эндотрахеальным наркозом лигатурным способом. Червеобразный отросток расположен типично, гиперемирован, напряжен, утолщен до 0,9 см. Мутный выпот в области малого таза взят на посев. Рана ушита наглухо. Аппендикс отправлен на гистологическое исследование.
Послеоперационный диагноз: «Флегмонозный аппендицит». Микроорганизмы в абдоминальной жидкости не обнаружены. Макроскопическая картина: отросток длиной 4 см, диаметр 0,6 см, серозная оболочка тусклая с наложением фибрина, на разрезе стенка утолщена, точечный просвет. Микроскопическая картина: эпителий частично отсутствует. В стенке — очаговая лимфолейкоцитарная инфильтрация, расстройства кровообращения. Краевое стояние лейкоцитов, липоматоз подслизистой основы. Серозная оболочка и брыжейка отечные, выраженная лимфолейкоцитарная инфильтрация, наложение фибрина. Заключение: морфологическая картина соответствует флегмонозному аппендициту, фибринозно-гнойному периаппендициту и мезентериолиту.
Пациенту назначены антибиотики (внутривенно цефотаксим и амикацин). Он был доставлен из операционной в ОРИТ в сопровождении анестезиолога-реаниматолога в состоянии частичной медикаментозной седации. Дыхание самостоятельное: FiO2 21%, SpO2 99%, без дотации кислорода. ЧДД 18 в 1 мин, хрипов нет. К 18:00 30.11.2021 отмечена положительная динамика за счет восстановления сознания, начала энтеральной нагрузки. Послеоперационные раны без признаков воспаления. Пробуждение после наркоза без особенностей. Показано наблюдение хирургом с коррекцией питания по клиническим и лабораторным показателям. Однако в ОРИТ пациент провел несколько часов, так как был получен положительный результат исследования на SARS-CoV-2 носоротоглоточного мазка, обусловивший перевод в инфекционное отделение на койку обсервации. Продолжена инфузионная внутривенная терапия сбалансированными солевыми растворами с учетом энтерального питания, внутривенная антибактериальная терапия (цефотаксим 1 г 3 р/сут и амикацин 400 мг 2 р/сут капельно). В динамике: дыхание самостоятельное, хрипов нет, ритм регулярный, экскурсия грудной клетки удовлетворительная; в дотации кислорода не нуждается (SpO2 96%). Налет на языке отсутствует. Вздутия живота, болезненности при пальпации нет. Диурез адекватный проводимой терапии. При осмотре педиатром отмечена гиперемия слизистой ротоглотки, небных дужек, везикулярное дыхание в легких. В терапии оставлено внутривенное введение антибиотиков, добавлен умифеновир, с целью коррекции водно-электролитного баланса продолжена инфузионная терапия. Течение коронавирусной инфекции без проявления дыхательной недостаточности. При КТ-исследовании грудной клетки очаговых и инфильтративных изменений не выявлено. В терапии введено: в нос физиологический раствор по 3 капли 3 р/сут, очистительная клизма при отсутствии стула.
В локальном статусе: послеоперационные раны без особенностей. В последующие дни катаральные симптомы со стороны верхних дыхательных путей уменьшились. На фоне проводимой терапии к 07.12.2021 респираторных явлений нет. Послеоперационный период без осложнений. Антибактериальная терапия завершена. В ОАК (07.12.2021) гемоглобин 160 г/л, лейкоциты 7,65×109/л, лимфоциты 23%, моноциты 8%, нейтрофилы 65%. Белки острой фазы: С-реактивный белок 42 мг/л (норма 0–6 мг/л), ферритин 100,6 мкг/л (норма 6–320 мкг/л). Показатели АЛТ, АСТ, мочевины, креатинина, метаболитов крови (концентрации билирубина, глюкозы, лактозы) и электролитов (натрий, калий) — в пределах референсных значений.
Данный клинический пример демонстрирует течение коронавирусной инфекции (выявленной при лабораторном обследовании) без дыхательной недостаточности, с флегмонозным аппендицитом, неосложненным течением при своевременно назначенной терапии. На основании клинической картины и лабораторных данных с самого начала болезни невозможно было заподозрить коронавирусную инфекцию, поскольку на первый план в симптоматике выступил болевой абдоминальный синдром, а катаральные явления отсутствовали. Лишь инструментальные методы обследования позволили выставить диагноз ОА, а мазок из носоглотки методом ПЦР — SARS-CoV-2-инфекцию, что позволило обосновать проведение адекватного своевременного лечения: хирургического и противовирусного. Подобная тактика обеспечила неосложненное течение послеоперационного периода, способствовала выздоровлению пациента с последующей выпиской из стационара под наблюдение участкового педиатра.
Наши данные совпадают с данными других авторов, согласно которым у пациентов с COVID-19 также развивались различные желудочно-кишечные проявления, которые не сопровождались респираторными симптомами [41]. Результаты метаанализа Z. Pogorelić et al. [42] указывают на значительно более высокую заболеваемость осложненным аппендицитом у детей во время пандемии COVID-19, чем в период до пандемии. A.G. Willms et al. [43] изучили в общей сложности 1915 аппендэктомий из 41 больницы Германии и обнаружили, что в период пандемии частота осложненного аппендицита значительно возросла, в то время как частота негативных аппендэктомий значительно снизилась.
Заключение
Таким образом, резюмируя вышесказанное, необходимо отметить, что лечение ребенка, госпитализированного с абдоминальным болевым синдромом, требует персонифицированого подхода и должно осуществляться с учетом клинической картины и тяжести течения болезни. Схожесть клинических проявлений острого состояния, требующего неотложной хирургической помощи (острый аппендицит), и острого инфекционного заболевания, сопровождающегося болями в животе, подчеркивает необходимость включения в план ведения пациентов вирусологического обследования всех больных при поступлении в многопрофильный стационар, что в определенной мере будет способствовать ускорению сроков выявления больных с COVID-19, что еще и важно для предупреждения ее распространения в больнице. Необходимы дальнейшие исследования.
2. Jin X., Lian J.S., Hu J.H. et al. Epidemiological, clinical and virological characteristics of 74 cases of coronavirus-infected disease 2019 (COVID-19) with gastrointestinal symptoms. Gut. 2020;69:1002–1009. DOI: 10.1136/gutjnl-2020-320926.
3. Xiao F., Tang M., Zheng X. et al. Evidence for Gastrointestinal Infection of SARS-CoV-2. Gastroenterology. 2020;158:1831–1833.e3. DOI: 10.1053/j.gastro.2020.02.055.
4. Tullie L., Ford K., Bisharat M. et al. Gastrointestinal features in children with COVID-19: an observation of varied presentation in eight children. Lancet Child Adolesc Health. 2020;4(7):e19–e20. DOI: 10.1016/S2352-4642(20)30165-6.
5. Suresh Kumar V.C., Mukherjee S., Harne P.S. et al. Novelty in the gut: a systematic review and meta-analysis of the gastrointestinal manifestations of COVID-19. BMJ Open Gastr. 2020;7(1):e000417. DOI: 10.1136/bmjgast-2020-000417.
6. Galanopoulos M., Gkeros F., Doukatas A. et al. COVID-19 pandemic: Pathophysiology and manifestations from the gastrointestinal tract. World J Gastroenterol. 2020;26(31):4579–4588. DOI: 10.3748/wjg.v26.i31.4579.
7. Han C., Duan C., Zhang S. et al. Digestive Symptoms in COVID-19 Patients With Mild Disease Severity: Clinical Presentation, Stool Viral RNA Testing, and Outcomes. Am J Gastroenterol. 2020;115(6):916–923. DOI: 10.14309/ajg.0000000000000664.
8. Горелов А.В., Николаева С.В., Акимкин В.Г. Коронавирусная инфекция COVID-19 у детей в Российской Федерации. Инфекционные болезни. 2020;18(3):15–20. [Gorelov A.V., Nikolaeva S.V., Akimkin V.G. Coronavirus infection covid-19 in children in the Russian Federation. Infectious diseases. 2020;18(3):15–20 (in Russ.)]. DOI: 10.20953/1729-9225-2020-3-15-20.
9. Chen N., Zhou M., Dong X. et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet. 2020;395(10223):507–513. DOI: 10.1016/S0140-6736(20)30211-7.
10. Guan W.J., Ni Z.Y., Hu Y. et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020;382(18):1708–1720. DOI: 10.1056/NEJMoa2002032.
11. Николаева С.В., Феклисова Л.В., Понежева Ж.Б. и др. Особенности диагностики новой коронавирусной инфекции у детей, госпитализированных в многопрофильный стационар. Вопросы практической педиатрии. 2021;16(6):18–23. [Nikolaeva S.V., Feklisova L.V., Ponezheva Zh.B. et al. Diagnostics of a new coronavirus infection in children admitted to a multidisciplinary hospital. Clinical practice in pediatrics. 2021;16(6):18–23 (in Russ.)]. DOI: 10.20953/1817-7646-2021-6-18-23.
12. Ramachandran P., Onukogu I., Ghanta S. et al. Gastrointestinal Symptoms and Outcomes in Hospitalized Coronavirus Disease 2019 Patients. Dig Dis. 2020;38(5):373–379. DOI: 10.1159/000509774.
13. Han C., Duan C., Zhang S. et al. Digestive Symptoms in COVID-19 Patients With Mild Disease Severity: Clinical Presentation, Stool Viral RNA Testing, and Outcomes. Am J Gastroenterol. 2020;115(6):916–923. DOI: 10.14309/ajg.0000000000000664.
14. Pan L., Mu M., Yang P. et al. Clinical Characteristics of COVID-19 Patients With Digestive Symptoms in Hubei, China: A Descriptive, Cross-Sectional, Multicenter Study. Am J Gastroenterol. 2020;115(5):766–773. DOI: 10.14309/ajg.0000000000000620.
15. Ling Y., Xu S.B., Lin Y.X. et al. Persistence and clearance of viral RNA in 2019 novel coronavirus disease rehabilitation patients. Chin Med J (Engl). 2020;133(9):1039–1043. DOI: 10.1097/CM9.0000000000000774.
16. Zhang J., Garrett S., Sun J. Gastrointestinal symptoms, pathophysiology, and treatment in COVID-19. Genes Dis. 2021;8(4):385–400. DOI: 10.1016/j.gendis.2020.08.013.
17. Walls A.C., Park Y.J., Tortorici M.A. et al. Structure, Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein. Cell. 2020;181(2):281–292.e6. DOI: 10.1016/j.cell.2020.02.058.
18. Burgueño J.F., Reich A., Hazime H. et al. Expression of SARS-CoV-2 entry molecules ACE2 and TMPRSS2 in the gut of patients with IBD. Inflamm Bowel Dis. 2020;26(6):797–808. DOI: 10.1093/ibd/izaa085.
19. Harmer D., Gilbert M., Borman R., Clark K.L. Quantitative mRNA expression profiling of ACE 2, a novel homologue of angiotensin converting enzyme. FEBS Lett. 2002;532(1–2):107–110. DOI: 10.1016/s0014-5793(02)03640-2.
20. Xiao F., Tang M., Zheng X. et al. Evidence for gastrointestinal infection of SARS-CoV-2. Gastroenterology. 2020;158(6):1831–1833. DOI: 10.1053/j.gastro.2020.02.055.
21. Effenberger M., Grabherr F., Mayr L. et al. Faecal calprotectin indicates intestinal inflammation in COVID-19. Gut. 2020;69(8):1543–1544. DOI: 10.1136/gutjnl-2020-321388.
22. Lin L., Jiang X., Zhang Z. et al. Gastrointestinal symptoms of 95 cases with SARS-CoV-2 infection. Gut. 2020;69(6):997–1001. DOI: 10.1136/gutjnl-2020-321013.
23. Armellini E., Repici A., Alvisi C. et al. Analysis of patients attitude to undergo urgent endoscopic procedures during COVID-19 outbreak in Italy. Dig Liver Dis. 2020;52(7):695–699. DOI: 10.1016/j.dld.2020.05.015. Полный список литературы Вы можете найти на сайте http://www.rmj.ru
24. Wang C., Wang S., Li D. et al. Human intestinal defensin 5 inhibits SARS-CoV-2 invasion by cloaking ACE2. Gastroenterology. 2020;159(3):1145–1147.e4. DOI: 10.1053/j.gastro.2020.05.015.
25. Scaldaferri F., Ianiro G., Privitera G. et al. The Thrilling Journey of SARS-CoV-2 into the Intestine:From Pathogenesis to Future Clinical Implications. Inflamm Bowel Dis. 2020;26(9):1306–1314. DOI: 10.1093/ibd/izaa181.
26. Zuo T., Zhang F., Lui G.C.Y. et al. Alterations in Gut Microbiota of Patients With COVID-19 During Time of Hospitalization. Gastroenterology. 2020;159(3):944–955.e8. DOI: 10.1053/j.gastro.2020.05.048.
27. Gu S., Chen Y., Wu Z. et al. Alterations of the Gut Microbiota in Patients With Coronavirus Disease 2019 or H1N1 Influenza. Clin Infect Dis. 2020;71(10):2669–2678. DOI: 10.1093/cid/ciaa709.
28. Zuo T., Zhan H., Zhang F. et al. Alterations in fecal fungal microbiome of patients with COVID-19 during time of hospitalization until discharge. Gastroenterology. 2020;159(4):1302–1310.e5. DOI: 10.1053/j.gastro.2020.06.048.
29. Cheung K.S., Hung I., Chanet P. et al. Gastrointestinal manifestations of SARS-CoV-2 infection and virus load in fecal samples from a Hong Kong Cohort: systematic review and meta-analysis. Gastroenterology. 2020;159(1):81–95. DOI: 10.1053/j.gastro.2020.03.065.
30. Guo M., Tao W., Flavell R., Zhu S. Potential intestinal infection and faecal-oral transmission of SARS-CoV-2. Nat Rev Gastroenterol Hepatol. 2021;18(4):269–283. DOI: 10.1038/s41575-021-00416-6.
31. Wölfel R., Corman V.M., Guggemos W. et al. Virological assessment of hospitalized patients with COVID-2019. Nature. 2020;581(7809):465–469. DOI: 10.1038/s41586-020-2196-x.
32. Baud D., Dimopoulou Agri V., Gibson G.R. et al. Using probiotics to flatten the curve of coronavirus disease COVID-2019 pandemic. Front Public Health. 2020;8:186. DOI: 10.3389/fpubh.2020.00186.
33. Tian Y., Rong L., Nian W., He Y. Review article: gastrointestinal features in COVID-19 and the possibility of faecal transmission. Aliment Pharmacol Ther. 2020;51(9):843–851. DOI: 10.1111/apt.15731.
34. Dong Z.Y., Xiang B.J., Jiang M. et al. The Prevalence of Gastrointestinal Symptoms, Abnormal Liver Function, Digestive System Disease and Liver Disease in COVID-19 Infection: A Systematic Review and Meta-Analysis. J Clin Gastroenterol. 2021;55(1):67–76. DOI: 10.1097/MCG.0000000000001424.
35. Lin L., Jiang X., Zhang Z. et al. Gastrointestinal symptoms of 95 cases with SARS-CoV-2 infection. Gut. 2020;69(6):997–1001. DOI: 10.1136/gutjnl-2020-321013.
36. Jin X., Lian J.S., Hu J.H. et al. Epidemiological, clinical and virological characteristics of 74 cases of coronavirus-infected disease 2019 (COVID-19) with gastrointestinal symptoms. Gut. 2020;69(6):1002–1009. DOI: 10.1136/gutjnl-2020-320926.
37. Sultan S., Altayar O., Siddique S.M. et al. Electronic address: ewilson@gastro.org. AGA Institute Rapid Review of the Gastrointestinal and Liver Manifestations of COVID-19, Meta-Analysis of International Data, and Recommendations for the Consultative Management of Patients with COVID-19. Gastroenterology 2020;159(1):320–334.e27. DOI: 10.1053/j.gastro.2020.05.001.
38. Styrud J., Eriksson S., Nilsson I. et al. Appendectomy versus antibiotic treatment in acute appendicitis. a prospective multicenter randomized controlled trial. World J Surg. 2006;30(6):1033–1037. DOI: 10.1007/s00268-005-0304-6.
39. Lishman J., Kohler C., de Vos C. et al. Acute appendicitis in multisystem inflammatory syndrome in children with COVID-19. Pediatr Infect Dis J. 2020;39(12):e472–e473. DOI: 10.1097/INF.0000000000002900.
40. Yock-Corrales A., Lenzi J., Ulloa-Gutiérrez R. et al. Acute Abdomen and Appendicitis in 1010 Pediatric Patients With COVID-19 or MIS-C: A Multinational Experience from Latin America. Pediatr Infect Dis J. 2021;40(10):e364–e369. DOI: 10.1097/INF.0000000000003240.
41. Galanopoulos M., Gkeros F., Doukatas A. et al. COVID-19 pandemic: Pathophysiology and manifestations from the gastrointestinal tract. World J Gastroenterol. 2020;26(31):4579–4588. DOI: 10.3748/wjg.v26.i31.4579.
42. Pogorelić Z., Anand S., Žuvela T. et al. Incidence of Complicated Appendicitis during the COVID-19 Pandemic versus the Pre-Pandemic Period: A Systematic Review and Meta-Analysis of 2782 Pediatric Appendectomies. Diagnostics (Basel). 2022;12(1):127. DOI: 10.3390/diagnostics12010127.
43. Willms A.G., Oldhafer K.J., Conze S. et al. Appendicitis during the COVID-19 lockdown: results of a multicenter analysis in Germany. Langenbecks Arch Surg. 2021;406(2):367–375. DOI: 10.1007/s00423-021-02090-3.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.