Третий этап кардиореабилитации после перенесенного острого коронарного синдрома: распространенность сахарного диабета и его факторов риска
DOI: 10.32364/2587-6821-2021-5-4-176-184
Цель исследования: охарактеризовать факторы риска (ФР) сахарного диабета 2 типа (СД2) среди пациентов после перенесенного острого коронарного синдрома на третьем этапе кардиореабилитации.
Материал и методы: проведен ретроспективный анализ 200 пациентов, из них 151 (75,5%) мужчина. Средний возраст пациентов составил 61,7±9,6 года. Все они в течение 12 мес. на амбулаторном этапе проходили программу кардиореабилитации (ПКР), которая включала: адекватную медикаментозную терапию (в том числе высокоинтенсивную терапию аторвастатином в виде монотерапии или в комбинации с эзетимибом), физическую и психологическую реабилитацию, лечебное питание, профилактическое групповое консультирование (школы здоровья). Изучаемыми параметрами были количественные (уровень глюкозы крови натощак, масса тела, индекс массы тела, окружность талии, окружность бедер, индекс формы тела) и качественные (избыточная масса тела, ожирение, другие ФР СД2, сахарный диабет, предиабет de novo)) признаки.
Результаты исследования: в группе пациентов после острого коронарного синдрома на третьем этапе кардиореабилитации зарегистрирована высокая распространенность традиционных и некоторых дополнительных ФР СД2 — 90% больных имели 6 и более ФР СД2. По завершении ПКР распространенность СД2 в группе составила 24%, продемонстрировав статистически значимый прирост (р<0,05). Было зарегистрировано статистически значимое увеличение доли пациентов с высоконормальным уровнем глюкозы крови. Наиболее часто неблагоприятные изменения углеводного обмена de novo (предиабет; СД2 и предиабет суммарно) регистрировались среди пациентов с исходным уровнем глюкозы крови в диапазоне 5,6–6,0 ммоль/л (высоконормальный уровень). Реализация ПКР позволяет контролировать массу тела в группе пациентов с риском СД2. Был отмечен статистически значимый прирост окружности талии, индекса формы тела и отношения окружность талии / рост, что может свидетельствовать о перераспределении жировой массы с увеличением висцерального жира и косвенно указывать на неблагоприятную тенденцию к увеличению инсулинорезистентности.
Заключение: необходим поиск ФР выявленных неблагоприятных метаболических изменений и способов оптимизации ведения пациентов указанной группы, в том числе в аспекте медикаментозных вмешательств, на основе оценки метаболических преимуществ и недостатков.
Ключевые слова: острый коронарный синдром, кардиореабилитация, сахарный диабет 2 типа, предиабет, инсулинорезистентность, факторы риска, статины.
Для цитирования: Друк И.В., Кореннова О.Ю., Савченко М.В., Шукиль Л.В., Ряполова Е.А., Подольная С.П. Третий этап кардиореабилитации после перенесенного острого коронарного синдрома: распространенность сахарного диабета и его факторов риска. РМЖ. Медицинское обозрение. 2021;5(4):176-184. DOI: 10.32364/2587-6821-2021-5-4-176-184.
I.V. Druk1, O.Yu. Korennova1,2, M.V. Savchenko2, L.V. Shukil1, E.A. Ryapolova1. S.P. Podolnaya2
1Omsk State Medical University, Omsk, Russian Federation
2Clinical Cardiologic Dispensary, Omsk, Russian Federation
Aim: to determine risk factors for type 2 diabetes (T2D) in patients with the prior acute coronary syndrome (ACS) in the 3rd phase of cardiac rehabilitation.
Patients and Methods: retrospective analysis of medical records of 200 patients (151 men, 75.5%) was performed. The mean age was 61.7±9.6 years. All patients attended a 12-month cardiac rehab program that included adequate pharmacotherapy (atorvastatin monotherapy or atorvastatin plus ezetimibe), physical and psychological rehabilitation, therapeutic feeding, and preventive group consultations (health schools). Both quantitative (fasting blood glucose, weight, body mass index, waist circumference, hip circumference, a body shape index) and qualitative (overweight, obesity, other risk factors for T2D, diabetes, de novo diabetes) parameters were studied.
Results: in patients with prior ACS, a high prevalence of conventional and additional risk factors for T2D (≥ 6 risk factors were revealed in 90% of patients) was reported in the 3rd phase of cardiac rehab. After completing the cardiac rehab program, the prevalence of T2D in patients with prior ACS was 24% thereby demonstrating a significant increase (p < 0.05). Additionally, a significant increase in the proportion of patients with high normal blood glucose (5.0–6.0 mmol/l) was reported. Unfavorable de novo abnormalities of carbohydrate metabolism (pre-diabetes, T2D plus pre-diabetes) were commonly revealed in patients with high normal blood glucose. Cardiac rehab program provided weight control in patients with T2D risk. A significant increase in waist circumference, a body shape index, the waist-to-height ratio was reported thus demonstrating redistribution of fat mass and an increase in visceral fat. These signs may indicate an unfavorable trend of increased insulin resistance.
Conclusions: searching for risk factors of unfavorable metabolic abnormalities identified and means to optimize management of these patients (including medical treatment) based on the assessment of metabolic benefits and drawbacks is required.
Keywords: acute coronary syndrome, cardiac rehabilitation, type 2 diabetes, pre-diabetes, insulin resistance, risk factors, statins.
For citation: Druk I.V., Korennova O.Yu., Savchenko M.V. et al. Third phase of cardiac rehabilitation after acute coronary syndrome: prevalence of diabetes and its risk factors. Russian Medical Inquiry. 2021;5(4):176–184 (in Russ.). DOI: 10.32364/2587-6821-2021-5-4-176-184.
Введение
Сахарный диабет 2 типа (СД2) является распространенным, сложным в управлении заболеванием, которое представляет собой значительное бремя как для системы здравоохранения, так и для здоровья отдельных людей. По оценкам Международной диабетической федерации, число людей с сахарным диабетом, как ожидается, увеличится с 425 млн взрослых в 2017 г. до 629 млн к 2045 г., и доля людей с СД2 увеличивается в большинстве стран [1].
Неудовлетворительное управление хронической гипергликемией, недостаточная эффективность популяционной и индивидуальной профилактики СД2, безусловно, являются следствием большого количества факторов, в том числе политических и социальных, выходящих за рамки медицинской науки. Тем не менее нельзя не признать относительную ограниченность современного понимания патофизиологии диабета [2]. Современные исследования геномных ассоциаций подтверждают, что на развитие СД2 как любого «сложного заболевания» влияет широкий спектр биохимических, генетических, поведенческих и экологических детерминант, каждая из которых в отдельности обусловливает только часть риска развития заболевания [3]. Многочисленные наблюдательные исследования выявили большое количество факторов риска (ФР) развития СД2, некоторые из которых ассоциированы с фармакологическими вмешательствами. В частности, особый интерес вызывает взаимосвязь уровня липидов крови (в частности, холестерина ЛПНП) и риска развития СД2, тем более что в многочисленных исследованиях показано, что терапия статинами дозозависимо повышает риск СД2 [4, 5]. Частным случаем применения высокоинтенсивной терапии статинами является гиполипидемическая терапия после острого коронарного синдрома (ОКС).
Цель исследования: охарактеризовать ФР СД2 у пациентов после перенесенного ОКС на третьем этапе кардиореабилитации.
Материал и методы
Исследование проведено на базе БУЗ ОО «Клинический кардиологический диспансер». В период с 01.07.2018 по 01.02.2019 1004 пациента, перенесших ОКС и стентирование коронарных артерий, поступили на диспансерное наблюдение в первые 3 дня после выписки из сосудистых отделений стационаров г. Омска. В течение 31,3±5,2 дня для 773 (77,0%) пациентов по результатам консультации врача-кардиолога — специалиста по медицинской реабилитации и определения реабилитационного потенциала для указанных пациентов была сформирована индивидуальная программа кардиореабилитации (ПКР). Данная программа на амбулаторном этапе осуществлялась в течение 12 мес. и включала адекватную медикаментозную терапию (в том числе высокоинтенсивную терапию аторвастатином в виде монотерапии или, по показаниям, в комбинации с эзетимибом, двойную антиагрегантную терапию, антагонисты ренин-ангиотензин-альдостероновой системы (РААС), β-адреноблокаторы), физическую реабилитацию (индивидуально подобранные программы в зале лечебной физкультуры под контролем инструктора-методиста и/или дома), психологическую реабилитацию, лечебное питание, профилактическое групповое консультирование (школы здоровья).
В соответствии с общепринятыми критериями включения/исключения в отношении ПКР [6] в текущий анализ было включено 200 пациентов, из них 151 (75,5%) мужчина. Средний возраст пациентов составил 61,74±9,57 года. Изучаемыми параметрами были количественные (уровень глюкозы крови натощак, масса тела, индекс массы тела (ИМТ), окружность талии, окружность бедер, индекс формы тела) и качественные (избыточная масса тела, ожирение, другие ФР СД2, сахарный диабет, предиабет
de novo) признаки.
Статистический анализ осуществляли с использованием пакетов программы Statistica 10. Проверку нормальности распределения проводили с использованием критерия Шапиро — Уилка, данные записывали как среднее и среднеквадратическое отклонение (M±σ). Анализировали таблицы сопряженности для двух зависимых групп с применением критерия Мак-Нимара. Для сравнения количественных данных применяли процедуры непараметрической статистики для зависимых выборок (критерий Вилкоксона). Во всех случаях критический уровень значения p принимался менее 0,05.
Результаты исследования
Клиническая характеристика группы представлена в таблице 1. Из 200 человек, включенных в исследования, 190 (98%) были старше 45 лет. Треть пациентов имела признаки мультифокального атеросклероза, у 46 (23%) в анамнезе, до развития ОКС, был инфаркт миокарда или мозговой инсульт (из них у 2 — инфаркт миокарда и мозговой инсульт), у большинства — АГ. Доминировала ХСН с сохраненной фракцией выброса левого желудочка. У 133 (70%) пациентов ХСН соответствовала функциональному классу (ФК) II, у 52 (27,3%) — ФК I и у 5 (2,6%) — ФК III. У 40 (20%) пациентов в анамнезе имелся СД2.

В соответствии с ПКР и клиническим статусом пациенты получали комплексную медикаментозную терапию (табл. 2), которая корректировалась в зависимости от клинических целей. В частности, более 50% пациентов нуждались в комбинированной гиполипидемической терапии (препарат группы статинов + эзетимиб).
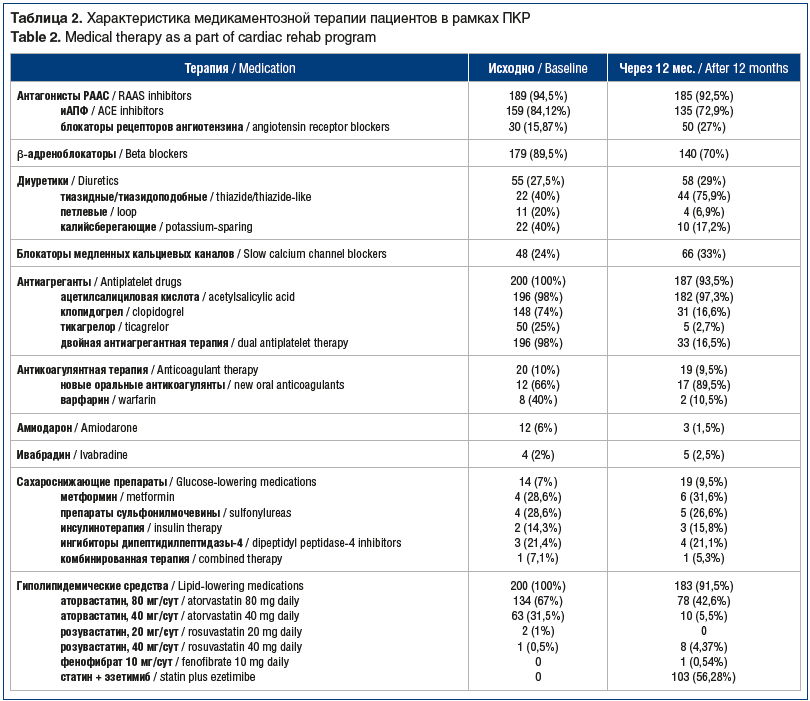
Мы оценили исходный статус пациентов, отражающий традиционные и дополнительные ФР СД2 (табл. 3). Помимо наличия сердечно-сосудистого заболевания (признак, формирующий изучаемую группу пациентов), АГ и возраст ≥45 лет были характерными для данной группы ФР.
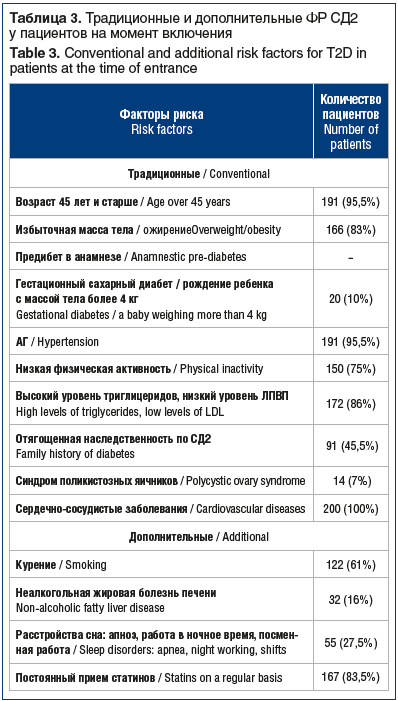
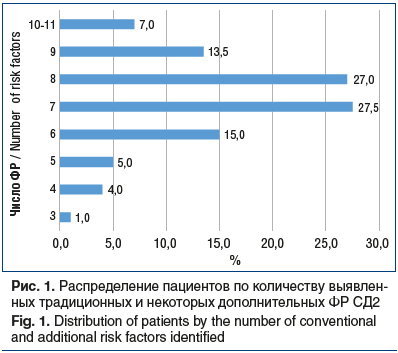
Среди дополнительных ФР ни в одном случае среди пациентов изучаемой группы не встречался черный акантоз, прием значимых препаратов (длительный/постоянный прием атипичных антипсихотиков, неселективных β-адреноблокаторов, глюкокортикостероидов). Вследствие трудности объективной оценки мы не рассматривали такие известные дополнительные ФР, как низкая масса при рождении, недостаточное потребление клетчатки, повышенное потребление насыщенных жирных кислот и пр. [7]. При оценке только традиционных ФР в среднем у пациентов регистрировалось 5 ФР (5,47±1,19), минимальное количество ФР — 2 (у 2 (1%)), максимальное количество ФР — 9 (у 1 (0,5%)). При учете дополнительных ФР в среднем у пациентов регистрировалось около 7 ФР (7,36±1,52), минимальное количество ФР — 3, максимальное — 11 (рис. 1).
Абдоминальное ожирение — один из основных модифицируемых ФР СД2, было выявлено у 75 (37,5%) обследованных, нормальная масса тела (ИМТ<25 кг/м2) имела место только в 34 (17%) наблюдениях. В течение 12 мес. наблюдения проводился контроль комплаентности пациентов, выбывших из наблюдения досрочно не было. Отмечена следующая динамика метаболических параметров: при отсутствии статистически значимой динамики массы тела и ИМТ значимо возросла окружность талии (ОТ) и индекс формы тела (табл. 4).
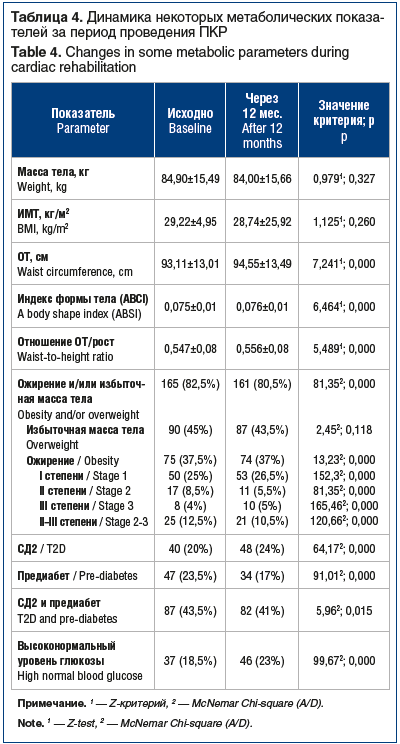
Было зарегистрировано значимое снижение доли пациентов с ожирением II–III степени при статистически значимом увеличении числа пациентов с ожирением I степени. За время наблюдения был зарегистрирован статистически значимый прирост числа случаев СД2 — 8 случаев СД2 de novo, а также значимый прирост частоты выявления высоконормального уровня глюкозы крови (см. табл. 4).
Учитывая тот факт, что порог гликемии натощак ≥5,6 ммоль/л некоторыми зарубежными экспертными группами классифицируется как предиабетическое состояние, а также отечественные данные о клинической значимости высоконормального уровня гликемии (5,6–6,0 ммоль/л) [7, 8], мы проанализировали изменение частоты его регистрации (см. табл. 4). Был выявлен статистически значимый прирост частоты указанного признака за время наблюдения: высоконормальный уровень глюкозы на момент завершения наблюдения регистрировался примерно у каждого 4-го пациента общей группы. Уточним, что по рекомендациям Российской ассоциации эндокринологов, соответствующим позиции ВОЗ, уровень глюкозы крови натощак <6,1 ммоль/л в настоящее время рассматривается как нормальный [9].
Чаще всего нарушения углеводного обмена (признак «предиабет», «СД2 или предиабет») регистрировали среди пациентов с исходно высоконормальным уровнем глюкозы крови (табл. 5). Статистически значимых различий по частоте СД2 среди рассматриваемых групп пациентов не было зарегистрировано, что может быть связано с небольшой численностью групп. Для сравнения: среди 47 пациентов с предиабетом развитие СД2 констатировали в 3 (6,38%) наблюдениях. При этом среди пациентов без ранее установленного СД/предиабета и с исходным уровнем глюкозы крови <5,6 ммоль/л (n=77) в трети случаев (n=24, 31,17%) был зарегистрирован уровень гликемии натощак в диапазоне 5,6–6,0 ммоль/л.
Обсуждение
В изучаемой группе пациентов мы выявили значительную распространенность ФР СД2. При выборе спектра традиционных ФР мы опирались на актуальные отечественные и зарубежные рекомендации [7, 9, 10]. Из известных дополнительных ФР мы оценили наиболее доступные, на наш взгляд, для объективной оценки. Абсолютное большинство пациентов, кроме формирующего группу признака — «сердечно-сосудистые заболевания», имели еще 2 независимых ФР СД2 — АГ и возраст ≥45 лет. Таким образом, 3 ФР СД2 — минимальное количество признаков, зарегистрированное у 2% пациентов. Большинство пациентов имели 6 и более ФР СД2 одновременно. На втором месте по частоте встречаемости среди ФР были дислипидемия, постоянный прием статинов и избыточная масса тела / ожирение, на третьем месте — низкая физическая активность.
При завершении ПКР распространенность СД2 в группе составила 24%, что существенно выше среднепопуляционных значений. В частности, по данным онлайн-регистра, общая численность пациентов с СД в РФ на 01.01.2019 составляет 4,58 млн (3,12%), в том числе с СД2 — 4,24 млн [11]. Причинно-следственные связи между СД2, глюкозой плазмы натощак (ГПН) и ИБС имеют большое значение для глобального общественного здравоохранения, поскольку распространенность СД2 в мире неуклонно растет и ИБС является ведущей причиной смерти в мире [12]. По данным метаанализа 102 проспективных исследований было установлено, что у пациентов с уровнем гликемии ≥7,0 ммоль/л риск развития ИБС выше на 78%, у пациентов с уровнем гликемии 6,1–7,0 ммоль/л — на 17%, у лиц с гликемией 5,6–6,1 ммоль/л — на 11% [12]. Следует отметить, что порог гликемии натощак ≥5,6 ммоль/л, в отличие от рекомендаций ВОЗ, классифицируется Американской диабетической ассоциацией (ADA) с 2003 г. как предиабетическое состояние [7]. Современные исследования подтверждают известные наблюдения, что СД2 и ГПН являются не только ФР возникновения ССЗ, но и фактором, ассоциированным с худшим прогнозом смертности по количеству рестенозов при установленной ИБС, числу повторных инфарктов миокарда и развитию ХСН [13–16]. В целом в нашем исследовании был отмечен значимый прирост числа случаев СД2 (p=0,000). При анализе случаев нарушений углеводного обмена de novo было выявлено, что наиболее часто таковые регистрировались среди пациентов с исходным уровнем глюкозы крови в более высоком диапазоне нормы (5,6–6,0 ммоль/л). Кроме того, при анализе группы пациентов с исходным уровнем глюкозы крови <5,6 ммоль/л за время наблюдения высоконормальный уровень сформировался у трети больных. Следует упомянуть, что в недавнем бразильском лонгитюдном когортном исследовании показано, что риск развития СД2 предсказывают такие состояния, как нарушение гликемии натощак, определенное по критериям ВОЗ, и нарушение толерантности к глюкозе, тем не менее их чувствительность низка, а наибольшей чувствительностью обладает уровень ГПН, классифицируемый ADA в качестве нарушения гликемии натощак (≥5,6 ммоль/л) [17].
Многочисленные наблюдательные исследования выявили большое количество ФР развития СД2, но в связи с тем, что наблюдательные исследования не могут предложить достоверных доказательств причинно-следственных связей между наблюдаемыми ФР и тем или иным исходом заболевания, изучение ФР СД2 продолжается. Новые возможности независимой оценки причинно-следственных связей в системе «эндогенный ФР — заболевание» открыл метод менделевской рандомизации. В отношении части традиционных факторов причинно-следственные связи действительно были подтверждены в менделевских рандомизированных исследованиях (МРИ). Прежде всего это касается таких маркеров повышенного риска СД2, как ИМТ, ожирение, ОТ. В то же время по другим ФР (системное воспаление, триглицериды, липопротеин А, холестерин ЛПВП, некоторые поведенческие ФР, АГ) в противовес заключению наблюдательных исследований метаанализы МРИ не продемонстрировали причинно-следственные связи либо результаты оказались противоречивыми [5, 13, 18].
Как известно, увеличение массы тела после ОКС может быть связано с существенным снижением физической активности [19]. В нашем исследовании за время наблюдения на фоне уменьшения доли пациентов с ожирением II–III степени отмечено значимое увеличение числа пациентов с ожирением I степени. Однако следует отметить, что в группе было зарегистрировано статистически значимое увеличение ОТ. Последнее (наравне с ИМТ) является основным ФР развития СД2 по данным как наблюдательных исследований, так и МРИ [5, 13]. Более того, учитывая существенные ограничения оценки ИМТ (отсутствие половых различий, учета нежировой массы) и изолированной оценки ОТ (зависимость от размеров тела), в качестве инструмента оценки прогноза пациентов был предложен индекс формы тела, учитывающий одновременно рост, массу тела и ОТ [21]. Было показано, что индекс формы тела при противоречивых результатах по отдельным заболеваниям является удобным инструментом для оценки риска смерти и кардиометаболического риска [22–25]. В нашем наблюдении был отмечен статистически значимый прирост индекса формы тела и отношения ОТ/рост, что свидетельствует о перераспределении жировой массы с увеличением висцерального жира. Возможно, мы зарегистрировали ранние изменения, предшествующие значимому увеличению массы тела у части пациентов. Следует также отметить, что возможную роль в указанной негативной динамике может играть прием статинов. Так, в рандомизированных исследованиях и в недавних популяционных МРИ (исследование носительства SNPs в гене HMGCR) было показано, что прием статинов может быть связан с увеличением массы тела [20, 26].
Это особенно интересно в контексте давно установленного факта повышения статинами риска СД2 в дозозависимой форме, особенно у пациентов с нарушениями углеводного обмена, что послужило поводом к изменению инструкции к препаратам в 2012 г. [27]. Статины нарушают синтез холестерина гепатоцитами, повышают экспрессию печеночных рецепторов ЛПНП и снижают концентрацию циркулирующего холестерина ЛПНП путем ингибирования 3-гидрокси-3-метилглутарил-кофермент А редуктазы (HMG-CoA редуктазы), что приводит к пропорциональному снижению риска ССЗ [5]. На основании результатов продольного Фрамингемского исследования сердца было высказано предположение, что низкие уровни ЛПНП были связаны с СД2: была очевидна заметная взаимосвязь между ЛПНП и СД2, причем гиполипидемическое лечение ассоциировалось с повышенным риском развития СД2 [28]. Однако результаты 10-летнего наблюдения (n=1819) за здоровыми (по сахарному диабету) родственниками первой степени родства пациентов с СД2 30–70 лет, не получавших гиполипидемических препаратов, показали, что более высокий уровень ЛПНП достоверно ассоциирован с более высоким риском развития СД2, независимо от возраста, пола, уровня ГПН, ОТ или АД [35]. Многоцентровые рандомизированные исследования показали, что риск СД2 при терапии статинами связан частично с их прямым действием — ингибированием HMG-CoA редуктазы, частично — с увеличением массы тела [26, 29].
На текущий момент не существует однозначного представления о клеточных механизмах диабетогенного действия статинов. Предполагается, что снижение чувствительности к инсулину может быть опосредовано снижением фосфорилирования рецептора инсулина, субстрата 1 рецептора инсулина, гликогенсинтазакиназы 3β, уменьшением активности GLUT-4, снижением уровня геранилгеранилпирофосфата, повышением секреции макрофагами интерлейкина-1β [5, 30]. В отношении нарушений секреции инсулина β-клетками на фоне приема статинов также предполагается несколько последствий ингибирования статинами HMG-CoA редуктазы: снижается уровень убихинона (CoQ10) в дозозависимой форме, что приводит к уменьшению производства АТФ и высвобождения инсулина, ухудшается митохондриальная функция в β-клетках и может увеличиваться внутриклеточный уровень холестерина, что повышает его липотоксичные эффекты в β-клетках [5, 30, 31]. Исследование METSIM продемонстрировало снижение чувствительности к инсулину (на 24%) и секреции инсулина (на 12%) при лечении статинами (особенно симвастатином и аторвастатином) [32]. Наиболее выраженное снижение чувствительности к инсулину было отмечено у участников, получавших терапию статинами и имевших нормальный уровень глюкозы крови [33].
В целом исследования показывают, что абсолютный риск развития СД2 на фоне применения статинов находится в диапазоне от 0,3% до 0,5% или 0,1% в год [4]. Однако результаты исследований предполагают, что указанные риски, рассчитанные на основании клинических исследований с небольшой длительностью наблюдения, могут недооценивать риск СД2 [34]. В то же время показано, что в когорте пациентов с избыточной массой тела / ожирением риск СД2 на фоне терапии статинами может быть существенно выше, с отношением шансов 1,36 (95% ДИ 1,17–1,58) [35]. В исследованиях TNT и IDEAL продемонстрировано, что при 0–1 ФР СД2 (глюкоза крови натощак >5,6 ммоль/л, уровень триглицеридов >150 мг/дл, ИМТ>30 кг/м2, АГ) у пациентов не отмечается новых случаев СД2 на фоне приема высокой дозы статина (аторвастатин 80 мг/сут) или низкой дозы (аторвастатин 10 мг/сут или симвастатин). У пациентов с 2–4 ФР относительный риск СД2 составил 1,24 (95% ДИ 1,08–1,42) [35–37].
Популяционные исследования подтверждают, что гипергликемический эффект статинов является класс-специфическим, но проявляющимся в различной степени в зависимости от дозы препарата. Данные нескольких исследований статинов, популяционных исследований, клинических исследований и исследований
in vitro позволяют предположить, что симвастатин, аторвастатин и розувастатин — наиболее диабетогенные статины [33, 38].
В нашем наблюдении абсолютное большинство пациентов получали аторвастатин, меньшая часть — розувастатин, оба препарата — в дозах, соответствующих терапии высокой интенсивности, обладающей максимальным диабетогенным потенциалом [39].
За время нашего наблюдения было зарегистрировано статистически значимое повышение числа новых случаев СД2, несмотря на полноценное выполнение пациентами индивидуально спланированной программы физической реабилитации, предотвратившее ожидаемое повышение массы тела, что не позволяет исключить вероятность диабетогенных эффектов высокоинтенсивной терапии статинами. Следует отметить, что, хотя гипергликемический эффект статинов является класс-специфическим, на сегодняшний день совершенно очевидны различия между препаратами.
Метаанализ исследований из баз данных MEDLINE, EMBASE и CENTRAL, опубликованных до марта 2017 г., оценивал влияние статинов на гликемический контроль у больных СД2. Было продемонстрировано, что среди изученных статинов (аторвастатин, симвастатин, розувастатин, правастатин, питавастатин) высокоинтенсивная терапия аторвастатином статистически значимо повышает уровень ГПН в сравнении с плацебо, умеренно интенсивной терапией аторвастатином, розувастатином и симвастатином, а умеренно интенсивная терапия питавастатином снижает ГПН в сравнении с плацебо, умеренно интенсивной терапией аторвастатином, розувастатином и высокоинтенсивной терапией аторвастатином. Исследователи сделали вывод, что у пациентов с СД2 умеренной интенсивности терапия питавастатином улучшает гликемический контроль, в то время как аторвастатин высокой интенсивности ухудшает
его [40]. Несмотря на то, что СД2 является также известным ФР ССЗ, что показано в наблюдательных исследованиях и подтверждено в МРИ [19], польза от применения статинов в отношении профилактики ССЗ неоспорима, в том числе и у пациентов с СД2 [41]. Недавнее МРИ продемонстрировало причинно-следственную связь между повышенным уровнем ЛПНП и риском СД2, что доказывает необходимость клинического применения гиполипидемических препаратов у пациентов с СД2 в качестве средства снижения риска развития у них ССЗ [42]. Кроме того, в группе пациентов, принимающих статины, отмечена более низкая совокупная заболеваемость диабетической ретинопатией и диабетической нейропатией [43]. В связи с этим статины остаются приоритетными липидснижающими препаратами. Однако необходимо с большим вниманием относиться к контролю ФР СД2 и динамическому контролю гликемии на фоне терапии статинами.
Существуют рекомендации, что любой случай СД2 de novo в течение 1 года после введения статинов должен быть тщательно изучен для оценки того, может ли СД2 быть ассоциирован с приемом статинов [44]. При их безусловной верности следует отметить, что в связи с высокой распространенностью ФР СД2 в группе пациентов с ССЗ не всегда возможно сделать однозначное заключение. В этой связи рекомендации по исходному приоритетному выбору более безопасных средств среди препаратов класса статинов для пациентов с высоким риском СД2, безусловно, выглядят целесообразными, однако необходимы дополнительные исследования в этом направлении. Кроме того, текущие данные говорят о том, что нестатиновые гиполипидемические препараты (эзетимиб, фибраты, ингибиторы PCSK-9) не повышают риск СД2 [31]. В частности, в отличие от статинов (ROR = 1,75, 95% ДИ 1,72–1,78), для фибратов не было обнаружено ассоциации (ROR = 0,76, 95% ДИ 0,71–0,82) между приемом препарата и развитием СД2. Значение ROR также было ниже для комбинации статины + фибраты (ROR = 1,46, 95% ДИ 1,28–1,67) [45]. Добавление к статину эзетимиба по влиянию на холестерин ЛПНП приблизительно эквивалентно эффекту тройного удвоения дозы статина (около 18% дополнительного снижения уровня ЛПНП). В исследовании IMPROVE-IT добавление эзетимиба к симвастатину привело к дополнительному снижению уровня ЛПНП на 0,4 ммоль/л, ассоциированному со скромным 7% снижением риска сердечно-сосудистых событий. При этом не было отмечено статистически значимого увеличения частоты новых случаев СД2 в группе, получавшей симвастатин + эзетимиб, в сравнении с группой, получавшей симвастатин + плацебо [46]. Следует отметить, что доказательства эффективности снижения риска сердечно-сосудистых событий за счет использования дополнительных методов лечения в сочетании со статином средней интенсивности уступают таковым для терапии статинами высокой интенсивности. Тем не менее использование второго агента может быть целесообразным в отдельных случаях первичной профилактики ССЗ у пациентов с непереносимостью высокоинтенсивной терапии или с риском СД2. Безусловно, оценка возможностей оптимизации гиполипидемической терапии для вторичной сердечно-сосудистой профилактики требует отдельных исследований.
Заключение
В нашем наблюдении в группе пациентов после ОКС с множественными ФР СД2 за период реализации ПКР (12 мес.), включавшей в том числе высокоинтенсивную терапию статинами, наблюдалось статистически значимое увеличение ОТ, индекса формы тела, отношения ОТ/рост и числа случаев СД2 без существенной динамики массы тела и ИМТ. Необходим поиск ФР указанных неблагоприятных метаболических изменений и способов оптимизации ведения пациентов указанной группы, в том числе в аспекте медикаментозных вмешательств, на основе оценки их метаболических преимуществ и недостатков.
Сведения об авторах:
Друк Инна Викторовна — д.м.н., доцент, заведующая кафедрой внутренних болезней и семейной медицины ДПО ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0001-8317-7765.
Кореннова Ольга Юрьевна — д.м.н., профессор, профессор кафедры внутренних болезней и семейной медицины ДПО ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; заместитель главного врача БУЗОО «ККД»; 644024, Россия, г. Омск, ул. Лермонтова, д. 41; ORCID iD 0000-0001-8047-5521.
Савченко Марина Владимировна — врач-кардиолог БУЗОО «ККД»; 644024, Россия, г. Омск, ул. Лермонтова, д. 41; ORCID iD 0000-0001-8637-9784.
Шукиль Людмила Владимировна — доктор фармацевтических наук, доцент кафедры фармакологии с курсом клинической фармакологии ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0002-1546-0734.
Ряполова Елена Александровна — к.м.н., доцент кафедры внутренних болезней и семейной медицины ДПО ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0002-1473-6321.
Подольная Светлана Павловна — врач-кардиолог БУЗОО «ККД»; 644024, Россия, г. Омск, ул. Лермонтова, д. 41; ORCID iD 0000-0002-2059-7727.
Контактная информация: Друк Инна Викторовна, e-mail: drukinna@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 21.01.2021.
Поступила после рецензирования 15.02.2021.
Принята в печать 15.03.2021.
About the authors:
Inna V. Druk — Dr. Sc. (Med.), Associate Professor, Head of the Department of Internal Diseases & Family Medicine of Postgraduate Medical Education, Omsk State Medical University, 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0001-8317-7765.
Olga Yu. Korennova — Dr. Sc. (Med.), Professor, professor of the Department of Internal Diseases & Family Medicine of Postgraduate Medical Education, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; Deputy Head Doctor, Clinical Cardiologic Dispensary; 41, Lermontov str., Omsk, 644024, Russian Federation; ORCID iD 0000-0001-8047-5521.
Marina V. Savchenko — cardiologist, Clinical Cardiologic Dispensary; 41, Lermontov str., Omsk, 644024, Russian Federation; ORCID iD 0000-0001-8637-9784.
Lyudmila V. Shukil — Dr. Sc. (Pharm.), associate professor of the Department of Pharmacology with the Course of Clinical Pharmacology, Omsk State Medical University, 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0002-1546-0734.
Elena A. Ryapolova — C. Sc. (Med.), associate professor of the Department of Internal Diseases & Family Medicine of Postgraduate Medical Education, Omsk State Medical University, 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0002-1473-6321.
Svetlana P. Podolnaya — cardiologist, Clinical Cardiologic Dispensary, 41, Lermontov str., Omsk, 644024, Russian Federation; ORCID iD 0000-0002-2059-7727.
Contact information: Inna V. Druk, e-mail: drukinna@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 21.01.2021.
Revised 15.02.2021.
Accepted 15.03.2021.
2. McCarthy M.I., Abecasis G.R., Cardon L.R. et al. Genome-wide association studies for complex traits: consensus, uncertainty and challenges. Nat Rev Genet. 2008;9:356–369. DOI: 10.1038/nrg2344.
3. Sattar N., Preiss D., Murray H.M. et al. Statins and risk of incident diabetes: a collaborative meta-analysis of randomised statin trials. Lancet. 2010;375:735–742. DOI: 10.1016/S0140-6736 (09) 61965-6.
4. Agarwala A., Kulkarni S.U., Maddox T. The association of statin therapy with incident diabetes: evidence, mechanisms, and recommendations. Curr Cardiol Rep. 2018:20 (7):50. DOI: 10.1007/s11886-018-0995-6.
5. Laakso M. Biomarkers for type 2 diabetes. Mol Metab. 2019;27S (Suppl): S139–S146. DOI: 10.1016/j.molmet.2019.06.016.
6. Реабилитация и вторичная профилактика у больных, перенесших инфаркт миокарда с подъемом сегмента ST. Российские клинические рекомендации. M.; 2014. [Rehabilitation and secondary prevention in patients with ST-segment elevation myocardial infarction. Russian clinical guidelines. M.; 2014 (in Russ.)].
7. American Diabetes Association. 2. Classification and Diagnosis of Diabetes: Standards of Medical Care in Diabetes-2020. Diabetes Care. 2020;43(Suppl 1): S14–S31. DOI: 10.2337/dc20-S002. PMID: 31862745.
8. Друк И.В., Ибрагимова М.М., Блажко Д.В. и др. Артериальная гипертензия и кардиометаболическая коморбидность у пациентов с различным уровнем глюкозы крови в недиабетическом диапазоне. Артериальная гипертензия 2020;26(2):2019–229. DOI: 10.18705/1607-419X-2020-26-2-219-229. [Druk I.V., Ibragimova M.M., Blazhko D.V. et al. Hypertension and cardiometabolic comorbidity in patients with different levels of blood glucose in the non-diabetic range. Arterial Hypertension. 2020;26(2):219–229 (in Russ.)]. DOI: 10.18705/1607-419X-2020-26-2-219-229.
9. Дедов И.И., Шестакова М.В., Майоров А.Ю., ред. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. 9-й выпуск. М.; 2019. DOI: 10.14341/DM221S1. [Dedov I.I., Shestakova M.V., Mayorov A. Yu., eds. Standarts of specialized diabetes care. Edited by 9th Edition (revised). Moscow; 2019 (in Russ.)]. DOI: 10.14341/DM221S1.
10. Bellou V., Belbasis L., Tzoulaki I., Evangelou E. Risk factors for type 2 diabetes mellitus: An exposure-wide umbrella review of meta-analyses. PLoS One. 2018;13(3): e0194127. DOI: 10.1371/journal.pone.0194127.
11. Шестакова М.В., Викулова О.К., Железнякова А.В. и др. Эпидемиология сахарного диабета в Российской Федерации: что изменилось за последнее десятилетие? Терапевтический архив. 2019;91(10):4–13. DOI: 10.26442/00403660.2019.10.000364. [Shestakova M.V., Vikulova O.K., Zheleznyakova A.V., et al. Diabetes epidemiology in Russia: what has changed over the decade? Terapevticheskii arkhiv. 2019;91(10):4–13 (in Russ.). DOI: 10.26442/00403660.2019.10.000364.
12. The Emerging Risk Factors Collaboration. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative meta-analysis of 102 prospective studies. Lancet. 2010;375(9733):2215–2222. DOI: 10.1016/S0140-6736 (10) 60484-9.
13. Ahmad O.S., Morris J.A., Mujammami M. et al. A Mendelian randomization study of the effect of type-2 diabetes on coronary heart disease. Nat Commun. 2015;6:7060. DOI: 10.1038/ncomms8060.
14. De Miguel-Yanes J.M., Jimenez-Garcia R., Hernandez-Barrera V. et al. Impact of type 2 diabetes mellitus on in-hospital-mortality after major cardiovascular events in Spain (2002–2014). Cardiovasc Diabetol. 2017;16(1):126. DOI: 10.1186/s12933-017-0609-4.
15. Qin Z., Zhou K., Li Y.P. et al. Remnant lipoproteins play an important role of in-stent restenosis in type 2 diabetes undergoing percutaneous coronary intervention: a single-centre observational cohort study. Cardiovasc Diabetol. 2019;18(1):11. DOI: 10.1186/s12933-019-0819-z.
16. Kurisu S., Inoue.I, Kawagoe T. et al. Diabetes mellitus is associated with insufficient microvascular reperfusion following revascularization for anterior acute myocardial infarction. Intern Med. 2003;42:554–559. DOI: 10.2169/internalmedicine.42.554.
17. Schmidt M.I., Bracco P.A., Yudkin J.S. et al. Intermediate hyperglycaemia to predict progression to type 2 diabetes (ELSA-Brasil): an occupational cohort study in Brazil. Lancet Diabetes Endocrinol. 2019;7(4):267–277. DOI: 10.1016/S2213-8587 (19) 30058-0.
18. Smith G.D., Lawlor D.A., Harbord R. et al. Clustered environments and randomized genes: a fundamental distinction between conventional and genetic epidemiology. PLoS Med. 2007;4(12): e352. DOI: 10.1371/journal.pmed.0040352.
19. Swerdlow D.I. Mendelian Randomization and Type 2 Diabetes. Cardiovasc Drugs Ther. 2016;30(1):51–57. DOI: 10.1007/s10557-016-6638-5.
20. Tonet E., Maietti E., Chiaranda G. et al. Physical activity intervention for elderly patients with reduced physical performance after acute coronary syndrome (HULK study): rationale and design of a randomized clinical trial. BMC Cardiovasc Disord. 2018;18(1):98. DOI: 10.1186/s12872-018-0839-8.
21. Krakauer N.Y., Krakauer J.C. A new body shape index predicts mortality hazard independently of body mass index. PLoS ONE. 2012;7(7):e39504. DOI: 10.1371/journal.pone.0039504.
22. Gažarová M., Galšneiderová M., Mečiarová L. Obesity diagnosis and mortality risk based on a body shape index (ABSI) and other indices and anthropometric parameters in university students. Rocz Panstw Zakl Hig. 2019;70(3):267–275. DOI: 10.32394/rpzh.2019.0077.
23. Gomez-Peralta F., Abreu C., Cruz-Bravo M. et al. Relationship between "a body shape index (ABSI)" and body composition in obese patients with type 2 diabetes. Diabetol Metab Syndr. 2018;10:21. DOI: 10.1186/s13098-018-0323-8.
24. Gomez-Marcos M.A., Gomez-Sanchez L., Patino-Alonso M.C. et al. Capacity adiposity indices to identify metabolic syndrome in subjects with intermediate cardiovascular risk (MARK study). PLoS One. 2019;14(1):e0209992. DOI: 10.1371/journal.pone.0209992.
25. Ji M., Zhang S., An R. Effectiveness of a body shape index (ABSI) in predicting chronic diseases and mortality: a systematic review and meta-analysis. Obes Rev. 2018;19:737–759. DOI: 10.1111/obr.12666.
26. Swerdlow D.I., Preiss D., Kuchenbaecker K.B. et al. HMG-coenzyme A reductase inhibition, type 2 diabetes, and bodyweight: evidence from genetic analysis and randomised trials. Lancet. 2015;385(9965):351–361. DOI: 10.1016/S0140-6736 (14) 61183-1.
27. US Food and Drug Administration FDA Drug Safety Communication: important safety label changes to cholesterol-lowering statin drugs. 2012 (Electronic resource.) URL: http://www.fda.gov/Drugs/DrugSafety/ucm293101.htm (access date: 12.20.2020).
28. Andersson C., Lyass A., Larson M.G. et al. Low-density-lipoprotein cholesterol concentrations and risk of incident diabetes: epidemiological and genetic insights from the Framingham Heart Study. Diabetologia. 2015;58:2774–2780. DOI: 10.1007/s00125-015-3762-x.
29. Swerdlow D.I., Preiss D. Genetic insights into statin-associated diabetes risk. Curr Opin Lipidol. 2016;27(2):125–130. DOI: 10.1097/MOL.0000000000000272.
30. Cybulska B., Kłosiewicz-Latoszek L. How do we know that statins are diabetogenic, and why? Is it an important issue in the clinical practice? Kardiol Pol. 2018;76(8):1217–1223. DOI: 10.5603/KP.a2018.0150.
31. Perego C., Dalt L. Da., Pirillo A. et al. Cholesterol metabolism, pancreatic β-cell function and diabetes. Biochimica et Biophysica Acta (BBA) — Molecular Basis of Disease. 2019;1865(9):2149–2156. DOI: 10.1016/j.bbadis.2019.04.012.
32. Cederberg H., Stančáková A., Yaluri N. et al. Increased risk of diabetes with statin treatment is associated with impaired insulin sensitivity and insulin secretion: a 6 year follow-up study of the METSIM cohort. Diabetologia. 2015;58:1109–1117. DOI: 10.1007/s00125-015-3528-5.
33. Laakso M., Kuusisto J. Diabetes secondary to treatment with statins. Curr Diab Rep. 2017;17(2):10. DOI: 10.1007/s11892-017-0837-8.
34. Maki K.C., Diwadkar-Navsariwala V., Kramer M.W. Statin use and risk for type 2 diabetes: what clinicians should know. Postgraduate Medicine. 2018:130 (2):166–172. DOI: 10.1080/00325481.2018.1402658.
35. Crandall J.P., Mather K., Rajpathak S.N. et al. Statin use and risk of developing diabetes: results from the Diabetes Prevention Program. BMJ Open Diabetes Res Care. 2017;5: e000438.
36. Waters D.D., Ho J.E., Boekholdt S.M. et al. Cardiovascular event reduction versus new-onset diabetes during atorvastatin therapy: effect of baseline risk factors for diabetes. J Am Coll Cardiol. 2013;61:148–152.
37. Waters D.D., Ho J.E., DeMicco D.A. et al. Predictors of new-onset diabetes in patients treated with atorvastatin: results from 3 large randomized clinical trials. J Am Coll Cardiol. 2011;57:1535–1545.
38. Kim J., Lee H.S., Lee K. Effect of statins on fasting glucose in non-diabetic individuals: nationwide population-based health examination in Korea. Cardiovasc Diabetol. 2018;17:155. DOI: 10.1186/s12933-018-0799-4.
39. Кобалава Ж.Д., Лазарев П.В., Виллевальде С.В. Сахарный диабет, ассоциированный с терапией статинами: статус проблемы 2018 год. Российский кардиологический журнал. 2018;23(9):89–99. DOI: 10.15829/1560-4071-2018-9-89-99. [Kobalava Zh.D., Lazarev P.V., Villevalde S.V. Statins associated diabetes: state of the problem in 2018. Russian Journal of Cardiology. 2018;23(9):89–99 (in Russ.) DOI: 10.15829/1560-4071-2018-9-89-99.
40. Cui J.Y., Zhou R.R., Han S. et al. Statin therapy on glycemic control in type 2 diabetic patients: A network meta‐analysis. J Clin Pharm Ther. 2018;43:556–570. DOI: 10.1111/jcpt.12690.
41. Cosentino F., Grant P.J., Aboyans V. et al. ESC Scientific Document Group, 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD: The Task Force for diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and the European Association for the Study of Diabetes (EASD). Eur Heart J. 2020;41(2):255–323. DOI: 10.1093/eurheartj/ehz486.
42. Pan W., Sun W., Yang S. et al. LDL–C plays a causal role on T2DM: a Mendelian randomization analysis. Aging (Albany NY). 2020;12(3):2584–2594. DOI: 10.18632/aging.102763.
43. Nielsen S.F., Nordestgaard B.G. Statin use before diabetes diagnosis and risk of microvascular disease: a nationwide nested matched study. Lancet Diabetes Endocrinol. 2014;2:894–900.
44. Jones M., Tett S., Peeters G.M. et al. New-onset diabetes after statin exposure in elderly women: the australian longitudinal study on Women’s health. Drugs Aging. 2017;34:203–209. DOI: 10.1007/s40266-017-0435-0.
45. Montastruc F., Benevent J., Rousseau V., Durrieu G. et al. Risk of diabetes with fibrates and statins: a pharmacoepidemiological study in VigiBase®. Fundam Clin Pharmacol, 2019;33:108–112. DOI: 10.1111/fcp.12406.
46. Cannon C.P., Blazing M.A., Giugliano R.P. et al. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med. 2015;372(25):2387–2397. DOI: 10.1056/NEJMoa1410489.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.

