Сравнительная оценка влияния небиволола и метопролола на метаболические показатели и вазомоторную функцию эндотелия у больных эссенциальной артериальной гипертензией
Цель исследования: сравнение сосудистых и метаболических эффектов монотерапии метопрололом тартратом и небивололом гидрохлоридом при лечении больных неосложненной эссенциальной артериальной гипертензией (АГ).
Материал и методы: в исследование включено 50 пациентов, получавших терапию метопрололом (n=25) либо небивололом (n=25) в течение 3 мес. Исходно и в конце исследования контролировались следующие параметры: индекс массы тела (ИМТ), окружность талии (ОТ), липидный спектр, глюкоза крови, артериальное давление (АД), эндотелий-зависимая (ЭЗВД) и эндотелий-независимая (ЭНВД) вазодилатация плечевой артерии, определяемые при помощи ультразвука высокого разрешения.
Результаты исследования: завершили участие в исследовании 19 пациентов из группы метопролола и 18 пациентов из группы небиволола. В обеих группах достигнута сходная степень снижения АД и ЧСС. Были выявлены значимые различия по сосудистым показателям с достоверным улучшением ЭЗВД и ЭНВД при терапии небивололом (p<0,05 для обоих показателей), тенденцией к снижению ЭЗВД и достоверным снижением ЭНВД (p<0,05) в группе метопролола. Также значимые различия выявлены по динамике ИМТ (отсутствие изменений в группе небиволола и достоверное увеличение в группе метопролола, p<0,05), ОТ (тенденция к уменьшению в группе небиволола и близкое к достоверному повышение в группе метопролола, p<0,05), холестерина липопротеинов высокой плотности (существенное повышение в группе небиволола и значимое снижение в группе метопролола, p<0,01) и глюкозы крови (значимое снижение в группе небиволола и существенное повышение в группе метопролола, p<0,001). В объединенной группе (n=37) на фоне терапии выявлены достоверные отрицательные корреляции между изменением ЭЗВД и ОТ, общего холестерина, холестерина липопротеинов низкой плотности и глюкозы крови.
Заключение: таким образом, два селективных β-адреноблокатора метопролол и небиволол оказывают противоположное влияние на метаболические и сосудистые показатели: негативное в отношении первого и положительное в отношении второго, что потенциально может обусловливать различный прогноз больных АГ при длительной терапии. Имеется взаимосвязь между эндотелиальными и метаболическими эффектами изучавшихся препаратов.
Ключевые слова: эссенциальная артериальная гипертензия, метопролол, небиволол, вазомоторная функция эндотелия, метаболические нарушения.
Для цитирования: Семенкин А.А., Живилова Л.А., Назаров А.Г., Притыкина Т.В., Друк И.В., Логинова Е.Н. Сравнительная оценка влияния небиволола и метопролола на метаболические показатели и вазомоторную функцию эндотелия у больных эссенциальной артериальной гипертензией. РМЖ. Медицинское обозрение. 2021;29(9):26-30.
Nebivolol versus metoprolol: comparative evaluation of their effect on metabolic parameters and endothelial vasomotor function in patients with essential hypertension
A.A. Semenkin, L.A. Zhivilova, A.G. Nazarov, T.V. Pritykina, I.V. Druk, E.N. Loginova
Omsk State Medical University, Omsk
Aim: to compare the vascular and metabolic effects of monotherapy with metoprolol tartrate and nebivolol hydrochloride in the treatment of patients with uncomplicated essential hypertension.
Patients and Methods: the study included 50 patients treated with metoprolol (n=25) or nebivolol (n=25) for 3 months. The following parameters were monitored at baseline and at the end of the study: body mass index (BMI), waist circumference (WC), lipid spectrum, blood glucose, blood pressure (BP), endothelium-dependent (EDV) and endothelium-independent (EIDV) vasodilation of the brachial artery, determined by high-resolution ultrasound.
Results: the study protocol was completed by 19 patients from the metoprolol group and 18 patients from the nebivolol group. In both groups, a similar degree of reduction in BP and heart rate was achieved. The following vascular parameters significantly differ between groups with significant improvement of EDV and EIDV on nebivolol (p<0,05 for both parameters), tendency to decrease of EDV and significant decrease of EIDV (p<0,05) on metoprolol. Significant differences were also revealed in the BMI trend (no changes in the nebivolol group versus significant increase in the metoprolol group, p<0.05), WC (decreasing tendency in the nebivolol group and a significant increase in the metoprolol group, p<0,05), HDL cholesterol (a significant increase in the nebivolol group and a significant decrease in the metoprolol group, p<0.01) and blood glucose (a significant decrease in the nebivolol group and a significant increase in the metoprolol group, p<0,001). In th e combined group (n=37) during therapy, significant negative correlations were revealed between changes in EDV and WC, total cholesterol, LDL cholesterol and blood glucose.
Conclusion: thus, two selective beta-blockers, (metoprolol and nebivolol) have the opposite effect on metabolic and vascular parameters: negative effect — metoprolol, and positive effect — nebivolol, which can potentially cause a diverse prognosis of patients with hypertension during long-term therapy. There is an association between the endothelial and metabolic effects of the studied drugs.
Keywords: essential hypertension, metoprolol, nebivolol, endothelial vasomotor function, metabolic disorders.
For citation: Semenkin A.A., Zhivilova L.A., Nazarov A.G. et al. Nebivolol versus metoprolol: comparative evaluation of their effect on metabolic parameters and endothelial vasomotor function in patients with essential hypertension. RMJ. 2021;9:26–30.
Введение
Основная цель терапии артериальной гипертензии (АГ) заключается в максимальном снижении риска сердечно-сосудистых осложнений и смерти от них. Существенный вклад в развитие неблагоприятных исходов вносят дополнительные метаболические факторы риска, такие как ожирение, нарушения углеводного обмена, дислипидемия, а также сосудистая дисфункция, проявляющаяся, прежде всего, нарушением функции эндотелия [1–3]. В рекомендациях подчеркивается, что основная цель лечения АГ достигается за счет не только снижения артериального давления (АД), но и коррекции всех модифицируемых факторов риска, предупреждения, замедления темпа прогрессирования и/или уменьшения степени поражения органов-мишеней, лечения ассоциированных и сопутствующих заболеваний [4]. С этих позиций β-адреноблокаторы являются неоднозначными препаратами. В ряде статей и отдельных клинических рекомендациях [5, 6] высказываются сомнения относительно использования β-адреноблокаторов в качестве препаратов первого ряда выбора для лечения неосложненной АГ.
Большое количество данных [7–10] свидетельствует о неблагоприятном влиянии данной группы препаратов на углеводный и липидный обмен. Считается, что селективные β1-адреноблокаторы лишены этих свойств. Тем не менее имеются исследования [11–13], доказывающие наличие неблагоприятных метаболических эффектов, в частности в отношении углеводного обмена, у широко используемого β-адреноблокатора — метопролола. Так, в исследовании GEMINI [11] терапия метопрололом приводила к достоверному ухудшению контроля гликемии у больных АГ и сахарным диабетом (СД), а в исследовании COMET [12] — к большему увеличению частоты развития СД в сравнении с карведилолом у больных с сердечной недостаточностью. Для высокоселективного β-адреноблокатора последнего поколения — небиволола подобных эффектов не зарегистрировано [13].
Убедительных данных о положительном влиянии традиционных β-адреноблокаторов на функцию эндотелия в литературе не представлено. В отличие от этого, было доказано, что небиволол вызывает вазорелаксацию, увеличивая выработку оксида азота (NO) эндотелиальными клетками [14].
Целью нашего исследования было сравнение сосудистых и метаболических эффектов монотерапии метопрололом тартратом и небивололом гидрохлоридом при лечении больных неосложненной эссенциальной АГ.
Материал и методы
В исследование включено 50 мужчин и женщин в возрасте 35–65 лет, больных эссенциальной АГ II стадии с повышением АД 1–3-й степени, без клинически выраженных проявлений атеросклероза любой локализации, систолической дисфункции левого желудочка сердца, печеночной или почечной недостаточности, пороков сердца, семейных нарушений липидного обмена, СД и сопутствующих заболеваний, требующих постоянной медикаментозной терапии. Дизайн исследования — открытое, рандомизированное, сравнительное, проспективное. Протокол исследования был одобрен этическим комитетом ФГБОУ ВО ОмГМУ Минздрава России. Все больные дали добровольное информированное согласие на участие в исследовании.
Если больной на момент включения в исследование получал антигипертензивную терапию, первичному обследованию предшествовал «период вымывания» препаратов продолжительностью не менее 3 периодов полувыведения. После проведения первичного обследования больные случайным образом распределялись на 2 группы по 25 человек в каждой, которым проводилась монотерапия либо небивололом гидрохлоридом (группа небиволола) в дозе 2,5–5 мг 1 р/сут, либо метопрололом тартратом (группа метопролола) в суточной дозе 75–150 мг за 3 приема. В дополнение к медикаментозной терапии всем больным давались рекомендации по изменению образа жизни (пищевое поведение, физическая активность). Продолжительность исследования составила 3 мес. Дозы препаратов корректировались в течение 1-го месяца терапии и в последующем не изменялись.
При включении в исследование и через 3 мес. лечения проводилось обследование, включавшее: антропометрические показатели (индекс массы тела (ИМТ), окружность талии (ОТ)); уровень АД; липидный спектр и глюкоза венозной крови натощак; определение зависимой от потока вазодилатации (эндотелий-зависимая вазодилатация (ЭЗВД)) и эндотелий-независимой вазодилатации (ЭНВД) плечевой артерии на фоне сублингвального приема 500 мкг нитроглицерина, при помощи ультразвука высокого разрешения по методике D.S. Celermajer et al. (1992) [15].
Статистическая обработка данных проводилась с помощью программы SPSS 13.0. Данные представлены как среднее значение ± стандартное отклонение либо среднее значение и 95% доверительный интервал (ДИ). Достоверность различий средних значений показателей оценивалась при помощи t-теста Стьюдента для несвязанных и связанных выборок. Для сравнения дихотомических данных использовался критерий χ2. Наличие ассоциаций между отдельными показателями оценивалось при помощи корреляционного анализа Пирсона. Во всех процедурах анализа критический уровень значимости нулевой статистической гипотезы (р) принимали равным 0,05.
Результаты исследования
Из 50 включенных в исследование пациентов его закончили 19 больных из группы метопролола и 18 — из группы небиволола: 4 больных из группы метопролола и 5 пациентов из группы небиволола выбыли в связи с недостаточной гипотензивной эффективностью препарата и невозможностью увеличения дозы в связи со значительно выраженным брадикардическим эффектом, 3 пациента (2 из группы метопролола и 1 из группы небиволола) отказались продолжить участие в связи с ухудшением субъективного статуса, у 1 больного из группы небиволола развилась постуральная гипотония. В связи с этим результаты статистической обработки данных приведены только по 37 пациентам.
Начальная доза метопролола составляла 25 мг 3 р/сут. Коррекция дозы метопролола в течение 1-го месяца терапии была проведена у 14 больных и составила в среднем 114 мг/сут. Начальная доза небиволола была 2,5 мг 1 р/сут. Доза небиволола корректировалась у 15 больных и составила в среднем 4,6 мг/сут.
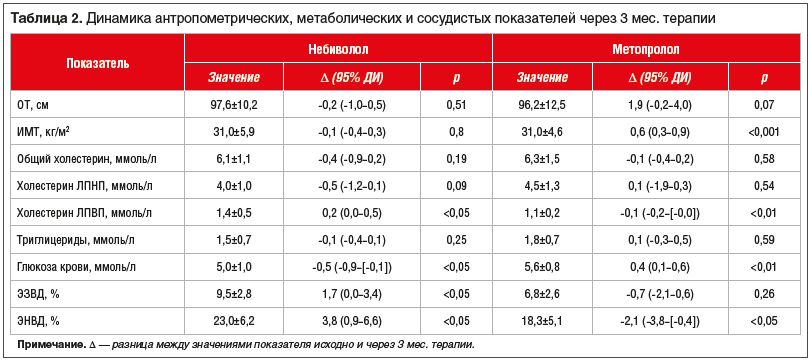
Как видно из данных, представленных в таблице 1, группы были сравнимы по полу, возрасту, уровню АД, ЧСС, антропометрическим и метаболическим показателям (p>0,05 для всех параметров).
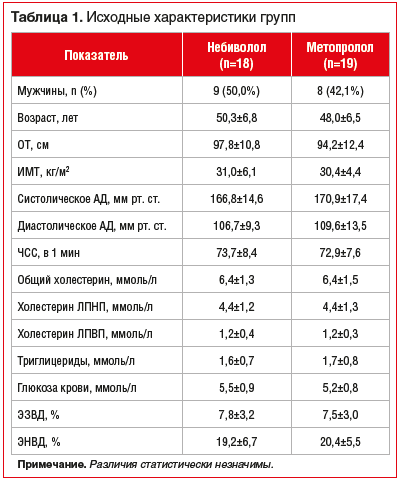
Степень снижения АД и ЧСС на момент завершения исследования продемонстрирована на рисунке 1. Различия по степени снижения АД и ЧСС между группами были статистически незначимы. Средние значения систолического АД (САД) через 3 мес. терапии составили 145,0±10,3 мм рт. ст. против 147,4±14,3 мм рт. ст. (р=0,56), диастолического АД (ДАД) — 97,7±7,8 мм рт. ст. против 97,6±12,1 мм рт. ст. (р=0,99), ЧСС — 63,2±4,4 в 1 мин против 60,6±5,5 в 1 мин (р=0,12) в группах небиволола и метопролола соответственно. Целевых уровней АД (менее 140/90 мм рт. ст.) достигли 7 (38,9%) человек на терапии небивололом и 6 (31,6%) — на терапии метопрололом.
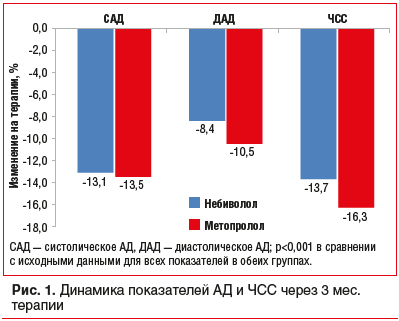
В таблице 2 представлена динамика данных антропометрии, метаболических и сосудистых показателей. Значимых изменений антропометрических показателей за период наблюдения в группе небиволола отмечено не было, тогда как в группе метопролола выявлено достоверное увеличение ИМТ и близкое к достоверному — ОТ. Межгрупповые различия по динамике этих параметров оказались статистически значимыми. Наблюдались разнонаправленные изменения показателей холестерина ЛПНП, триглицеридов, глюкозы крови (снижение на терапии небивололом и повышение на терапии метопрололом) и холестерина ЛПВП (повышение на терапии небивололом и снижение на терапии метопрололом). Изменения уровня глюкозы крови и холестерина ЛПВП были статистически значимыми как по отношению к исходным значениям в группах, так и при межгрупповом сравнении. Межгрупповые различия по динамике холестерина ЛПНП приближались к статистически значимым (p=0,06). Через 3 мес. терапии в группе небиволола выявлено значимое улучшение как дилатации плечевой артерии на эндотелий-зависимый стимул, так и вазодилатационного резерва, определяемого по реакции на сублингвальный прием нитроглицерина. В противоположность этому, на терапии метопрололом определялась тенденция к снижению вазомоторной функции эндотелия и достоверное снижение ЭНВД. Межгрупповые различия по обоим сосудистым показателям также были статистически значимыми (p<0,05).
В таблице 3 приведены корреляционные взаимосвязи между изменением сосудистых показателей, АД и метаболических параметров на фоне терапии в объединенной выборке пролеченных больных (n=37). Корреляции считались для общей выборки, чтобы определить общие тенденции на фоне лечения β-адреноблокаторами с различным влиянием на метаболические параметры и для большей наглядности. Отдельно в группах наблюдались те же самые тенденции, но в связи с относительно небольшим объемом групп некоторые выявленные корреляции были незначимыми. В соответствии с приведенными данными изменение АД не было связано с динамикой вазомоторной функции эндотелия, но имелись значимые обратные корреляции умеренной и средней силы с изменением ряда метаболических параметров, таких как ОТ, общий холестерин, холестерин ЛПНП и глюкоза крови. Наиболее сильная корреляция определена для динамики ЭЗВД и глюкозы крови. Для ЭНВД не выявлено значимых ассоциаций с изменением гемодинамических и метаболических параметров, однако отмечена значимая положительная корреляция средней силы с динамикой ЭЗВД (r=0,51, p<0,01).

Обсуждение
Проведенное исследование показало, что при сходном гипотензивном эффекте два представителя класса β-адреноблокаторов (метопролол и небиволол) значимо различаются по дополнительным метаболическим и сосудистым эффектам. Данные о негативной динамике уровня липидов и глюкозы крови на фоне терапии метопрололом согласуются с имеющимися сведениями о способности традиционных β-адреноблокаторов индуцировать метаболические изменения, включая инсулинорезистентность [9, 16]. В свою очередь, метаболические показатели на фоне приема небиволола не только не ухудшились, но даже улучшились. Негативные эффекты β-адреноблокаторов отчасти прямо или косвенно связаны с блокадой β2-адренорецепторов, в той или иной степени выраженной у различных представителей этого класса препаратов. Доказано, что селективность небиволола в несколько раз выше, чем у метопролола [17], что в определенной мере объясняет выявленные различия метаболических эффектов. В аспекте селективности может трактоваться и достоверное увеличение ИМТ в группе метопролола в отличие от группы небиволола, несмотря на наличие одинаковых рекомендаций по изменению образа жизни. Известно, что применение традиционных β-адреноблокаторов ассоциируется с увеличением ИМТ и замедлением основного обмена на фоне сниженного термогенеза, что частично реализуется через β2- и β3-адренорецепторы [18–21]. В свою очередь, увеличение массы тела может приводить к развитию инсулинорезистентности, усугубляющей липидные нарушения.
Исследование еще раз подтвердило, что применение небиволола, в отличие от метопролола, сопровождается улучшением вазомоторной функции эндотелия. Этот эффект связан с наличием у небиволола способности увеличивать выработку NO эндотелиальными клетками [14]. Блокада β2-адренорецепторов приводит к констрикции гладкомышечных клеток сосудов и проявляется повышением тонуса периферических артерий на фоне применения традиционных β-адреноблокаторов [21, 22], что может не реализоваться в условиях высокоселективной блокады β1-адренорецепторов. Разная степень селективности двух использованных нами препаратов, по-видимому, объясняет наблюдавшиеся различия по изменению резерва вазодилатации, определявшегося по реакции на сублингвальный прием нитроглицерина, с достоверным снижением на фоне терапии метопрололом и повышением на терапии небивололом. Наличие прямой корреляционной связи между ЭНВД и ЭЗВД предполагает участие NO-зависимых механизмов в этих эффектах.
Данные корреляционного анализа подтвердили наличие взаимосвязи между продемонстрированными изменениями метаболических показателей и вазомоторной функции эндотелия на фоне терапии. Действительно, наличие выявленных корреляций в общей выборке можно было бы предположить, учитывая разнонаправленное влияние препаратов как на функцию эндотелия, так и на метаболические параметры, но улучшение метаболических параметров и существенное улучшение функции эндотелия в группе небиволола наблюдалось не у всех пациентов, так же как и ухудшение — не у всех пациентов в группе метопролола. И при отсутствии взаимосвязей между сосудистыми и метаболическими параметрами вовсе не обязательно, чтобы эти изменения происходили однонаправленно у каждого отдельного пациента, независимо от принимаемого препарата. С одной стороны, значимость ожирения, нарушений липидного и углеводного обмена в формировании эндотелиальной дисфункции хорошо изучена [23]. С другой, разнонаправленные изменения периферического кровотока в жировой ткани и скелетной мускулатуре на фоне терапии метопрололом и небивололом влияют на утилизацию глюкозы и метаболизм липидов, формируя или нивелируя метаболические нарушения [24]. Выявленные в ходе исследования различия метаболических и сосудистых эффектов двух β-адреноблокаторов потенциально могут реализоваться неодинаковым влиянием на прогноз пациентов с АГ при длительной терапии. Неблагоприятное прогностическое значение эндотелиальной дисфункции продемонстрировано во многих исследованиях [3]. Нет данных крупных исследований о связи негативных метаболических изменений на фоне терапии β-адреноблокаторами с ухудшением прогноза. Тем не менее по результатам большого метаанализа H.A. Bradley et al. [5] делают заключение, что при лечении АГ β-адреноблокаторы не влияют на общую и сердечно-сосудистую смертность, осложнения ИБС и менее эффективны в отношении мозгового инсульта в сравнении с другими группами антигипертензивных препаратов. По данным анализа регистра REACH [25], отмечено повышение сердечно-сосудистого риска у больных АГ без ИБС на терапии, включавшей данную группу препаратов. В относительно небольшом исследовании T. Almgren et al. [26] с длительным периодом наблюдения (25–28 лет) у больных АГ, получавших преимущественно β-адреноблокаторы и диуретики, риск сердечно-сосудистых осложнений (инфаркт миокарда, мозговой инсульт) и общая смертность были достоверно выше у лиц с вновь развившимся СД, независимо от эффективности контроля уровня АД. При этом среднее время от момента развития СД до кардиальных осложнений составляло около 9 лет.
К ограничениям данного исследования можно отнести относительно невысокие дозы использованных препаратов, так как при увеличении дозы β-адреноблокаторов их селективность частично утрачивается, они начинают оказывать влияние на β2-адренорецепторы [8], что могло бы отразиться на результатах. Относительно небольшой период наблюдения (3 мес.) не позволяет делать заключение о сохранении выявленных различий при длительной терапии. В исследовании оценивался метопролола тартрат — препарат с коротким периодом полувыведения, в связи с чем результаты исследования не могут быть перенесены на метопролола сукцинат — лекарственную форму с замедленным высвобождением.
Заключение
Два селективных β-адреноблокатора — метопролол и небиволол — независимо от степени снижения АД оказывают противоположное влияние на метаболические параметры и вазомоторную функцию эндотелия: негативное в отношении первого и положительное в отношении второго. Имеется взаимосвязь между метаболическими и сосудистыми эффектами препаратов. Однако относительно небольшой период наблюдения (3 мес.) не позволяет делать заключение о сохранении выявленных различий при длительной терапии. При условии сохранения данных различий при длительной терапии больных АГ потенциально небиловол может иметь преимущества перед метопрололом в плане улучшения сердечно-сосудистого прогноза, что должно быть подтверждено в дальнейших исследованиях с соответствующим дизайном.
2. Hu G., Qiao Q., Tuomilehto J. et al. Prevalence of the metabolic syndrome and its relation to all-cause and cardiovascular mortality in nondiabetic European men and women. Arch Intern Med. 2004;164(10):1066–1076. DOI: 10.1001/archinte.164.10.1066.
3. Martin B.J., Anderson T.J. Risk prediction in cardiovascular disease: the prognostic significance of endothelial dysfunction. Can J Cardiol. 2009;25(A):15A–20A. DOI: 10.1016/S0828-282X(09)71049-9.
4. Mancia G., Fagard R., Narkiewicz K. et al. 2013 ESH/ESC guidelines for the management of arterial hypertension: the Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Eur Heart J. 2013;34(28):2159–2219. DOI: 10.1093/eurheartj/eht151.
5. Bradley H.A., Wiyonge C.S., Volmink V.A. et al. How strong is the evidence for use of beta-blockers as first line therapy for hypertension? J Hypertens. 2006;24:2131–2141. DOI: 10.1097/01.hjh.0000249685.58370.28.
6. National Institute for Health and Clinical Excellence. Hypertension (CG127): clinical management of primary hypertension in adults. London: Royal College of Physicians (UK); 2011. (Electronic resource.) URL: http://www.nice.org.uk/guidance/CG127 (access date: 02.09.2021).
7. Brook R.D. Mechanism of Differential Effects of Antihypertensive Agents on Serum Lipids. Curr Hypertens Rep. 2000;2:370–377. DOI: 10.1007/s11906-000-0040-0.
8. Frishman W.H. Alpha- and beta-adrenergic blocking drugs. In: Frishman W.H., Sica D.A., eds. Cardiovascular Pharmaceutics, 3rd ed. Minneapolis, M.N.: Cardiotext Inc.;2011:57–86.
9. Ram C.V. Beta-blockers in hypertension. Am J Cardiol. 2010;106(12):1819–1825. DOI: 10.1016/j.amjcard.2010.08.023.
10. Bangalore S., Parkar S., Grossman E., Messerli F.H. A meta-analysis of 94,492 patients with hypertension treated with beta blockers to determine the risk of new-onset diabetes mellitus. Am J Сardiol. 2007;100(8):1254–1262. DOI: 10.1016/j.amjcard.2007.05.057.
11. Bakris G.L., Fonseca V., Katholi R.E. et al. Metabolic effects of carvedilol vs metoprolol in patients with type 2 diabetes mellitus and hypertension: a randomized controlled trial. JAMA. 2004;292(18):2227–2236. DOI: 10.1001/jama.292.18.2227.
12. Torp-Pedersen C., Metra M., Charlesworth A. et al. Effects of metoprolol and carvedilol on pre-existing and new onset diabetes in patients with chronic heart failure: data from the Carvedilol Or Metoprolol European Trial (COMET). Heart. 2007;93(8):968–973. DOI: 10.1136/hrt.2006.092379.
13. Agabiti Rosei E., Rizzoni D. Metabolic profile of nebivolol, a beta-adrenoceptor antagonist with unique characteristics. Drugs. 2007;67(8):1097–1107. DOI: 10.2165/00003495-200767080-00001.
14. Wehland M., Grosse J., Simonsen U. et al. The effects of newer beta-adrenoceptor antagonists on vascular function in cardiovascular disease. Curr Vasc Pharmacol. 2012;10(3):378–390. DOI: 10.2174/157016112799959323.
15. Celermajer D.S., Sorensen K.E., Gooch V.M. et al. Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis. Lancet. 1992;340:1111–1115. DOI: 10.1016/0140-6736(92)93147-F.
16. Fonseca V.A. Effects of beta-blockers on glucose and lipid metabolism. Curr Med Res Opin. 2010;26(3):615–629. DOI: 10.1185/03007990903533681.
17. Brixius K., Bundkirchen A., Bölck B. et al. Nebivolol, bucindolol, metoprolol and carvedilol are devoid of intrinsic sympathomimetic activity in human myocardium. Br J Pharmacol. 2001;133(8):1330–1338. DOI: 10.1038/sj.bjp.0704188.
18. Pischon T., Sharma A.M. Use of beta-blockers in obesity hypertension: potential role of weight gain. Obes Rev. 2001;2(4):275–280. DOI: 10.1046/j.1467-789X.2001.00044.x.
19. Astrup A., Simonsen L., Bülow J. et al. Epinephrine mediates facultative carbohydrate-induced thermogenesis in human skeletal muscle. Am J Physiol. 1989;257(3:Pt 1):E340–E345. DOI: 10.1152/ajpendo.1989.257.3.E340.
20. Lamont L.S. Beta-blockers and their effects on protein metabolism and resting energy expenditure. J Cardiopulm Rehabil. 1995;15(3):183–185. DOI: 10.1097/00008483-199505000-00003.
21. Mason R.P., Giles T.D., Sowers J.R. Evolving mechanisms of action of beta blockers: focus on nebivolol. J Cardiovasc Pharmacol. 2009;54(2):123–128. DOI: 10.1097/FJC.0b013e3181ad207b.
22. Khouri C., Jouve T., Blaise S. et al. Peripheral vasoconstriction induced by β-adrenoceptor blockers: a systematic review and a network meta-analysis. Br J Clin Pharmacol. 2016;82(2):549–560. DOI: 10.1111/bcp.12980.
23. Vanhoutte P.M. Endothelial dysfunction: the first step toward coronary arteriosclerosis. Circ J. 2009;73(4):595–601. DOI: 10.1253/circj.CJ-08-1169.
24. Бубнова М.Г. Возможности современного β-адреноблокатора небиволола в контроле артериальной гипертонии и управлении сердечно-сосудистым риском пациента. Атмосфера. Новости кардиологии. 2015;1:28–35. [Bubnova M.G. Possibilities of the modern β-blocker nebivolol in the control of arterial hypertension and the management of the patient’s cardiovascular risk. Atmosphere. Cardiology news. 2015;1:28–35 (in Russ.)].
25. Bangalore S., Steg G., Deedwania P. et al. β-Blocker use and clinical outcomes in stable outpatients with and without coronary artery disease. JAMA. 2012;308(13):1340–1349. DOI: 10.1001/jama.2012.12559.
26. Almgren T., Wilhelmsen L., Samuelsson O. et al. Diabetes in treated hypertension is common and carries a high cardiovascular risk: results from a 28-year follow-up. J Hypertens. 2007;25(6):1311–1317. DOI: 10.1097/HJH.0b013e328122dd58.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
