Спекл-трекинг эхокардиография для оценки сократимости левого желудочка при остром нижнем инфаркте миокарда
DOI: 10.32364/2587-6821-2021-5-4-169-175
Цель исследования: оценить результаты эхокардиографии с применением спекл-трекинг технологии пациентов трудоспособного возраста с острым нижним инфарктом миокарда (ИМ) в раннем периоде после стентирования коронарных артерий.
Материал и методы: эхокардиографию с использованием спекл-трекинг технологии провели на ультразвуковом сканере Epiq-7 (Philips, США) 55 пациентам с острым нижним ИМ через 1 нед. после чрескожного коронарного вмешательства и 29 практически здоровым лицам трудоспособного возраста. Пациентов с острым нижним ИМ разделили на 2 группы: с наличием зон нарушений локальной сократимости (дис-, а- и гипокинез) — 45 человек, без зон нарушений локальной сократимости — 10 человек.
Результаты исследования: по данным ангиографии наиболее частой причиной ИМ являлась окклюзия правой коронарной артерии (в 1-й группе — в 82,2% случаев, во 2-й группе — в 60% случаев) на фоне многососудистого поражения (в 84,4% и 90% соответственно). В группе с нарушением локальной сократимости снижение фракции выброса левого желудочка (ФВ ЛЖ) регистрировали в 28,9% случаев, глобальной продольной деформации — в 86,7% случаев, глобальной циркулярной деформации — в 76,7% случаев, тогда как в группе с сохраненной локальной сократимостью ФВ ЛЖ оставалась в пределах нормы, глобальная продольная деформация ухудшалась в 100% случаев, а циркулярная деформация — в 70%. Наличие и степень локальной дисфункции не влияли на степень уменьшения сегментарной деформации (медиана варьировала от -9% до -15%). При нижнем ИМ регионарная деформация нарушалась в 6 нижних (базальных и медиальных нижнеперегородочных, нижних и нижнебоковых) сегментах ЛЖ как при гипокинезе, так и при нормокинезе.
Заключение: диагностическая ценность ультразвуковой оценки систолической функции ЛЖ по спекл-трекинг технологии значительно возрастает по сравнению с диагностической ценностью ориентации только на ФВ и объективизирует эффективность хирургического вмешательства. Другим преимуществом данной программы является возможность количественного выражения динамики восстановления как глобальной, так и локальной систолической сократимости, что позволяет осуществлять персонифицированную терапию.
Ключевые слова: нижний инфаркт миокарда, эхокардиография, спекл-трекинг технология, чрескожное коронарное вмешательство, фракция выброса.
Для цитирования: Акрамова Э.Г., Власова Е.В. Спекл-трекинг эхокардиография для оценки сократимости левого желудочка при остром нижнем инфаркте миокарда. РМЖ. Медицинское обозрение. 2021;5(4):169-175. DOI: 10.32364/2587-6821-2021-5-4-169-175.
E.G. Akramova1,2, Е.V. Vlasova2
1Kazan State Medical Academy — Branch of the Russian Medical Academy
of Continuous Professional Education, Kazan, Russian Federation
2Medical Wing of the Kazan Federal University, Kazan, Russian Federation
Aim: to assess the results of speckle tracking echocardiography (STE) in patients of working age with acute inferior wall myocardial infarction (MI) in the early period after coronary stenting.
Patients and Methods: STE was performed using EPIQ-7 Ultrasound Machine (Philips, USA) in 55 patients with acute inferior wall MI one week after percutaneous coronary intervention and 29 healthy individuals of working age. Patients with acute inferior wall MI were divided into two subgroups, i.e., with (n=45) or without (n=10) areas of local contractile impairment (dyskinesia, akinesia, hypokinesia).
Results: the most common cause of MI was the occlusion of the right coronary artery (82.4% in subgroup 1 and 60% in subgroup 2) in multivascular involvement (84.4% and 90%. respectively). In patients with local contractile impairment, reduced left ventricular ejection fraction (EF) was reported in 28.9%, global longitudinal strain in 86.7%, and global circular strain in 76.7% . Meanwhile, in patients without local contractile impairment, left ventricular ejection fraction (LV EF) was within normal ranges, global longitudinal strain was reported in 100% and global circumferential strain in 70%. The presence and severity of local dysfunction did not affect the reduction in segmental strain (median varied from -9% to -15%). In inferior wall MI, the abnormal regional longitudinal strain of 6 LV segments (basal and mid inferoseptal, inferior, and inferolateral) was reported in both hypokinesia and normokinesia.
Conclusions: ultrasound evaluation of systolic LV function using STE is characterized by greater diagnostic value compared to the measurement of EF only and objectifies the efficacy of surgery. Quantitative assessment of the recovery of both global and local systolic contractility is another advantage of STE allowing for personalized treatment.
Keywords: inferior wall myocardial infarction, echocardiography, speckle tracking technology, perc utaneous coronary intervention, ejection fraction.
For citation: Akramova E.G., Vlasova Е.V. Assessment of left ventricular contractility in acute inferior wall myocardial infarction by speckle tracking echocardiography. Russian Medical Inquiry. 2021;5(4):169–175 (in Russ.). DOI: 10.32364/2587-6821-2021-5-4-169-175.
Введение
Инфаркт миокарда (ИМ) продолжает оставаться одной из ведущих проблем здравоохранения, несмотря на внедрение ряда новых хирургических и консервативных методов и тактик лечения, в том числе чрескожного коронарного вмешательства (ЧКВ) с установкой стента в инфаркт-зависимой артерии. Согласно данным Британского регистра ЧКВ, полученным при анализе 88 188 ИМ с подъемом ST-сегмента за 2005–2013 гг., пятилетняя выживаемость с исключением внесосудистой смерти составляет 87,1% [1]. Долговременный прогноз после проведения реперфузии миокарда в немалой степени зависит от своевременности и качества диагностики структурно-функциональных изменений сердца, способствующей адекватному ведению пациентов.
При стратификации риска для данного контингента фундаментальным критерием выступает величина фракции выброса (ФВ) левого желудочка (ЛЖ) [2]. Вместе с тем значения ФВ, хотя и выражаются количественно, во многом определяются квалификацией специалиста ультразвуковой диагностики, что отражается в 10–14% межисследовательской вариабельности показателя [3]. Кроме того, регионарные дисфункции регистрируют лишь при ИМ, составляющем более 10% от площади ЛЖ, и трансмуральности более 52%, определяя диагностическую точность ультразвуковых показателей систолической функции ЛЖ относительно результатов, полученных с помощью МРТ, на уровне 78%, а прогностическую ценность отрицательного результата — на уровне 62% [4].
Включение в программы современных ультразвуковых сканеров спекл-трекинг технологии дополнило субъективную визуальную оценку глобальной и локальной сократимости сердца полуавтоматической цифровой технологией. В настоящее время, по данным комитета Европейской ассоциации сердечно-сосудистой визуализации (European Association of Cardiovascular Imaging, EACVI), из 96 лабораторий эхокардиографии в 22 странах программу спекл-трекинг визуализации имеют 96%. Однако отсутствие нормативов глобальной и локальной деформации миокарда желудочков обусловливает ее ограниченное использование. В Европе технологию спекл-трекинг используют повседневно только в 37% лабораторий, в отдельных случаях — в 59%, не используют — в 4% [5]. Наиболее часто к ней обращаются при подозрении на дисфункцию ЛЖ при сохранной ФВ.
При анализе данных пациентов, госпитализированных с диагнозом острого ИМ в медико-санитарную часть ФГАОУ ВО КФУ в 2018 г., установлено, что 41,5% имели поражение нижней стенки ЛЖ, которое по сравнению с передним ИМ чаще сопровождалось распространенным коронарным атеросклерозом (в 71,4% и 44,4% случаев соответственно, p=0,01). Пациенты с таким диагнозом, как правило, в стационар попадали позже (в первые сутки — 88,9% и 64,2% соответственно, p=0,01), умирали в более молодом возрасте (медиана возраста — 68 лет и 81 год соответственно), госпитальная летальность среди них была более высокой (6,2% и 2,8% соответственно, p=0,01).
Цель исследования: оценить результаты эхокардиографии с применением спекл-трекинг технологии пациентов трудоспособного возраста с острым нижним ИМ в раннем периоде после стентирования коронарных артерий.
Материал и методы
Выборка включала данные эхокардиографии 55 человек (44 мужчины и 11 женщин трудоспособного возраста) с острым нижним ИМ из контингента лиц, поступивших в медико-санитарную часть ФГАОУ ВО КФУ с июня 2019 г. по май 2020 г. Контрольная группа состояла из 29 практически здоровых лиц соответствующего возраста и пола. Критериями исключения из анализа были возраст старше 65 лет, фибрилляция предсердий, постинфарктный кардио-склероз, неудовлетворительное качество ультразвуковых изображений.
Исследование проводили на ультразвуковом сканере Epiq-7 (Philips, США) через 1 нед. после ЧКВ. Глобальную систолическую функцию ЛЖ оценивали по ФВ по Симпсону, экскурсии латерального конца фиброзного кольца (mitral annular plane systolic excursion, MAPSE) в М-режиме, скоростям систолического движения латерального (S’L) и септального (S’s) концов фиброзного кольца митрального клапана в импульсно-волновом режиме тканевого допплера, глобальным продольной (global longitudinal strain, GLS) и циркулярной (global circumferential strain, GCS) деформациям по спекл-трекинг технологии. За норму принимали ФВ ЛЖ для мужчин >52%, для женщин — >54% [6], GLS — <-18% [7]. Регионарную функцию ЛЖ анализировали визуально в двухмерном режиме по 16 сегментам с подсчетом индекса движения стенки (wall motion score index, WMSI) и количественно по спекл-трекинг технологии согласно продольным и циркулярным деформациям 17 сегментов ЛЖ [6]. Нарушение локальной сократимости диагностировали при визуализации дис-, а- или гипокинеза >2 смежных сегментов.
Модели смертности и повторной госпитализации в связи с сердечной недостаточностью после острого ИМ четко показали большую прогностическую значимость нарушений локальной сократимости по сравнению с ФВ ЛЖ [8]. Исходя из данного положения, пациентов с острым нижним ИМ по результатам визуального исследования в двухмерном режиме сократимости ЛЖ разделили на 2 группы: с наличием зон нарушений локальной сократимости (дис-, а- и гипокинез) — 45 человек, без зон нарушений локальной сократимости — 10 человек. В обеих группах превалировали мужчины 50–65 лет (80%).
Статистическую обработку данных провели с использованием программы AtteState версии 12.0.5 (Гайдышев И.П., Россия) для Microsoft Excel. Проверку нормальности распределения вариационных рядов осуществляли с помощью общепризнанных критериев Колмогорова — Смирнова. Вычисляли медиану, верхний и нижний квартили (Me (Q25; Q75)) анализируемых выборок. Статистическую значимость различий определяли непараметрическим методом с помощью U-критерия Манна — Уитни. Совпадение значений двух независимых выборок принимали за нулевую гипотезу. Критическим уровнем значимости при проверке статистических гипотез приняли p<0,05.
Результаты исследований
Ангиография показала, что чаще всего причиной ИМ была окклюзия правой коронарной артерии (в группе с наличием зон нарушения локальной сократимости — у 82,2%, в группе без зон нарушения локальной сократимости — у 60%) на фоне многососудистого поражения (у 84,4% и 90% соответственно).
Индекс WMSI, учитывающий не только количество, но и степень поражения (дис-, а- и гипокинез), составил 1,13 (1,06; 1,19) при норме 1,0. У 13,3% пациентов из группы с наличием зон нарушения локальной сократимости выявили акинез, у остальных — гипокинез, характеризующийся снижением систолического утолщения и движения пораженного сегмента. Среди 45 лиц с нарушениями локальной сократимости чаще визуализировали а- и гипокинез медиального нижнего (44,4%), базальных нижнего (68,9%) и нижнебокового (49%) сегментов ЛЖ.
В двухмерном режиме по величине ФВ в группе с нарушениями локальной сократимости в 28,9% случаев регистрировали незначительное снижение глобальной функции ЛЖ (у женщин — до 44%, у мужчин — до 42%), тогда как среди лиц без зон изменений локальной сократимости ФВ ЛЖ оставалась в пределах нормальных значений.
Значения MAPSE в М-режиме и S’L и S’s в импульсно-волновом режиме тканевого допплера отражают продольную систолическую функцию ЛЖ. В группе с нарушением локальной сократимости относительно показателей контрольной группы значение медианы MAPSE снижалось, но оставалось в пределах рекомендуемых норм (табл. 1) [6].
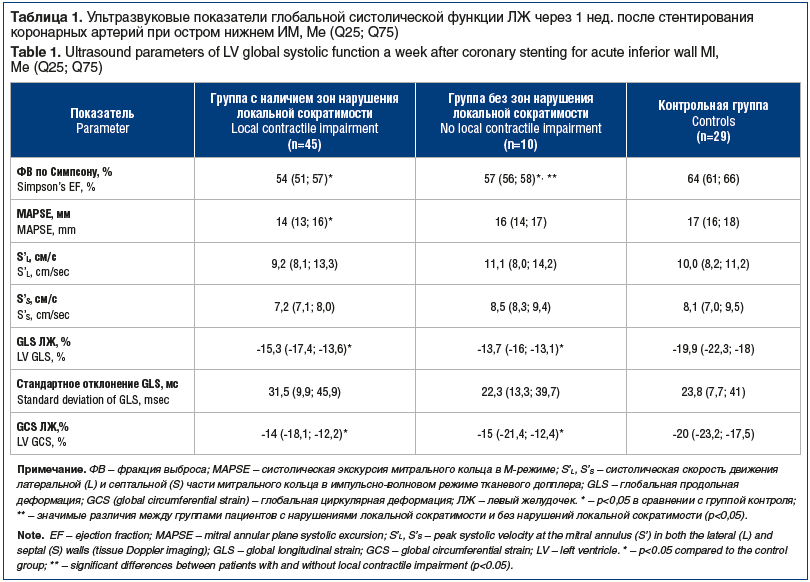
Эхокардиография с использованием спекл-трекинга выявила снижение глобальной деформации миокарда ЛЖ как в продольном, так и в циркулярном направлении относительно и контрольной группы, и рекомендуемых норм. Принципиально важным является то, что такие изменения обнаружили в обеих группах пациентов с острым нижним ИМ.
Среди лиц с нарушением локальной сократимости снижение GLS регистрировали в 86,7% случаев, GCS — в 76,7%, т. е. частота выявления глобальной систолической дисфункции ЛЖ по сравнению с традиционной ориентацией на ФВ повышалась в 3 раза. Более того, в группе с сохранной локальной сократимостью у всех обследованных визуализировали изменения GLS, у 70% — изменения GCS.
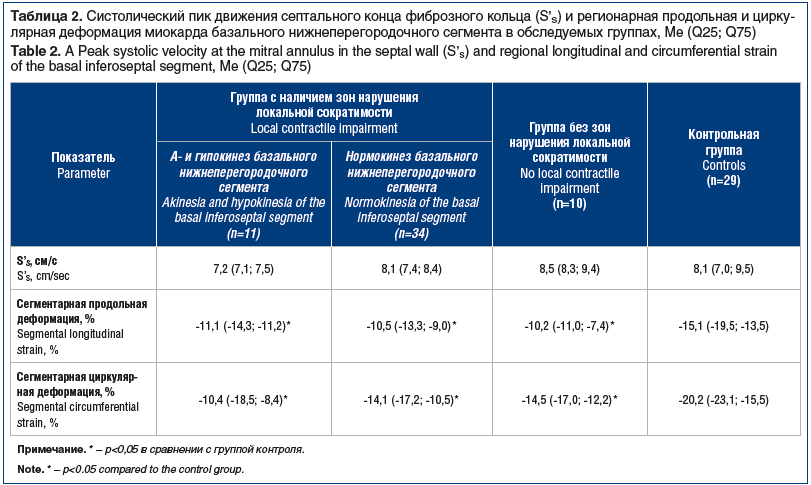
В группе с зонами нарушения локальной сократимости у 11 пациентов визуализировали а- или гипокинез базального нижнеперегородочного сегмента ЛЖ, у остальных 34 лиц сократимость данного сегмента сохранена. Величину S’S определяют с септального конца фиброзного кольца митрального клапана в четырехкамерной апикальной позиции, являющегося основанием базального нижнеперегородочного сегмента миокарда ЛЖ. По спекл-трекинг технологии определяют не только глобальную, но и сегментарную деформацию. Для оценки роли наличия или отсутствия нарушения сократимости базального нижнеперегородочного сегмента ЛЖ значения параметров, измеряемых в данном сегменте (S’S, продольная и циркулярная деформация), разделили на подгруппы с а- и гипокинезом базального нижнеперегородочного сегмента и нормокинезом данного сегмента. Статистически значимые различия по значению систолического пика движения септального конца фиброзного кольца (S’s) и регионарной продольной и циркулярной деформации миокарда базального нижнеперегородочного сегмента между подгруппами отсутствовали (табл. 2).
Значения S’L и MAPSE регистрируют по движению латерального конца фиброзного кольца митрального клапана в четырехкамерной апикальной позиции, являющегося основанием базального переднебокового сегмента миокарда ЛЖ. Гипокинез базального переднебокового сегмента ЛЖ среди обследованных пациентов отсутствовал. Тем не менее медиана MAPSE среди лиц с гипокинезом соседнего с ним базального нижнебокового сегмента (14 (13; 16) мм) очень высоко значимо отличалась (p=0,0003) от аналогичного показателя группы без зон нарушения локальной сократимости (16 (14; 17) мм).
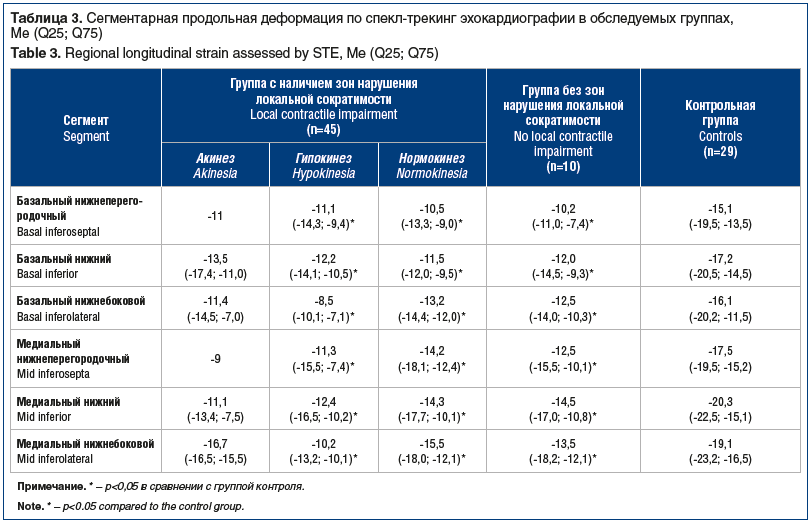
По спекл-трекинг технологии определяют не только глобальную, но и сегментарную деформацию. У каждого из 45 лиц группы с наличием зон нарушения локальной сократимости проанализирована локальная систолическая функция 6 нижних сегментов (базальный нижний, базальный нижнеперегородочный, базальный нижнебоковой, медиальный нижний, медиальный нижнеперегородочный и медиальный нижнебоковой). Из этих 270 сегментов 17 сегментов были акинетичны, 82 — гипокинетичны, остальные — нормокинетичны. Вопреки ожиданиям степень снижения сегментарной продольной деформации не зависела от наличия и вида (а-, гипокинез) нарушения систолического сокращения (табл. 3). Более того, ухудшение регионарной продольной деформации всех 6 нижних сегментов ЛЖ у пациентов с острым нижним ИМ наблюдали как в группе с нарушением локальной сократимости, так и в группе с отсутствием нарушения локальной сократимости.
Во всех 3 анализируемых группах (группы с зонами нарушения локальной сократимости и без зон нарушения локальной сократимости, контрольная группа) непараметрическая корреляция между толщиной базального нижнебокового сегмента ЛЖ и величиной сегментарной деформации данного сегмента оказалась статистически незначимой. В двухмерном режиме утолщение базального нижнебокового сегмента (≥11 мм) выявляли у 59% лиц с нижнебоковым гипокинезом: у 50% — с нижним гипокинезом и у 63,6% с нижнеперегородочным гипокинезом. Не исключено, что утолщение вызвано развитием отека мио-карда. У 17,7% пациентов с нарушением локальной сократимости и у 30% с сохраненной локальной сократимостью за нижней и нижнебоковой стенкой ЛЖ визуализировали небольшое количество жидкости в виде диастолической сепарации листков перикарда до 1–2 мм. Такой небольшой объем жидкости в протоколе указывать не принято, но его наличие на фоне ИМ может косвенно указывать на развивающиеся нарушения сократимости данных сегментов.
Обсуждение
В зависимости от локализации поражения ЛЖ сердца выделяют передний и нижний ИМ. На сегодняшний день внимание клиницистов смещено в сторону переднего ИМ, характеризующегося более выраженной клиникой и, как считали на протяжении многих десятилетий, худшим прогнозом. Данные о распространенности, госпитальной летальности и трехлетней смертности нижнего ИМ в нашем учреждении совпадают с результатами других исследователей, свидетельствуя о равнозначности встречаемости двух форм ИМ при больших рисках отдаленных неблагоприятных последствий нижнего ИМ [9, 10].
В ряде работ показано, что после реперфузионной терапии сократительная функция ЛЖ восстанавливается относительно быстро. Даже при ФВ ЛЖ менее 40% в острый период уже через 3 мес. она не восстанавливается только у 28% пациентов [11]. Длительное сохранение низкой ФВ ЛЖ расценивают как фактор высокого риска смерти. Наблюдение на протяжении более 10 лет за пациентами с нижним ИМ (n=1000) выявило, что среди умерших были худшие значения ФВ (43±10%) и GLS ЛЖ (-12,0±3,5%) по сравнению с выжившими (48±9% и -14,2±3,5% соответственно; p=0,001) [12].
Значения менее 50% при нижнем ИМ относят к независимым предикторам трехлетней смертности [10]. В нашем исследовании у большинства пациентов на фоне как отсутствия, так и наличия зон нарушения локальной сократимости ФВ ЛЖ оставалась в пределах нормы. В ряде работ также показано, что для нижнего ИМ характерна сохраненная или незначительно сниженная ФВ ЛЖ [13–15]. Нормальные значения ФВ ЛЖ, определяемые в В-режиме, после хирургического вмешательства могут дезориентировать при выборе тактики и стратегии ведения пациента. В этих случаях для установления риска неблагоприятного исхода наиболее оптимальным вариантом выступает величина GLS ЛЖ по спекл-трекинг. Так, значение более -12,65% в первые 48 ч после реперфузии (n=110) свидетельствовало о высокой вероятности неблагоприятных событий через 30 дней: сердечно-сосудистой смерти, повторной госпитализации из-за сердечной недостаточности или необходимости срочной реваскуляризации [2].
В более ранних работах показано, что через 1 нед. после ЧКВ у лиц с нижним ИМ улучшение GLS, GCS и радиальной деформаций не происходит или восстанавливается лишь продольная деформация при сохранении нарушений базальной ротации [16, 17]. Позже использование однофотонной эмиссионной компьютерной томографии позволило установить, что между GLS ЛЖ и размером ИМ существует весомая связь и один показатель можно выводить из другого: при площади ИМ более 20% значения деформации будут менее -11,9%; при площади, превышающей 40%, — более -10,7% [18]. Хотя, по другим источникам (n=1128), нарушения GLS ЛЖ ассоциируются не с размером ИМ, а с наличием и тяжестью остаточной ишемии [19]. Отсутствие восстановления деформации миокарда в раннем периоде после ЧКВ может быть также объяснено сохранением отека и оглушенности миокарда ЛЖ. По результатам МРТ сердца с контрастным усилением на 2-е сутки после ЧКВ у 70,2% пациентов с ИМ развивается феномен микрососудистого повреждения в виде обструкции и/или геморрагического пропитывания миокарда [20]. Подобные повреждения объясняют фрагментацией и дистальной эмболизацией тромба в момент выполнения реканализации.
У лиц с острым ИМ нижней стенки ЛЖ при визуальном осмотре в двухмерном режиме а-, гипокинез обычно выявляют лишь в 2–3 из 16 сегментов ЛЖ. В то же время исследования с применением спекл-трекинг технологии демонстрируют, что регионарная деформация ЛЖ ухудшается в 87% сегментов и улучшается после ЧКВ в 60% сегментов [17]. Территория кровоснабжения правой коронарной артерии (по нашим данным, инфаркт-связанная артерия в 78,2% случаев нижнего ИМ) не превышает 6 сегментов, огибающая артерия (21,2%) — не более 5 из 17 сегментов. Следовательно, площадь ЛЖ с нарушением сегментарной деформации больше области перфузии артерии, ответственной за возникновение ИМ. Предполагают, что нарушение продольной деформации вне области перфузии инфаркт-связанной коронарной артерии может быть ведущим маркером неблагоприятных исходов [21].
Выявленное уменьшение движения латерального конца фиброзного кольца митрального клапана в четырехкамерной апикальной позиции при нормокинезе базального переднебокового сегмента миокарда ЛЖ и гипокинезе базального нижнебокового сегмента, вероятнее всего, свидетельствует о том, что MAPSE в большей степени отражает снижение GLS, чем топографию локальной дисфункции. Подтверждением могут служить результаты МРТ, по которым уменьшение смещения атриовентрикулярного кольца у пациентов с ИМ через 1 нед. после ЧКВ не зависело от площади и местоположения поражения [22].
Субъективность оценки локальной сократимости по двухмерному режиму определяет интерес к взаимоотношениям а- и гипокинеза со значениями деформации пораженных сегментов, регистрируемых по спекл-трекинг технологии. Показано, что у лиц с ИМ высокую чувствительность и специфичность при диагностике трансмуральных сегментов по МРТ имеет значение сегментарной продольной деформации более -12%, акинетичных сегментов по эхокардиографии — -13,3%, гипокинетичных сегментов ЛЖ по эхокардиографии — -16,8% [23, 24]. При дискинезе стенки ЛЖ в отсутствие коронарного атеросклероза, например при стрессовой кардиомиопатии и псевдодискинезе на фоне сдавления нижней стенки ЛЖ диафрагмой, показатели сегментарной деформации остаются в норме [26, 27]. В то же время при нестабильной стенокардии стеноз более 70% правой коронарной и огибающей артерий снижал продольную сегментарную деформацию соответственно базального нижнего (с -19 до -12,5%) и базального бокового (с -21 до -14%) сегментов ЛЖ в отсутствие нарушения локальной сократимости [25]. По нашим данным, наличие и степень локальной дисфункции не влияют на степень снижения сегментарной деформации (медиана варьировала от -9 до -15%). В 6 нижних сегментах сегментарная деформация снижалась при нижнем ИМ как при наличии их а-, гипокинеза, так и в их отсутствие.
Заключение
Эхокардиографическое обследование с использованием спекл-трекинг технологии пациентов трудоспособного возраста с острым нижним ИМ в раннем периоде после стентирования коронарных артерий выявило снижение GLS (в 86,7% случаев при нарушении локальной сократимости и в 100% случаев при сохранной локальной сократимости) и GCS (в 76,7% и 70% соответственно). Диагностическая ценность ультразвуковой оценки систолической функции ЛЖ по спекл-трекинг технологии значительно возрастает по сравнению с ориентацией только на ФВ и объективизирует эффективность хирургического вмешательства. Другим преимуществом данной программы является возможность количественного выражения динамики восстановления как глобальной, так и локальной систолической сократимости, что позволяет осуществлять персонифицированную терапию.
Сведения об авторах:
Акрамова Эндже Гамировна — д.м.н., доцент, доцент кафедры ультразвуковой диагностики КГМА — филиала ФГБОУ ДПО РМАНПО Минздрава России; 420012, Россия, г. Казань, ул. Бутлерова, д. 36; врач отделений ультразвуковой и функциональной диагностики медико-санитарной части ФГАОУ ВО КФУ; 420043, Россия, г. Казань, ул. Чехова, д. 1A; ORCID iD 0000-0002-1900-7726.
Власова Евгения Валерьевна — врач отделения ультразвуковой диагностики медико-санитарной части ФГАОУ ВО КФУ; 420043, Россия, г. Казань, ул. Чехова, д. 1A; ORCID iD 0000-0002-4254-6971.
Контактная информация: Власова Евгения Валерьевна, e-mail: kardioevgeniya@gmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 26.07.2020.
Поступила после рецензирования 17.08.2020.
Принята в печать 05.09.2020.
About the authors:
Endzhe G. Akramova — Dr. Sc. (Med.), Associate Professor, Associate Professor of the Department of Ultrasound Diagnostics, Kazan State Medical Academy — Branch of the Russian Medical Academy of Continuous Professional Education; 36, Butlerov str., Kazan, 420012, Russian Federation; physician of the Department of Ultrasound Diagnostics and Functional Diagnostics, Medical Wing of the Kazan Federal University; 1A, Chekhov str., Kazan, 420043, Russian Federation; ORCID iD 0000-0002-1900-7726.
Evgeniya V. Vlasova — physician of the Department of Ultrasound Diagnostics, Medical Wing of the Kazan Federal University; 1A, Chekhov str., Kazan, 420043, Russian Federation; ORCID iD 0000-0002-4254-6971.
Contact information: Evgeniya V. Vlasova, e-mail: kardioevgeniya@gmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 26.07.2020.
Revised 17.08.2020.
Accepted 05.09.2020.
2. Bendary A., Tawfeek W., Mahros M., Salem M. The predictive value of global longitudinal strain on clinical outcome in patients with ST‐segment elevation myocardial infarction and preserved systolic function. Echocardiography. 2018;35:915–921. DOI: 10.1111/echo.13866.
3. Thavendiranathan P., Popović Z.B., Flamm S.D. et al. Improved interobserver variability and accuracy of echocardiographic visual left ventricular ejection fraction assessment through a self-directed learning program using cardiac magnetic resonance images. J Am Soc Echocardiogr. 2013;26(11):1267–1273. DOI: 10.1016/j.echo.2013.07.017.
4. Van Mourik M.J.W., Zaar D.V.J., Smulders M.W. et al. Adding Speckle-Tracking Echocardiography to Visual Assessment of Systolic Wall Motion Abnormalities Improves the Detection of Myocardial Infarction. J Am Soc Echocardiogr. 2019;32(1):65–73. DOI: 10.1016/j.echo.2018.09.007.
5. Marsan N.A., Michalski B., Cameli M. et al. EACVI Survey on Standardization of Cardiac Chambers Quantification by Transthoracic Echocardiography. Eur Heart J Cardiovasc Imaging. 2020;21(2):119–123. DOI: 10.1093/ehjci/jez297.
6. Lang R.M., Badano L.P., Mor-Avi V. et al. Recommendations for Cardiac Chamber Quantification by Echocardiography in Adults: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2015;28:1–39. DOI: 10.1016/j.echo.2014.10.003.
7. Galderisi M., Cosyns B., Edvardsen T. et al. Standardization of Adult Transthoracic Echocardiography Reporting in Agreement With Recent Chamber Quantification, Diastolic Function, and Heart Valve Disease Recommendations: An Expert Consensus Document of the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2017;18(12):1301–1310. DOI: 10.1093/ehjci/jex244.
8. Møller J.E., Hillis G.S., Oh J.K. et al. Wall motion score index and ejection fraction for risk stratification after acute myocardial infarction. Am Heart J. 2006;151:419–425. DOI: 10.1016/j.ahj.2005.03.042.
9. Mishra T.K., Das B. ST-Segment Elevated Acute Myocardial Infarction: Changing Profile Over Last 24 Years. J Assoc Physicians India. 2016;64(6):28–34.
10. Huang X., Redfors B., Chen S. et al. Predictors of mortality in patients with non‐anterior ST‐segment elevation myocardial infarction: Analysis from the HORIZONS‐AMI trial. Catheter Cardiovasc Interv. 2019;94:172–180. DOI: 10.1002/ccd.28096.
11. Stolfo D., Cinquetti M., Merlo M. et al. ST-elevation myocardial infarction with reduced left ventricular ejection fraction: Insights into persisting left ventricular dysfunction. A pPCI-registry analysis. Int J Cardiol. 2016;215:340–345. DOI: 10.1016/j.ijcard.2016.04.097.
12. Abou R., Goedemans L., van der Bijl P. et al. Correlates and Long-Term Implications of Left Ventricular Mechanical Dispersion by Two-Dimensional Speckle-Tracking Echocardiography in Patients with ST-Segment Elevation Myocardial Infarction. J Am Soc Echocardiogr. 2020;33(8):964–972. DOI: 10.1016/j.echo.2020.03.010.
13. Rajesh G.N., Raju D., Nandan D. et al. Echocardiographic assessment of right ventricular function in inferior wall myocardial infarction and angiographic correlation to proximal right coronary artery stenosis. Indian Heart J. 2013;65:522–528. DOI: 10.1016/j.ihj.2013.08.021.
14. El Sebaie M.H., El Khateeb O. Right ventricular echocardiographic parameters for prediction of proximal right coronary artery lesion in patients with inferior wall myocardial infarction. J Saudi Heart Assoc. 2016;28:73–80. DOI: 10.1016/j.jsha.2015.10.002.
15. Feldmann K.J., Goldstein J.A., Marinescu V. et al. Disparate Impact of Ischemic Injury on Regional Wall Dysfunction in Acute Anterior vs Inferior Myocardial Infarction. Cardiovasc Revasc Med. 2019;20(11):965–972. DOI: 10.1016/j.carrev.2018.12.016.
16. Park S.M., Hong S.J., Ahn C.M. et al. Different impacts of acute myocardial infarction on left ventricular apical and basal rotation. Eur Heart J Cardiovasc Imaging. 2012;13(6):483–489. DOI: 10.1093/ejechocard/jer272.
17. Song C.F., Zhou Q., Guo R.Q. Alteration in the global and regional myocardial strain patterns in patients with inferior ST-elevation myocardial infarction prior to and after percutaneous coronary intervention. Kaohsiung J Med Sci. 2014;30(1):29–34. DOI: 10.1016/j.kjms.2013.04.005.
18. Doğan C., Bayram Z., Candan Ö. et al. Prediction of infarct size using two‐dimensional speckle tracking echocardiography in acute myocardial infarction. Echocardiography. 2017;34:376–382. DOI: 10.1111/echo.13457.
19. Dimitriu-Leen A.C., Scholte A.J.H.A., Katsanos S. et al. Influence of Myocardial Ischemia Extent on Left Ventricular Global Longitudinal Strain in Patients After ST-Segment Elevation Myocardial Infarction. Am J Cardiol 2017;119:1–6. DOI: 10.1016/j.amjcard.2016.08.091.
20. Алексеева Я.В., Вышлов Е.В., Рябов В.В. и др. Феномены микрососудистого повреждения миокарда при первичном инфаркте миокарда с подъемом сегмента ST. Кардиологический вестник. 2019;14(2):54–60. [Alekseeva I.V., Vishlov E.V., Rabov V.V. et al. Phenomena of microvascular myocardial damage in primary myocardial infarction with SТ segment elevation. Kardiologicheskij vestnik. 2019;14(2):54–60 (in Russ.)].
21. Biering-Sørensen T., Jensen J.S., Pedersen S.H. et al. Regional Longitudinal Myocardial Deformation Provides Incremental Prognostic Information in Patients with ST-Segment Elevation Myocardial Infarction. PLoS One. 2016;11(6):e0158280. DOI: 10.1371/journal.pone.0158280.
22. Pahlm U., Seemann F., Engblom H. et al. Longitudinal left ventricular function is globally depressed within a week of STEMI. Clin Physiol Funct Imaging. 2018;38:1029–1037. DOI: 10.1111/cpf.12521.
23. Eitan A., Kehat I., Mutlak D. et al. Longitudinal two-dimensional strain for the diagnosis of left ventricular segmental dysfunction in patients with acute myocardial infarction. Int J Cardiovasc Imaging. 2018;34(2):237–249. DOI: 10.1007/s10554-017-1231-y.
24. Driss A.B., Lepage C.B.D., Sfaxi A. et al. Strain predicts left ventricular functional recovery after acute myocardial infarction with systolic dysfunction. Int J Cardiol. 2020;307:1–7. DOI: 10.1016/j.ijcard.2020.02.039.
25. Santos N.S.S.D., Vilela A.A., Barretto R.B.M. et al. Applicability of Longitudinal Strain of Left Ventricle in Unstable Angina. Arq Bras Cardiol. 2018;110(4):354–361. DOI: 10.5935/abc.20180062.
26. Kataoka A., Funabashi N., Yajima R. et al. Differentiation of pseudodyskinesis of inferior left ventricular wall from inferior myocardial infarction by assessment of regional myocardial strain using two-dimensional speckle tracking echocardiography. International Journal
of Cardiology. 2011;152(3):362–368. DOI: 10.1016/j.ijcard.2010.08.006.
27. Ahmed M., Sardana M., Rasla S. et al. Comparative Left Ventricular Mechanical Deformation in Acute Apical Variant Stress Cardiomyopathy and Acute Anterior Myocardial Infarction Utilizing 2-dimensional Longitudinal Strain Imaging. Echocardiography. 2020;37(6):832–840. DOI: 10.1111/echo.14675.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
