Роль полиморфизма гена β-1-адренорецепторов в развитии дилатационной кардиомиопатии
DOI: 10.32364/2587-6821-2020-4-7-394-398
Цель исследования: выявить закономерности развития идиопатической дилатационной кардиомиопатии (ДКМП) и дилатации миокарда ишемического генеза (ДМ ИГ), исследуя полиморфный вариант rs 1801252 (Ser49Gly) гена ADRB1.
Материал и методы: обследована когорта из 221 пациента (средний возраст 55,30±9,69 года). Всем респондентам проводился стандартный набор лабораторных, инструментальных обследований, в т. ч. коронароангиография. В первую группу были определены 111 пациентов с ДКМП идиопатического генеза, из них 99 (89,2%) мужчин, у которых были исключены вероятные факторы развития дилатации полостей сердца. Во вторую группу вошли 110 пациентов с ДМ ИГ, из них 100 (91,5%) мужчин, у которых имелись достоверные признаки ишемической болезни сердца. В группу контроля вошел 221 человек (средний возраст 53,6±4,8 года) без признаков заболеваний сердечно-сосудистой системы. У всех пациентов и в группе контроля проводилось молекулярно-генетическое исследование методом полимеразной цепной реакции полиморфизма rs 1801252 (Ser49Gly) гена ADRB1.
Результаты исследования: среди пациентов с ДКМП обоего пола носителями распространенного гомозиготного генотипа A145A являлись 70,3%, гетерозиготного генотипа A145G — 27,0%, редкого гомозиготного генотипа G145G — 2,7%. В группе контроля также преобладали пациенты — носители гомозиготного генотипа по распространенному аллелю A145A — 71,9%. Носителей гетерозиготного генотипа A145G было 25,3%, а гомозиготного генотипа G145G по редкому аллелю — 2,7%. В результате анализа распределения частоты генотипов полиморфного локуса rs 1801252 (Ser49Gly) гена ADRB1 у пациентов с ДКМП и у лиц группы контроля различия не установлены. В группе пациентов с ДМ ИГ частота распространенного гомозиготного генотипа A145A составила 68,2%, меньше было пациентов с гетерозиготным генотипом A145G — 29,1%, а редкий гомозиготный генотип G145G выявлен в 2,7% случаев. В группе пациентов с ДМ ИГ не выявлено ассоциации с полиморфизмом rs 1801252 (Ser49Gly) гена ADRB1, так как результаты сравнения с данными лиц контрольной группы не показали статистически значимых различий. В то же время выявлены отличия по частоте аллелей полиморфного локуса rs1801252 (Ser49Gly) гена ADRВ1: у больных мужчин с ДКМП
и ДМ ИГ аллель 145А встречался статистически значимо чаще (р=0,0001), чем в группе контроля.
Заключение: полученные данные позволяют предположить, что носительство аллеля 145А гена ADRB1 может служить дополнительным фактором риска развития дилатации миокарда.
Ключевые слова: дилатационная кардиомиопатия, дилатация миокарда ишемического генеза, генетический полиморфизм, ген β-1-адренорецептора, сердечная недостаточность, генетическая предрасположенность.
Для цитирования: Кузнецова О.О., Никулина С.Ю., Чернова А.А., Максимов В.Н., Матюшин Г.В. Роль полиморфизма гена β-1-адренорецепторов в развитии дилатационной кардиомиопатии. РМЖ. Медицинское обозрение. 2020;4(7):394-398. DOI: 10.32364/2587-6821-2020-4-7-394-398.
O.O. Kuznetsova1,2, S.Yu. Nikulina1, A.A. Chernova1, V.N. Maximov3, G.V. Matyushin1
1Krasnoyarsk State Medical University named after Prof. Voino-Yasenetsky, Krasnoyarsk, Russian Federation
2Federal Center for Cardiovascular Surgery, Krasnoyarsk, Russian Federation
3Institute of Internal and Preventive Medicine, the branch of Federal Publicly Funded
Scientific Institution Federal Research Center of Cytology and Genetics, the Siberian
Branch of the Russian Academy of Sciences, Novosibirsk, Russian Federation
Aim: to identify patterns of development of idiopathic dilated cardiomyopathy (IDC) and ischemic cardiomyopathy (ICM) by studying the rs 1801252 (Ser49Gly) polymorphic variant of the ADRB1 gene.
Patients and Methods: a cohort of 221 patients (mean age — 55.30±9.69 years) was examined. All respondents underwent a standard set of laboratory and instrumental examinations, including coronary angiography. The first group included 111 patients with IDC, 99 of them (89.2%) were men, who were excluded from probable factors of dilated cardiomyopathy. The second group included 110 patients with IDC, including 100 (91.5%) men who had reliable signs of CHD. The control group included 221 people (mean age — 53.6±4.8 years) without signs of cardiovascular diseases. A molecular genetic study of the rs 1801252 (Ser49Gly) polymorphism of the ADRB1 gene was performed in all patients and in the control group.
Results: among patients with IDC of both gender, 70.3% were carriers of the common homozygous A145A genotype, 27.0% of the heterozygous A145G genotype, and 2.7% of the rare homozygous G145G genotype. In the control group, there was also a predominant number of patients who carried the homozygous genotype for the common A145A allele — 71.9%. Carriers of the heterozygous A145G genotype were 25.3%, and the homozygous G145G genotype for a rare allele — 2.7%. The analysis of the genotypes frequency distribution of the polymorphic locus rs 1801252 (Ser49Gly) of the ADRB1 gene in patients with IDC and in the control group showed no differences. In the group of patients with ICM, the frequency of the common homozygous A145A genotype was 68.2%, there were fewer patients with the heterozygous A145G genotype — 29.1%, and the rare homozygous G145G genotype was detected in 2.7% of cases. There was no association with the ICM 1801252 (Ser49Gly) polymorphism of the ADRB1 gene in the group of patients with ICM, since the results of comparison with the control group data showed no statistically significant differences. At the same time, there were differences in the frequency of alleles of the polymorphic locus rs1801252 (Ser49Gly) of the ADRB1 gene: in male patients with IDC and ICM, the 145A allele was statistically significantly more common (p=0.0001) than in the control group.
Conclusion: the data obtained suggest that the carrier of the 145A allele of the ADRB1 gene may serve as an additional risk factor for the development of dilated cardiomyopathy.
Keywords: dilated cardiomyopathy, ischemic cardiomyopathy, genetic polymorphism, β-1-adrenergic receptor gene, heart failure, genetic predisposition.
For citation: Kuznetsova O.O., Nikulina S.Yu., Chernova A.A. et al. β-1-adrenoreceptor gene polymorphism role in the development of dilated cardiomyopathy. Russian Medical Inquiry. 2020;4(7):394–398. DOI: 10.32364/2587-6821-2020-4-7-394-398.
Введение
Дилатационная кардиомиопатия (ДКМП) — редкое заболевание сердца, характеризующееся дилатацией левого желудочка и систолической дисфункцией, приводящими к сердечной недостаточности и внезапной сердечной смерти [1]. По данным литературы, встречаемость ДКМП колеблется от 5 до 10 случаев на 100 тыс. населения [2, 3]. Дилатационная кардиомиопатия относится к наследственным заболеваниям сердца, которые в значительной степени обусловлены моногенными нарушениями. Понимание молекулярной патологии наследственных заболеваний сердца значительно улучшилось с достижениями в области молекулярной генетики, и генетическое тестирование становится все более доступным как часть диагностических и прогностических инструментов [4].
В настоящее время, несмотря на то что несколько состояний были идентифицированы как причины развития ДКМП (вирусные инфекции, аутоиммунные расстройства), большое количество случаев классифицируются как идиопатические [5]. Недавние исследования показывают, что почти в 60% случаев данная патология является наследственной. Технологические достижения в области генетического анализа выявили более 60 генов, связанных с этим заболеванием. Все эти гены кодируют широкий спектр белков миоцитов, главным образом саркомерных и десмосомных, но физиопатологические пути еще не полностью раскрыты [6]. Одним из таких генов является ген β-1-адренорецепторов ADRB1. Этот ген локализован на коротком плече 10-й хромосомы — 10q24-q26. Ген составляет 1434 bp, и в его структуре отсутствуют интроны. Этот ген кодирует белок, состоящий из 477 аминокислот [3].
Доказано, что у пациентов с сердечной недостаточностью полиморфизм гена ADRB1 с заменой амионокислот в пози-ции 49 ассоциирован с выживаемостью. Проводились исследования по влиянию полиморфизма одного нуклеотида (ПОН) на застойную сердечную недостаточность (ЗСН). При исследовании 49-го кодона гена ADRB1 было сделано предположение, что полиморфный аллель Gly49 связан с ДКМП, однако в ходе другого исследования подтвердить это не удалось [7, 8]. В другой работе показано, что частота госпитализаций и уровень смертности среди пациентов с ЗСН при наличии полиморфного аллеля Gly49 ниже, чем при наличии аллеля Ser49 [9]. Было высказано предположение, что Gly49 принимает участие в защитном действии на миокард при ЗСН [7]. При проведении исследования в японской популяции зависимости между полиморфизмом гена и ЗСН не выявлено [10].
В одном из исследований проводилось определение связи гена ADRB1 Ser49Gly (rs1801252) и Arg389Gly (rs1801253) с восстановлением фракции выброса левого желудочка у пациентов с сердечной недостаточностью. Установлено, что гомозиготные по полиморфизму гена ADRB1 Ser 49Ser пациенты имели достоверно большую вероятность восстановления фракции левого желудочка, чем носители Gly49 [11].
Принимая во внимание, что ADRB1 являются основными регуляторами сердечного ритма, можно предположить, что специфические ПОН гена ADRB1 оказывают клинически значимое влияние на частоту сердечных сокращений (ЧСС). В популяциях Японии и Китая полиморфизм гетерозиготного генотипа (Ser49Gly) влиял на сердечный ритм в покое независимо от других факторов. У пациентов с гомозиготным генотипом (Gly49) наблюдается снижение ЧСС на 5 в минуту по сравнению с этим показателем у пациентов с гомозиготным генотипом (Ser49) [12].
ADRB1 напрямую влияют на сердечный выброс и способность переносить физическую нагрузку. При определении способности переносить физическую нагрузку у пациентов с идиопатической или ишемической кардиомиопатией было выявлено, что пациенты, гомозиготные по полиморфному аллелю Gly389, были значительно слабее, чем пациенты с аллелем Arg389. У пациентов с ЗСН, которые ожидали пересадку сердца, при наличии полиморфного аллеля Arg389 наблюдалось значительное увеличение потребления кислорода и периода физической активности, чем у пациентов с полиморфным аллелем Gly389 [13].
Таким образом, есть основания предполагать, что, зная особенности полиморфизма гена ADRB1 при кардиомиопатиях различного генеза, можно будет повлиять на предотвращение риска внезапной сердечной смерти при своевременной диагностике данной патологии.
Цель исследования: выявить закономерности развития идиопатической ДКМП и дилатации миокарда ишемического генеза (ДМ ИГ), исследуя полиморфный вариант rs1801252 (Ser49Gly) гена ADRB1.
Материал и методы
Проведено проспективное исследование, в которое включены пациенты женского и мужского пола, старше 18 лет, жители Красноярского края. Исследование было одобрено локальным этическим комитетом ФГБОУ ВО КрасГМУ им. проф. Войно-Ясенецкого Минздрава России. Все пациенты подписывали информированное согласие на участие в исследовании.
Обследован 221 пациент с ДКМП и ДМ ИГ. Средний возраст больных составил 55,30±9,69 года (от 20–70 лет). Пациентов с ДКМП было 111 человек, из них 99 (89,2%) мужчин. Средний возраст больных с ДКМП составил 51,73±9,74 года.
Группу пациентов с ДМ ИГ составили 110 человек, из них 100 (91,5%) мужчин. Средний возраст больных данной группы составил 58,68±8,38 года.
В контрольную группу включен 221 человек (199 мужчин; средний возраст 53,6±4,8 года), не имевших, по данным обследования, признаков сердечно-сосудистых заболеваний.
Всем обследуемым проводился стандартный набор лабораторных, инструментальных исследований, в т. ч. коронароангиография. При подозрении на миокардит проводилась магнитно-резонансная томография сердца. Первая группа пациентов была сформирована с учетом отсутствия возможных причин развития дилатации полостей сердца. Пациенты с проявлениями ИБС были отнесены во вторую группу.
Всем пациентам был проведен молекулярно-генетический анализ с целью выявления носительства генотипов полиморфизма rs 1801252 (Ser49Gly) гена ADRB1. С помощью метода фенолхлороформной экстракции выделяли структуру ДНК. Методом полимеразной цепной реакции проводили генотипирование полиморфизма rs 1801252 (Ser49Gly) гена ADRB1 с последующим анализом полиморфизма длины рестрикционных фрагментов [14].
Также при анализе показателей частоты аллелей и генотипов гена ADRB1 мы использовали так называемую «сверхдоминантную модель», т. е. объединенное сравнение двух гомозиготных генотипов с гетерозиготным. Мы сравнивали частоту генотипов AG и суммарную частоту генотипов AA и GG в основных группах (пациенты с ДКМП и ДМ ИГ) и группе контроля.
Для статистической обработки данных использовали пакет статистических программ Statistica v. 7.0. Используя критерий χ2, проводили оценку значимости межгрупповых различий и соответствия частоты генотипов закону Харди — Вайнберга в исследуемой выборке. По отношению шансов (ОШ) и его 95% доверительному интервалу (ДИ) рассчитывали силу ассоциаций генотипических характеристик исследуемых генов с риском возникновения неблагоприятного исхода. При ОШ=1 подтверждалось отсутствие ассоциаций, при OШ>1 — положительная связь аллеля или генотипа с заболеванием, при OШ<1 — отрицательная связь аллеля или генотипа с заболеванием.
Результаты исследования
Распределение частоты встречаемости генотипов среди пациентов с ДКМП обоего пола было следующим: 70,3% пациентов — носители распространенного гомозиготного генотипа A145A; 27,0% — носители гетерозиготного генотипа A145G; 2,7% — носители редкого гомозиготного генотипа G145G. В группе контроля преобладали носители гомозиготного генотипа по распространенному аллелю A145A — 71,9%. Меньше было носителей гетерозиготного генотипа A145G — 25,3% и еще меньше (2,7%) — носителей гомозиготного генотипа G145G по редкому аллелю. Анализ распределения частоты генотипов полиморфного локуса rs 1801252 (Ser49Gly) гена ADRB1 не показал различий между пациентами с ДКМП и группой здоровых лиц.
Количество больных ДКМП мужчин — носителей распространенного гомозиготного генотипа A145A составило 69,7%, носителей гетерозиготного генотипа A145G — 28,3%, а носителей редкого гомозиготного генотипа G145G — 2,0%. В группе контроля также преобладали мужчины — носители гомозиготного генотипа по распространенному аллелю A145A — 72,9% (табл. 1).
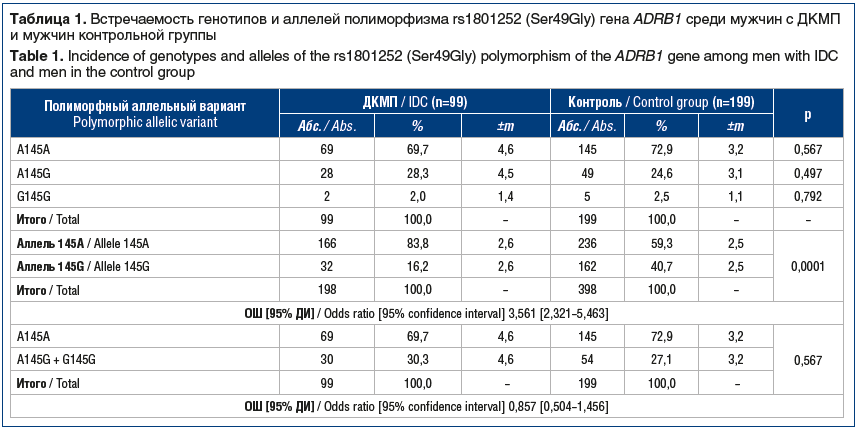
Не выявлено достоверных отличий по полиморфным аллельным вариантам rs1801252 (Ser49Gly) гена ADRB1 между мужчинами с ДКМП и мужчинами контрольной группы. В то же время при сравнении частоты аллелей полиморфного локуса rs1801252 (Ser49Gly) гена ADRВ1 установлено, что аллель 145А у мужчин с ДКМП встречался статистически значимо чаще, чем у мужчин в группе контроля — 83,8% против 59,3% (р=0,0001).
Среди пациентов с ДМ ИГ в целом носителями распространенного гомозиготного генотипа A145A были 68,2%, носителями гетерозиготного генотипа A145G — 29,1%, а носителями редкого гомозиготного генотипа G145G — 2,7%. В контрольной группе количество носителей соответствующих генотипов составило 71,9, 25,3 и 2,7% соответственно. В группе пациентов с ДМ ИГ не выявлено ассоциации с полиморфизмом rs1801252 (Ser49Gly) гена ADRB1, так как результаты сравнения с данными лиц контрольной группы были статистически незначимы.
Среди мужчин с ДМ ИГ показатели частоты генотипов распределились следующим образом (табл. 2). Количество мужчин — носителей распространенного гомозиготного генотипа A145A составило 67,0%, гетерозиготного генотипа A145G — 30,0%, редкого гомозиготного генотипа G145G — 3,0%. В контрольной группе количество мужчин — носителей соответствующих генотипов составило 72,9, 24,6 и 2,5% соответственно. У пациентов с ДМ ИГ мужского пола не выявлено ассоциации с полиморфизмом rs1801252 (Ser49Gly) гена ADRB1.
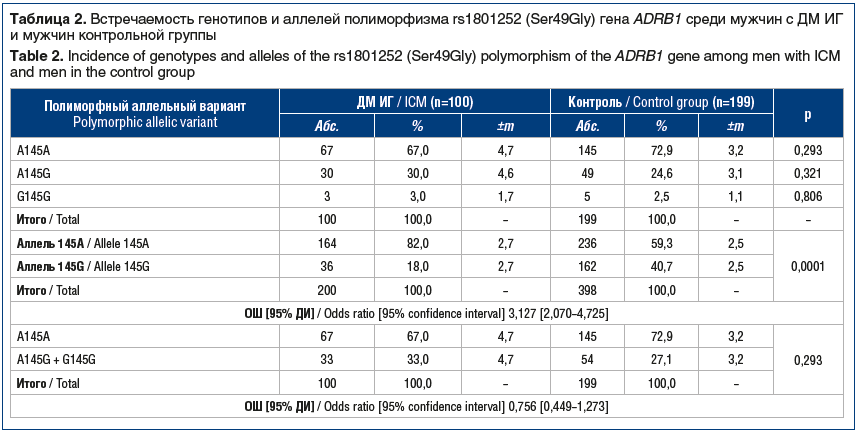
При сравнении частоты аллелей полиморфного локуса rs1801252 (Ser49Gly) гена ADRВ1 установлено, что аллель 145А у мужчин с ДМ ИГ встречался статистически значимо чаще, чем у здоровых мужчин контрольной группы (82,0% против 59,3%; р=0,0001).
Достоверных различий по полиморфным аллельным вариантам rs1801252 (Ser49Gly) гена ADRB1 между женщинами с ДКМП и ДМ ИГ и женщинами контрольной группы получено не было.
Обсуждение
В нашей работе при исследовании полиморфизма rs 1801252 (Ser49Gly) гена ADRB1 не выявлено значимых различий по частоте генотипов у пациентов с ДКМП и ДМ ИГ и лиц контрольной группы. Однако выявлены различия по частоте аллеля полиморфного локуса rs1801252 (Ser49Gly) гена ADRВ1 между больными и лицами контрольной группы: у больных мужчин с ДКМП и ДМ ИГ аллель 145А встречался статистически значимо чаще, чем в группе контроля. Учитывая, что данные получены при анализе показателей частоты встречаемости аллелей у мужчин с ДКМП и ДМ ИГ, мы предполагаем, что носительство аллеля 145А гена ADRB1 может служить дополнительным фактором риска развития дилатации миокарда наряду с другими факторами риска. Для подтверждения наших выводов требуется исследование с бόльшим размером выборки больных с дилатацией миокарда.
Биологический смысл использования «сверхдоминантной» модели в нашем исследовании предполагает, что для изменения риска развития кардиомиопатий различного генеза у мужчин достаточно хотя бы одного вариантного аллеля, в нашем случае — аллеля А145. В доступной нам литературе не встретились работы, подтверждающие ассоциацию полиморфизма гена ADRВ1 с дилатацией миокарда ишемического генеза и ее идиопатическим вариантом.
Заключение
Наличие генетических особенностей разных популяций определяет важность их изучения. Проведение молекулярно-генетического исследования предикторов наследственной предрасположенности к кардиомиопатиям является актуальным и перспективным. Кардиологи должны будут научиться интегрировать эти новые знания в диагностические протоколы, чтобы улучшить ведение семей с наследственными кардиомиопатиями, в частности обсуждать с пациентами и их семьями генетические аспекты этих заболеваний, включая риск передачи болезни в семье. Для этого необходимо базовое понимание принципов генетического консультирования, которое должно будет помочь пациентам преодолеть психологические,социальные, профессиональные, этические и юридические последствия генетического заболевания.
Данные проведенного нами молекулярно-генетического исследования больных с кардиомиопатиями различного генеза могут стать вкладом в мировые базы данных по полногеномным исследованиям и анализа патофизиологических механизмов развития дилатации миокарда.
Сведения об авторах:
Кузнецова Оксана Олеговна — к.м.н., доцент кафедры кардиологии, функциональной и клинико-лабораторной диагностики ИПО, ФГБОУ ВО КрасГМУ им. проф. Войно-Ясенецкого Минздрава России; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; врач-кардиолог ФГБУ «ФЦ ССХ» Минздрава России; 660020, Россия, г. Красноярск, ул. Караульная, д. 45; ORCID iD 0000-0003-2247-4242.
Никулина Светлана Юрьевна — д.м.н., профессор, заведующая кафедрой внутренних болезней № 1, ФГБОУ ВО КрасГМУ им. проф. Войно-Ясенецкого Минздрава России; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; ORCID iD 0000-0002-6968-7627.
Чернова Анна Александровна — д.м.н., доцент кафедры внутренних болезней № 1, ФГБОУ ВО КрасГМУ им. проф. Войно-Ясенецкого Минздрава России; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; ORCID iD 0000-0003-2977-1792.
Максимов Владимир Николаевич — д.м.н., профессор, заведующий лабораторией молекулярно-генетических исследований терапевтических заболеваний; НИИТПМ — филиал ИЦиГ СО РАН; 630089, Россия, г. Новосибирск, ул. Б. Богаткова, д. 175/1; ORCID iD 0000-0002-7165-4496.
Матюшин Геннадий Васильевич — д.м.н., профессор, заведующий кафедрой кардиологии, функциональной и клинико-лабораторной диагностики ФГБОУ ВО КрасГМУ им. проф. Войно-Ясенецкого Минздрава России; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; ORCID iD 0000-0002-0150-6092.
Контактная информация: Кузнецова Оксана Олеговна, e-mail: Isachenko102@inbox.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 14.07.2020, поступила после рецензирования 28.07.2020, принята в печать 11.08.2020.
About the authors:
Oksana O. Kuznetsova — Cand. of Sci. (Med.), Associate Professor of the Department of Cardiology, Functional, Clinical and Laboratory Diagnosis of the Institute of Continuing Education, Krasnoyarsk State Medical University named after Prof. Voino-Yasenetsky: 1, Partizana Zheleznyaka, Krasnoyarsk, 660022, Russian Federation; cardiologist, Federal Center for Cardiovascular Surgery: 45, Karaulnaya str., Krasnoyarsk, 660020, Russian Federation; ORCID iD 0000-0003-2247-4242.
Svetlana Yu. Nikulina — Dr. of Sci. (Med.), Professor, Head of the Department of Internal diseases No. 1, Krasnoyarsk State Medical University named after Prof. Voino-Yasenetsky: 1, Partisana Zheleznyaka str., Krasnoyarsk, 660022, Russian Federation; ORCID iD 0000-0002-6968-7627.
Anna A. Chernova — Dr. of Sci. (Med.), Associate Professor of the Department of Internal Diseases No. 1, Krasnoyarsk State Medical University named after Prof. Voino-Yasenetsky: 1, Partisana Zheleznyaka str., Krasnoyarsk, 660022, Russian Federation; ORCID iD 0000-0003-2977-1792.
Vladimir N. Maximov — Dr. of Sci. (Med.), Professor, Head of the Laboratory of Molecular Genetic Research of Therapeutic Diseases; Institute of Internal and Preventive Medicine, the branch of Federal Publicly Funded Scientific Institution Federal Research Center of Cytology and Genetics, the Siberian Branch of the Russian Academy of Sciences: 175/1, B. Bogatkova str., Novosibirsk, 630089, Russian Federati on; ORCID iD 0000-0002-7165-4496.
Gennady V. Matyushin — Dr. of Sci. (Med.), Professor, Head of the Department of Cardiology, Functional and Clinical Laboratory Diagnostics, Krasnoyarsk State Medical University named after Prof. Voino-Yasenetsky: 1, Partisana Zheleznyaka str., Krasnoyars, 630022, Russian Federation; ORCID iD 0000-0002-0150-6092.
Contact information: Oksana O. Kuznetsova, e-mail: Isachenko102@inbox.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 14.07.2020, revised 28.07.2020, accepted 11.08.2020.
2. Барт Б.Я., Беневская В.Ф. Дилатационная кардиомиопатия в практике терапевта и кардиолога (лекция). Терапевтический архив. 2004;79(1):12–17. [Bart B.Y., Benevskaya V.F. Dilated cardiomyopathy in therapeutic and cardiological practice (lecture). Therapeutic archive. 2004;79(1):12–17 (in Russ.)].
3. Sugrue D.D., Rodeheffer R.J., Codd M.B. et al. The clinical course of idiopathic dilated cardiomyopathy. A population-based study. Ann Intern Med. 1992;117(2):117–123. DOI: 10.7326/0003-4819-117-2-117.
4. Muir A.R., Menown I.B. Genetic biomarkers in cardiovascular disease. Biomark Med. 2013;7(4):497–499. DOI: 10.2217/bmm.13.82.
5. Startari U., Taylor M.R., Sinagra G. et al. Dilated cardiomyopathy: etiology, clinical criteria for diagnosis and screening of the familial form. Ital Heart J Suppl. 2002;3(4):378–385.
6. Perez-Serra A., Toro R., Sarquella-Brugada G. et al. Genetic basis of dilated cardiomyopathy. Int J Cardiol. 2016;224:461–472. DOI: 10.1016/j.ijcard.2016.09.068.
7. Podlowski S., Wenzel K., Luther H.P. et al. Beta1-adrenoceptor gene variations: a role in idiopathic dilated cardiomyopathy? J Mol Med (Berl). 2000;78(2):87–93. DOI: 10.1007/s001090000080.
8. Small K., Mcgraw D., Liggett S. Pharmacology and physiology of human adrenergic receptor polymorphisms. Annu Rev Pharmacol Toxicol. 2003;43:381–411. DOI: 10.1146/annurev.pharmtox.43.100901.135823.
9. Börjesson M., Magnusson Y., Hjalmarson A. et al. A novel polymorphism in the gene coding for the beta — adrenergic receptor associated with survival in patients with heart failure. Eur Heart J. 2000;21(22):1853–1858. DOI: 10.1053/euhj.1999.1994.
10. Nonen S., Okamoto H., Akino M. et al. No positive association between adrenergic receptor variants of alpha2cDel322–325, beta1Ser49, beta1Arg389 and the risk for heart failure in the Japanese population. Br J Clin Pharmacol. 2005;60(4):414–417. DOI: 10.1111/j.1365-2125.2005.02447.x.
11. Luzum J.A., English J.D., Ahmad U.S. et al. Association of Genetic Polymorphisms in the Beta-1 Adrenergic Receptor with Recovery of Left Ventricular Ejection Fraction in Patients with Heart Failure. J Cardiovasc Transl Res. 2019;12(4):280–289. DOI: 10.1007/s12265-019-09866-5.
12. Ranade K., Jorgenson E., Sheu W.H. et al. A polymorphism in the beta1 adrenergic receptor is associated with resting heart rate. Am J Hum Genet. 2002;70(4):935–942. DOI: 10.1086/339621.
13. Sandilands A.J., Parameshwar J., Large S. et al. Confirmation of a role for the 389R>G beta-1 adrenoceptor polymorphism on exercise capacity in heart failure. Heart. 2005;91(12):1613–1614. DOI: 10.1136/hrt.2004.047282.
14. Афанасьев С.А., Реброва Т.Ю., Муслимова Э.Ф. и др. Ассоциация полиморфных вариантов гена ADRB1 с сократительной дисфункцией миокарда и адренореактивностью эритроцитов у пациентов с нарушениями ритма. Российский кардиологический журнал. 2019;24(7):47–52. DOI: 10.15829/1560-4071-2019-7-47-52. [Afanasiev S.A., Rebrova T. Yu., Muslimova E.F. et al. Association of polymorphic variants of ADRB1 gene with contractile myocardial dysfunction and erythrocyte adrenoreactivity in patients with rhythm disorders. Russian Journal of Cardiology. 2019;24(7):47–52 (in Russ.)]. DOI: 10.15829/1560-4071-2019-7-47-52.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
