Опыт применения калия и магния аспарагината в терапии сердечно-сосудистых заболеваний
DOI: 10.32364/2587-6821-2022-6-8-433-442
В статье обсуждаются вопросы эффективности и профиля безопасности препаратов калия и магния аспарагината у пациентов с сердечно-сосудистыми заболеваниями (ССЗ). Имеются данные о важной роли дефицита калия и магния в генезе ССЗ и увеличении смертности. Гипокалиемию и гипомагниемию часто регистрируют у пациентов кардиологического профиля. Освещены результаты многоцентровых рандомизированных исследований у больных с ССЗ (артериальной гипертонией, ишемической болезнью сердца, нарушениями сердечного ритма). В статье представлены два клинических наблюдения успешного применения препаратов калия и магния аспарагината (препарата Панангин®, «Гедеон Рихтер») в лечении сердечно-сосудистых осложнений, связанных с электролитным дисбалансом. Полученные результаты многочисленных исследований пациентов с ССЗ дают основание считать, что дополнительное назначение калия и магния аспарагината к основной терапии способствует повышению эффективности проводимого лечения. Таким образом, применение калия и магния аспарагината может быть рекомендовано пациентам кардиологического профиля.
Ключевые слова: калия и магния аспарагинат, Панангин, гипомагниемия, гипокалиемия, артериальная гипертония, ишемическая болезнь сердца, инфаркт миокарда, удлиненный интервал QT, аритмии сердца, желудочковая тахикардия.
Для цитирования: Ялымов А.А., Ефремова Ю.Е., Шехян Г.Г., Чараева Т.Г. Опыт применения калия и магния аспарагината в терапии сердечно-сосудистых заболеваний. РМЖ. Медицинское обозрение. 2022;6(8):433-442. DOI: 10.32364/2587-6821-2022-6-8-433-442.
A.A. Yalymov1, Yu.E. Efremova2, G.G. Shekhyan1, T.G. Charaeva1
1M.F. Vladimirskiy Moscow Regional Research and Clinical Institute, Moscow, Russian Federation
2Acad. E.I. Chazov National Medical Research Center of Cardiology, Moscow, Russian Federation
The article discusses the efficacy and safety profile of potassium and magnesium aspartate agents in the treatment of patients with cardiovascular diseases (CVD). The data demonstrate that potassium and manganese deficiency play an important role in the etiology of CVD and the increased mortality. Hypokalemia and hypomagnesemia are frequently reported in patients with cardiological disorders. The article elucidates the results of multi-center randomized trials in patients with CVD (arterial hypertension, ischemic heart diseases, and cardiac arrhythmia). Also, the article presents two clinical cases with the successful use of potassium and magnesium aspartate (Panangin®, Gedeon Richter) in the treatment of cardiovascular complications associated with electrolyte imbalance. Based on the results of multiple studies involving CVD patients it is suggested that the addition of potassium and magnesium aspartate to the essential therapy improves the effectiveness of CVD management. Thus, potassium and magnesium aspartate can be recommended to cardiac patients.
Keywords: potassium and magnesium aspartate, Panangin, hypomagnesemia, hypopotassemia, arterial hypertension, ischemic heart disease, myocardial infarction, prolonged QT interval, cardiac arrhythmias, ventricular tachycardia.
For citation: Yalymov A.A., Efremova Yu.E., Shekhyan G.G., Charaeva T.G. Experience with the use of potassium and magnesium aspartate in the treatment of cardiovascular diseases. Russian Medical Inquiry. 2022;6(8):433–442 (in Russ.). DOI: 10.32364/2587-6821-2022-6-8-433-442.
Введение
Калий и магний являются наиболее значимыми внутриклеточными катионами, необходимыми для поддержания электролитного баланса и обеспечения нормальной жизнедеятельности организма. Ионы калия участвуют в формировании биоэлектрической активности клеток, мембранного потенциала действия, нервно-мышечной передаче и мышечных сокращениях. Магний является кофактором большого количества ферментов и универсальным регулятором биохимических реакций, участвует в процессах регулирования поляризации клеточных мембран, формировании спонтанной электрической активности нервной ткани и проводящей системы сердца. Нормальное функционирование кардиомиоцита невозможно без поддержания должной концентрации магния [1–3]. Дефицит магния также связывают с проатерогенным действием за счет изменения активности ферментов: снижения активности лецитин-холестерол-аминотрансферазы и липопротеинлипазы и повышения активности ГМГ-КоА-редуктазы [4]. Калий и магний поступают в организм человека с пищей, магний также поступает с водой. Гипокалиемией считается снижение сывороточной концентрации калия <3,5 ммоль/л, гипомагниемией — снижение сывороточной концентрации магния <0,8 ммоль/л, однако значения уровня калия и магния в сыворотке крови в пределах референтных значений могут наблюдаться при наличии внутриклеточного дефицита электролитов.
Причины дефицита калия и магния
Наиболее распространенным механизмом возникновения недостатка электролитов является увеличение их экскреции. Низкое потребление калия с пищей редко приводит к клиническим проявлениям гипокалиемии, однако наличие коморбидных состояний, прием тиазидных диуретиков и других препаратов способствуют усугублению гипокалиемии.
Гипокалиемию можно классифицировать как легкую (концентрация калия в сыворотке крови 3,0–3,4 ммоль/л), умеренную (2,5–2,9 ммоль/л) или тяжелую (<2,5 ммоль/л), при этом клинические симптомы усугубляются с увеличением степени тяжести. Основные причины гипокалиемии представлены в таблице 1 [5].

Среди наиболее распространенных причин дефицита магния рассматриваются недостаточное поступление электролита с пищей (при нерациональном питании, соблюдении определенных видов диет) или нарушение его всасывания в кишечнике, рвота или хроническая диарея, злоупотребление алкоголем, эндокринные заболевания (сахарный диабет, гипертиреоз, гиперпаратиреоз), прием диуретиков, первичный и вторичный гиперальдостеронизм.
Клинические проявления дефицита калия и магния
В большинстве случаев легкая гипокалиемия и гипомагниемия протекают бессимптомно. Умеренный или тяжелый дефицит электролитов может вызывать нарушения нервно-мышечной передачи (мышечную слабость, утомляемость, которые в конечном итоге приводят к восходящему параличу, острой дыхательной недостаточности из-за паралича диафрагмы, рабдомиолизу); нарушения сердечного ритма и проводимости; тошноту, рвоту, запор, снижение перистальтики желудочно-кишечного тракта, кишечную непроходимость, почечные симптомы (метаболический ацидоз, полиурию).
Гипокалиемия приводит к увеличению продолжительности и дисперсии интервала QT, замедляет внутрисердечную проводимость и индуцирует аномальную пейсмекерную активность, в том числе раннюю постдеполяризацию [6, 7]. Нарушения сердечного ритма наиболее часто встречаются при гипокалиемии, особенно при наличии сопутствующих сердечно-сосудистых заболеваний (ССЗ) и терапии сердечными гликозидами и антиаритмическими препаратами [8]. Типичные изменения ЭКГ на фоне гипокалиемии представлены в таблице 2 [5].

Следует помнить о том, что проаритмогенный риск гипокалиемии повышается у больных с ишемической болезнью сердца (ИБС), сердечной недостаточностью (СН), гипертрофией левого желудочка, а также на фоне применения ряда лекарственных средств, как было указано выше. У некоторых пациентов с тяжелой гипокалиемией могут отсутствовать типичные изменения ЭКГ [9–11].
Незамедлительная коррекция гипокалиемии и гипомагниемии у пациентов с острыми состояниями улучшает прогноз при проведении электрической дефибрилляции и снижает частоту повторных нарушений ритма сердца после его остановки [12, 13].
Основные кардиопротективные эффекты калия и магния
Основными кардиопротективными клиническими эффектами калия и магния являются антиаритмический, антигипертензивный, антиишемический, диуретический, спазмолитический, противосудорожный, седативный, снотворный, кроме того, возможно снижение внутричерепного давления [14, 15].
Антиаритмический эффект восполнения уровня калия и магния подтвержден в большом количестве клинических исследований и широко используется в клинической практике в течение многих лет. Снижение уровня калия и магния в сыворотке крови ассоциировано с повышенным риском возникновения нарушений ритма сердца и возникновения предсердных и желудочковых аритмий [16–18].
Эффективность применения калия и магния при нарушениях сердечного ритма, в том числе на фоне приема антиаритмических препаратов I и III класса и сердечных гликозидов (в случае развития гликозидной интоксикации), доказана в клинических исследованиях. В исследовании [19] было продемонстрировано, что инфузия калия и магния аспарагината (КМА) эффективно восстанавливала синусовый ритм у пациентов с возникшей интраоперационно атриовентрикулярной диссоциацией. Сульфат магния применяется при купировании желудочковой тахикардии типа «пируэт», возникающей у пациентов с удлиненным интервалом QT. В исследовании [20] была доказана целесообразность использования солей магния при лечении желудочковой тахикардии типа «пируэт», преимущественно у пациентов с удлиненным интервалом QT, а также назначение КМА больным с инфарктом миокарда (ИМ) и неблагоприятным прогнозом. В данной работе была подчеркнута необходимость раннего введения препарата (в первые 6 ч после развития ИМ).
В российских клинических рекомендациях по ведению пациентов с фибрилляцией предсердий (ФП) рекомендовано внутривенное введение препаратов калия перед восстановлением синусового ритма [21].
Антигипертензивный эффект калия и магния был выявлен в ряде клинических исследований. По результатам метаанализа 19 исследований (n=586, из них 412 пациентов с артериальной гипертензией (АГ)) было показано, что пер-оральное дополнительное употребление калия способствовало более выраженному гипотензивному эффекту. Снижение артериального давления (АД) было более выраженным у пациентов с исходно высоким АД (-8,2 мм рт. ст. для систолического АД и -4,5 мм рт. ст. для диастолического АД (ДАД)) и связано с длительностью приема препаратов калия [22]. Следует учитывать тот факт, что пациенты, страдающие АГ, имеют относительно высокую распространенность гипокалиемии — от 3,8% до 7,2% [23]. В рамках диагностики и клинического наблюдения пациентов с АГ необходимо регулярно контролировать уровень калия, в особенности на фоне постоянной терапии тиазидными или петлевыми диуретиками. В российских клинических рекомендациях по лечению АГ у взрослых, утвержденных Минздравом России, рекомендовано определение уровня калия, в них также отмечена необходимость увеличения потребления калия с пищей [24].
Препараты магния снижают АД при АГ. В исследовании, изучающем взаимосвязь уровня АД и приема препаратов магния в течение 2 мес. у 64 пациентов, было продемонстрировано, что магний способствует снижению АД пропорционально тяжести АГ. Результаты, опубликованные Департаментом медицины Центра ветеранов (США), свидетельствуют, что потребление магния в дозах от 53 до 511 мг/сут приводит к уменьшению уровня ДАД, каждые 100 мг/сут вызывают снижение ДАД на 3,22 мм рт. ст.
В исследованиях была продемонстрирована целесо-образность и эффективность коррекции уровня магния с помощью пищевых добавок, их применение способствовало нормализации уровня АД при легкой АГ у пожилых [25, 26].
Антиишемический эффект калия и магния был также продемонстрирован в ряде исследований. Дефицит магния коррелирует с повышенным содержанием атерогенных липидов и оказывает проатерогенное действие. Роль применения калия и магния в остром периоде ИМ неоднократно оценивалась в клинических исследованиях, однако значимого снижения летальности в группе больных, получавших магний и калий, получено не было. В ряде работ у пациентов с ИМ было показано, что гипо- и гиперкалиемия ассоциированы с повышенной летальностью [27–30]. В нескольких работах была продемонстрирована U-обратная зависимость между уровнем калия и смертностью у пациентов с ИМ, что указывает на то, что более узкий интервал целевой концентрации калия может применяться и к этой популяции [27, 30]. У пациентов с острой СН после ИМ, помимо гипо- и гиперкалиемии, низкие нормальные и высокие нормальные значения уровня калия также были ассоциированы с высоким риском смерти [31]. Также у пациентов с ИМ увеличивается риск развития фибрилляции желудочков во время первичного чрескожного коронарного вмешательства [32, 33]. В остром периоде ИМ с целью предотвращения развития желудочковых аритмий показана своевременная коррекция гипокалиемии и гипомагниемии при их наличии [34].
Калий и магний в лечении ССЗ
Изучение роли калия и магния при ведении пациентов с ССЗ продемонстрировало в ряде исследований более низкую частоту развития сердечно-сосудистых осложнений (ССО) на фоне повышенного потребления калия и магния [36–38]. В метаанализе 11 исследований, включивших в себя наблюдение за 247 510 пациентами, было показано, что дополнительное потребление калия на 1,64 г (42 ммоль) в сутки ассоциировалось со снижением относительного риска возникновения инсульта на 21%, а также с тенденцией к снижению риска ишемических событий и общего риска ССЗ [38]. В США, по данным проспективного когортного национального исследования (n=12 267), за 15 лет наблюдения более высокое потребление калия ассоциировалось со снижением риска смертности (от ССЗ, в том числе ИБС, и от всех причин) на 20%, результат существенно не зависел от пола, расы, индекса массы тела, наличия АГ, уровня образования или физической активности [39]. По результатам метаанализа 16 исследований (n=313 041) было продемонстрировано, что при увеличении уровня магния на 0,2 ммоль/л наблюдалось снижение риска развития ССЗ (преимущественно ИБС и нарушений ритма сердца) на 30% (95% ДИ 0,56–0,88) [40].
В исследовании PREDIMED (n=7216), где изучалась роль средиземноморской диеты у пациентов с высоким риском развития ССЗ в течение 5 лет, была выявлена связь между потреблением магния и частотой ССО, снижение риска смерти при этом составило 34% в группе высокого потребления магния [41].
На сегодняшний день благодаря накопленным данным ряда клинических исследований сохраняется актуальность применения препаратов калия и магния у больных с различными ССЗ. Оптимальной формой для дополнительного введения данных электролитов при терапии ССЗ является КМА.
Собственный опыт и обсуждение применения калия и магния аспарагината в терапии ССЗ
Пациент А., 64 года, 10.02.2021 обратился к врачу-терапевту в поликлинике по месту жительства с жалобами на снижение аппетита, боль в эпигастральной области при приеме пищи, тошноту, сердцебиение, резкую слабость, головокружение, снижение веса на 8 кг за 1 мес. На протяжении 2 нед. пациент употреблял только жидкую пищу в связи с усилением болевого синдрома в эпигастральной области и выраженным рвотным рефлексом при приеме твердой пищи.
Anamnesis morbi: с 2014 г. страдает АГ с максимальным АД 180/90 мм рт. ст., адаптирован к АД 120/80 мм рт. ст.
С 2019 г. диагностирована ИБС: стенокардия напряжения II ФК. Пароксизмальная предсердная тахикардия. Инсульт, ИМ отрицает.
В мае 2019 г. диагностирована меланома кожи правой голени. В июне 2019 г. проведена резекция первичной опухоли. В декабре 2019 г. рецидив: выявлены метастазы в регионарных лимфатических узлах. В январе 2020 г. проведена резекция паховых и подколенных лимфатических узлов правой нижней конечности. Регулярно принимает: ацетилсалициловую кислоту 100 мг/сут, верапамил 120 мг/сут, периндоприл 5 мг/сут, фуросемид 120 мг/нед., метформин 2000 мг/сут. Настоящее ухудшение с 07.01.2021, когда появились вышеперечисленные жалобы.
Перенесенные заболевания: язвенная болезнь двенадцатиперстной кишки, хронический гастрит, хронический геморрой, ожирение II стадии, сахарный диабет 2 типа, целевой уровень гликированного гемоглобина менее 7,0%, дислипидемия, меланома кожи правой голени T3N3Mх, стадия IIIc. Метастазы в регионарных лимфатических узлах. Резекция первичной опухоли (2019 г.), а также подколенных и паховых лимфатических узлов справа (2020 г.).
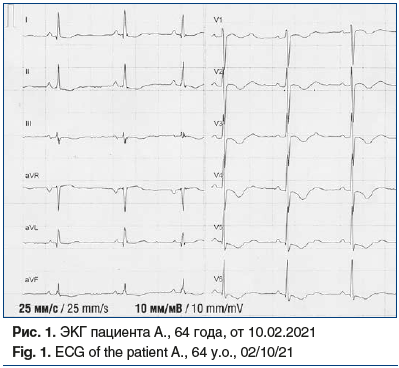
На момент осмотра: состояние средней тяжести. Кожа бледная, с землистым оттенком, отеков нет. Склеры иктеричные. Температура тела 36,5 °С. В легких везикулярное дыхание, единичные сухие хрипы, ЧДД 23 в 1 мин. Ритм сердца неправильный за счет пробежек предсердной тахикардии и частой предсердной экстрасистолии, ЧСС в среднем 105 в 1 мин, АД 90/55 мм рт. ст. Живот мягкий, болезненный в эпигастральной области. Синдром Менделя положительный. Размеры печени по Курлову 14×13×13 см. Область почек не изменена. Синдром поколачивания отрицательный. Мочеиспускание свободное. Очаговой и менингеальной симптоматики нет. По результатам общего анализа крови выявлены анемия (гемоглобин 118 г/л), повышение уровней лейкоцитов до 11,3×109/л (норма 4–9×109/л), тромбоцитов до 366×109/л (норма 180–320×109/л). В биохимическом анализе крови отмечены гипопротеинемия (общий белок 60 г/л), повышение уровня мочевины до 11,8 ммоль/л (норма от 2,5 до 8,3 ммоль/л), повышение уровня КФК до 564 Ед/л (норма до 190 Ед/л), гипер-гликемия (16,8 ммоль/л) и гипокалиемия (2,9 ммоль/л). Активность маркеров некроза миокарда в динамике представлена в таблице 3.
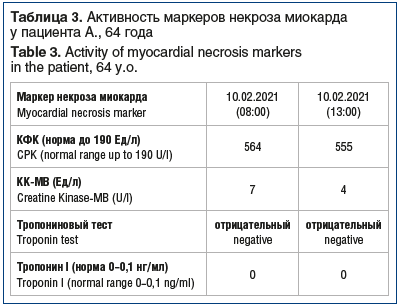
На ЭКГ (рис. 1) отмечается увеличение продолжительности интервала QT, косонисходящая депрессия сегмента ST и отрицательные зубцы Т в большинстве отведений, отчетливые зубцы U.
ЭхоКГ (10.02.2021): аорта 3,2 см, левое предсердие 4,2 см (объем 85 мл), правое предсердие 46 мл, правый желудочек 4,6 см. Легочная артерия (ЛА) 1,9 см, давление ЛА 19,3 мм рт. ст. Межжелудочковая перегородка 10 мм, задняя стенка левого желудочка 9 мм, конечно-диастолический объем левого желудочка 119 мл, конечно-систолический объем левого желудочка 58 мл, фракция выброса (ФВ) 51%. Нижняя полая вена 1,8 см, спадается на вдохе более 50%. Аорта, створки аортального клапана и митрального клапана уплотнены. Гипертрофии миокарда нет. Дилатация левого предсердия. Глобальная сократимость левого желудочка не нарушена. Небольшое количество жидкости в полости перикарда. Митральная регургитация I стадии.
ЭГДС (10.02.2019): эрозивный эзофагит. Множественные язвы желудка и двенадцатиперстной кишки.
Диагноз: Основной: ИБС: стенокардия напряжения III ФК.
Фоновый: гипертоническая болезнь III стадии. АГ контролируемая, риск ССО 4. Сахарный диабет 2 типа, целевой уровень гликированного гемоглобина <7,0%. Ожирение II стадии.
Осложнения: пароксизмальная предсердная тахикардия. ХСН IIА, ХСН с сохраненной ФВ (ФВ 51%), II ФК (NYHA).
Сопутствующий: эрозивный эзофагит. Язвенная болезнь желудка и двенадцатиперстной кишки, обострение. Хронический геморрой. Меланома кожи правой голени T3N3Mх, стадия IIIc. Резекция первичной опухоли (2019 г.). Прогрессирование: метастазы в регионарные лимфатические узлы. Резекция подколенных, паховых лимфатических узлов справа (2020 г.).
Дифференциальный диагноз состояний и заболеваний, сопровождающихся депрессией сегмента ST на ЭКГ: оценка ЭКГ-феномена, заключающегося в депрессии сегмента ST, включает анализ изменения ЭКГ и клинических симптомов. Изменения сегмента ST могут быть вариантом нормальной ЭКГ, признаком некоронарогенных изменений миокарда и показателем наличия острой коронарной ишемии и других состояний [42]. Терапевтическая тактика в отношении больных с депрессией сегмента ST различная.
У здоровых людей снижение сегмента ST не должно превышать 0,5 мм, редко в III стандартном отведении может наблюдаться снижение сегмента ST более чем на 0,5 мм, если последующий зубец T низкой амплитуды или отрицательный.
Учитывая наличие у пациента гипокалиемии, обусловленной обезвоживанием, целесообразно проведение инфузионной терапии. Препаратами выбора являются препараты КМА в таблетках, покрытых пленочной оболочкой, или в виде концентрата для приготовления раствора для инфузий. Аспарагиновая кислота способствует транспорту ионов магния через клеточную мембрану. КМА обладает высокой клинической эффективностью при лечении различного рода аритмий и широко применяется в отечественной практике.
В случае отсутствия показаний к неотложной терапии (уровень калия в сыворотке >2,5 ммоль/л, отсутствуют нарушения в работе проводящей системы сердца) препараты калия назначают внутрь в дозе 40–120 ммоль/сут. При гипокалиемии предпочтительно назначение КМА. При невозможности перорального приема (на фоне патологии ЖКТ или неврологической патологии) калия хлорид вводят в концентрации 40 ммоль/л в/в капельно (не быстрее 10 ммоль/ч). При тяжелой гипокалиемии (уровень калия в сыворотке <2,5 ммоль/л, нарушения ритма сердца) соли калия вводят в/в со скоростью не выше 20 ммоль/ч в концентрации не выше 60 ммоль/л.
В данном клиническом случае у коморбидного пациента с ИБС, АГ, сахарным диабетом, онкологическим заболеванием, на фоне постоянного приема петлевых диуретиков и в результате длительной рвоты развилась умеренная симптомная гипокалиемия, сопровождавшаяся характерными изменениями ЭКГ. Для купирования гипокалиемии был внутривенно введен КМА (Панангин®, «Гедеон Рихтер»), после чего состояние пациента улучшилось, симптомы регрессировали, уровень калия в сыворотке крови пришел в норму.
Пациентка В., 43 года, обратилась в поликлинику 21.01.2022 с жалобами на сердцебиение, перебои в работе сердца, одышку при ходьбе.
Anamnesis morbi: в 1988 г. диагностирован ревматический порок сердца (митральный стеноз, аортальная недостаточность). В 1992 г. проведена митральная коммисуротомия. В 2000 г. диагностирован рестеноз митрального клапана, выполнено протезирование митрального клапана. С 2008 г. диагностирована пароксизмальная форма мерцательной аритмии. Прошлый пароксизм от 30.12.2021 купирован прокаинамидом на догоспитальном этапе.
Клинику стенокардии пациентка не описывает. Инсульт, ИМ отрицает. Регулярно принимает соталол 80 мг/сут, верошпирон 25 мг/сут, фуросемид 40 мг/нед., варфарин 5 мг/сут. Настоящее ухудшение с 18:00 16.01.2022, когда на фоне физической нагрузки отметила появление вышеперечисленных жалоб. Обратилась за медицинской помощью в поликлинику.
Anamnesis vitae: рост и развитие соответствуют возрасту. Работает учителем в школе, инвалидность: II группа.
Перенесенные заболевания: хронический бронхит.
Вредные привычки: не курит. Алкоголь не употребляет.
При осмотре: состояние средней тяжести. Кожа бледная, цианоз губ. Пастозность голеней. Температура тела 36,6 °С. В легких везикулярное дыхание, хрипов нет, ЧДД 18 в 1 мин. Ритм сердца неправильный, ЧСС 120 в 1 мин, пульс 110 в 1 мин, АД 90/60 мм рт. ст., мелодия протеза митрального клапана. Живот мягкий, безболезненный. Размеры печени по Курлову 12×11×10 см. Симптомов раздражения брюшины нет. Область почек не изменена. Синдром поколачивания отрицательный. Сознание ясное, очаговой и менингеальной симптоматики нет. В общем анализе крови существенных отклонений от референтных значений не выявлено, в биохимическом анализе крови обращала на себя внимание гипокалиемия (3,1 ммоль/л). МНО в диапазоне от 1,5 до 3,06 за время наблюдения.
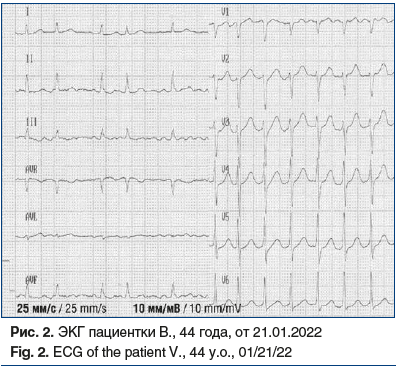
На ЭКГ (рис. 2) зарегистрирован нерегулярный ритм с ЧСС 75–150 в 1 мин, низкоамплитудная нерегулярная волна f с частотой 350–750 в 1 мин. Альтернированные комплексы QRS расположены на различных расстояниях друг от друга.
Дополнительные методы исследования: ЭхоКГ, чреспищеводная ЭхоКГ, суточное мониторирование ЭКГ, УЗИ щитовидной железы, коагулограмма (МНО).
Дифференциальный диагноз проводился со следующими состояниями: синусовая тахикардия, предсердная тахикардия, трепетание предсердий, желудочковая тахикардия, частая политопная предсердная экстрасистолия.
Основной: хроническая ревматическая болезнь сердца. Сочетанный ревматический порок сердца: митральный стеноз, аортальная недостаточность. Митральная комиссуротомия (1992 г.). Рестеноз и протезирование митрального клапана (1997 г.).
Осложнения: пароксизмальная форма ФП. CHA2DS2-VASc — 1 балл. Затянувшийся пароксизм ФП от 16.01.2022 mEHRA IIb. ХСН IIА, II ФК (NYHA).
Принципы лечения фибрилляции предсердий
В настоящее время для определения тактики лечения ФП используют алгоритм 4S — ABC (рис. 3).
![Рис. 3. Тактика стратификации и лечения фибрилляции предсердий 4S-ABC [21] Fig. 3. 4S-AF scheme and ABC pathway guided management of atrial fibrillation: risk stratification and treatment [21] Рис. 3. Тактика стратификации и лечения фибрилляции предсердий 4S-ABC [21] Fig. 3. 4S-AF scheme and ABC pathway guided management of atrial fibrillation: risk stratification and treatment [21]](/upload/medialibrary/f73/433-6.png)
Одним из определяющих принципов лечения ФП является стратификация риска тромбоэмболических осложнений и определение давности возникновения приступа. При пароксизме ФП давностью менее 48 ч целесообразно экстренное восстановление ритма (электрическая или фармакологическая кардиоверсия: антиаритмические препараты IА группы (хинидин, прокаинамид), IС группы (лаппаконитина гидробромид, пропафенон и т. д.) и III группы (амиодарон, рефралон)).
При наличии затянувшегося пароксизма ФП (давность аритмии более 48 ч, но меньше 12 мес.) восстановление синусового ритма возможно только после 4-недельной адекватной антикоагулянтной терапии либо после выполнения чреспищеводной ЭхоКГ, доказывающей отсутствие тромбоза полостей сердца. В качестве подготовительной терапии к плановому восстановлению синусового ритма целесообразно назначение пульсурежающих препаратов (антиаритмические препараты II группы: β-блокаторы, IV группы: антагонисты кальция (верапамил, дилтиазем) или сердечные гликозиды) и антикоагулянтных препаратов.
При постоянной форме ФП, как правило, назначают пульсурежающие и антикоагулянтные препараты. Целесообразность назначения антикоагулянтов необходимо определять по шкале прогнозирования риска CHA2DS2-VASc и шкале прогнозирования риска кровотечения HAS-BLED.
Учитывая наличие у пациентки персистирующей формы ФП с адекватным уровнем МНО (за период более 1 мес. превышает значение 2) целесообразно восстановление синусового ритма. Возможно проведение фармакологической кардиоверсии, но более обосновано использование электрической кардиоверсии (разряд субмаксимальной и максимальной мощности) после нормализации уровня сывороточного калия.
В данном случае у пациентки с ревматическим пороком сердца и ФП на фоне длительной терапии антиаритмическим препаратом III класса и петлевым диуретиком развилась умеренная гипокалиемия, потребовавшая коррекции перед восстановлением синусового ритма. Достижение нормального уровня калия крови на фоне введения КМА (препарат Панангин® по 2 таблетки 3 р/сут) способствовало успешному восстановлению и удержанию синусового ритма у данной пациентки.
Заключение
Гипокалиемия и гипомагниемия связаны с высоким риском побочных эффектов и патологических клинических состояний, в особенности при ССЗ. Адекватное клиническое ведение пациентов с ССЗ должно включать в себя мониторинг уровня электролитов крови и осуществление своевременной коррекции уровня калия и магния. При высоком риске развития гипокалиемии и гипомагниемии следует проводить профилактику развития дефицита калия и магния, что особенно актуально для пациентов с нарушениями ритма сердца, АГ, СН и ишемией миокарда. Оптимальным в коррекции гипокалиемии и гипомагниемии является применение КМА (например, препарата Панангин® компании «Гедеон Рихтер») в повседневной клинической практике.
Ялымов Анатолий Александрович — к.м.н., профессор кафедры терапии ФУВ, старший научный сотрудник отделения кардиологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0000-0002-5322-3369.
Ефремова Юлия Евгеньевна — к.м.н., старший научный сотрудник научно-организационного отдела ФГБУ «НМИЦК им. ак. Е.И. Чазова» Минздрава России; 121552, Россия, г. Москва, ул. 3-я Черепковская, д. 15а; ORCID iD 0000-0001-8674-9669.
Шехян Грант Георгиевич — к.м.н., профессор кафедры терапии ФУВ, руководитель отделения кардиологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0000-0003-0442-644X.
Чараева Татьяна Глебовна — младший научный сотрудник отделения кардиологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0000-0002-0113-7741.
Контактная информация: Ялымов Анатолий Александрович, e-mail: ayalymov@gmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 09.07.2022.
Поступила после рецензирования 02.08.2022.
Принята в печать 25.08.2022.
About the authors:
Anatoliy A. Yalymov — C. Sc. (Med.), Professor of the Department of Therapy, Faculty of Continuing Medical Education, senior researcher of the Department of Cardiology, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0000-0002-5322-3369.
Yuliya E. Efremova — C. Sc. (Med.), senior researcher of the Scientific and Organizational Department, Acad. E.I. Chazov National Medical Research Center of Cardiology; 15a, 3rd Cherepanovskaya str., Moscow, 121552, Russian Federation; ORCID iD 0000-0001-8674-9669.
Grant G. Shekhyan — C. Sc. (Med.), Professor of the Department of Therapy, Faculty of Continuing Medical Education, Head of the Cardiology Department, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0000-0003-0442-644X.
Tatyana G. Charaeva — junior researcher of the Cardiology Department, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0000-0002-0113-7741. Contact information: Anatoliy A. Yalymov, e-mail: ayalymov@gmail.com
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 09.07.2022.
Revised 02.08.2022.
Accepted 25.08.2022.
2. Степура О.Б., Остроумова О.Д. Применение пероральных препаратов магния для лечения сердечно-сосудистых заболеваний. РМЖ. 2010;3:109.
3. McLean R.M., Wang N.X. Potassium. Adv Food Nutr Res. 2021;96:89–121. DOI: 10.1016/bs.afnr.2021.02.013.
4. Wolf F., Cittadini A. Chemistry and biochemistry of magnesium. Mol Aspects Med. 2003;24(1–3):3–9. DOI: 10.1016/s0098-2997(02)00087-0.
5. Krogager M.L., Kragholm K., Thomassen J.Q. et al. Update on management of hypokalaemia and goals for the lower potassium level in patients with cardiovascular disease: a review in collaboration with the European Society of Cardiology Working Group on Cardiovascular Pharmacotherapy. Eur Heart J Cardiovasc Pharmacother. 2021;7(6):557–567. DOI: 10.1093/ehjcvp/pvab038.
6. Громова О.А., Торшин И.Ю., Калачева А.Г. и др. Метаанализ клинических исследований воздействия оротата магния на сердечно-сосудистую систему. Терапевтический архив. 2015;6:88–97. DOI: 10.17116/terarkh201587688-97.
7. Weiss J.N., Qu Z., Shivkumar K. Electrophysiology of Hypokalemia and Hyperkalemia. Circ Arrhythm Electrophysiol. 2017;10(3):e004667. DOI: 10.1161/CIRCEP.116.004667.
8. Näppi S.E., Virtanen V.K., Saha H.H. et al. QTc dispersion increases during hemodialysis with low-calcium dialysate. Kidney Int. 2000;57(5):2117–2122. DOI: 10.1046/j.1523-1755.2000.00062.x.
9. Руксин В.В. Неотложная кардиология. СПб.: Невский Диалект; 1997.
10. Diaz R., Goyal A., Mehta S.R. et al. Glucose-Insulin-Potassium Therapy in Patients With ST-Segment Elevation Myocardial Infarction. JAMA. 2007;298(20):2399–2405.
11. Woods K.L., Fletcheer S., Foffe C., Haider Y. Intravenous magnesium sulphate in suspected acute myocardial infarction. Results of the second Leicester Intravenous Magnesium Intervention Trial (LIMIT-2). Lancet. 1992;339(8809):1553–1558. DOI: 10.1016/0140-6736(92)91828-v.
12. Ryan T.J., Antman E.M., Brooks N.H. et al. 1999 update: ACC/AHA Guidelines for the Management of Patients With Acute Myocardial Infarction: Executive Summary and Recommendations: A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on Management of Acute Myocardial Infarction). Circulation. 1999;100(9):1016–1030. DOI: 10.1161/01.cir.100.9.1016.
13. Shechter M., Hod H., Chouraqui P. et al. Magnesium therapy in acute myocardial infarction when patients are not candidates for thrombolytic therapy. Am J Cardiol. 1995;75(5):321–323. DOI: 10.1016/s0002-9149(99)80546-3.
14. Ялымов А.А., Задионченко В.С., Шехян Г.Г. и др. Применение препаратов калия и магния в кардиохирургической клинике. Consilium Medicum. Хирургия. 2012;2:13–17.
15. Шляхто Е.В. Метаболизм миокарда у больных ИБС. Сердечная недостаточность. 2003;4(1):19–21.
16. Hulting J. In-hospital ventricular fibrillation and its relation to serum potassium. Acta Med Scand Suppl. 1981;647:109–116. DOI: 10.1111/j.0954-6820.1981.tb02646.x.
17. Hagengaard L., Sogaard P., Espersen M. et al. Association between serum potas- sium levels and short-term mortality in patients with atrial fibrillation or flutter co-treated with diuretics and rate- or rhythm-controlling drugs. Eur Heart J Cardiovasc Pharmacother. 2020;6(3):137–144. DOI: 10.1093/ehjcvp/pvz024.
18. Pu J., Zhang C., Quan X. et al. Effects of potassium aspartate and magnesium on ventricular arrhythmia in ischemia-reperfusion rabbit heart. J Huazhong Univ Sci Technolog Med Sci. 2008;28(5):517–519. DOI: 10.1007/s11596-008-0506-x.
19. Knüttgen D., Weidemann D., Doehn M. Restoring sinus rhythm after intraoperatively occurring isorhythmic AV dissociation by the use of K-Mg aspartate or Mg aspartate. Magnes Trace Elem. 1990;9(6):303–308.
20. Ryan M., Lown B., Horn H. Comparison of ventricular ectopic activity during 24-hour monitoring and exercise testing in patients with coronary heart disease. N Engl J Med. 1975;292(5):224–229. DOI: 10.1056/NEJM197501302920502.
21. Клинические рекомендации. Фибрилляция и трепетания предсердий. 2020 г. (Электронный ресурс.) URL: https://scardio.ru/content/Guidelines/2020/Clinic_rekom_FP_TP-unlocked.pdf?ysclid=l7m7tpha9j689295469 (дата обращения: 06.07.2022).
22. Cappuccio F.P., MacGregor G.A. Does potassium supplementation lower blood pressure? A meta-analysis of published trials. J Hypertens. 1991;9(5):465–473. DOI: 10.1097/00004872-199105000-00011.
23. Krogager M.L., Torp-Pedersen C., Mortensen R.N. et al. Short-term mortality risk of serum potassium levels in hypertension: a retrospective analysis of nationwide registry data. Eur Heart J. 2017;38:104–112. DOI: 10.1093/eurheartj/ehw129.
24. Клинические рекомендации. Артериальная гипертензия у взрослых. 2020 г. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/schema/622 (дата обращения: 06.07.2022).
25. Geleijnse J.M., Witteman J.C.M., den Breeijen J.H. et al. Dietary electrolyte intake and blood pressure in older subjects: the Rotterdam Study. J Hypertens. 1996;14(6):737–741. DOI: 10.1097/00004872-199606000-00009.
26. Wirell M.P., Wester P.O., Stegmayr B.G. Nutritional dose of magnesium in hypertensive patients on beta blockers lowers systolic blood pressure: a double-blind, cross-over study. J Intern Med. 1994;236(2):189–195. DOI: 10.1111/j.1365-2796.1994.tb01282.x.
27. Goyal A., Spertus J.A., Gosch K. et al. Serum potassium levels and mortality in acute myocardial infarction. JAMA. 2012;307:157–164. DOI: 10.1001/jama.2011.1967.
28. Shiyovich A., Gilutz H., Plakht Y. Serum potassium levels and long-term post-discharge mortality in acute myocardial infarction. Int J Cardiol. 2014;172(2):e368–e370. DOI: 10.1016/j.ijcard.2013.12.296.
29. Colombo M.G., Kirchberger I., Amann U. et al. Association of serum potassium concentration with mortality and ventricular arrhythmias in patients with acute myocardial infarction: a systematic review and meta-analysis. Eur J Prev Cardiol. 2018;25(6):576–595. DOI: 10.1177/2047487318759694.
30. Xu H., Faxen J., Szummer K. et al. Dyskalemias and adverse events associated with discharge potassium in acute myocardial infarction. Am Heart J. 2018;205:53–62. DOI: 10.1016/j.ahj.2018.06.009.
31. Krogager M.L., Eggers-Kaas L., Aasbjerg K. et al. Short-term mortality risk of serum potassium lev- els in acute heart failure following myocardial infarction. Eur Heart J Cardiovasc Pharmacother. 2015;1(4):245–251. DOI: 10.1093/ehjcvp/pvv026.
32. Трекова Н.А., Андрианова М.Ю., Толстова П.А. и др. Применение раствора калия и магния аспарагината для поддержания баланса калия и магния при кардиохирургических вмешательствах в условиях искусственного кровообращения. Анестезиология и реаниматология. 2008;5:17–21.
33. Ravn Jacobsen M., Jabbari R., Glinge C. et al. Potassium disturbances and risk of ventricular fibrillation among patients with ST-segment–elevation myocardial infarction. J Am Heart Assoc. 2020;9(4):e014160. DOI: 10.1161/JAHA.119.014160.
34. Клинические рекомендации. Желудочковые нарушения ритма. Желудочковые тахикардии и внезапная сердечная смерть. 2020 г. (Электронный ресурс.) URL: https://scardio.ru/content/Guidelines/2020/Clinic_rekom_ZHNR-unlocked.pdf (дата обращения: 06.07.2022).
35. Díaz R., Paolasso E.A., Piegas L.S. et al. Metabolic modulation of acute myocardial infarction. The ECLA (Estudios Cardiológicos Latinoamérica) Collaborative Group. Circulation. 1998;98(21):2227–2234. DOI: 10.1161/01.cir.98.21.2227.
36. Liao F., Folsom A.R., Brancati F.L. Is low magnesium concentration a risk factor for coronary heart disease? The Atherosclerosis Risk in Communities (ARIC) Study. Am Heart J. 1998;136(3):480–490. DOI: 10.1016/s0002-8703(98)70224-8.
37. Mehta S.R., Yusuf S., Díaz R. et al. Effect of glucose-insulin-potassium infusion on mortality in patients with acute ST-segment elevation myocardial infarction: the CREATE-ECLA randomized controlled trial. JAMA. 2005;293(4):437–446. DOI: 10.1001/jama.293.4.437.
38. D’Elia L., Barba G., Cappuccio F.P., Strazzullo P. Potassium intake, stroke, and cardiovascular disease a meta-analysis of prospective studies. J Am Coll Cardiol. 2011;57(10):1210–1219. DOI: 10.1016/j.jacc.2010.09.070.
39. Yang Q., Liu T., Kuklina E.V. et al. Sodium and potassium intake and mortality among US adults: prospective data from the third national health and nutrition examination survey. Arch Intern Med. 2011;171(13):1183–1191. DOI: 10.1001/archinternmed.2011.257.
40. Del Gobbo L.C., Imamura F., Wu J.H. et al. Circulating and dietary magnesium and risk of cardiovascular disease: a systematic review and meta-analysis of prospective studies. Am J Clin Nutr. 2013;98(1):160–173. DOI: 10.3945/ajcn.112.053132.
41. Guasch-Ferré M., Bulló M., Estruch R. et al. Dietary magnesium intake is inversely associated with mortality in adults at high cardiovascular disease risk. J Nutr. 2014;144(12):1956–1962. DOI: 10.3945/jn.113.183012.
42. Ялымов А.А., Шехян Г.Г., Щикота А.М. и др. Причины и клиническое значение ЭКГ-феномена депрессии сегмента ST. Consilium Medicum. 2013;15(5):108–118.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
