Комплексное лечение пациентов с хронической ишемией, угрожающей потерей конечности: все ли возможности антикоагулянтной терапии нами используются?
DOI: 10.32364/2587-6821-2020-4-7-445-451
Введение: медикаментозная коррекция системы гемостаза является одним из важнейших направлений комплексного лечения облитерирующих заболеваний артерий нижних конечностей (ОЗАНК), в т. ч. при хронической ишемии, угрожающей потерей конечности (ХИУПК).
Цель исследования: оценить эффективность и безопасность применения сулодексида (СД) у пациентов с ОЗАНК при проведении комплексного лечения ХИУПК.
Материал и методы: проведено двухцентровое проспективное исследование, в котором из 520 пациентов 318 (211 — с признаками ХИУПК, 107 — без признаков ХИУПК) подверглись реваскуляризирующим вмешательствам, 202 пациента с ХИУПК получали многокомпонентное комплексное консервативное лечение. По 30 пациентов в группах оперированных и 50 пациентов в группе консервативного лечения получали в дополнение к стандартному лечению СД перорально по 2 капсулы 2 р./сут (1000 ЛЕ/сут). До и после лечения оценивали выраженность болевого синдрома, дистанцию безболевой ходьбы, некоторые лабораторные показатели системы гемостаза, а также наличие побочных реакций и осложнений.
Результаты исследования: у оперированных больных как с ХИУПК, так и без ХИУПК вне зависимости от применения СД отмечено существенное снижение выраженности болевого синдрома и увеличение дистанции безболевой ходьбы. Применение СД сопровождалось снижением показателей фибриногена, Д-димера, растворимых фибрин-мономерных комплексов (РФМК) и ингибитора активатора плазминогена (PAI-1) в подгруппе пациентов с ХИУПК, и показателей фибриногена и PAI-1 в подгруппе пациентов без ХИУПК (p<0,05). У неоперированных больных с ХИУПК применение СД сопровождалось снижением выраженности болевого синдрома и показателей фибриногена, Д-димера, РФМК и PAI-1 (p<0,05), хотя и менее существенным, чем при выполнении реваскуляризации. Побочных реакций и осложнений, связанных с применением СД, не отмечено.
Выводы: улучшение клинических и лабораторных показателей в основном определяется эффективностью выполненной реваскуляризации конечности. В комплексном лечении больных ОЗАНК применение СД безопасно и эффективно, что проявляется уменьшением выраженности болевого синдрома, увеличением дистанции безболевой ходьбы и нормализацией некоторых показателей коагулограммы.
Ключевые слова: хроническая ишемия, угрожающая потерей конечности, критическая ишемия нижних конечностей, облитерирующие заболевания артерий нижних конечностей, комплексное лечение, сулодексид.
Для цитирования: Кательницкий И.И., Дарвин В.В., Зорькин А.А. Комплексное лечение пациентов с хронической ишемией, угрожающей потерей конечности: все ли возможности антикоагулянтной терапии нами используются? РМЖ. Медицинское обозрение. 2020;4(7):445-451. DOI: 10.32364/2587-6821-2020-4-7-445-451.
I.I. Katelnitsky1, V.V. Darvin2, A.A. Zorkin2
1Rostov State Medical University, Rostov-on-Don, Russian Federation
2Surgut State University, Surgut, Russian Federation
Background: medical correction of the hemostatic system is one of the most important directions for complex treatment of obliterating diseases of lower limbs arteries (ODLLA), including cases of chronic limb-threatening ischaemia (CLTI).
Aim: to evaluate the efficacy and safety of the sulodexide use in patients with ODLLA when conducting a comprehensive treatment of CLTI.
Patients and Methods: 520 patients underwent two-center prospective study, 318 of whom (211 — with signs of ODLLA, 107 — without signs of CLTI) underwent revascularization interventions, whereas, 202 patients with CLTI received multicomponent complex conservative treatment. In addition to standard treatment, 30 patients who underwent surgery interventions and the group of 50 patients receiving conservative treatment received sulodexide orally in 2 capsules bis in day (1000 LE/day). The severity of the pain syndrome, the distance of pain-free walking, some laboratory indicators of hemostatic system, as well as the presence of adverse events and complications were evaluated before and after treatment.
Results: in operated patients with both CLTI and without it, regardless of the sulodexide use, there was a significant decrease in the severity of pain syndrome and an increase in the distance of pain-free walking. Sulodexide use was accompanied by reduced fibrinogen, D-dimer, soluble fibrin monomer complexes (SFMC) and plasminogen activator inhibitor (PAI-1) in the subgroup of patients with CLTI, and indicators of fibrinogen and PAI-1 in the subgroup of patients without CLTI (p<0.05). In non-operated patients with CLTI, sulodexide use was accompanied by a decrease in pain syndrome and indicators of fibrinogen, D-dimer, SFMC, and PAI-1 (p<0.05). However, it was less significant after performed revascularization. There were no adverse events or complications associated with the sulodexide use.
Conclusions: improvement of clinical and laboratory parameters was mainly determined by the efficacy of performed limb revascularization. In the complex treatment of patients with ODL LA, the sulodexide use was safe and effective, which was manifested by a decrease in the pain severity, an increase in the distance of pain-free walking and normalization of some coagulogram indicators.
Keywords: chronic limb-threatening ischaemia, critical limb ischemia, obliterating diseases of lower limb arteries, complex treatment, sulodexide.
For citation: Katelnitsky I.I., Darvin V.V., Zorkin A.A. Comprehensive treatment of patients with chronic limb-threatening ischaemia: are we using all the possibilities of anticoagulant therapy? Russian Medical Inquiry. 2020;4(7):445–451. DOI: 10.32364/2587-6821-2020-4-7-445-451.
Введение
Облитерирующие заболевания артерий нижних конечностей (ОЗАНК) — сосудистая патология, имеющая большую социальную и экономическую значимость [1, 2]. Эти заболевания характеризуются мультифокальным поражением сосудистого русла, носят прогрессирующий характер и приводят к инвалидности и смерти от гангрены конечности или сосудистых катастроф [2–4]. Длительное время для обозначения финальной стадии ОЗАНК применялся термин «критическая ишемия», в последние годы вытесненный более широким в понимании термином «хроническая ишемия, угрожающая потерей конечности» (ХИУПК) [5].
Многофакторность и многокомпонентность патогенеза ОЗАНК и ХИУПК требуют мультидисциплинарного подхода к диагностике и лечению пациентов с этой патологией [5, 6]. Несмотря на внедрение новых, высокотехнологичных способов лечения ХИУПК, таких как эндоваскулярная и гибридная реваскуляризация, а также применение препаратов для неоваскулогенеза и разработку новых схем комбинированной антиагрегантной и антикоагулянтной терапии, непосредственные и отдаленные результаты лечения нельзя назвать удовлетворительными [4]. Примерно у 30% пациентов с ХИУПК по ряду причин не удается выполнить реваскуляризацию, и это ассоциируется со значительным риском ампутации конечности в ближайшие 5 лет — от 30% [7] до 50% [8] против 8,5–21,2% случаев утраты конечности у больных с восстановленным кровообращением [9]. При этом периоперационная летальность составляет около 30%, а 5-летняя выживаемость не превышает 25–30% [10]. Одним из нерешенных вопросов патогенетической терапии ХИУПК является целенаправленная коррекция нарушений системы гемостаза, во многом определяющих неблагоприятные исходы реваскуляризирующих вмешательств [11, 12]. В настоящее время для лечения ХИУПК предлагаются различные подходы к применению дезагрегантных и антикоагулянтных препаратов, которые часто реализуются в многокомпонентных схемах терапии. Это в значительной степени увеличивает риск осложнений, прежде всего геморрагического характера [5, 6, 11–13].
Для лечения ХИУПК необходимы средства, оказывающие многофакторное воздействие на многие патогенетические процессы: коагуляционный и сосудисто-тромбоцитарный гемостаз, систему фибринолиза, эндотелиальную дисфункцию и т. д., а также обладающие высоким профилем безопасности. Из препаратов комплексного действия при сосудистой патологии используется биологический лекарственный препарат сулодексид (СД), состоящий из естественной смеси гликозаминогликанов с гепариноподобным действием и дерматансульфата. Считается, что он, в отличие от нефракционированного и низкомолекулярных гепаринов, индуцирует антитромбиновый механизм без выраженных изменений основных коагуляционных тестов, оказывая также ангиопротективное и фибринолитическое действие [14–16]. Необходимо отметить, что применению СД при сосудистой патологии посвящено значительное количество исследований, но большая часть из них относится к изучению его эффективности при заболеваниях вен [16–18] или при ОЗАНК с ишемией II стадии по Покровскому — Фонтейну [19–21]. В связи с этим оценка результатов использования СД при ОЗАНК, особенно на этапе развития ХИУПК, представляет определенный интерес.
Цель исследования: оценить эффективность применения СД в комплексном лечении пациентов с облитерирующими атеросклеротическими поражениями магистральных артерий нижних конечностей при проведении комплексного лечения ХИУПК.
Материал и методы
В двухцентровое проспективное исследование включено 520 пациентов с ОЗАНК, которым проводилось комплексное лечение в отделении сосудистой хирургии БУ «Сургутская городская клиническая больница» и клинике госпитальной хирургии ФГБОУ ВО РостГМУ Минздрава России в период с 2009 по 2019 г. Критериями включения в исследование были ОЗАНК атеросклеротического генеза, верифицированные методами традиционной ангиографии и мультиспиральной КТ-ангиографии. Для оценки выраженности ишемических проявлений использовали классификацию Покровского — Фонтейна. Всем пациентам проводили клиническое, лабораторное и инструментальное обследование по единому протоколу.
Реваскуляризирующие вмешательства выполняли с учетом показаний, отраженных в международных и национальных клинических рекомендациях [5, 6], открытым, эндоваскулярным или гибридным способом, в т. ч. в виде многоэтажных реваскуляризаций (с 2015 г. при выполнении таких вмешательств восстановление кровотока проводим в соответствии с ангиосомным принципом). Обязательным компонентом хирургического лечения было выполнение этапных некрэктомий и «малых» ампутаций, при необходимости в сочетании с вакуум-терапией. Базисная периоперационная терапия соответствовала действующим клиническим рекомендациям [6]. Критериями невключения в исследование были: документированный иммунодефицит, медикаментозная иммунодепрессия, неспецифический артериит, технически неудачная попытка реваскуляризации. Под неблагоприятным результатом реваскуляризации понимали прогрессирование ишемии, которая стала причиной ранней высокой ампутации конечности, развитие синдрома полиорганной недостаточности с летальным исходом на этапе госпитализации.
Изначально все пациенты были разделены на 2 группы: 318 из них подверглись различным реваскуляризирующим вмешательствам (группа А), остальные 202 прошли общепринятое [6] многокомпонентное этапное комплексное консервативное лечение (группа В). В группе А 211 больных имели признаки ХИУПК (группа А1), у 107 они отсутствовали (группа А2). Пациенты групп А1 и А2 были сопоставимы по основным клиническим и параклиническим параметрам. Все пациенты группы В имели признаки ХИУПК, отказ от проведения реваскуляризации у них был связан с особенностями течения заболевания (прогрессирование после выполненной ранее реваскуляризации; топографо-анатомические особенности артериальной окклюзии, предполагающие техническую невозможность или крайне высокий риск неудачи реваскуляризирующего вмешательства; фоновая патология, препятствующая выполнению хирургического вмешательства; отказ пациента от оперативного лечения).
По 30 пациентов в группах А1 и А2, а также 50 пациентов группы В дополнительно к базисной терапии [6] получали СД перорально по 2 капсулы 2 р./сут (1000 ЛЕ/сут), они рассматривались в качестве основных подгрупп (СД+). Длительность приема была не менее 30 сут. Пациентов, которым СД не назначали, рассматривали в качестве подгрупп сравнения (СД-). В каждой из групп исходно и в конце курса оценивали выраженность болевого синдрома по визуально-аналоговой шкале (ВАШ), показатель дистанции безболевой ходьбы (ДББХ), некоторые лабораторные гемостазиологические показатели (протромбиновый индекс, активированное частичное тромбопластиновое время (АЧТВ), фибриноген, тромбиновое время, антитромбин III, протеины C и S, Д-димеры, растворимые фибрин-мономерные комплексы (РФМК), плазминоген, ингибитор активатора плазминогена (PAI-1), XIIа-зависимый фибринолиз) [22–24].
Дополнительно оценивали профиль безопасности СД, выявляли неблагоприятные побочные эффекты и оценивали частоту осложнений, в т. ч. геморрагических, связанных с приемом препарата.
Статистическую обработку полученных результатов выполняли с использованием программы Statistica 6.1. При нормальном распределении значимость различий оценивали по t-критерию Стьюдента, при ненормальном распределении использовали непараметрический критерий Манна — Уитни. Различия между показателями считали статистически значимыми при p<0,05.
Результаты и обсуждение
Средний возраст пациентов составил 67±11 лет, соотношение мужчин и женщин — 12:1. В группе А клинически значимое монолатеральное поражение отмечено у 215 пациентов, билатеральное — у 103, в группе В преобладало билатеральное поражение (у 164 пациентов). Многоуровневая окклюзия отмечена у 62 пациентов группы А и у 116 пациентов группы В. У 202 (39%) пациентов наблюдался мультифокальный характер атеросклеротического поражения с преимущественным вовлечением коронарного и брахиоцефального сосудистых бассейнов. Сахарный диабет как фоновая патология встречался у 274 (52,7%) пациентов.
В группе пациентов с ХИУПК, которым была выполнена реваскуляризация, в срок до 30 сут отмечено существенное, почти трехкратное снижение выраженности болевого синдрома как в подгруппе СД+, так и в подгруппе СД-. Это сопровождалось более чем двукратным повышением величины ДББХ также в обеих подгруппах. Из всех лабораторных показателей системы гемостаза положительная динамика отмечена практически для всех показателей системы свертывания, противосвертывания и фибринолиза (табл. 1). Таким образом, нами установлено, что у пациентов с ХИУПК данные показатели имеют тенденцию к нормализации после реваскуляризации независимо от того, применялся или не применялся СД. Об этом также косвенно свидетельствуют данные ряда исследований [22–24]. Вместе с тем применение СД существенно влияло на выраженность некоторых лабораторных тестов. После лечения подгруппы СД+ и СД- статистически значимо различались по уровням фибриногена, Д-димера, РФМК и PAI-1, что согласуется с имеющимися данными о влиянии препарата на некоторые параметры системы гемостаза [14–16].
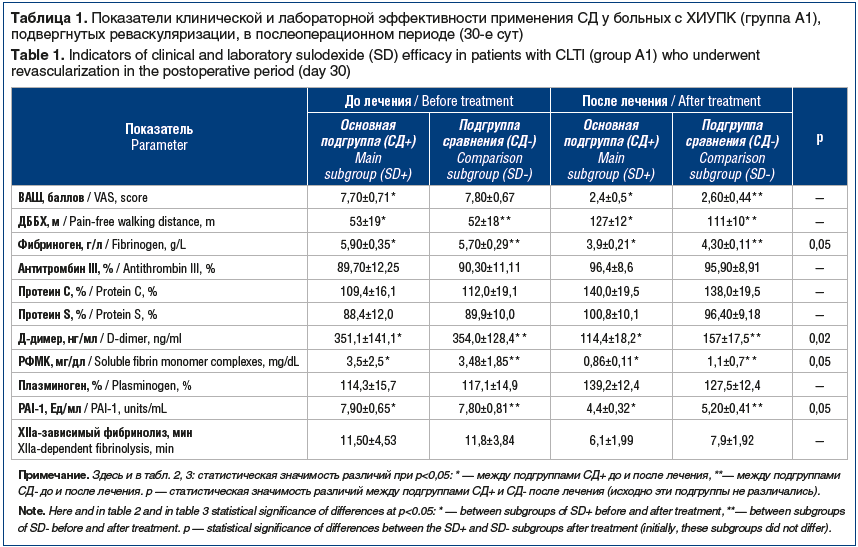
Ситуация, схожая с описанной выше, отмечена и в группе пациентов без ХИУПК, которым также было выполнено реваскуляризирующее вмешательство (табл. 2). У них в срок до 30 сут также отмечено существенное снижение выраженности болевого синдрома как при применении, так и без применения СД, при этом снижение интенсивности боли было более значительным, чем в группе А1. Величина ДББХ также в обеих подгруппах существенно выросла, причем больше, чем среди пациентов с ХИУПК (различия статистически значимы, p<0,05). Из лабораторных показателей системы гемостаза положительную динамику имели показатели свертывания, противосвертывания и фибринолиза (как и в группе А1), однако статистически значимо до и после лечения отличались только показатели фибриногена и PAI-1, что мы также связываем с дополнительным применением в комплексной терапии СД [14, 16, 25].
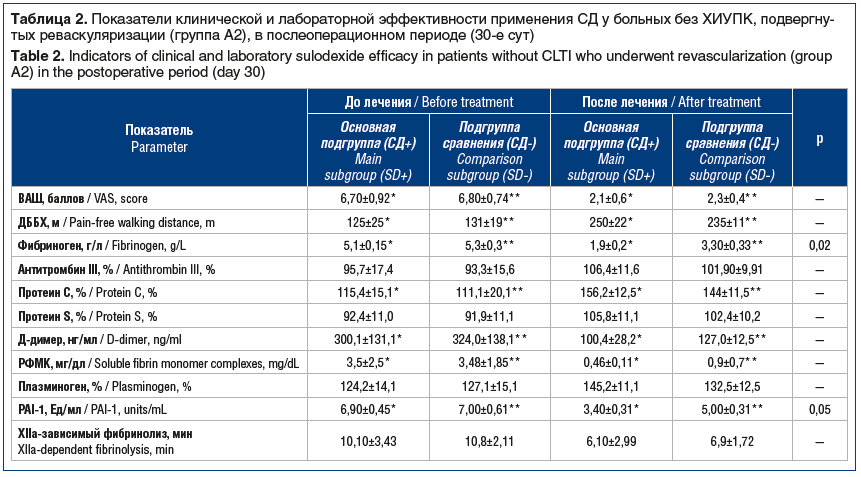
Все значимые клинико-лабораторные показатели в группе пациентов с ХИУПК, которым не проводились реваскуляризирующие вмешательства (группа В; табл. 3), оказались существенно хуже, чем в группах А2 и, особенно, А1 (различия статистически значимы, p<0,05), что свидетельствует о том, что даже проводимая в полном объеме комплексная терапия не может конкурировать с реваскуляризацией. Данное утверждение согласуется с многочисленными исследованиями, лежащими в основе сформированных международных и национальных клинических рекомендаций по лечению пациентов с ХИУПК [4, 6, 7, 13].
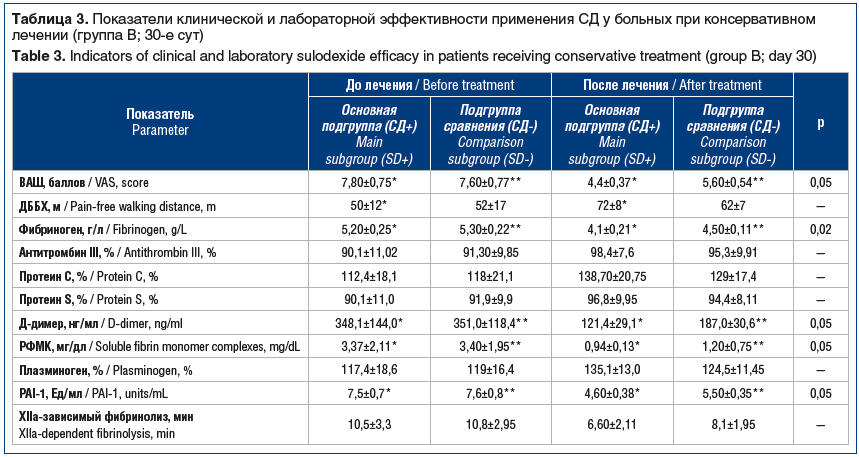
Вместе с тем необходимо отметить, что комплексное консервативное лечение как с применением, так и без применения СД положительно сказывалось на состоянии пациентов с ХИУПК и сопровождалось снижением выраженности болевого синдрома, положительными изменениями маркерных тестов системы гемостаза. При этом отмечен существенный вклад СД в увеличение ДББХ, что подтверждается рядом проведенных ранее исследований [14, 15, 18, 20, 21]. Использование в комплексной терапии ХИУПК СД сопровождалось более существенным, чем в подгруппе сравнения, статистически значимым снижением: выраженности ишемического болевого синдрома, показателей фибриногена, Д-димера и РФМК, а также PAI-1 периферической крови — все это свидетельствует о снижении выраженности эндотелиальной дисфункции и субклинически протекающего ДВС-синдрома.
Нами не отмечено каких-либо осложнений и побочных реакций, связанных с применением СД, в т. ч. геморрагического характера, что подтверждается ранее проведенными исследованиями [14, 15, 20].
Критически оценивая полученные нами данные, считаем, что обнаруженные различия лабораторных показателей системы гемостаза не являются окончательными в связи с относительно небольшим количеством наблюдений, а также ограниченной длительностью курса терапии СД. Дальнейшие исследования могут, с учетом выявленных трендов, продемонстрировать более отчетливое влияние СД прежде всего на показатели противосвертывания и фибринолиза, что было бы существенным вкладом как в предотвращение ранних и поздних тромботических осложнений реваскуляризирующих вмешательств, так и в сокращение частоты иных неблагоприятных сосудистых событий — катастроф в бассейнах коронарных и брахиоцефальных сосудов, являющихся конкурентными причинами летального исхода при ХИУПК [4, 6, 7, 11].
Выводы
При ОЗАНК, в т. ч. с ХИУПК, применение СД в комплексном лечении эффективно и безопасно.
Положительные клинические и лабораторные изменения при ОЗАНК как с ХИУПК, так и без ХИУПК связаны преимущественно с успешно выполненной реваскуляризацией конечности.
У пациентов с ОЗАНК без ХИУПК, которым было выполнено реваскуляризирующее вмешательство, периоперационное применение СД улучшало клинико-лабораторный эффект от комплексного лечения, однако статистически значимые различия подгрупп СД+ и СД- касались только показателей фибриногена и PAI-1.
Периоперационное применение СД у пациентов с ОЗАНК и ХИУПК, которым было выполнено реваскуляризирующее вмешательство, сопровождалось более выраженным клинико-лабораторным эффектом при статистически значимых отличиях показателей фибриногена, Д-димера, РФМК и PAI-1.
У пациентов с ОЗАНК и ХИУПК, получающих только комплексное консервативное лечение, применение СД сопровождалось статистически значимым снижением выраженности болевого синдрома, изменениями показателей фибриногена, Д-димера, РФМК и PAI-1.
Полученные данные могут быть полезны для понимания механизмов нарушений системы гемостаза при ОЗАНК и ХИУПК, а также для совершенствования комплексной медикаментозной терапии этой категории пациентов с целью улучшения непосредственных и отдаленных результатов лечения.
Сведения об авторах:
Кательницкий Иван Иванович — д.м.н., профессор, заведующий кафедрой хирургических болезней № 1, ФГБОУ ВО РостГМУ Минздрава России, 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29; ORCID iD 0000-0001-9913-740X.
Дарвин Владимир Васильевич — д.м.н., профессор, заведующий кафедрой хирургических болезней медицинского института, БУ ВО «Сургутский государственный университет», 628412, Россия, г. Сургут, пр. Ленина, д. 1; ORCID iD 0000-0002-2506-9798.
Зорькин Алексей Александрович — к.м.н., доцент, доцент кафедры факультетской хирургии медицинского института, БУ ВО «Сургутский государственный университет», 628412, Россия, г. Сургут, пр. Ленина, д. 1; ORCID iD 0000-0002-3208-4179.
Контактная информация: Зорькин Алексей Александрович, e-mail: az_99@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 09.09.2020, поступила после рецензирования 23.09.2020, принята в печать 07.10.2020.
About the authors:
Ivan I. Katelnitsky — Dr. of Sci. (Med.), Head of the Department of Surgical Diseases No. 1, Rostov State Medical University: 29, Nakhichevansky lane, Rostov-on-don, 344022, Russian Federation; ORCID iD 0000-0001-9913-740X.
Vladimir V. Darwin — Dr. of Sci. (Med.), Professor, Head of the Department of Surgical Diseases of the Medical Institute, Surgut State University: 1, Lenina prospect, Surgut, 628412, Russian Federation; ORCID iD 0000-0002-2506-9798.
Alexey A. Zorkin — Cand. of Sci. (Med.), Associate Professor of the Department of Intermediate Level Surgery of the Medical Institute, Surgut State University: 1, Lenina prospect, Surgut, 628412, Russian Federation; ORCID iD 0000-0002-3208-4179.
Contact information: Alexey A. Zorkin, e-mail: az_99@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 09.09.2020, revised 23.09.2020, accepted 07.10.2020.
2. Зудин А.М., Засорина М.А., Орлова М.А. Эпидемиологические аспекты хронической критической ишемии нижних конечностей. Хирургия. Журнал им. Н.И. Пирогова. 2014;10:91–95.
3. Dua A., Lee C.J. Epidemiology of peripheral arterial disease and critical limb ischemia. Tech Vasc Interv Radiol. 2016;19(2):91–95. DOI: 10.1053/j.tvir.2016.04.001.
4. Freisinger E., Reinecke H. High amputation rates and mortality — is critical limb ischemia still a losing game? Wasa. 2015;44:325. DOI: 10.1024/0301-1526/a000448.
5. Международные сосудистые рекомендации по лечению хронической ишемии, угрожающей потерей конечности. Под ред. А.В. Ерошенко и др. М.; 2019.
6. Национальные рекомендации по диагностике и лечению заболеваний артерий нижних конечностей. Российский согласительный документ. М.; 2019.
7. Miyahara T., Suhara M., Nemoto Y. et al. Long-term results of treatment for critical limb ischemia. Ann Vasc Dis. 2015;8:192–197. DOI: 10.3400/avd.oa.15-00074.
8. Prompers L., Schaper N., Apelqvist J. et al. Prediction of outcome in individuals with diabetic foot ulcers: Focus on the differences between individuals with and without peripheral arterial disease: The EURODIALE Study. Diabetologia. 2008;51:747–755. DOI: 10.1007/s00125-008-0940-0.
9. Faglia E., Clerici G., Clerissi J. et al. Long-term prognosis of diabetic patients with critical limb ischemia: a population-based cohort study. Diabetes Care. 2009;32:822–827. DOI: 10.2337/dc08-1223.
10. Davies M.G. Critical limb ischemia: cell and molecular therapies for limb salvage. MDCVJ. 2012;8(4):20–27. DOI: 10.14797/mdcj-8-4-20.
11. Дрожжин Е.В., Никитина Ю.В., Сидоркина О.Н., Федоров Д.А. Динамика изменений в фибринолитической системе гемостаза у больных с синдромом критической ишемии нижних конечностей. Современные проблемы науки и образования. 2012. (Электронный ресурс). URL: http://science-education.ru/ru/article/view?id=7447 (дата обращения: 28.08.2020).
12. Lüscher T.F., Steffel J. Individualized antithrombotic therapy. Hamostaseologie. 2016;36(1):26–32. DOI: 10.5482/HAMO-14-12-0080.
13. Mangiafico R.A., Mangiafico M. Medical treatment of critical limb ischemia: current state and future directions. Curr Vasc Pharmacol. 2011;9:6:658–676. DOI: 10.2174/157016111797484107.
14. Gaddi A., Galetti C., Iluminati B. et al. Meta analysis of some results of clinical trails of sulodexide therapy in peripheral occlusive arterial disease. J Int Med Res. 1996;24:389–406. DOI: 10.1177/030006059602400501.
15. Кузнецов М.Р., Косых И.В., Толстихин В.Ю. и др. Сулодексид в консервативном лечении заболеваний периферических артерий. Ангиология и сосудистая хирургия. 2015;21(4):45–50.
16. Петриков А.С., Белых В.И., Шойхет Я.Н. Особенности реканализации глубоких вен нижних конечностей у больных с тромбозом при пролонгированном лечении сулодексидом. Хирургия. Журнал им. Н.И. Пирогова. 2015;6:58–64. DOI: 10.17116/hirurgia2015658-64.
17. Стойко Ю.М., Гудымович В.Г., Цыплящук А.В. Современные аспекты эндотелиопротекции в лечении больных с хронической венозной недостаточностью в стадии трофических расстройств. Ангиология и сосудистая хирургия. 2016;22(4):109–114.
18. Михальский В.В., Горюнов С.В., Семенцова И.А. и др. Сулодексид в комплексной терапии тяжелых форм синдрома диабетической стопы. Ангиология и сосудистая хирургия. 2001;7(3):33–36.
19. Коваленко В., Калитко И., Темрезов М. и др. Возможности лечения больных с атеротромботическим поражением артерий нижних конечностей. Врач. 2010;3:55–58.
20. Coccheri S., Scondotto G., Agnelli G. et al. Sulodexide in the treatment of intermitten claudication. Eur Heart J. 2002;23:1057–1065. DOI: 10.1053/euhj.2001.3033.
21. Gaddi A.V., Capello F., Gheorghe-Fronea O.F. et al. Sulodexide improves pain-free walking distance in patients with lower extremity peripheral arterial disease: A systematic review and meta-analysis. JRSM Cardiovasc. Dis. 2020;9:2048004020907002. DOI: 10.1177/2048004020907002.
22. Kleinegris M.C., Cate Ten H., Cate-Hoek A.J. D-dimer as a marker for cardiovascular and arterial thrombotic events in patients with peripheral arterial disease. A systematic review. Thromb. Haemost. 2013;110(2):233–243. DOI: 10.1160/TH13-01-0032.
23. Rayt H.S., Merker L., Davies R.S. Coagulation, fibrinolysis, and platelet activation following open surgical or percutaneous angioplasty revascularization for symptomatic lower limb chronic ischemia. Vasc Endovascular Surg. 2016;50(3):193–201. DOI: 10.1177/1538574416638759.
24. Park J.K., Bae D.S., Kim Y.H., Shin K.J. Aging, hypercoagulability, and leg necrosis in critical limb ischemia. Ann Vasc Surg. 2015;29(2):227–236. DOI: 10.1016/j.avsg.2014.07.033.
25. Raffetto J.D., Calanni F., Mattana P., Khalil R.A. Sulodexide Promotes Arterial Relaxation via Endothelium-Dependent Nitric Oxide-Mediated Pathway. Biochem Pharmacol. 2019;166:347–356. DOI: 10.1016/j.bcp.2019.04.021.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.