Клинические исследования розувастатина в контексте актуальных Рекомендаций EAS/ESC по дислипидемиям
Рубрика:
Кардиология
Ингибиторы ГМГ-КоА-редуктазы являются фундаментальным классом препаратов для профилактики и лечения атеросклероза и его осложнений. В статье обсуждаются аспекты международной программы GALAXY в контексте последних Европейских рекомендаций, основные результаты исследований розувастатина в российской рутинной клинической практике. Современные исследования FOURIER, ODYSSEY OUTCOMES подтвердили безопасность средних и высоких доз статинов. В 2018 г. был опубликован новый Консенсус Европейского Общества Атеросклероза, в котором эксперты обобщили данные по безопасности терапии статинами в отношении печени, почек, обмена глюкозы, когнитивной функции, риска геморрагического инсульта и риска развития катаракты. Резидуальный (остаточный) риск, связанный с неадекватной терапией статинами, в нашей стране составляет примерно 90% и практически не меняется в последние годы. Оптимизация терапии статинами больных высокого и очень высокого риска для снижения сердечно-сосудистой смертности и увеличения продолжительности жизни в нашей стране — одна из самых важных задач в отечественной медицине. В последние годы в РФ активно регистрируются новые классы гиполипидемических средств, однако альтернативы статинам ни в мире, ни в нашей стране на сегодня нет.
Ключевые слова: ингибиторы ГМГ-КоА-редуктазы, статины, атеросклероз, дислипидемия, безопасность, розувастатин, Крестор.
Ключевые слова: ингибиторы ГМГ-КоА-редуктазы, статины, атеросклероз, дислипидемия, безопасность, розувастатин, Крестор.
A.V. Susekov
Russian Medical Academy of Continuous Professional Education, Moscow
HMG-CoA reductase inhibitors are a fundamental drug class for atherosclerosis and its complications prevention and treatment. The article deals with the “GALAXY” international program aspects within the framework of the latest European Guidelines and with the main rosuvastatin study results in Russian routine clinical practice. Current “FOURIER, ODYSSEY OUTCOMES” studies have confirmed the statin moderate and high dosages’ safety. In 2018, a new European Atherosclerosis Society Consensus was published, in which experts summarized data on the statin therapy safety for liver, kidneys, glucose metabolism, cognitive function, and hemorrhagic stroke and cataract risks. The residual risk associated with inadequate statin therapy in our country is approximately 90% and has not changed much in recent years. Statin therapy optimization in high-risk patients is a domestic medicine’s high priority task to further reduce cardiovascular mortality and increase life expectancy in our country. In recent years, new classes of lipid-lowering agents have been actively registered in the Russian Federation. However, today there is no alternative to adequate statin treatment in the population either in the world or in our country.
Keywords: HMG-CoA reductase inhibitors, statins, atherosclerosis, dyslipidemia, safety, rosuvastatin, Crestor.
For citation: Susekov A.V. Current ESC/EAS Guidelines for the management of dyslipidemias — rosuvastatin clinical studies. RMJ. Medical Review. 2019;1(II):93–98.
В статье обсуждаются аспекты международной программы GALAXY в контексте последних Европейских рекомендаций, основные результаты исследований розувастатина в российской рутинной клинической практике.
Введение
Ингибиторы ГМГ-КоА-редуктазы (статины) являются ключевыми препаратами для профилактики и лечения атеросклероза, они активно применяются в клинической практике уже более 45 лет [1–9]. В 1971 г. японские ученые Акира Эндо и Масао Курода из отдела прикладной биологии Токийского университета начали поиск микробных агентов, угнетающих внутриклеточный синтез холестерина (ХС) [2]. Гипотеза, которая лежала в основе этих опытов, заключалась в том, что определенные микроорганизмы продуцируют ингибиторы фермента 3-гидроксиметил-глютарил-коэнзим А-редуктазы (ГМК-КоА-редуктазы) для защиты от других микроорганизмов. Этот фермент катализирует переход ацетилкоэнзима А в мевалонат на начальном этапе синтеза ХС.В 1971–1973 гг. было протестировано более 6000 микробных штаммов, и в результате этого труда были получены первые субстанции, ингибирующие синтез ХС: цитринин (citrinin) из грибка Pythium ultimum и мевастатин (mevastatin) из грибка Penicillum citrinum [2]. Независимо от научной группы А. Эндо, американский исследователь A. Brown в 1976 г. выделил компактин из грибка Penicillinum brevicompactum [3]. В 1978 г. сотрудники американской компании Merck Sharp and Dohme (MSD) из грибка Aspergillis terreus выделили субстрат для препарата ловастатин (мевакор); годом позже японские ученые из компании SANKIO Co. Ltd. получили мевинолин, субстрат для правастатина. До внедрения в клиническую практику этот первый статин был подробно изучен на животных моделях в довольно высоких дозах — до 200 мг/кг [3].
За последние десятилетия класс ингибиторов ГМГ-КоА-редуктазы прошел большой путь клинических исследований, благодаря которым были внесены существенные изменения во многие международные рекомендации и консенсусы по диагностике и лечению липидного обмена в разных популяциях в 2004–2019 гг. [4–11]. Из 10 представителей класса статинов в текущем десятилетии активно используются только 4: симвастатин, аторвастатин, питавастатин и розувастатин. Ввиду разных причин (в основном по причине безопасности) на разных этапах клинических исследований исключались такие препараты, как гленвастатин (Hoecht), церивастатин (Bayer, Германия), практически не используются ловастатин, флувастатин и правастатин (за исключением Мексики). Более 30 лет потребовалось для того, чтобы выяснить, что статины (как и другие гиполипидемические препараты) несут в себе гипотетический риск развития сахарного диабета (+9%; 95% ДИ 1,02–1,17) [12]. Вместе с тем эти риски перекрываются снижением сердечно-сосудистых (СС) осложнений и ассоциированы не со статинами per se, а с предрасположенностью пациентов к сахарному диабету (с исходным повышением уровня глюкозы плазмы и гликированного гемоглобина HBA1c) [9, 12].
Статины — самый изученный и, пожалуй, самый безопасный класс препаратов для снижения содержания ХС, о чем, помимо 40-летней истории клинических исследований, свидетельствует недавно опубликованный Консенсус Европейского Общества Атеросклероза 2018 г. [9]. Осенью 2018 г. вышли новые американские Рекомендации по дислипидемиям [10], в начале 2019 г. опубликован Консенсус по безопасности лечения статинами Американской Ассоциации Сердца (AHA) и Американского Колледжа Кардиологов [11]. В новых американских Рекомендациях впервые акцентирован приоритет максимального снижения ХС липопротеинов низкой плотности (ХС-ЛНП) перед их целевым уровнем не более 1,8 ммоль/л, что делает приоритетным назначение умеренных и высоких доз статинов (например, оригинального аторвастатина 40–80 мг/сут или оригинального розувастатина (Крестора) 20–40 мг/сут). Именно умеренные (а не начальные дозы) статинов обеспечивают 40–50% снижение уровня ХС-ЛНП у больных высокого или очень высокого CC-риска. Впервые в американских Рекомендациях появилась «нижняя граница» в снижении ХС-ЛНП — 0,67 ммоль/л (в разделе, посвященном терапии ингибиторами PCSK9). Подробно обзор новых липидных Рекомендаций и Консенсуса AHA по статинам планируется дать в отдельной публикации.
Розувастатин (Крестор) — статин 4-го поколения с максимальной липидснижающей активностью в отношении «плохого холестерина» ХС-ЛНП (– 65%), хорошей переносимостью и безопасностью, включая высокие дозы (40 мг/сут) [13, 14]. В начале 2000-х гг. для этого статина была запланирована и завершена большая международная программа клинических исследований GALAXY [13, 14]. В первой части обзора [13] обсуждались перспективы розувастатина (Крестора) в контексте последних Европейских рекомендаций по диагностике и лечению дислипидемий 2016 г. [4], значение для современной практики завершенных исследований розувастатина из проекта GALAXY [15], базовые принципы применения статинов в первичной профилактике, а также значение завершенных исследований Крестора у больных с дислипидемиями, коронарным атеросклерозом, метаболическим синдромом, сахарным диабетом 2 типа, атеросклерозом сонных артерий. Кроме того, в этом обзоре обсуждаются значение завершенных исследований статинов (розувастатина) у больных с хронической почечной недостаточностью (ХПН) и риском первого или повторного ишемического инсульта, эффективность и безопасность применения высоких доз розувастатина и аторвастатина, установленных в исследовании VOYAGER.
Применение статинов у больных с ХПН: сравнительная эффективность и безопасность высоких доз
Многие заболевания почек (хронический пиелонефрит и гломерулонефрит) и их прогрессирование до ХПН являются независимыми факторами риска развития атеросклероза и его осложнений [15–17]. Хроническая почечная недостаточность классифицируется на 5 стадий и положительно коррелирует с дебютом и прогрессированием ишемической болезни сердца (ИБС) независимо от других факторов риска атеросклероза [15–17]. Хроническая болезнь почек диагностируется как нарушение структуры и функции почек, которое сохраняется более 3 мес. при скорости клубочковой фильтрации (СКФ) <60 мл/мин/1,73 м2 и оказывает негативное влияние на здоровье человека [18, 19]. Симптомы ХПН развиваются медленно и вызывают уремическую дислипидемию, которая и приводит к развитию атеросклероза и ИБС. Известно, что пациенты с сочетанием ХПН и ИБС имеют гораздо более высокую смертность в отличие от больных с ИБC и нормальной функцией почек [20].
Как правило, уремическая дислипидемия сопровождается инсулинорезистентностью, сахарным диабетом 2 типа и зависит от степени ХПН и методов лечения (консервативная терапия или диализ) [19, 21]. В патогенезе дислипидемии при ХПН также играет роль низкая экспрессия ЛНП-рецепторов (будучи белками, они теряются с мочой), что, в свою очередь, приводит к снижению концентрации ХС-ЛНП в гепатоцитах, повышению активности ГМГ-КоА-редуктазы и ацетил-коэнзим-холестерол-ацилтрансферазы. Эти реакции, в свою очередь, способствуют повышению синтеза ХС в печени, снижению активности 7-α-гидролазы (меньше ХС эвакуируется через пул желчных кислот) и в конечном итоге повышению концентрации ХС-ЛНП в плазме крови [22].
Согласно Рекомендациям Европейского Общества Атеросклероза 2016 г. выраженная ХПН (III–V степени) является индикатором высокого или очень высокого СС-риска, что требует терапии статинами в монотерапии или в комбинации с достижением целевого уровня ХС-ЛНП <1,8 ммоль/л (степень доказательности IA) [4]. С учетом особенностей фармакокинетики и фармакодинамики статинов их можно применять при коррекции дислипидемии у больных с ХПН в сниженных дозах, за исключением аторвастатина, который назначается без коррекции доз вне зависимости от степени ХПН (табл. 1) [22]. Тактические вопросы применения статинов у больных с ХПН подразумевают разумный баланс эффективности и безопасности, особенно это касается риска миопатий и рабдомиолиза, а также риска протеинурии и гематурии. В исследовании PLANET-I участвовали 353 пациента из 11 стран (старше 18 лет с СД 1 и 2 типа и уровнем ХС-ЛНП ≥2,33 ммоль/л) [23]. После вводного периода и назначения начальных доз статинов, после рандомизации пациенты принимали розувастатин 10, 40 мг/сут или аторвастатин 80 мг/сут в течение 52 нед. Первичной конечной точкой в исследовании PLANET-I была динамика соотношения (индекса) белка и креатинина [23]. К концу исследования пациенты на фоне приема аторвастатина 80 мг/сут продемонстрировали большее снижение этого индекса (-28,3%), чем пациенты, применявшие разные дозы розувастатина (10 мг/сут — -15,6%; 40 мг/сут — -18,2% соответственно). Побочные реакции зафиксированы у 60% больных на фоне лечения аторвастатином 80 мг/сут и у 57 и 64% больных на фоне терапии розувастатином 10 и 40 мг/сут соответственно. Авторы делают вывод, что, по предварительным данным, аторвастатин 80 мг/сут, по-видимому, имеет большие ренопротективные свойства, чем розувастатин.
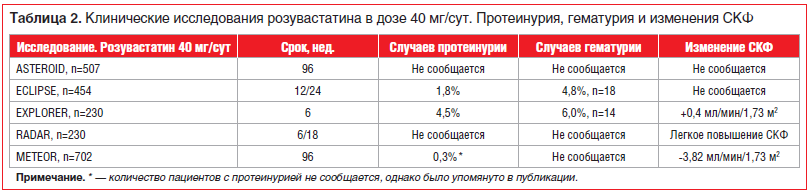
Более того, согласно результатам исследований PLANET I, II и ECLIPSE [24] розувастатин (40 мг/сут) имеет более высокий риск протеинурии (до 1,8%) и гематурии (до 4%) по сравнению с аторвастатином 80 мг/сут (протеинурия — 0,4%, гематурия — 2,1% соответственно), в то же время начальные дозы Крестора (10 мг/сут) такими эффектами не обладают [23, 24].
![Таблица 1. Коррекция дозы статинов в зависимости от СКФ (адаптировано с изменениями из: [22]) Таблица 1. Коррекция дозы статинов в зависимости от СКФ (адаптировано с изменениями из: [22])](/upload/medialibrary/704/93-1.png)
В рутинной клинической практике бессимптомная протеинурия встречается не так уж и редко — до 10% случаев при анализе с помощью dip stick (палочки). Протеинурия может быть физиологической (при физической нагрузке, беременности) и патологической. Существуют 2 вида протеинурии. При гломерулярной протеинурии в проксимальных почечных канальцах теряются высокомолекулярные белки, включая большие количества альбумина. Этот вид протеинурии считается клинически значимым и неблагоприятным для прогноза ХПН. Тубулярная протеинурия развивается по причине сниженной реабсорбции низкомолекулярных белков (небольшое количество альбумина, α1-микроглобулин, β2-микроглобулин). Тубулярная протеинурия не является клинически значимой, и именно она встречается при применении высокой дозы розувастатина 40 мг/сут [24].
Розувастатин более активен в отношении ГМГ-КоА-редуктазы, чем аторвастатин, и, кроме печени, проявляет свою активность также в почках, что может обусловливать физиологическую тубулярную протеинурию. В литературе есть указания на то, что механизм протеинурии при приеме розувастатина 40 мг/сут может быть связан со снижением рецептор-опосредованного эндоцитоза у лабораторных животных, однако подобных данных в отношении человека не имеется [25].
Автор настоящей работы не стал бы назначать высокие дозы статинов (аторвастатина 80 мг/сут и розувастатина 40 мг/сут) больным с ХПН прежде всего из-за риска миопатий и рабдомиолиза. Больные с выраженной ХПН и клинически значимым атеросклерозом в повседневной клинической практике встречаются крайне редко, об этом можно судить, к примеру, по исходным характеристикам пациентов из исследования SHARP [26]. Исследовалась когорта пациентов с ХПН со средним возрастом 62 года, 63% мужчин, 23% больных СД 2 типа, средняя СКФ 27 мл/мин/1,73 м2. Лишь 15% больных исходно имели в анамнезе СС-заболевания. В исследовании AURORA по изучению розувастатина 10 мг/сут [27] участвовали больные с ХПН на гемодиализе (средний возраст 64 года, исходный уровень ХС был в норме —174 мг/дл, или 4,53 ммоль/л). В анамнезе этих больных инфаркт миокарда был лишь у 10%, операция реваскуляризации — у 6%. Можно допустить, что наличие начальной степени ХПН per se не является абсолютным показанием к назначению статинов, и, по мнению автора, пациента надо реклассифицировать относительно других значительных факторов СС-риска (например, с использованием алгоритма SCORE).
С другой стороны, при ХПН III–V степени со сниженной СКФ вряд ли имеет смысл назначать высокие дозы аторвастатина и розувастатина. В этих случаях комбинированная терапия статинами и эзетемибом не менее эффективна в отношении контроля дислипидемии и более безопасна.
В таблице 2 представлены основные данные по частоте встречаемости протеинурии и гематурии и динамика СКФ в ключевых исследованиях розувастатина в дозе 40 мг/сут. В соответствии с инструкцией по использованию оригинального розувастатина у менее 1% пациентов может выявляться протеинурия при приеме 10 и 20 мг/сут, незначительная протеинурия при приеме 20 мг/сут, у 3% больных при приеме 40 мг/сут. В большинстве случаев протеинурия уменьшается или исчезает в процессе лечения и не ведет к острому или прогрессирующему заболеванию почек. Очевидно, что частота этих осложнений крайне мала, а снижение СКФ незначительно (0,41 мл/мин/1,73 м2). Анализ безопасности не показал ухудшения ХПН в сравниваемых группах, включая принимавших розувастатин [28].
Монотерапия статинами и снижение риска ишемического инсульта
К настоящему времени нет опубликованных исследований с участием больных каротидным атеросклерозом, которые показали бы, что снижение уровня ХС-ЛНП может уменьшить количество СС-риска в первичной профилактике. Несмотря на это, в мировой научной литературе (международные рекомендации) содержатся объективные сведения о том, что терапия статинами снижает риски первого или повторного ишемических инсультов [4–7, 29, 30]. Дебют ишемического инсульта, как правило, вызывают основные факторы СС-риска: артериальная гипертония, курение, сахарный диабет, ожирение, несбалансированное питание, низкая физическая активность, фибрилляция предсердий, дислипидемия и психосоциальные причины (стресс, депрессия) [30]. Один из главных факторов ишемического инсульта — атеросклероз с наличием бляшек в сонных артериях. Атеросклероз — причина почти трети инсультов, около 50% инсультов развиваются в связи с каротидным атеросклерозом [30]. По данным литературы, почти 80% инсультов, вызванных эмболом из каротидной зоны, происходит внезапно, без всяких предшествующих симптомов [30].В ретроспективных анализах ранних исследований статинов (вторичная профилактика) относительное снижение фатального ишемического инсульта составило 19–50%, самое большое снижение риска инсульта зарегистрировано в исследовании MIRACLE с применением высокой дозы аторвастатина (80 мг/сут) у больных ОКС (-48%; p=0,045) [31]. В исследовании вторичной профилактики TNT показано, что в группе больных, получавших высокую дозу аторвастатина 80 мг/сут, снижение риска инсульта составило 25% (p=0,02) [32].
В первой обзорной статье уже обсуждалось значение исследования JUPITER для первичной профилактики CC-осложнений [13]. По комбинированной конечной точке этого знакового для международных рекомендаций исследования снижение риска фатального и нефатального инсульта у больных с повышенным уровнем высокочувствительного С-реактивного белка (вч-СРБ) было высокодостоверным и составило значимые -48% (p<0,002) — больше, чем снижение по первичной КТ в этом исследовании (-44%) [33]. Эти данные вполне сопоставимы с результатами исследования MIRACLE (больные после острого коронарного синдрома) и TNT (ишемический инсульт в анамнезе), в котором исследовалась высокая доза аторвастатина 80 мг/сут [31, 32]. Вероятно, один из ключевых механизмов снижения риска инсульта на терапии статинами — это снижение количества маркеров воспаления, количества моноцитов, провоспалительных цитокинов и вч-СРБ, что в итоге снижает склонность опасных бляшек к разрыву и тромбообразованию. В ряде исследований было показано, что терапия статинами значительно снижала риск развития мерцательной аритмии, которая также является основным фактором риска развития инсульта [34–36].
Все статины, помимо липидомодулирующих эффектов, обладают многочисленными нелипидными (плейотропными) эффектами [30–40]. От 35 до 80% пользы «позитивного плейотропизма» статинов может быть непосредственно связано с их основным эффектом — снижением уровня ХС-ЛНП. Важное клиническое значение имеет стабилизация бляшек в коронарных и сонных артериях: снижение количества макрофагов, усиленная пролиферация гладких мышечных клеток, стабилизация покрышки атеромы и снижение количества окисленных липопротеинов в кровотоке и в составе бляшек. Ранние плейотропные эффекты статинов у больных с атеросклерозом (в т. ч. у пациентов до и после ишемического инсульта) реализуются также через улучшение эндотелиальной функции, снижение агрегации тромбоцитов и улучшение фибринолитических свойств крови [37–39].
В научной литературе обсуждаются также механизмы снижения риска мозговых осложнений у больных, перенесших ишемический инсульт: небольшое снижение АД при терапии статинами, уменьшение риска ишемического инсульта и образования муральных тромбов в левом желудочке сердца. Статины обладают нейропротективными эффектами (за счет повышения продукции NO), увеличением мозгового кровотока и уменьшением размера мозгового инфаркта [38]. Другие плейотропные механизмы действия статинов связаны с блокадой синтеза изопреноидов, которые являются промежуточными продуктами биосинтеза ХС (Rho, Rac и Cdc42) [41]. Что касается применения статинов для профилактики первого или второго инсульта, российские врачи (особенно неврологи) все еще консервативно относятся к такому лечению, несмотря на то, что степень доказательности такой стратегии, согласно Европейским рекомендациям 2016 г., самая высокая — IA [4].
Опасения по поводу риска геморрагического инсульта необоснованны, поскольку еще в 2009 г. на сессиях Конгресса Международного Общества Атеросклероза в Бостоне (США) обсуждалось, что такие клинические переменные в исследовании SPARCL [42], как геморрагия в анамнезе (отношение шансов (ОШ) 5,81); пожилой возраст (на каждые +10 лет; ОШ 1,37), гипертония II степени с систолическим АД 160 мм рт. ст. (ОШ 6,19), являются главными предикторами геморрагического инсульта у больных, принимавших аторвастатин 80 мг/сут. Можно посоветовать практикующему врачу: прежде чем назначать высокие дозы статинов для профилактики первого или повторного ишемического инсульта, нужно убедиться, что: 1) первый инсульт (если он был) не геморрагический; 2) нормализовать артериальное давление; 3) с осторожностью назначать высокие дозы ингибиторов ГМГ-КоА-редуктазы пожилым людям. Основные положения Рекомендаций 2016 г., регламентирующие назначение статинов для профилактики ишемического инсульта, представлены в таблице 3.
![Таблица 3. Рекомендации по контролю липидов для пер- вичной и вторичной профилактики инсульта (адаптировано с изменениями из: [5]) Таблица 3. Рекомендации по контролю липидов для пер- вичной и вторичной профилактики инсульта (адаптировано с изменениями из: [5])](/upload/medialibrary/76c/93-3.png)
В недавних Рекомендациях AHA по безопасности терапии статинами указано, что назначения статинов больным, имеющим геморрагический инсульт (особенно в лобной доле головного мозга), надо избегать [11]. Однако в этих же Рекомендациях авторы советуют не отменять статины у больных с геморрагическим инсультом в анамнезе, если риск ишемического инфаркта мозга или ишемического инсульта остается высоким.
Современная доказательная база статинов: метаанализ исследования VOYAGER
Одно из последних рандомизированных исследований статинов (монотерапия, сравнение head to head) SATURN закончилось в 2011 г. [43]. Начиная с 2014 г. основные новости по эффективности липидснижающей терапии по «твердым» конечным точкам были уже получены на комбинированной терапии (статины + новые липидснижающие агенты) — с эзетимибом (IMPROVE-IT), эвалокумабом (FOURIER), алирокумабом (ODYSSEY-OUTCOMES) и анацетрапибом (HPS3/TIMI55-REVEAL) [44–47]. Важно заметить, что в контрольных группах этих исследований пациенты высокого и очень высокого СС-риска принимали статины в средних (FOURIER) [45] и, преимущественно, высоких дозах (ODYSSEY-OUTCOMES) [46].В последние 3–4 года новые данные по эффективности, переносимости и безопасности терапии статинами публикуются либо по результатам крупных метаанализов, либо по базам данных больших ретроспективных исследований, например VOYAGER (An indiVidual patient data meta-analysis Of statin therapY in At risk Groups: Effects of Rosuvastatin, Atorvastatin and Simvastatin) [48–52]. Вся популяция исследования VOYAGER составила 32 258 человек, из них подгруппа пациентов с очень высоким СС-риском — 21 656 человек [48]. Больше трети составили пациенты с сахарным диабетом 2 типа (n=8859), 6061 — с атерогенной дислипидемией, 15 498 — с документированным атеросклерозом различных сосудистых бассейнов [48]. Средний возраст больных составил 60 лет, мужчин было 57%, больных белой расы — 79,9%. Исходно средние уровни липидов в популяции пациентов VOYAGER были следующими: средний уровень ХС-ЛНП 4,38 ммоль/л, ХС-ЛВП — 1,25 ммоль/л (достаточно высокий); медиана уровня триглицеридов (Тг) 1,81 ммоль/л. Среднее снижение уровня Хс-ЛНП при удвоении доз симвастатина составило -27% (n=365, 10 мг/сут); -33% (n=2929, 20 мг/сут), -39% (n=548, 40 мг/сут) и -45% (n=479, 80 мг/сут) (мы говорим о публикации 2010 г., когда эта доза симвастатина еще была разрешена) [48]. У пациентов, принимавших аторвастатин, среднее снижение уровня ХС-ЛНП составило 36, 41, 46 и 50% при применении суточных доз этого статина 10, 20, 40 и 80 мг соответственно. Как и ожидалось, максимальное снижение липидов, в частности ХС-ЛНП, было достоверным (получено у больных на фоне приема оригинального розувастатина). При начальной дозе 5 мг/сут уровень ХС-ЛНП снизился на 39%, при 10 мг/сут — на 44%, при 20 мг — на 50% и при максимальной дозе 40 мг — на 55% [48]. Примечательно, что у больных с исходно высоким уровнем ХС-ЛНП >160 мг/дл (>4,1 ммоль/л) липидснижающая способность розувастатина была максимальной, даже при дозе 5 мг/сут целевых значений ХС-ЛНП достигли 38% больных, а при дозе 40 мг/сут — 74,1% (при 10 мг аторвастатина — 28,7%, при 80 мг — 71%) [48]. Что касается уровня Тг (был исходно нормальным), то на возрастающих дозах розувастатина снижение их уровня было 18–21%, на терапии аторвастатином — 18–25% и на симвастатине — 12–14%. В субпопуляции VOYAGER у больных с СД 2 типа [49] были получены аналогичные результаты, максимальная липидснижающая эффективность снижалась в ряду розувастатина, аторвастатина и симвастатина. Максимальное снижение уровня ХС-ЛНП было достигнуто при лечении розувастатином 40 мг/сут и составило 56%, что было выше, чем при лечении максимальными дозами (80 мг/сут) аторвастатина и симвастатина (-51%).
Особое значение при лечении статинами больных с СД 2 типа имеет повышение уровня ХС-ЛВП, который является суррогатом для процесса обратного транспорта ХС из периферии в печень. В этой субпопуляции анализа VOYAGER (СД 2) на максимальной дозе оригинального розувастатина повышение этого показателя было максимальным по сравнению с двумя другими статинами (+5,8%), в то время как при лечении симвастатином 40 мг/сут уровень ХС-ЛВП изменился с +5,8% до +1,8%. В контексте новых Рекомендаций по дислипидемиям 2016 г. (помимо безопасности) интересуют сравнительные аспекты эффективности и безопасности двух основных статинов — аторвастатина и розувастатина. В публикации по исследованию VOYAGER (2015 г.) представлен современный ретроспективный анализ терапии статинами 8496 пациентов 4 подгрупп (А — с СС-заболеваниями атеросклеротического генеза; Б — с выраженной гиперхолестеринемией с уровнем ХС-ЛНП >190 мг/дл (>4,1 ммоль/л); В — c сахарным диабетом 2 типа; Г — с первичной профилактикой атеросклероза (10-летний риск СС-осложнений ≥7,5%). При сравнении аторвастатина 80 мг/сут и розувастатина 40 мг/сут в этих 4 подгруппах выявлены различия в их ХС-снижающей эффективности: розувастатин 40 мг по сравнению с аторвастатином с высокой дозой имел небольшие, но достоверные преимущества (табл. 4). В этом анализе показано преимущество розувастатина перед аторвастатином также и в средних дозах (в среднем на 3–5%), различия были достоверны (p<0,05).
![Таблица 4. Сравнительная эффективность аторвастатина и розувастатина в снижении уровня ХС-ЛНП у разных категорий пациентов (адаптировано с изменениями из: [51]) Таблица 4. Сравнительная эффективность аторвастатина и розувастатина в снижении уровня ХС-ЛНП у разных категорий пациентов (адаптировано с изменениями из: [51])](/upload/medialibrary/4d8/93-4.png)
Заключение
Ингибиторы ГМГ-КоА-редуктазы являются фундаментальным классом препаратов для профилактики и лечения атеросклероза и его осложнений. За 45 лет эволюции этого класса препаратов проведены сотни клинических исследований в разных популяциях, была установлена сильная положительная корреляция между степенью снижения ХС-ЛНП и снижением СС-риска, а также с улучшением прогноза у пациентов, получавших статины. Доказательная база трех основных статинов первоначально получена в плацебо-контролируемых исследованиях 1994–2001 гг. (симвастатин), далее в сравнительных исследованиях 1998–2005 гг. (начальных и высоких доз аторвастатина), затем в исследованиях 2000–2011 гг. по изучению сравнительной эффективности двух сильных статинов. Ключевые результаты рандомизированных исследований со статинами широко цитируются в трех больших метаанализах 2010, 2012, 2015 гг. [51–55]. К середине 2000-х гг. уже было невозможно планировать и проводить плацебо-контролируемые исследования у больных с атеросклерозом, как в середине 1990-х (4S), поэтому доказательная база всего класса статинов по «твердым» конечным должна быть взаимозаменяема. Снижение СС-риска и улучшение прогноза, полученное в исследовании JUPITER по первичной профилактике, — это лицензия для более широкого использования розувастатина именно во вторичной профилактике, поскольку этот статин, применяемый в средней и высокой дозе, обладает максимальным эффектом в снижении ХС-ЛНП и, соответственно, степени СС-риска у тяжелых пациентов с документированным атеросклерозом. Это хорошо проиллюстрировано активным назначением розувастатина во вторичной профилактике по данным фармакоэпидемиологических исследований DYSIS I, II и метаанализа базы данных VOYAGER. В этой статье и другой обзорной публикации [13] обсуждались разные аспекты международной программы GALAXY в контексте последних Европейских рекомендаций [4], а также позиционирование основных результатов исследований оригинального розувастатина на российскую рутинную клиническую практику. Современные исследования комбинированной гиполипидемической терапии (FOURIER, ODYSSEY OUTCOMES) еще раз подтвердили безопасность средних и высоких доз статинов уже в нынешнем десятилетии. В частности, в контрольной группе на статинах в ODYSSEY-OUTCOMES частота повышения АСТ и АЛТ в этих проектах не превысила 2,4%, повышение КФК наблюдалось у не более 0,7%, нейрокогнитивные расстройства встречались лишь у 1,5% больных (столько же в основной группе). В 2018 г. был опубликован новый Консенсус Европейского Общества Атеросклероза [9], в котором эксперты обобщили данные по безопасности статинотерапии в отношении печени, почек, обмена глюкозы, когнитивной функции, риска геморрагического инсульта и риска развития катаракты. Оригинальная публикация этого Консенсуса размещена на сайте www.липидология.рф. Вместе с тем терапия статинами в РФ пока далека от идеальной по стартовым и поддерживающим дозам и, особенно, длительности лечения. Резидуальный (остаточный) риск, связанный с неадекватной терапией статинами, в нашей стране составляет примерно 90% (DYSIS I Study) [56] и практически не меняется в последние годы (DYSIS II, 2014). Оптимизация терапии статинами больных высокого и очень высокого риска для снижения сердечно-сосудистой смертности и увеличения продолжительности жизни в нашей стране — одна из самых важных задач в отечественной медицине [57–59]. В последние годы в РФ активно регистрируются новые классы гиполипидемических средств, однако альтернативы статинам ни в мире, ни в нашей стране на сегодня нет.
Литература
1. Endo A. The discovery and development of HMG-CoA reductase inhibitors. Journal of Lipid Research.1992;33:1569‒1582.
2. Endo A., Kuroda M., Tsujita Y. ML-236A, ML-236B and ML-236C, new inhibitors of cholesterolgenesis produced by Penicillinunm citrinum. J. Antibiot. (Japan). 1976;29:1346‒1348.
3. Brown A.G., Smale T.C., King R. et al. Crystal and molecular structure of compactin, a new antifungal metabolite from Penicillinum brevicompactum. J. Chem. Soc. Perkin I. 1976;1165‒1170.
4. Catapano A., Graham I., De Backer G.D. et al. 2016 ESC/EAS Guidelines for the Management of Dyslipideamias. The Task Force for the management of Dyslipideamias. Eur Heart. J. 2016. DOI:10.1093/eurheartj/ehw272.
5. Stone N.J., Robinson J., Lichtenstein A.H. et al. 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2014;63(25 Pt B):2889–2934.
6. The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on cardiovascular Disease Prevention in Clinical Practice. 2016 Guidelines on Cardiovascular disease prevention in clinical practice. Eur Heart J. DOI:10.1093/eurheartj/ehw106.
7. Aboyans V., Ricco J.-B., Bartelink E.L. et al. The Task Force for the Diagnosis and Treatment of Peripheral Arterial Diseases of the European Society of Cardiology (ESC) and of the European Society for Vascular Surgery (ESVS) 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS). Eur Heart J 2018;39(9):763‒816. DOI: 10.1093/eurheartj/ehx095.
8. Ference B.A., Ginsberg H.N., Graham I. et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J. 2017;38(32):2459–2472. DOI: 10.1093/eurheartj/ehx144.
9. Mach F., Ray K.K., Wiklund O. et al. Adverse effects of statin therapy: perception vs. the evidence — focus on glucose homeostasis, cognitive, renal and hepatic function, haemorrhagic stroke and cataract. Eur Heart J. 2018;39(27):2526–2539. DOI: 10.1093/eurheartj/ehy182.
10. Grundy S.M., Stone N.J., Bailey A.L. et al. 2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA Guideline on the Management of Blood Cholesterol: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol. 2018;8:S0735–1097(18)39034-X. DOI: 10.1016/j.jacc.2018.11.003.
11. Newman C., Preiss D., Tobert J. et al. Statin Safety and Associated Adverse Events. A Scientific Statement of American Heart Association. Arterioscler Thromb Vasc Biol. 2018;39:e38–e81. DOI:10.1161/ATV.0000000000000073.
12. Sattar N., Preiss D., Murray H.M. et al. Statins and risk of incident diabetes: a collaborative meta-analysis of randomized statin trials. Lancet. 2010;375(9716):735–742. DOI: 10.1016/S0140-6736(09)61965-6.
13. Сусеков А.В. Клинические исследования с розувастатином из проекта GALAXY в контексте новых Рекомендаций EAS/ESC 2016 по дислипидемиям. Consilium Medicum. 2017;19(12):32‒40. [Susekov A.V. Clinical studies with rosuvastatin from the GALAXY project in the context of new EAS / ESC 2016 Dyslipidemia Recommendations. Consilium Medicum. 2017;19(12):32‒40 (in Russ.)].
14. Schuster H., Fox J. Investigating cardiovascular risk reduction — the Rosuvastatin GALAXY Programme. Exp Opin. 2004;5:1187‒1200.
15. Olechnowicz-Tietz S., Gluba A., Banach M. et al. The risk of atherosclerosis in patients with chronic kidney disease. Int Urol Nephrol. 2013;45:1605‒1612.
16. Gansevoort R.T., Correa-Rotter R., Hemmelgarn B.R. et al. Chronic kidney disease and cardiovascular risk: epidemiology, mechanisms, and prevention. Lancet. 2013;382:339‒352.
17. Matsushita K., van der Velder M., Astor B.C. et al. Chronic Kidney Disease Prognosis Consortium. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet. 2010;375:2073‒2081.
18. Barry R., James M.T. Guidelines for classification of acute kidney disease and disorders. Nephron. 2015;131:221‒226.
19. KDOQI™ Clinical Practice Guidelines and Clinical Practice Recommendations for Diabetes in Chronic Kidney Disease. Am J Kid Dis. 2007;49(2):S12–154.
20. Loncar G., Barthelemy O., Berman E. et al. Impact of renal failure on all-cause mortality and other outcomes in patients treated by percutaneous coronary intervention. Arch Cardiovasc Dis. 2015;108;554‒562.
21. Lancquaniti A., Boliqnano D., Donato V. et al. Alterations of lipid metabolism in chronic nephropathies: mechanisms, diagnosis and treatment. Kid Blood Res. 2010;33(2):100‒110. DOI: 10.1159/000302712.
22. Tonelli M., Wanner C., Kidney Disease: Improving Global Outcomes Lipid Guideline Development Work Group Members. Lipid management in chronic kidney disease:synopsis of the Kidney Disease: Improving Global outcomes 2013 clinical practice guidelines. Ann Intern Med. 2014;160(3):182. DOI: 10.7326/M13-2453.
23. De Zeeuw D., Anzalone D.A., Cain V.A. et al. Renal effects of atorvastatin and rosuvastatin in patients with diabetes who have progressive renal disease (PLANET I): a randomized clinical trial. Lancet Diabetes Endocrin. 2015;3(3):181‒190. DOI: 10.1016/S2213-8587(14)70246-3.
24. Faergeman O., Hill L., Windler E. et al. Efficacy and tolerability of rosuvastatin and atorvastatin when force-titrated in patients with primary hypercholesterolemia: results from the ECLIPSE study. Cardiology. 2008;111(4):219‒228. DOI: 10.1159/000127442.
25. Sidaway J.E., Davidson R.G., McTaggart F. et al. Inhibition of 3-hydroxy-3-methylglutaryl-CoA reductase receptor-mediated endocytosis in opossum kidney cells. J Am Nephrol. 2004;15:2258‒2265.
26. Blazing M.A., Giugliano R.P., de Lemos J.A. et al. On-treatment analysis of the Improved Reduction of Outcomes: Vytorin Efficacy International Trial (IMPROVE-IT). Am Heart J. 2016;182:89‒96. DOI: 10.1016/j.ahj.2016.09.004.
27. Fellstrom B., Jardine A., Schmieder R. et al. Rosuvastatin and Cardiovascular Events in patients undergoing hemodialysis. N Engl J Med. 2009;360:1395‒407.
28. Su X., Zhang L., Lv L. et al. Effect of statins on kidney disease outcomes: a systemic review and meta-analysis. Am J Kidney Disease. 2016: 67:881‒892.
29. Amarenco P., Labreuche J., Lavallee P. et al. Statins in stroke prevention and carotid atherosclerosis: systemic review and up-to-date meta-analysis. Stroke 2004;35:2902‒2909.
30. Inzitari D., Eliasziw M., Gates P. et al. The causes and risk of stroke in patients with asymptomatic internal-carotid-artery stenosis. North American Symptomatic Carotid Endarterectomy Trial Collaborators. N Engl J Med. 2000;342:1693–700.
31. Schwartz G.G., Olsson A.G., Ezekowitz M.D. et al. Myocardial Ischemia Reduction with Aggressive Cholesterol Lowering (MIRACL) Study Investigators Effects of atorvastatin on early recurrent ischemic events in acute coronary syndromes: the MIRACL study: a randomized controlled trial. JAMA. 2001;285(13):1711–1718.
32. LaRosa J.C., Grundy S.M., Waters D.D. et al. Treating to New Targets (TNT) Investigators. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med. 2005;352(14):1425‒1435.
33. Ridker P.M., Danielson E., Fonseca F.A. et al. JUPITER Study Group. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med. 2008;359(21):2195‒2207. DOI: 10.1056/NEJMoa0807646.
34. Young-Xu Y., Jabbour S., Goldberg R. et al. Usefulness of statin drugs in protecting against atrial fibrillation in patients with coronary artery disease. Am J Cardiol. 2003;92(12):1379‒1383.
35. Ozaydin M., Varol E., Aslan S.M. Еffect of atorvastatin on the recurrence rates of atrial fibrillation after electrical cardioversion. Am J Cardiol. 2006;97(10):1490‒1493.
36. Loffredo L., Angelico F., Perri L., Violi F. Upstream therapy with statin and recurrence of atrial fibrillation after electrical cardioversion. Review of the literature and meta-analysis. BMC Cardiovasc Disord. 2012;12:107. DOI: 10.1186/1471-2261-12-107.
37. Wolozin B., Wang S.W., Li N.C. et al. Simvastatin is associated with a reduced incidence of dementia and Parkinson’s disease. BMC Med. 2007;5:20.
38. Wang Q., Yan J., Chen X. et al. Statins: multiple neuroprotective mechanisms in neurodegenerative diseases. Exp Neurol. 2011;230(1):27‒34. DOI: 10.1016/j.expneurol.2010.04.006.
39. Arnaud C., Veillard N.R., Mach F. et al. Cholesterol-independent effects of statins in inflammation, immunomodulation and atherosclerosis. Curr Drug Targets Cardiovasc Haematol Disord. 2005:5(2):127–134.
40. Thongtang N., Diffenderfer M.R., Ooi E.M. et al. Effects of atorvastatin on human C-reactive protein metabolism. Atherosclerosis. 2013;226(2):466‒470. DOI: 10.1016/j.atherosclerosis. 2012.11.012.
41. Tsai N.W., Lee L.H., Huang C.R. et al. The association of statin therapy and high-sensitivity C-reactive protein level for predicting clinical outcome in acute non-cardioembolic ischemic stroke. Clin Chim Acta. 2012;413(23‒24):1861‒1865. DOI: 10.1016/j.cca.2012.07.021.
42. Amarenco P., Goldstein L.B., Szarek M. et al. SPARCL Investigators. Effects of intense low-density lipoprotein cholesterol reduction in patients with stroke or transient ischemic attack: the Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL) trial. Stroke. 2007;38(12):3198‒204.
43. Nicholls S.J., Borgman M., Nissen S.E. et al. Impact of statins on progression of atherosclerosis: rationale and design of SATURN (Study of Coronary Atheroma by InTravascular Ultrasound: effect of Rosuvastatin Versus AtorvastatiN). Curr Med Res Opin. 2011;27(6):1119‒1129. DOI: 10.1185/03007995.2011.570746.
44. Blazing M.A., Giugliano R.P., de Lemos J.A. et al. On-treatment analysis of the Improved Reduction of Outcomes: Vytorin Efficacy International Trial (IMPROVE-IT). Am Heart J. 2016;182:89‒96. DOI: 10.1016/j.ahj.2016.09.004.
45. Sabatine M.S., Giugliano R.P., Keech A.C. et al. FOURIER Steering Committee and Investigators. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med. 2017;376(18):1713‒1722. DOI: 10.1056/NEJMoa1615664.
46. Maki K.C. The ODYSSEY Outcomes trial: Clinical implications and exploration of the limits of what can be achieved through lipid lowering. J Clin Lipidol. 2018;12(5):1102–1105. DOI: 10.1016/j.jacl.2018.05.016.
47. HPS3/TIMI55-REVEAL collaborative Group. Effects of Anacetrapib in Patients with Atherosclerotic Vascular Disease. N Engl J Med. 2017;377(13):1217–1227. DOI: 10.1056/NEJMoa1706444.
48. Nicholls S.J., Brandrup-Wognsen G., Palmer M., Barter P.J. Meta-analysis of comparative efficacy of increasing dose of Atorvastatin versus Rosuvastatin versus Simvastatin on lowering levels of atherogenic lipids (from VOYAGER). Am J Cardiol. 2010;105(1):69‒76. DOI: 10.1016/j.amjcard.2009.08.651.
49. Nicholls S.J., Ballantyne C.M., Barter P.J. et al. Effect of two intensive statin regimens on progression of coronary disease. N Engl J Med. 2011;365:2078–2087. DOI: 10.1056/NEJMoa1110874.
50. Karlson B.W., Palmer M.K., Nicholls S.J. et al. To what extent do high-intensity statins reduce low-density lipoprotein cholesterol in each of the four statin benefit groups identified by the 2013 American College of Cardiology/American Heart Association guidelines? A VOYAGER meta-analysis. Atherosclerosis. 2015;241(2):450‒454. DOI: 10.1016/j.atherosclerosis.2015.05.029.
51. Karlson B.W., Palmer M.K., Nicholls S.J. et al. Doses of rosuvastatin, atorvastatin and simvastatin that induce equal reductions in LDL-C and non-HDL-C: Results from the VOYAGER meta-analysis. Eur J Prev Cardiol. 2016;23(7):744‒747. DOI: 10.1177/2047487315598710.
52. Karlson B.W., Wiklund O., Palmer M.K. et al. Variability of low-density lipoprotein cholesterol response with different doses of atorvastatin, rosuvastatin, and simvastatin: results from VOYAGER. Eur Heart J Cardiovasc Pharmacother. 2016;2(4):212‒217. DOI: 10.1093/ehjcvp/pvw006.
53. Cholesterol Treatment Trialists (CTT) Collaborators Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet. 2010;376:1670–1681.
54. Cholesterol Treatment Trialists’ (CTT) Collaborators, Mihaylova B., Emberson J. et al. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials. Lancet. 2012;380:581–590.
55. Cholesterol Treatment Trialists (CTT) Collaborators. Fulcher J., O’Connel R., Voysey M. Efficacy and safety of LDL-lowering therapy among men and women: meta-analysis of individual data from 174,000 participants in 27 randomised trials. Lancet. 2015;385:1397–1405.
56. Оганов Р.Г., Кухарчук В.В., Арутюнов Г.П и др. Сохраняющиеся нарушения показателей липидного спектра у пациентов с дислипидемией, получающих статины, в реальной клинической практике в Российской Федерации (российская часть исследования DYSIS). Кардиоваскулярная терапия и профилактика. 2012;11(4):1‒10. [Oganov R.G., Kukharchuk V.V., Arutyunov G.P. et al. Persisting disorders in lipid profile parameters in patients with dyslipidemia receiving statins in actual clinical practice in the Russian Federation (Russian part of the DYSIS study). Cardiovascular therapy and prevention. 2012;1(4):1‒10 (in Russ.)].
57. Житникова Л.М. «Новые» статины — новые возможности для врача и пациента. РМЖ. 2011;29:1832. [Zhitnikova L.M. «New» statins — new opportunities for the doctor and patient. RMJ. 2011;29:1832 (in Russ.)].
58. Костюкевич О.И. Дислипидемия у кардиологических пациентов с сочетанным поражением ЖКТ: новое в патогенезе и современные возможности терапии. РМЖ. 2011;14:870. [Kostyukevich O.I. Dyslipidemia in cardiac patients with combined gastrointestinal lesions: new in pathogenesis and modern possibilities of therapy. RMJ. 2011;14:870 (in Russ.)].
59. Вёрткин А.Л., Кульниченко Т.В., Скотников А.С. Роль розувастатина в терапии пациентов с высоким кардиоваскулярным риском. РМЖ. 2011;31:1996. [Vertkin A.L., Kulnichenko T.V., Skotnikov A.S. The role of rosuvastatin in the treatment of patients with high cardiovascular risk. RMJ. 2011;31:1996 (in Russ.)].
2. Endo A., Kuroda M., Tsujita Y. ML-236A, ML-236B and ML-236C, new inhibitors of cholesterolgenesis produced by Penicillinunm citrinum. J. Antibiot. (Japan). 1976;29:1346‒1348.
3. Brown A.G., Smale T.C., King R. et al. Crystal and molecular structure of compactin, a new antifungal metabolite from Penicillinum brevicompactum. J. Chem. Soc. Perkin I. 1976;1165‒1170.
4. Catapano A., Graham I., De Backer G.D. et al. 2016 ESC/EAS Guidelines for the Management of Dyslipideamias. The Task Force for the management of Dyslipideamias. Eur Heart. J. 2016. DOI:10.1093/eurheartj/ehw272.
5. Stone N.J., Robinson J., Lichtenstein A.H. et al. 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol. 2014;63(25 Pt B):2889–2934.
6. The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on cardiovascular Disease Prevention in Clinical Practice. 2016 Guidelines on Cardiovascular disease prevention in clinical practice. Eur Heart J. DOI:10.1093/eurheartj/ehw106.
7. Aboyans V., Ricco J.-B., Bartelink E.L. et al. The Task Force for the Diagnosis and Treatment of Peripheral Arterial Diseases of the European Society of Cardiology (ESC) and of the European Society for Vascular Surgery (ESVS) 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS). Eur Heart J 2018;39(9):763‒816. DOI: 10.1093/eurheartj/ehx095.
8. Ference B.A., Ginsberg H.N., Graham I. et al. Low-density lipoproteins cause atherosclerotic cardiovascular disease. 1. Evidence from genetic, epidemiologic, and clinical studies. A consensus statement from the European Atherosclerosis Society Consensus Panel. Eur Heart J. 2017;38(32):2459–2472. DOI: 10.1093/eurheartj/ehx144.
9. Mach F., Ray K.K., Wiklund O. et al. Adverse effects of statin therapy: perception vs. the evidence — focus on glucose homeostasis, cognitive, renal and hepatic function, haemorrhagic stroke and cataract. Eur Heart J. 2018;39(27):2526–2539. DOI: 10.1093/eurheartj/ehy182.
10. Grundy S.M., Stone N.J., Bailey A.L. et al. 2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA Guideline on the Management of Blood Cholesterol: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol. 2018;8:S0735–1097(18)39034-X. DOI: 10.1016/j.jacc.2018.11.003.
11. Newman C., Preiss D., Tobert J. et al. Statin Safety and Associated Adverse Events. A Scientific Statement of American Heart Association. Arterioscler Thromb Vasc Biol. 2018;39:e38–e81. DOI:10.1161/ATV.0000000000000073.
12. Sattar N., Preiss D., Murray H.M. et al. Statins and risk of incident diabetes: a collaborative meta-analysis of randomized statin trials. Lancet. 2010;375(9716):735–742. DOI: 10.1016/S0140-6736(09)61965-6.
13. Сусеков А.В. Клинические исследования с розувастатином из проекта GALAXY в контексте новых Рекомендаций EAS/ESC 2016 по дислипидемиям. Consilium Medicum. 2017;19(12):32‒40. [Susekov A.V. Clinical studies with rosuvastatin from the GALAXY project in the context of new EAS / ESC 2016 Dyslipidemia Recommendations. Consilium Medicum. 2017;19(12):32‒40 (in Russ.)].
14. Schuster H., Fox J. Investigating cardiovascular risk reduction — the Rosuvastatin GALAXY Programme. Exp Opin. 2004;5:1187‒1200.
15. Olechnowicz-Tietz S., Gluba A., Banach M. et al. The risk of atherosclerosis in patients with chronic kidney disease. Int Urol Nephrol. 2013;45:1605‒1612.
16. Gansevoort R.T., Correa-Rotter R., Hemmelgarn B.R. et al. Chronic kidney disease and cardiovascular risk: epidemiology, mechanisms, and prevention. Lancet. 2013;382:339‒352.
17. Matsushita K., van der Velder M., Astor B.C. et al. Chronic Kidney Disease Prognosis Consortium. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet. 2010;375:2073‒2081.
18. Barry R., James M.T. Guidelines for classification of acute kidney disease and disorders. Nephron. 2015;131:221‒226.
19. KDOQI™ Clinical Practice Guidelines and Clinical Practice Recommendations for Diabetes in Chronic Kidney Disease. Am J Kid Dis. 2007;49(2):S12–154.
20. Loncar G., Barthelemy O., Berman E. et al. Impact of renal failure on all-cause mortality and other outcomes in patients treated by percutaneous coronary intervention. Arch Cardiovasc Dis. 2015;108;554‒562.
21. Lancquaniti A., Boliqnano D., Donato V. et al. Alterations of lipid metabolism in chronic nephropathies: mechanisms, diagnosis and treatment. Kid Blood Res. 2010;33(2):100‒110. DOI: 10.1159/000302712.
22. Tonelli M., Wanner C., Kidney Disease: Improving Global Outcomes Lipid Guideline Development Work Group Members. Lipid management in chronic kidney disease:synopsis of the Kidney Disease: Improving Global outcomes 2013 clinical practice guidelines. Ann Intern Med. 2014;160(3):182. DOI: 10.7326/M13-2453.
23. De Zeeuw D., Anzalone D.A., Cain V.A. et al. Renal effects of atorvastatin and rosuvastatin in patients with diabetes who have progressive renal disease (PLANET I): a randomized clinical trial. Lancet Diabetes Endocrin. 2015;3(3):181‒190. DOI: 10.1016/S2213-8587(14)70246-3.
24. Faergeman O., Hill L., Windler E. et al. Efficacy and tolerability of rosuvastatin and atorvastatin when force-titrated in patients with primary hypercholesterolemia: results from the ECLIPSE study. Cardiology. 2008;111(4):219‒228. DOI: 10.1159/000127442.
25. Sidaway J.E., Davidson R.G., McTaggart F. et al. Inhibition of 3-hydroxy-3-methylglutaryl-CoA reductase receptor-mediated endocytosis in opossum kidney cells. J Am Nephrol. 2004;15:2258‒2265.
26. Blazing M.A., Giugliano R.P., de Lemos J.A. et al. On-treatment analysis of the Improved Reduction of Outcomes: Vytorin Efficacy International Trial (IMPROVE-IT). Am Heart J. 2016;182:89‒96. DOI: 10.1016/j.ahj.2016.09.004.
27. Fellstrom B., Jardine A., Schmieder R. et al. Rosuvastatin and Cardiovascular Events in patients undergoing hemodialysis. N Engl J Med. 2009;360:1395‒407.
28. Su X., Zhang L., Lv L. et al. Effect of statins on kidney disease outcomes: a systemic review and meta-analysis. Am J Kidney Disease. 2016: 67:881‒892.
29. Amarenco P., Labreuche J., Lavallee P. et al. Statins in stroke prevention and carotid atherosclerosis: systemic review and up-to-date meta-analysis. Stroke 2004;35:2902‒2909.
30. Inzitari D., Eliasziw M., Gates P. et al. The causes and risk of stroke in patients with asymptomatic internal-carotid-artery stenosis. North American Symptomatic Carotid Endarterectomy Trial Collaborators. N Engl J Med. 2000;342:1693–700.
31. Schwartz G.G., Olsson A.G., Ezekowitz M.D. et al. Myocardial Ischemia Reduction with Aggressive Cholesterol Lowering (MIRACL) Study Investigators Effects of atorvastatin on early recurrent ischemic events in acute coronary syndromes: the MIRACL study: a randomized controlled trial. JAMA. 2001;285(13):1711–1718.
32. LaRosa J.C., Grundy S.M., Waters D.D. et al. Treating to New Targets (TNT) Investigators. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med. 2005;352(14):1425‒1435.
33. Ridker P.M., Danielson E., Fonseca F.A. et al. JUPITER Study Group. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med. 2008;359(21):2195‒2207. DOI: 10.1056/NEJMoa0807646.
34. Young-Xu Y., Jabbour S., Goldberg R. et al. Usefulness of statin drugs in protecting against atrial fibrillation in patients with coronary artery disease. Am J Cardiol. 2003;92(12):1379‒1383.
35. Ozaydin M., Varol E., Aslan S.M. Еffect of atorvastatin on the recurrence rates of atrial fibrillation after electrical cardioversion. Am J Cardiol. 2006;97(10):1490‒1493.
36. Loffredo L., Angelico F., Perri L., Violi F. Upstream therapy with statin and recurrence of atrial fibrillation after electrical cardioversion. Review of the literature and meta-analysis. BMC Cardiovasc Disord. 2012;12:107. DOI: 10.1186/1471-2261-12-107.
37. Wolozin B., Wang S.W., Li N.C. et al. Simvastatin is associated with a reduced incidence of dementia and Parkinson’s disease. BMC Med. 2007;5:20.
38. Wang Q., Yan J., Chen X. et al. Statins: multiple neuroprotective mechanisms in neurodegenerative diseases. Exp Neurol. 2011;230(1):27‒34. DOI: 10.1016/j.expneurol.2010.04.006.
39. Arnaud C., Veillard N.R., Mach F. et al. Cholesterol-independent effects of statins in inflammation, immunomodulation and atherosclerosis. Curr Drug Targets Cardiovasc Haematol Disord. 2005:5(2):127–134.
40. Thongtang N., Diffenderfer M.R., Ooi E.M. et al. Effects of atorvastatin on human C-reactive protein metabolism. Atherosclerosis. 2013;226(2):466‒470. DOI: 10.1016/j.atherosclerosis. 2012.11.012.
41. Tsai N.W., Lee L.H., Huang C.R. et al. The association of statin therapy and high-sensitivity C-reactive protein level for predicting clinical outcome in acute non-cardioembolic ischemic stroke. Clin Chim Acta. 2012;413(23‒24):1861‒1865. DOI: 10.1016/j.cca.2012.07.021.
42. Amarenco P., Goldstein L.B., Szarek M. et al. SPARCL Investigators. Effects of intense low-density lipoprotein cholesterol reduction in patients with stroke or transient ischemic attack: the Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL) trial. Stroke. 2007;38(12):3198‒204.
43. Nicholls S.J., Borgman M., Nissen S.E. et al. Impact of statins on progression of atherosclerosis: rationale and design of SATURN (Study of Coronary Atheroma by InTravascular Ultrasound: effect of Rosuvastatin Versus AtorvastatiN). Curr Med Res Opin. 2011;27(6):1119‒1129. DOI: 10.1185/03007995.2011.570746.
44. Blazing M.A., Giugliano R.P., de Lemos J.A. et al. On-treatment analysis of the Improved Reduction of Outcomes: Vytorin Efficacy International Trial (IMPROVE-IT). Am Heart J. 2016;182:89‒96. DOI: 10.1016/j.ahj.2016.09.004.
45. Sabatine M.S., Giugliano R.P., Keech A.C. et al. FOURIER Steering Committee and Investigators. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med. 2017;376(18):1713‒1722. DOI: 10.1056/NEJMoa1615664.
46. Maki K.C. The ODYSSEY Outcomes trial: Clinical implications and exploration of the limits of what can be achieved through lipid lowering. J Clin Lipidol. 2018;12(5):1102–1105. DOI: 10.1016/j.jacl.2018.05.016.
47. HPS3/TIMI55-REVEAL collaborative Group. Effects of Anacetrapib in Patients with Atherosclerotic Vascular Disease. N Engl J Med. 2017;377(13):1217–1227. DOI: 10.1056/NEJMoa1706444.
48. Nicholls S.J., Brandrup-Wognsen G., Palmer M., Barter P.J. Meta-analysis of comparative efficacy of increasing dose of Atorvastatin versus Rosuvastatin versus Simvastatin on lowering levels of atherogenic lipids (from VOYAGER). Am J Cardiol. 2010;105(1):69‒76. DOI: 10.1016/j.amjcard.2009.08.651.
49. Nicholls S.J., Ballantyne C.M., Barter P.J. et al. Effect of two intensive statin regimens on progression of coronary disease. N Engl J Med. 2011;365:2078–2087. DOI: 10.1056/NEJMoa1110874.
50. Karlson B.W., Palmer M.K., Nicholls S.J. et al. To what extent do high-intensity statins reduce low-density lipoprotein cholesterol in each of the four statin benefit groups identified by the 2013 American College of Cardiology/American Heart Association guidelines? A VOYAGER meta-analysis. Atherosclerosis. 2015;241(2):450‒454. DOI: 10.1016/j.atherosclerosis.2015.05.029.
51. Karlson B.W., Palmer M.K., Nicholls S.J. et al. Doses of rosuvastatin, atorvastatin and simvastatin that induce equal reductions in LDL-C and non-HDL-C: Results from the VOYAGER meta-analysis. Eur J Prev Cardiol. 2016;23(7):744‒747. DOI: 10.1177/2047487315598710.
52. Karlson B.W., Wiklund O., Palmer M.K. et al. Variability of low-density lipoprotein cholesterol response with different doses of atorvastatin, rosuvastatin, and simvastatin: results from VOYAGER. Eur Heart J Cardiovasc Pharmacother. 2016;2(4):212‒217. DOI: 10.1093/ehjcvp/pvw006.
53. Cholesterol Treatment Trialists (CTT) Collaborators Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet. 2010;376:1670–1681.
54. Cholesterol Treatment Trialists’ (CTT) Collaborators, Mihaylova B., Emberson J. et al. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials. Lancet. 2012;380:581–590.
55. Cholesterol Treatment Trialists (CTT) Collaborators. Fulcher J., O’Connel R., Voysey M. Efficacy and safety of LDL-lowering therapy among men and women: meta-analysis of individual data from 174,000 participants in 27 randomised trials. Lancet. 2015;385:1397–1405.
56. Оганов Р.Г., Кухарчук В.В., Арутюнов Г.П и др. Сохраняющиеся нарушения показателей липидного спектра у пациентов с дислипидемией, получающих статины, в реальной клинической практике в Российской Федерации (российская часть исследования DYSIS). Кардиоваскулярная терапия и профилактика. 2012;11(4):1‒10. [Oganov R.G., Kukharchuk V.V., Arutyunov G.P. et al. Persisting disorders in lipid profile parameters in patients with dyslipidemia receiving statins in actual clinical practice in the Russian Federation (Russian part of the DYSIS study). Cardiovascular therapy and prevention. 2012;1(4):1‒10 (in Russ.)].
57. Житникова Л.М. «Новые» статины — новые возможности для врача и пациента. РМЖ. 2011;29:1832. [Zhitnikova L.M. «New» statins — new opportunities for the doctor and patient. RMJ. 2011;29:1832 (in Russ.)].
58. Костюкевич О.И. Дислипидемия у кардиологических пациентов с сочетанным поражением ЖКТ: новое в патогенезе и современные возможности терапии. РМЖ. 2011;14:870. [Kostyukevich O.I. Dyslipidemia in cardiac patients with combined gastrointestinal lesions: new in pathogenesis and modern possibilities of therapy. RMJ. 2011;14:870 (in Russ.)].
59. Вёрткин А.Л., Кульниченко Т.В., Скотников А.С. Роль розувастатина в терапии пациентов с высоким кардиоваскулярным риском. РМЖ. 2011;31:1996. [Vertkin A.L., Kulnichenko T.V., Skotnikov A.S. The role of rosuvastatin in the treatment of patients with high cardiovascular risk. RMJ. 2011;31:1996 (in Russ.)].

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
