Достижение целевого уровня холестерина липопротеинов низкой плотности: современные возможности
Снижение уровня холестерина липопротеинов низкой плотности (ХС-ЛНП) с использованием ингибиторов ГМГ-КоА-редуктазы (статинов) — краеугольный камень первичной и вторичной профилактики неблагоприятных сердечно-сосудистых исходов. В обновленные в 2019 г. рекомендации Европейского общества кардиологов по лечению дислипидемии введены более низкие целевые уровни ХС-ЛНП для пациентов со средним, высоким и очень высоким риском. Новые цели лечения повышают роль комбинированной терапии, при этом первым шагом является добавление эзетимиба к ингибитору ГМГ-КоА-редуктазы (статину). Такой подход хорошо изучен, эффективен и безопасен. Эта комбинация обладает синергическим эффектом и улучшает метаболизм углеводов. В данном обзоре приводится анализ основных характеристик, клинической эффективности и безопасности фиксированных комбинаций современных липидснижающих препаратов, показаны перспективы комбинированной терапии с использованием эзетимиба. Рассмотренные исследования позволили установить, что применение фиксированной комбинации статина и эзетимиба ведет к повышению приверженности пациентов длительной липидснижающей терапии, а следовательно, к улучшению прогноза для пациентов.
Ключевые слова: ингибиторы ГМГ-КоА-редуктазы, эзетимиб, розувастатин, аторвастатин, симвастатин, фиксированные комбинации липидснижающих препаратов, Розулип Плюс.
Для цитирования: Котовская Ю.В., Ерусланова Е.А. Достижение целевого уровня холестерина липопротеинов низкой плотности: современные возможности. РМЖ. Медицинское обозрение. 2019;3(10(I)):45-48.
Yu.V. Kotovskaya, E.A. Yeruslanova
Russian Clinical and Research Center of Gerontology, the branch of the Pirogov Russian National Research Medical University, Moscow
A decrease in low-density lipoprotein cholesterol (LDL cholesterol) level using HMG-CoA reductase inhibitors (statins) is the cornerstone of primary and secondary prevention of adverse cardiovascular outcomes. The European Society of Cardiology 2019 updated guidelines on the dyslipidemia treatment include LDL cholesterol low target levels for patients of the medium, high and very high risk. New treatment targets increase the combination therapy role, whereas, the addition of ezetimibe to the HMG-CoA reductase inhibitor (statin) is the first step. This approach is well studied, effective and safe. This combination has a synergistic effect and improves carbohydrate metabolism. The review provides an analysis of the main characteristics, clinical efficacy and safety of fixed combinations in modern lipid-lowering agents. Also, it shows the prospects of combination therapy using ezetimibe. Considered studies allowed to establish that the fixed combination application of statin and ezetimibe leads to an increase in patients adherence to long-term lipid-lowering therapy, and, consequently, a prognosis improvement in patients.
Keywords: HMG-CoA reductase inhibitors, ezetimibe, rosuvastatin, atorvastatin, simvastatin, fixed combinations of lipid-lowering agents, Rosulip Plus.
For citation: Kotovskaya: Yu.V., Yeruslanova E.A. Fixed combinations of lipid-lowering drugs: issue status and prospects. RMJ. Medical Review. 2019;10(I):45–48.
В обзоре приводится анализ основных характеристик, клинической эффективности и безопасности фиксированных комбинаций современных липидснижающих препаратов, показаны перспективы комбинированной терапии с использованием эзетимиба
Целевые уровни ХС-ЛНП в современных рекомендациях
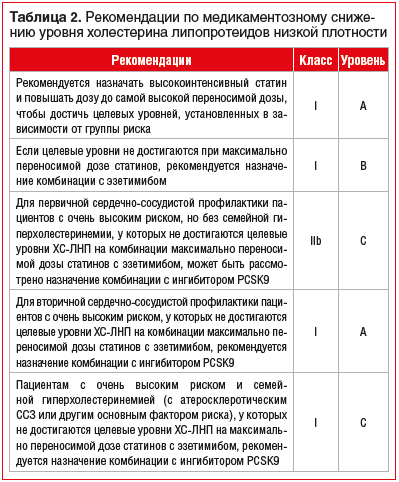
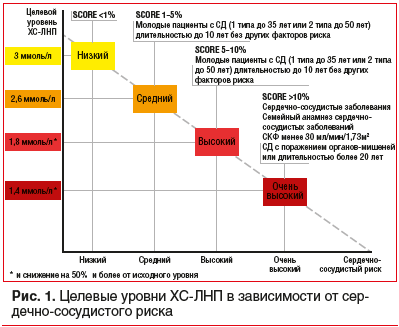
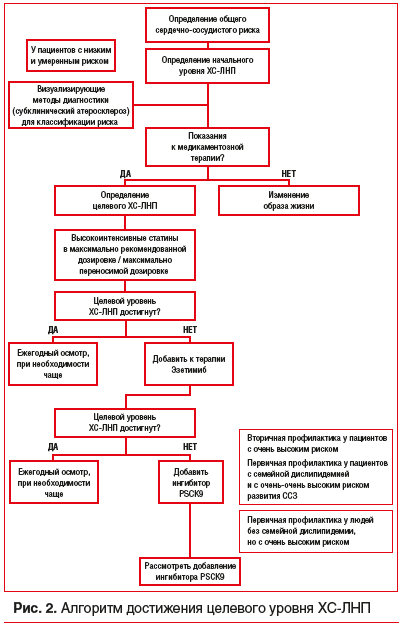
Сердечно-сосудистые заболевания (ССЗ) занимают первое место среди причин заболеваемости и смертности во всем мире [1]. Снижение уровня холестерина липопротеинов низкой плотности (ХС-ЛНП) с использованием ингибиторов ГМГ-КоА-редуктазы — краеугольный камень первичной и вторичной профилактики неблагоприятных сердечно-сосудистых исходов [2–8]. Согласно рекомендациям Европейского общества кардиологов 2019 г. пациентам с дислипидемией рекомендуется назначать высокоинтенсивный статин (например, аторвастатин или розувастатин), обеспечивающий необходимое снижение уровня ХС-ЛНП, и повышать дозу до максимальной переносимой, чтобы достичь целевых уровней ХС-ЛНП, установленных в зависимости от группы риска (табл. 1, 2). Целевые уровни ХС-ЛНП в зависимости от сердечно-сосудистого риска и алгоритм их достижения представлены на рисунках 1 и 2. У части пациентов, несмотря на использование высоких доз даже высокоинтенсивных статинов, не удается достичь целевых уровней ХС-ЛНП на фоне монотерапии. Даже при доказанности тезиса «чем ниже уровень ХС-ЛНП, тем ниже риск сердечно-сосудистой заболеваемости и смертности», несмотря на наличие четких клинических рекомендаций, показатели достижения целевого ХС-ЛНП среди пациентов, принимающих статины, составляют 33,7%, при этом у тех, кто получает статины для вторичной профилактики, — 58% [10], и им требуется комбинированная терапия с применением эзетимиба [11–15]. Прием фиксированной комбинации статина и эзетимиба повышает эффективность каждого препарата из пары (за счет синергического эффекта), увеличивает приверженность терапии и в некоторых случаях может быть более выгодным для пациента в экономическом отношении [16]. Целью данного обзора является анализ основных характеристик, клинической эффективности и безопасности фиксированных комбинаций современных липидснижающих препаратов для повышения возможности достижения целевого уровня ХС-ЛНП в соответствии с современными рекомендациями.

Симвастатин и эзетимиб
Первой фиксированной комбинацией статина и эзетимиба стала комбинация на основе симвастатина. Симвастатин 10–40 мг/сут снижает уровень ХС-ЛНП на 18–41% меньше, чем аторвастатин или розувастатин [17], что ограничивает его использование в случаях, когда требуется достижение современных целевых значений ХС-ЛНП. Биодоступность симвастатина составляет около 5%, время полувыведения — примерно 1–3 ч [18]. В целом препарат хорошо переносится, повышение уровня печеночных трансаминаз встречается у 1% пациентов [19].
Эзетимиб снижает уровень ХС-ЛНП, блокируя всасывание холестерина в тонком кишечнике и усиливая выделение холестерина с желчью. Множество исследований неоднократно демонстрировали синергический эффект назначения препаратов из класса статинов и эзетимиба [22–24].
Эффективность терапии эзетимибом и симвастатином была показана в рандомизированном двойном слепом плацебо-контролируемом исследовании IMProved Reduction of Outcomes: Vytorin Efficacy International Trial (IMPROVE-IT). Дизайн исследования был основан на сравнении монотерапии симвастатином (40 мг) и комбинированной терапии симвастатином и эзетимибом (40+10 мг) у пациентов после перенесенного инфаркта миокарда. В группе комбинированной терапии достигнутый уровень ХС-ЛНП был достоверно ниже (53,7 мг/дл против 69,5 мг/дл в группе монотерапии). Также было продемонстрировано уменьшение числа инфарктов и инсультов в группе комбинированной терапии (р<0,05) [25]. Интересны также результаты исследования 2017 г., которые показали, что протективный эффект комбинированной терапии был выше в группе с СКФ менее 45 мл/мин/1,73м2 [26].
Одновременный прием симвастатина и эзетимиба не увеличивал риск развития побочных эффектов статинов — миопатии и повышения уровня печеночных трансаминаз [27]. Более того, было показано, что комбинированный прием не увеличивает риск развития сахарного диабета 2 типа, что иногда наблюдается при терапии статинами в высоких дозах [28, 29].
Аторвастатин и эзетимиб
Аторвастатин в дозе 10–80 мг/сут снижает уровень ХС-ЛНП на 37–51%, уменьшает риск развития сердечно-сосудистых и цереброваскулярных осложнений, продемонстрировал свою эффективность при проведении как первичной, так и вторичной профилактики в серии клинических исследований и метаанализов [30].
Метаанализ, включивший 17 исследований, показал, что комбинированная терапия аторвастатином и эзетимибом снижает уровень ХС-ЛНП и триглицеридов и повышает уровень ХС-ЛВП (р<0,05) [31]. Комбинированная терапия продемонстрировала уменьшение атеросклероза коронарных артерий, по данным внутрисосудистого ультразвука, в сравнении с монотерапией аторвастатином [32]. Исследования показали сопоставимую частоту нежелательных реакций при комбинированной терапии аторвастатином и эзетимибом и монотерапии аторвастатином или эзетимибом, с единичными случаями повышения уровня печеночных трансаминаз, развитием миопатии или раздражением кишечника [33].
Розувастатин и эзетимиб
Розувастатин в дозе 5–40 мг/сут снижает уровень ХС-ЛНП на 46–55%, среднее снижение уровня холестерина и ХС-ЛНП — выше, чем у других препаратов из этой группы в эквивалентной дозировке. Биодоступность розувастатина составляет 20% (сопоставима с биодоступностью аторвастатина), время полувыведения — 19 ч. Большая часть препарата выделяется с желчью (72%), оставшаяся часть — с мочой. Препарат не метаболизируется системой цитохромов печени, в связи с этим практически не взаимодействует с другими препаратами. Такие побочные эффекты, как миопатия и рабдомиолиз встречаются редко (менее 0,1% и менее 0,01% соответственно) [19].
Эффективность и безопасность розувастатина были продемонстрированы в исследовании The Justification for the Use of statins in Prevention: an International Trial Evaluating Rosuvastatin (JUPITER) trial [33]. Назначение розувастатина снижало риск развития инфаркта, инсульта, уменьшало необходимость в реваскуляризации и госпитализации по поводу нестабильной стенокардии, а также риск смерти от всех причин на 44% по сравнению с плацебо (р<0,00001). Результаты исследования HOPE-3 (Heart Outcomes Prevention Evaluation 3) показали, что терапия розувастатином в сравнении с плацебо снижала риск развития сердечно-сосудистых осложнений у пациентов из группы со средним риском, в то время как только антигипертензивная терапия (кандесартаном) в сравнении с плацебо не приводила к снижению риска [35]. По сравнению с симвастатином и аторвастатином использование розувастатина уже в дозе 10 мг превосходит симвастатин в максимальной дозе 40 мг и эквивалентно применению аторвастатина 40 мг по способности снижать уровень ХС-ЛНП [1].
Эффективность комбинации розувастатина c эзетимибом была продемонстрирована в исследовании, включавшем 469 пациентов с высоким риском ССЗ, которые в течение 6 нед. получали либо монотерапию розувастатином (40 мг), либо комбинированную терапию розувастатином и эзетимибом (40+10 мг). Комбинированная терапия показала снижение уровня ХС-ЛНП на дополнительные 12% в сравнении с монотерапией (-69,8% против -57,1%). Более того, пациенты в группе комбинированной терапии чаще достигали целевого уровня ХС-ЛНП. Так, например, в группе с очень высоким риском 79,6% участников достигли целевых цифр (ХС-ЛНП менее 70 мг/дл), в то время как в группе монотерапии это удалось только в 35% случаев [36].
Безопасность и эффективность приема комбинированного препарата (эзетимиб 10 мг и розувастатин в дозе 5, 10 или 20 мг) были продемонстрированы в исследовании The Multiceneter Randomized Study of Rosuvastatin and Ezetimibe (MRS-ROSE). В ходе исследования сравнивалась эффективность комбинированного препарата с эффективностью монотерапии розувастатином в течение 8 нед. В зависимости от дозы розувастатина в комбинированном препарате уровень ХС-ЛНП снижался на 56–63%, что превышало эффективность монотерапии розувастатином в той же дозировке. Кроме того, у пациентов с сахарным диабетом или метаболическим синдромом отмечалось более значимое снижение уровня ХС-ЛНП, триглицеридов и общего холестерина среди получавших терапию комбинированным препаратом [37].
Исследование The Ildong Rosuvastatin & Ezetimibe for Hypercholestelomia (I-ROSETTE) показало, что безопасность и переносимость комбинированной терапии были сопоставимы с таковыми при монотерапии розувастатином [38].
Более высокая эффективность и благоприятный профиль безопасности комбинированной терапии розувастатином и эзетимибом по сравнению с увеличением дозы розувастатина были показаны в многоцентровом рандомизированном двойном слепом исследовании, проведенном в странах Северной и Южной Америки и Европы. 440 участников исследования были разделены на 2 параллельные группы (в зависимости от дозировки розувастатина), каждая из которых, в свою очередь, также разделялась на 2 группы: прием комбинированного препарата или увеличение дозы розувастатина (с 5 до 10 мг или с 10 до 20 мг, а в комбинированной терапии доза статина оставалась прежней). Целевого уровня ХС-ЛНП от 70 до 100 мг/дл достигли 59,4% пациентов, получавших комбинированную терапию, и только 30,9% при увеличении дозы розувастатина [39].
В январе 2019 г. в России зарегистрирован первый препарат фиксированной комбинации розувастатина и эзетимиба Розулип® Плюс. Препарат Розулип® Плюс показан в дополнение к диете пациентам с первичной гиперхолестеринемией (за исключением гетерозиготной семейной гиперхолестеринемии). Розулип® Плюс назначается в качестве заместительной терапии пациентам, липидный профиль которых адекватно контролировался одновременным применением отдельных препаратов розувастатина и эзетимиба в дозах, эквивалентных соответствующим дозам в фиксированной комбинации.
Перспективы комбинированной терапии с использованием эзетимиба
Бемпедоевая кислота — это липидснижающий препарат нового поколения, который способен снизить уровень ХС-ЛНП на 40%. Бемпедоевая кислота — это пролекарство, которое в печени превращается в бемпедоевый ацетил-коэнзим А, являющийся ингибитором фермента АТФ-цитрат липазы. В соответствии со своим механизмом действия этот препарат не только снижает уровень ХС-ЛНП, но и блокирует синтез жирных кислот [40–42].
Кoмбинация бемпедоевой кислоты (120 или 180 мг/сут) и эзетимиба (10 мг/сут) у пациентов с непереносимостью статинов и у тех, кто мог получать терапию статинами, привела к снижению уровня ХС-ЛНП на 43,1% и 47,7% соответственно в зависимости от дозировки препарата. Монотерапия бемпедоевой кислотой снижает уровень ХС-ЛНП на 27,5% и 30,1% (соответственно указанной дозе) и хорошо переносится [43]. В клиническом исследовании III фазы добавление этого препарата к терапии статинами и эзетимибом у пациентов с высоким и очень высоким риском развития ССЗ снижало уровень ХС-ЛНП на 28%, а риск развития ССЗ — на 33% [44]. Комбинация бемпедоевой кислоты и эзетимиба продолжает исследоваться как перспективная комбинация.
Заключение
Эзетимиб часто используется в качестве второго препарата для достижения целевого уровня ХС-ЛНП. Убедительно доказано, что комбинация статинов и эзетимиба эффективна и безопасна. В свете обновленных рекомендаций Европейского общества кардиологов 2019 г. комбинированная терапия розувастатином и эзетимибом привлекает особое внимание ввиду снижения рекомендуемых целевых значений ХС-ЛНП у пациентов с очень высоким риском менее 1,4 ммоль/л и снижения уровня ХС-ЛНП на 50% и более. Исследования продемонстрировали, что комбинация высокоинтенсивного статина (такого, как розувастатин) и эзетимиба снижает уровень ЛНП в среднем на 65% от исходного [9]. Достижение целевых значений ЛНП снизит риск развития сердечно-сосудистых осложнений, а видимый результат увеличит приверженность пациента терапии.
Препараты нового поколения на основе бемпедоевой кислоты демонстрируют многообещающие результаты по снижению уровня ХС-ЛНП как в монотерапии, так и в комбинации с другими препаратами (например, с эзетимибом) и интересны с точки зрения расширения возможностей достижения целевого ХС-ЛНП у пациентов, которые не могут принимать статины по разным причинам. Фиксированные комбинации липидснижающих препаратов позволяют уменьшить частоту нежелательных побочных реакций (например, уже доказано, что при совместном приеме эзетимиба со статинами снижается риск развития сахарного диабета), за счет синергического эффекта отмечается более значимое снижение уровня ХС-ЛНП и риска развития сердечно-сосудистых осложнений, более того, значительно повышается приверженность длительной липидснижающей терапии.
2. Grundy S.M., Cleeman J.I., Merz C.N. et al. Implications of recent clinical trials for the national cholesterol education program adult treatment panel III guidelines. Circulation. 2004;110(2):227–239.
3. Wood D., De Backer G., Faergeman O et al. Prevention of coronary heart disease in clinical practice: recommendations of the Second Joint Task Force of European and other Societies on Coronary Prevention. Athero sclerosis. 1998;140(2):199–270.
4. Euroaspire II Study Group. Lifestyle and risk factor management and use of drug therapies in coronary patients from 15 countries: principal results from EUROASPIRE II Euro Heart Survey Programme. Eur Heart J. 2001;22(7):554–572.
5. Jones P., Kafonek S., Laurora I., Hunninghake D. Comparative dose efficacy study of atorvastatin versus simvastatin, pravastatin, lovastatin, and fluvastatin in patients with hypercholesterolemia (the CURVES study). Am J Cardiol. 1998;81(5):582–587.
6. Baigent C., Keech A., Kearney P.M. et al. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins. Lancet. 2005;366(9493):1267–1278.
7. Baigent C., Blackwell L., Emberson J. et al. Efficacy and safety of more intensive lowering of LDL cholesterol: ametaanalysis of data from 170,000 participants in 26 randomised trials. Lancet. 2010;376(9753):1670–1681.
8. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: a randomised placebo-controlled trial. Lancet. 2002;360(9326):7–22.
9. Mach F., Baigent С., Catapano A.L. et al., ESC Scientific Document Group, 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk: The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS), European Heart Journal, ehz455. https://doi.org/10.1093/eurheartj/ehz455.
10. Schleyer T., Hui S., Wang J. et al. Quantifying Unmet Need in Statin-Treated Hyperlipidemia Patients and the Potential Benefit of Further LDL-C Reduction Through an EHR-Based Retrospective Cohort Study. Journal of Managed Care and Specialty Pharmacy. 2019;25(5):544. DOI: 10.18553/jmcp.2019.25.5.544.
11. Cannon C.P., Braunwald E., McCabe C.H. et al. Intensive versus moderate lipid lowering with statins after acute coronary syndromes. N Engl J Med. 2004;350(15):1495–1504.
12. De Lemos J.A., Blazing M.A., Wiviott S.D. et al. Early intensive vs a delayed conservative simvastatin strategy in patients with acute coronary syndromes: phase Z of the A to Z trial. JAMA. 2004;292(11):1307–1316.
13. LaRosa J.C., Grundy S.M., Waters D.D. et al. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med. 2005;352(14):1425–1435.
14. Cannon C.P., Steinberg B.A., Murphy S.A. et al. Metaanalysis of cardiovascular outcomes trials comparing inten- sive versus moderate statin therapy. J Am Coll Cardiol. 2006;48(3):438–445.
15. Pearson T.A., Laurora I., Chu H., Kafonek S. The lipid treatment assessment project (L-TAP): a multicenter survey to evaluate the percentages of dyslipidemic patients receiving lipid-lowering therapy and achieving low-density lipoprotein cholesterol goals. Arch Intern Med. 2000;160(4):459–467.
16. Bell D.S. Combine and conquer: advantages and disadvantages of fixed-dose combination therapy. Diabetes Obes Metab. 2013;15(4):291–300.
17. Scandinavian Simvastatin Survival Study Group Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet. 1994;344:1383–1389.
18. Schachter M. Chemical, pharmacokinetic and pharmacodynamic properties of statins: an update. Fundam Clin Pharmacol. 2005 Feb;19(1):117–125. Review.
19. The ESC Handbook on Cardiovascular Pharmacotherapy. Edited by J.C. Kaski, K.P. Kjeldsen. Oxford University Press. First edition published in 2019.
20. Sudhop T., Lutjohann D., Kodal A. et al. Inhibition of intestinal cholesterol absorption by ezetimibe in humans. Circulation. 2002;106(15):1943–1948.
21. Betters J.L., Yu L. NPC1L1 and cholesterol transport. FEBS Lett. 2010;584(13):2740–2747.
22. Ballantyne C.M., Houri J., Notarbartolo A. et al. Effect of ezetimibe coadministered with atorvastatin in 628 patients with primary hypercholesterolemia: a prospective, randomized, double-blind trial. Circulation. 2003;107(19):2409–2415.
23. Davidson M.H., McGarry T., Bettis R. et al. Ezetimibe coadministered with simvastatin in patients with primary hypercholesterolemia. J Am Coll Cardiol. 2002;40(12):2125–2134.
24. Bays H.E., Davidson M.H., Massaad R. et al. Safety and efficacy of ezetimibe added on to rosuvastatin 5 or 10 mg versus up-titration of rosuvastatin in patients with hypercholesterolemia (the ACTE study). Am J Cardiol. 2011;108(4):523–530.
25. Marphy S.A., Cannon C.P., Blazing M.A. et al. Reduction in Total Cardiovascular Events With Ezetimibe/Simvastatin Post-Acute Coronary Syndrome: The IMPROVE-IT Trial. J Am Coll Cardiol. 2016;67:353–361.
26. Stanifer J.W., Charytan D.M., White J. et al. Benefit of Ezetimibe Added to Simvastatin in Reduced Kidney Function. J Am Soc Nephrol. 2017 May 15:pii: AS. N.2016090957. DOI: 10.1681/ASN.2016090957. [Epub ahead of print]
27. Kei A.A., Filippatos T.D., Elisaf M.S. The safety of ezetimibe and simvastatin combination for the treatment of hypercholesterolemia. Expert Opin Drug Saf. 2016;15(4):559–569.
28. Sattar N., Preiss D., Murray H.M. et al. Statins and risk of incident diabetes: a collaborative meta-analysis of randomised statin trials. Lancet. 2010;375:735–742.
29. Barkas F., Elisaf M., Liberopoulos E. et al. Statin therapy with or without ezetimibe and the progression to diabetes. J Clin Lipidol. 2016;10(2):306–313.
30. Adams S.P., Tsang M., Wright J.M. Lipid-lowering efficacy of atorvastatin. Cochrane Database Syst Rev. 2015;(3):CD008226.
31. Ai C., Zhang S., He Q., Shi J. Comparing the combination therapy of ezetimibe and atorvastatin with atorvastatin monotherapy for regulating blood lipids: a systematic review and metaanalyse. Lipids Health Dis. 2018 Oct 17;17(1):239. DOI: 10.1186/s12944-018-0880-8.
32. Tsujita K., Sugiyama S., Sumida H. et al. Impact of dual lipid-lowering strategy with ezetimibe and atorvastatin on coronary plaque regression in patients with percutaneous coronary intervention: the multicenter randomized controlled PRECISE-IVUS trial. J Am Coll Cardiol. 2015;66:495–507.
33. Leiter L.A., Bays H., Conard S. et al. Efficacy and safety of ezetimibe added on to atorvastatin(40 mg) compared with uptitration of atorvastatin (to 80 mg) in hypercholesterolemic patients at high risk of coronary heart disease. Am J Cardiol. 2008;102:1495–1501.
34. Ridker P.M., Danielson E., Fonseca F.A. et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med. 2008;359(21):2195–2207.
35. Yusuf S., Bosch J., Dagenais G. et al. Cholesterol Lowering in Intermediate-Risk Persons without Cardiovascular Disease. N Engl J Med. 2016;374:2021–2031. DOI: 10.1056/NEJMoa1600176.
36. Ballantyne C.M., Weiss R., Moccetti T. et al. Efficacy and safety of rosuvastatin 40 mg alone or in combination with ezetimibe in patients at high risk of cardiovascular disease (results from the EXPLORER study). Am J Cardiol. 2007;99(5):673–680.
37. Kim K.J., Kim S.H., Yoon Y.W. et al. Effect of fixed-dose combinations of ezetimibe plus rosuvastatin in patients with primary hypercholesterolemia: MRS-ROZE (Multicenter Randomized Study of ROsuvastatin and eZEtimibe). Cardiovasc Ther. 2016;34(5):371–382.
38. Hong S.J., Jeong H.S., Ahn J.C. et al. A phase III, multicenter, randomized, double-blind, active comparator clinical trial to compare the efficacy and safety of combination therapy with ezetimibe and rosuvastatin versus rosuvastatin monotherapy in patients with hypercholesterolemia: I-ROSETTE (Ildong Rosuvastatin and Ezetimibe for Hypercholesterolemia) randomized controlled trial. Clin Ther. 2018;40(2):226–241.e224.
39. Bays H.E., Davidson M.H., Massaad R. et al. Am J Cardiol. Safety and efficacy of ezetimibe added on to rosuvastatin 5 or 10 mg versus up-titration of rosuvastatin in patients with hypercholesterolemia (the ACTE Study). 2011 Aug 15;108(4):523–30. DOI: 10.1016/j.amjcard.2011.03.079. Epub 2011 May 17.
40. Penson P., McGowan M., Banach M. Evaluating bempedoic acid for the treatment of hyperlipidaemia. Expert Opin Investig Drugs. 2017;26(2):251–259.
41. Burke A.C., Huff M.W. ATP-citrate lyase: genetics, molecular biology and therapeutic target for dyslipidemia. Curr Opin Lipidol. 2017;28(2):193–200.
42. Bilen O., Ballantyne C.M. Bempedoic acid (ETC-1002): an investigational inhibitor of ATP citrate lyase. Curr Atheroscler Rep. 2016;18(10):61.
43. Thompson P.D., MacDougall D.E., Newton R.S. et al. Treatment with ETC-1002 alone and in combination with ezetimibe lowers LDL cholesterol in hypercholesterolemic patients with or without statin intolerance. J Clin Lipidol. 2016;10(3):556–567.
44. Nash S. Evaluation of the efficacy and safety of bempedoic acid (ETC-1002) in patients with hyperlipidemia and statin intolerant (CLEAR Serenity). NCT02988115. https://clinicaltrials.gov.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
