Влияние нутритивного статуса на течение и исходы острых респираторных заболеваний у детей, протекающих с поражением нижних отделов респираторного тракта
DOI: 10.32364/2587-6821-2020-4-11-691-697
В статье рассмотрены актуальные вопросы влияния питания детей на течение и исходы острых респираторных заболеваний, протекающих с поражением нижних отделов органов респираторного тракта. На основании последних зарубежных публикаций представлены клинико-патогенетические аспекты формирования тяжелого, осложненного течения респираторных инфекций, в т. ч. внебольничных пневмоний, у детей младше 1 года с белково-энергетической недостаточностью. Приведены данные о взаимосвязи характера питания до начала заболевания с длительностью и характером течения бронхиолита. Показано, что во время острого лихорадочного состояния организм ребенка испытывает дефицит белка, связанный со снижением поступления питательных веществ, повышением потерь белка и изменением метаболизма белков. Подобное состояние ведет к иммунной дисфункции. Приведены данные собственных наблюдений, демонстрирующие снижение массы тела у всех детей старше 1 года, госпитализированных с острой респираторной инфекцией. С учетом вышеизложенного разработка алгоритмов диетической коррекции с применением сиппинговых продуктов у детей старше 1 года в остром периоде респираторных инфекций является крайне актуальным и мало изученным вопросом. Необходима коррекция не только белкового, жирового и углеводного состава питания детей в остром состоянии, но и комплексный подход с использованием витаминно-минеральных комплексов, про- и пребиотиков.
Ключевые слова: нутритивный статус, острые респираторные инфекции, внебольничные пневмонии, дети старше 1 года, белково-энергетическая недостаточность.
Для цитирования: Кремплевская С.П., Музыка А.Д., Мелехина Е.В., Фокина В.А., Барыкин В.И., Мирзонов В.А., Горелов А.В. Влияние нутритивного статуса на течение и исходы острых респираторных заболеваний у детей, протекающих с поражением нижних отделов респираторного тракта. РМЖ. Медицинское обозрение. 2020;4(11):691-697. DOI: 10.32364/2587-6821-2020-4-11-691-697.
S.P. Kremplevskaya1,2, A.D. Muzyka1, E.V. Melekhina1, V.A. Fokina1, V.I. Barykin2, V.A. Mirzonov2, A.V. Gorelov1,3
1Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being, Moscow, Russian Federation
2Khimki Regional Hospital, Khimki, Russian Federation
3I.M. Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russian Federation
The article discusses the effects of nutrition in children on the course and outcomes of acute respiratory infections (ARIs) affecting the lower respiratory tract. The clinical pathogenic aspects of the severe course of respiratory infections (including community-acquired pneumonia) in infants younger than 1 year of age with protein-energy malnutrition based on the recent foreign published data are addressed. The data on the association between nutrition prior to the onset of ARI and the course of bronchiolitis are uncovered. It was demonstrated that a child’s organism experiences protein deficiency during the acute fever resulting from reduced nutritional intake, increased protein loss, and the changes in protein metabolism. This leads to immune dysfunction. The authors report that all children older than 1 year of age who were admitted to hospitals with ARIs are underweight. Considering this, the development of diet correction algorithms using sipine p roducts in children older than 1 year of age with the acute stage of respiratory infections is a relevant and little-known issue. In addition to the correction of protein, fat, and carbohydrate composition of nutrition, a complex approach using vitamin mineral complexes, probiotics, and prebiotics is required.
Keywords: nutritional status, acute respiratory infections, community-acquired pneumonia, children older than 1 year of age, protein-energy malnutrition.
For citation: Kremplevskaya S.P., Muzyka A.D., Melekhina E.V. et al. Effect of nutritional status on the course and outcomes of acute respiratory infections in children affecting the lower respiratory tract. Russian Medical Inquiry. 2020;4(11):691–697. DOI: 10.32364/2587-6821-2020-4-11-691-697.
Актуальность
Инфекции органов респираторного тракта являются самой распространенной в мире патологией у населения любого возраста [1]. Респираторные инфекции, протекающие с поражением нижних отделов дыхательных путей (НДП), несмотря на применение современных методов диагностики и комплексной терапии, по сей день остаются одной из ведущих причин смерти детей младших возрастных групп во всем мире [2].
Пандемия новой коронавирусной инфекции, вызванной SARS-CoV-2, начавшаяся в Китае в конце 2019 г. и быстро охватившая весь мир, еще раз заставила задуматься о необходимости комплексного подхода к ведению пациентов с вирусным поражением легких, в т. ч. о диетотерапии [3, 4]. В настоящий момент совершенно очевидно, что состояние нутритивного статуса до начала заболевания во многом определяет его течение и исходы. В недавнем исследовании продемонстрировано, что у пациентов с новой коронавирусной инфекцией, госпитализированных в отделение интенсивной терапии, дефицит массы тела встречается чаще и сопровождается более выраженным снижением уровня альбумина, что, в свою очередь, является прогностически неблагоприятным признаком тяжелого течения
COVID-19 [3]. Дефицит массы тела у детей во время госпитализации — распространенная сопутствующая патология, которая встречается в 31,4% случаев и может влиять на клинические исходы у детей различного возраста [5]. У детей в развивающихся странах пневмонии и диареи являются одними из ведущих причин детской смертности. Основным предрасполагающим фактором развития этих состояний служит дефицит массы тела [6]. Исследователями было показано, что дети с z-показателем веса для возраста ≤-2 имели самый высокий уровень госпитализации с инфекцией НДП, вызванной респираторно-синцитиальным (РС) вирусом, т. е. недостаточное питание является фактором риска более тяжелого течения респираторных вирусных заболеваний [7].
Состояние нутритивного статуса в детском возрасте приобретает особое значение в связи с интенсивным ростом детского организма. Для своевременного подбора коррекции нутритивного статуса необходима его оценка в начале заболевания.
При рассмотрении влияния болезней различных органов и систем на состояние питания важно помнить, что тело человека состоит из мышечной и жировой массы. Состояние последней больше связано с энергетическим статусом, а первой — с белковым нутритивным статусом. Кроме того, рост ребенка в значительной степени зависит от адекватного потребления белка. Если ребенок получает недостаточно макро- и микроэлементов, то белок используется для удовлетворения энергетических потребностей [8]. В этой связи коррекция именно белковой составляющей рациона наиболее важна, т. к. белок необходим для синтеза антител и белков острой фазы, адекватного иммунного ответа на инфекцию (рис. 1).
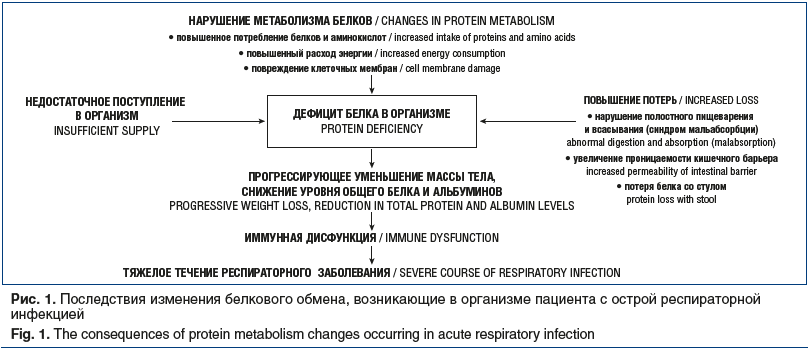
Проблема подбора алгоритмов нутритивной поддержки у пациентов с острыми респираторными заболеваниями в зависимости от возраста и тяжести течения заболевания существует во всем мире. Так, в 2018 г. были опубликованы результаты опроса медработников в Бельгии, Франции и Швейцарии, продемонстрировавшие как недостаточность знаний в этой области у медицинского персонала, так и нехватку и неполноту клинических протоколов и рекомендаций [9].
В исследованиях на животных продемонстрирована связь недостаточного питания с инфекционными заболеваниями дыхательных путей. У мышей, получавших диету с низким содержанием белка и инфицированных вирусом гриппа, наблюдались повышенная вирусная нагрузка, заболевание легких и смертность. Это было связано с нарушением вирус-специфических антител и ответов CD8+ Т-клеток [10]. Дефицит калорий у мышей привел к повышенному риску тяжелого гриппа, который был связан с нарушением вирус-специфического интерферона 1 типа и ответов NK-клеток [11].
С другой стороны, избыточное потребление насыщенных жирных кислот через активацию TLR-4 активирует хронический процесс воспаления и изменяет иммунный ответ на инфекции в сторону его снижения [12]. Графически описанные механизмы представлены на рисунке 2.
![Рис. 2. Изменение иммунного ответа организма при избыточном потреблении насыщенных жирных кислот (из [12] с адап- тацией Е.В. Мелехиной) Fig. 2. Changes in immune response in the excessive intake of saturated fatty acids (from [12], adaptation by E.V. Mel Рис. 2. Изменение иммунного ответа организма при избыточном потреблении насыщенных жирных кислот (из [12] с адап- тацией Е.В. Мелехиной) Fig. 2. Changes in immune response in the excessive intake of saturated fatty acids (from [12], adaptation by E.V. Mel](/upload/medialibrary/394/691-2.png)
Повышенная предрасположенность к инфекционным заболеваниям у пациентов с дефицитом питания в значительной степени связана с нарушением врожденного и адаптивного иммунитета [13], недоедание может оказывать влияние на барьерную функцию кожи [14, 15] слизистых оболочек [16, 17], кроветворные и лимфоидные органы [13].
Клинические симптомы заболеваний дыхательных путей часто включают тахипноэ, что может увеличить энергетические потребности за счет работы дыхательной мускулатуры и потерь жидкости с выдыхаемым воздухом [18]. Кроме того, к механизмам нарушения нутритивного статуса при инфекциях НДП можно отнести лихорадку (расход энергии увеличивается на 7–11% на каждый градус повышения температуры [19, 20]), воспаление, снижение аппетита, затруднение сосания.
Нутритивная поддержка — это обеспечение полноценного питания с применением методов, отличных от обычного приема пищи. В зависимости от тяжести состояния пациента и клинической ситуации она включает в себя энтеральное питание (пероральное или зондовое), парентеральное питание, систему стандартных диет и сиппинг [21]. При необходимости стандартные диеты могут быть частично дополнены или заменены смесями для энтерального питания. При выборе продукта для нутритивной поддержки необходимо обращать внимание на калорийность смеси (изо- или гиперкалорийные), состав белкового компонента, позволяющий компенсировать дефицит белка в организме (соотношение сывороточных белков и казеина), жирового компонента (необходимо включение в состав смеси среднецепочечных триглицеридов, усвоение которых происходит с минимальными затратами энергии), углеводного компонента (поступление легкодоступных углеводов в небольшом количестве). Наличие дополнительных компонентов в продукте питания, таких как про- и пребиотики и витаминно-минеральный комплекс, позволяет уменьшить количество назначений у ребенка с респираторной инфекцией среднетяжелого и тяжелого течения (рис. 3).

Несмотря на увеличенные энергетические потребности, многие дети, поступившие с бронхиолитом, получают недостаточное питание [22]. В то же время существуют трудности в нутритивной поддержке пациентов с бронхиолитом в амбулаторных условиях, приводящие к госпитализации [9].
Таким образом, состояние нутритивного статуса до начала острого респираторного заболевания и его изменения во многом определяют исходы заболевания. В связи с этим проблема разработки алгоритмов оценки нутритивного статуса и его коррекции у детей с острыми респираторными инфекциями является актуальной для педиатрии и инфектологии.
Нутритивный статус и острые респираторные инфекции у детей младше 1 года
Первый год жизни ребенка является особым периодом в жизни каждого индивидуума. Именно тогда происходит наиболее интенсивный рост организма по сравнению с любым другим периодом жизни — увеличение веса в 3 раза и роста в 2 раза по сравнению с таковыми при рождении. Очевидно, что правильное вскармливание в этот период — залог адекватного формирования основных регулирующих систем организма: нервной, эндокринной, иммунной. Оптимальным является грудное вскармливание.
Влияние нутритивного статуса на течение респираторных заболеваний у пациентов первого года жизни описано целым рядом исследователей, начиная с XIX в. Работы последних лет были посвящены инфекциям, протекающим с поражением НДП, у детей раннего возраста из развивающихся стран.
Е.А. Okiro наблюдали 469 детей грудного и раннего возраста в сельской местности в Кении. Было показано, что дефицит массы тела (более 2 стандартных отклонений) был фактором риска для всех причин патологии НДП, вызванной РС-вирусом. Задержка в росте от умеренной до тяжелой (z-оценка роста к возрасту ≤-2) была независимым прогностическим фактором РС-инфекции НДП [23]. Ретроспективный анализ медицинской документации 12 191 пациента на Филиппинах, проведенный S. Paynter et al., показал, что дети со снижением массы тела более чем на 2 стандартных отклонения чаще госпитализировались с инфекцией НДП РС-этиологии. Таким образом, недостаток массы тела увеличивает риск тяжелой РС-инфекции, ведущей к госпитализации пациента [7].
М.С. Weisgerber et al. показали взаимосвязь между калорийностью питания в стационаре и длительностью госпитализации пациентов с бронхиолитом. Авторами были ретроспективно проанализированы данные о 273 пациентах в возрасте младше 1 года. Были выявлены корреляции между потреблением калорий на 2-й день госпитализации и длительностью пребывания в стационаре у пациентов как на грудном, так и на искусственном вскармливании [24].
V. De Cosmi et al. в 2017 г. было описано состояние питания, обмена веществ и потребление макроэлементов у пациентов детского возраста с бронхиолитом. В исследование было включено 35 пациентов в возрасте 2,7–11,7 мес. Статус питания классифицировался в соответствии с критериями ВОЗ, а расход энергии в покое измерялся с помощью калориметра. При поступлении 63% пациентов были либо гиперметаболическими (25,8%), либо гипометаболическими (37,1%). Авторы сделали выводы о том, что у детей раннего возраста с острым бронхиолитом наблюдается высокая распространенность недостаточности питания и измененного метаболического состояния, которое не поддается точной оценке стандартными уравнениями. Неоднородность метаболического состояния свидетельствует о необходимости индивидуального подхода к питанию [25].
С учетом описанных выше взаимоотношений острых инфекционных заболеваний и нутритивного статуса у детей первого года жизни вопросы вскармливания в этой возрастной группе приобретают особое значение, поскольку питание должно обеспечивать сохранение физиологических темпов роста на фоне заболевания и в период восстановления после него. Грудное вскармливание позволяет обеспечить не только нутритивные потребности ребенка, но и позитивное влияние на течение заболевания, учитывая наличие в грудном молоке целого комплекса иммунологических компонентов, включая олигосахариды грудного молока, антитела, цитокины и растворимые рецепторы к ним, микробиоту грудного молока, а также пептиды, обладающие антимикробным потенциалом [26]. Немаловажное значение имеет и белковый компонент грудного молока — помимо того, что уже в желудке у младенца белки грудного молока частично расщепляются, что облегчает в дальнейшем их усвоение в тонкой кишке, преобладание сывороточных белков в грудном молоке обеспечивает достаточное содержание в них незаменимых аминокислот, некоторые из которых особенно важны для работы иммунной системы. Некоторые патогены могут изменять метаболизм этих аминокислот, направляя его по альтернативному пути, что делает аминокислоты менее доступными, снижает эффективность иммунологической защиты [27]. Чрезвычайно важна роль олигосахаридов грудного молока, для которых, в дополнение к позитивному иммуномодулирующему действию, описана ингибирующая активность в отношении целого ряда патогенных бактерий и вирусов [28]. В контексте данной статьи особенно актуальными являются данные о том, что как минимум два олигосахарида грудного молока — 2-фукозиллактоза и лакто-N-неотетраоза способны ингибировать репликацию РС-вируса — основного возбудителя бронхиолита у детей первых месяцев жизни [29]. Своеобразным клиническим подтверждением этих данных является исследование, демонстрирующее 50% снижение риска госпитализации по поводу острого бронхиолита среди детей, получавших грудное вскармливание, в сравнении с детьми, находившимися на искусственном вскармливании [30]. Помимо подтверждения безусловного преимущества грудного вскармливания эти данные актуализируют вопрос дифференцированного выбора смеси для детей первого года жизни с острыми инфекционными заболеваниями НДП, находящихся на искусственном вскармливании. С точки зрения состава оптимально отвечает потребностям детей с острыми инфекционными заболеваниями НДП смесь NAN® SUPREME (Nestle, Германия). Частично гидролизованные сывороточные белки, длинноцепочечные полиненасыщенные жирные кислоты, пробиотик L. rеuteri DSM 17938 дополнены уникальным комплексом из двух олигосахаридов, идентичных олигосахаридам грудного молока, — 2-фукозиллактозы и лакто-N-неотетраозы. Безусловным преимуществом смеси NAN® SUPREME является доказанная в клиническом исследовании способность снижать у здоровых детей риск эпизодов инфекционных заболеваний НДП [31].
Нутритивный статус и острые респираторные инфекции у детей старше 1 года
Влияние нутритивного статуса на течение и исходы респираторных инфекций у детей старше 1 года гораздо менее изучено, однако существует целый ряд работ, демонстрирующих более высокую смертность от пневмонии у детей с дефицитом массы тела [6–8].
Анализ смертности от пневмонии у ВИЧ-положительных и ВИЧ-негативных пациентов в Африке показал, что недоедание может способствовать неблагоприятным исходам пневмонии как у ВИЧ-инфицированных детей, так и у детей без ВИЧ-инфекции, нуждающихся в госпитализации [32].
В. Dembele et al. в 2008 г. опубликовали результаты исследования, в которое были включены 5054 ребенка в возрасте до 5 лет, госпитализированные с тяжелой пневмонией. Летальность составила 4,7%, при этом 55,0% умерших пациентов имели умеренно или сильно пониженный вес. Таким образом, недоедание было наиболее частым фактором, связанным со смертью [33]. Аналогичные данные о том, что новорожденные и дети с недоеданием подвергались повышенному риску смерти, получены иcследователями в Афганистане [34], Индии, Пакистане [35].
Недостаточность питания утяжеляет не только исходы, но и течение респираторных инфекций, протекающих с поражением респираторного тракта: бронхитов, бронхиолитов, пневмоний у детей старше 1 года. Так, французскими учеными в 2008 г. были описаны особенности питания детей с хроническим бронхитом в зависимости от функции легких. В исследование было включено 46 пациентов в возрасте от 6 до 17,5 года с хроническим бронхитом (без муковисцидоза). Оценивались масса тела, рост, толщина кожной складки, процент идеальной массы тела к росту, индекс массы тела (ИМТ), стандартное отклонение ИМТ, жировая масса и масса без жира, также проводилась оценка функции дыхания. У 28% пациентов выявлено снижение процента идеальной массы тела к росту (менее 90%), при этом показатели дыхания (жизненная емкость легких, объем форсированного выдоха за 1 секунду, максимальное давление вдоха и выдоха) были хуже у детей с недостаточной массой [36].
Важно отметить, что и эффективность стандартной терапии инфекций, протекающих с поражением НДП, снижается у детей с изменением нутритивного статуса. Проанализировано течение пневмонии у детей с белково-энергетической недостаточностью (БЭН) в возрасте 0–4 лет 11 мес., поступивших в отделение реанимации или отделение острой респираторной инфекции больницы в Дакке (Бангладеш) в период с апреля 2011 г. по июнь 2012 г. Все дети получали антибактериальную терапию (ампициллин, гентамицин), витамины, минеральные вещества в соответствии с протоколами лечения. Однако у детей с БЭН чаще регистрировалась неэффективность лечения (58% против 20%; p<0,001) и летальный исход (21% против 4%; p<0,001) по сравнению с детьми без БЭН [37].
Мы оценивали нутритивный статус у 19 детей в возрасте от 1 года до 5 лет, поступивших в инфекционное отделение ГАУЗ МО «Химкинская областная больница» МЗ РФ с острыми респираторными заболеваниями, протекающими с поражением НДП. У 10 детей был диагностирован бронхит, у 9 — внебольничная пневмония. Сроки госпитализации составили от 7 до 14 дней. Все пациенты получали стандартные диеты в отделении. При поступлении выявлено снижение ИМТ у 2 пациентов, тогда как при выписке ИМТ был снижен у 3 детей. Однако все наблюдавшиеся дети при выписке имели массу ниже, чем при поступлении. Потеря массы составила от 0,5 до 2 кг. Полученные данные свидетельствуют о необходимости коррекции питания детей старше 1 года с острыми респираторными заболеваниями, протекающими с поражением НДП.
Важным аспектом ведения пациентов с поражением НДП вследствие респираторной инфекции является обоснование и разработка алгоритмов коррекции питания детей в острый период заболевания и период реконвалесценции. Существует целый ряд работ, демонстрирующих уменьшение сроков и тяжести заболевания, а также частоты развития антибиотик-ассоциированных осложнений при подключении к основной терапии продуктов питания, содержащих пре- и пробиотики [38].
В доступной литературе имеются данные о взаимосвязи уровней витаминов и микроэлементов в сыворотке крови с течением пневмоний у детей и средним временем пребывания в стационаре. У детей с пневмониями уровень дефицита железа, цинка и витамина А был значительно выше, чем в группе здоровых детей. Уровень витамина D в сыворотке крови в группе пациентов с пневмонией, протекающей с синдромом бронхообструкции, был ниже, чем в группе пациентов с пневмонией без бронхообструкции и клинически здоровых. Уровни цинка, железа и витамина А
в сыворотке крови в группе пневмонии заметно повысились после проведенной коррекции нутритивного статуса. Сроки пребывания в стационаре пациентов, получавших коррекцию, были более короткими, чем у детей, которые не получали лечебное питание [39].
Заключение
В эпидемиологический сезон 2020–2021 гг. особое значение приобретает комплексный подход к ведению пациентов с респираторными заболеваниями, протекающими с поражением НДП. Показано, что даже при своевременном назначении антибактериальной терапии у детей с пневмониями не всегда происходит быстрый ответ на нее [33, 40]. Известно, что течение и исходы заболеваний НДП у детей во многом определяются состоянием их нутритивного статуса до начала заболевания и в процессе его течения [18, 19, 23, 32]. В связи с вышесказанным становится очевидной необходимость оценки нутритивного статуса в начале заболевания и на его протяжении с целью коррекции питания.
Таким образом, нутритивная поддержка детей с респираторными инфекциями как в остром лихорадочном периоде, так и в периоде реконвалесценции оказывает важное влияние на течение и прогноз заболевания у пациентов различного возраста.
Благодарность
Редакция благодарит компанию Nestle за оказанную помощь в технической редактуре настоящей публикации.
Acknowledgements
Editorial Board are grateful to Nestle company for technical edition.
Сведения об авторах:
Кремплевская София Павловна — врач-педиатр детского инфекционного отделения ГАУЗ МО «Химкинская ОБ», 141407, Россия, г. Химки, Куркинское ш., д. 11; очный аспирант клинического отдела инфекционной патологии ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; 111123, Россия, г. Москва, ул. Новогиреевская, д. 3А; ORCID iD 0000-0003-1064-3096.
Музыка Анна Драгиевна — к.м.н., старший научный сотрудник клинического отдела инфекционной патологии ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; 111123, Россия, г. Москва, ул. Новогиреевская, д. 3А; ORCID iD 0000-0002-2260-2533.
Мелехина Елена Валериевна — д.м.н., доцент по специальности педиатрия, ведущий научный сотрудник клинического отдела инфекционной патологии ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; 111123, Россия, г. Москва, ул. Новогиреевская, д. 3А; ORCID iD 0000-0002-9238-9302.
Фокина Виктория Алексеевна — врач-ординатор по специальности педиатрия ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; 111123, Россия, г. Москва, ул. Новогиреевская, д. 3А; ORCID iD 0000-0002-1587-9818.
Барыкин Вадим Иванович — заведующий детским инфекционным отделением ГАУЗ МО «Химкинская ОБ», 141407, Россия, г. Химки, Куркинское ш., д. 11; ORCID iD 0000-0003-0561-8793.
Мирзонов Владислав Александрович — д.м.н., главный врач ГАУЗ МО «Химкинская ОБ», 141407, Россия, г. Химки, Куркинское ш., д. 11; ORCID iD 0000-0003-0323-0218.
Горелов Александр Васильевич — д.м.н., профессор, член- корр. РАН, заместитель директора по научной работе ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; 111123, Россия, г. Москва, ул. Новогиреевская, д. 3А; профессор кафедры детских болезней ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0001-9257-0171. 0000-0001-9257-0171.
Контактная информация: Кремплевская София Павловна, e-mail: hcgb.muz.dio@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 18.09.2020, поступила после рецензирования 13.10.2020, принята в печать 06.11.2020.
About the authors:
Sofia P. Kremplevskaya — pediatrician of Children’s Infectious Department, Khimki Regional Hospital, 11, Kurkinskoe road, Khimki, 141407, Russian Federation; in-person postgraduate student of the Clinical Division of Infectious Diseases, Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being, 3A, Novogireevskaya str., Moscow, 111123, Russian Federation; ORCID iD 0000-0003-1064-3096.
Anna D. Muzyka — Cand. of Sci. (Med.), senior researcher of the Clinical Division of Infectious Diseases, Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being, 3A, Novogireevskaya str., Moscow, 111123, Russian Federation; ORCID iD 0000-0002-2260-2533.
Elena V. Melekhina — Doct. of Sci. (Med.), Associate Professor, leading researcher the Clinical Division of Infectious Diseases, Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being, 3A, Novogireevskaya str., Moscow, 111123, Russian Federation; ORCID iD 0000-0002-9238-9302.
Victoria A. Fokina — resident, Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being, 3A, Novogireevskaya str., Moscow, 111123, Russian Federation; ORCID iD 0000-0002-1587-9818.
Vadim I. Barykin — Head of Children’s Infectious Department, Khimki Regional Hospital, 11, Kurkinskoe road, Khimki, 141407, Russian Federation; ORCID iD 0000-0003-0561-8793.
Vladislav A. Mirzonov — Doct. of Sci. (Med.), Head Doctor, Khimki Regional Hospital, 11, Kurkinskoe road, Khimki, 141407, Russian Federation; ORCID iD 0000-0003-0323-0218.
Aleksandr V. Gorelov — Doct. of Sci. (Med.), Professor, Corresponding Member of RAS, Deputy Director for Scientific Work, Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being, 3A, Novogireevskaya str., Moscow, 111123, Russian Federation; professor of the Department of Children’s Diseases, I.M. Sechenov First Moscow State Medical University (Sechenov University), 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0001-9257-0171.
Contact information: Sofia P. Kremplevskaya, e-mail: hcgb.muz.dio@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 18.09.2020, revised 13.10.2020, accepted 06.11.2020.
2. Всемирная организация здравоохранения. (Электронный ресурс). URL: https://www.who.int/. Дата обращения: 26.08.2020. [World Health Organization. (Electronic resource). URL: https://www.who.int/. Access date: 26.08.2020 (in Russ.)].
3. Bedock D., Bel Lassen P., Mathian A. et al. Prevalence and severity of malnutrition in hospitalized COVID-19 patients. Clin Nutr ESPEN. 2020;40:214–219. DOI: 10.1016/j.clnesp.2020.09.018.
4. Gonçalves T.J.M., Gonçalves S.E.A.B., Guarnieri A. et al. Prevalence of obesity and hypovitaminosis D in elderly with severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2). Clin Nutr ESPEN. 2020;40:110–114. DOI: 10.1016/j.clnesp.2020.10.008.
5. Moreno J., Navazo S., Arteta E.L. et al. Influencia del estado nutricional en la evolución clínica del niño hospitalizado [Influence of nutritional status on clinical outcomes in hospitalised children]. Pediatr (Barc). 2019;91(5):328–335. DOI: 10.1016/j. anpedi.2019.01.014.
6. Schlaudecker E.P., Steinhoff M.C., Moore S.R. Interactions of diarrhea, pneumonia, and malnutrition in childhood: recent evidence from developing countries. Curr Opin Infect Dis. 2011;24(5):496–502. DOI: 10.1097/QCO.0b013e328349287d.
7. Paynter S., Ware R.S., Lucero M.G. et al. Malnutrition: a risk factor for severe respiratory syncytial virus infection and hospitalization. Pediatr Infect Dis J. 2014;33(3):267–271. DOI: 10.1097/INF.0000000000000096.
8. Pencharz P.B. Assessment of protein nutritional status in children.Pediatric Blood Cancer. 2008;50(2 Suppl):445–446. DOI: 10.1002/pbc.21415.
9. Valla F.V., Baudin F., Demaret P. et al. Nutritional management of young infants presenting with acute bronchiolitis in Belgium, France and Switzerland: survey of current practices and documentary search of national guidelines worldwide. European Journal of Pediatrics. 2019;178(3):331–340. DOI: 10.1007/s00431-018-3300-1.
10. Taylor A.K., Cao W., Vora K.P. et al. Protein energy malnutrition decreases immunity and increases susceptibility to influenza infection in mice. J Infect Dis. 2013;207:501–510. DOI: 10.1093/infdis/jis527.
11. Ritz B.W., Aktan I., Nogusa S., Gardner E.M. Energy restriction impairs natural killer cell function and increases the severity of influenza infection in young adult male C57BL/6 mice. J Nutr. 2008;138:2269–2275. DOI: 10.3945/jn.108.093633.
12. Rogero M.M., Calder P.C. Obesity, Inflammation, Toll-Like Receptor 4 and Fatty Acids. Nutrients. 2018;10(4):432. DOI: 10.3390/nu10040432.
13. Ibrahim M.K., Zambruni M., Melby C.L., Melby P.C. Impact of Childhood Malnutrition on Host Defense and Infection.Clin Microbiol Rev. 2017;30(4):919–971. DOI: 10.1128/CMR.00119-16.
14. Heath M.L., Sidbury R. Cutaneous manifestations of nutritional deficiency. Curr Opin Pediatr. 2006;18:417–422. DOI: 10.1097/01.mop.0000236392.87203.cc.
15. Leite S.N., Jordao A.A. Jr, Andrade T.A. et al. Experimental models of malnutrition and its effect on skin trophism. An Bras Dermatol. 2011;86:681–688. DOI: 10.1590/S0365-05962011000400009.
16. Martinsen T.C., Bergh K., Waldum H.L. Gastric juice: a barrier against infectious diseases.Basic Clin Pharmacol Toxicol. 2005;96:94–102. DOI: 10.1111/j.1742-7843.2005.pto960202.x.
17. Peterson L.W., Artis D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nat Rev Immunol. 2014;14:141–153. DOI: 10.1038/nri3608.
18. Premer D.M., Georgieff M.K. Nutrition for ill neonates. Pediatr Rev. 1999;20(9): e56–e62.
19. Stettler N., Schutz Y., Whitehead R., Jequier E. Effect of malaria and fever on energy metabolism in Gambian children. Pediatr Res. 1992;31:102–106. DOI: 10.1203/00006450-199202000-00002.
20. Benhariz M., Goulet O., Salas J. et al. Energy cost of fever in children on total parenteral nutrition. Clin Nutr. 1997;16:251–255. DOI: 10.1016/S0261-5614 (97) 80037-4.
21. Мескина Е.Р., Ушакова А.Ю. Тактика энтерального питания при инфекционных заболеваниях у детей. М.; 2018.
22. Unger S., Cunningham S. Effect of oxygen supplementation on length of stay for infants hospitalized with acute viral bronchiolitis. Pediatrics. 2008;121(3):470–475.
23. Okiro E.A., Ngama M., Bett A. et al. Factors associated with increased risk of progression to respiratory syncytial virus-associated pneumonia in young Kenyan children. Trop Med Int Health. 2008;13:914–926. DOI: 10.1111/j.1365-3156.2008.02092.x.
24. Weisgerber M.C., Lye P.S., Nugent M. et al. Relationship between caloric intake and length of hospital stay for infants with bronchiolitis. Hosp Pediatr. 2013;3(1):24–30. DOI: 10.1542/hpeds.2012-0032.
25. Cosmi V.D., Mehta N.M., Boccazzi A. et al. Nutritional status, metabolic state and nutrient intake in children with bronchiolitis. Int J Food Sci Nutr. 2017;68(3):378–383. DOI: 10.1080/09637486.2016.1245714.
26. Palmeira P., Carneiro-Sampaio M. Immunology of breast milk. Rev Assoc Med Bras. 2016;62(6):584–593. DOI: 10.1590/1806-9282.62.06.584.
27. Ren W., Rajendran R., Zhao Y. et al. Amino acids as mediators of metabolic cross talk between host and pathogen. Front Immunol. 2018;9:319. DOI: 10.3389/fimmu.2018.00319.
28. Doherty A.M., Lodge C.J., Dharmage S.C. et al. Human Milk Oligosaccharides and Associations With Immune-Mediated Disease and Infection in Childhood: A Systematic Review. Front Pediatr. 2018;6:91. DOI: 10.3389/fped.2018.00091.
29. Duska-McEwen G., Senft A.P., Ruetschilling T.L. et al. Human Milk Oligosaccharides Enhance Innate Immunity to Respiratory Syncytial Virus and Influenza in Vitro. Food and Nutrition Sciences. 2014;5:1387–1398. DOI: 10.4236/fns.2014.514151.
30. Lanari M., Prinelli F., Adorni F. et al. Maternal milk protects infants against bronchiolitis during the first year of life.Results from an Italian cohort of newborns. Early Hum Dev. 2013;89(Suppl 1):S51–S57. DOI: 10.1016/S0378-3782 (13) 70016-1.
31. Puccia G., Alliet P., Cajozzo C. et al. Effects of Infant Formula With Human Milk Oligosaccharides on Growth and Morbidity: A Randomized Multicenter Trial. J Pediatr Gastroenterol Nutr. 2017;64(4):624–631. DOI: 10.1097/MPG.0000000000001520.
32. Tam P.-Y.I., Wiens M.O., Kabakyenga J. et al. Pneumonia in HIV-exposed and Infected Children and Association With Malnutrition.Pediatr Infect Dis J. 2018;37(10):1011–1013. DOI: 10.1097/INF.0000000000001971.
33. Dembele B.P.P., Kamigaki T., Dapat C. et al. Aetiology and risks factors associated with the fatal outcomes of childhood pneumonia among hospitalised children in the Philippines from 2008 to 2016: a case series study. BMJ Open. 2019;9(3):e026895. DOI: 10.1136/bmjopen-2018-026895.
34. Zabihullah R., Dhoubhadel B.G., Rauf F.A. et al. Risk for Death among Children with Pneumonia, Afghanistan. Emerg Infect Dis. 2017;23(8):1404–1408. DOI: 10.3201/eid2308.151550.
35. Bassani D.G., Kumar R., Awasthi S. et al. Million Death Study Collaborators. Causes of neonatal and child mortality in India: a nationally representative mortality survey. Lancet. 2010;376:1853–1860. DOI: 10.1016/S0140-6736 (10) 61461-4.
36. Viola S., Boulé M., Tounian P. et al. Malnutrition in children with chronic bronchitis. Arch Pediatr. 2008;15(8):1270–1275. DOI: 10.1016/j.arcped.2008.04.007.
37. Chisti M.J., Salam M.A., Bardhan P.K. et al. Treatment Failure and Mortality amongst Children with Severe Acute Malnutrition Presenting with Cough or Respiratory Difficulty and Radiological Pneumonia. PLoS One. 2015;10(10):e0140327. DOI: 10.1371/journal.pone.0140327.
38. Jayawardena R., Sooriyaarachchi P., Chourdakis M. et al. Enhancing immunity in viral infections, with special emphasis on COVID-19: A review. Diabetes Metab Syndr. 2020;14(4):367–382. DOI: 10.1016/j.dsx.2020.04.015.
39. Zhou W., Zuo X., Li J., Yu Z. Effects of nutrition intervention on the nutritional status and outcomes of pediatric patients with pneumonia. Minerva Pediatr. 2016;68(1):5–10.
40. Kesavelu D., Franklyn N., Sreedharan L. Can Nutrition Play a Role as a Stimulant for COVID 19 in Children? Rev Recent Clin Trials. 2020 Nov 4. DOI: 10.2174/1574887115666201104154713. Online ahead of print.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
