Острые респираторные инфекции у детей: особенности иммунного ответа и пути коррекции
Рубрика:
Инфекционные болезни
В настоящее время острые респираторные инфекции (ОРВИ), включая грипп, представляют собой одну из самых актуальных медицинских и социально-экономических проблем. Терапия острых респираторных инфекций (ОРИ) у детей остается важной задачей практического здравоохранения. В статье приведены данные по эпидемиологии, этиологии ОРИ, представлена клиническая картина ОРИ. Подробно описаны факторы и механизмы взаимодействия иммунной системы слизистой оболочки пищеварительного и респираторного трактов. Показано, что кишечная микробиота оказывает непосредственно модулирующее действие на иммунный ответ по отношению к патогенам, поражающим дыхательные пути. В статье рассмотрены результаты исследований по изучению эффективности влияния пробиотических микроорганизмов на состояние мукозального иммунитета, а также продемонстрированы клинические эффекты. Приведены результаты ряда исследований, демонстрирующих клиническую эффективность пробиотического штамма бифидобактерий Bifidobacterium animalis subsp. lactis ВВ-12. Описаны пробиотические продукты, содержащие живые микробные культуры с доказанными пробиотическими свойствами, целесообразность их включения в рацион питания детей.
Ключевые слова: острые респираторные инфекции, мукоза-ассоциированная лимфоидная ткань, микробиота, Bifidobacterium lactis ВВ-12, пробиотик.
Ключевые слова: острые респираторные инфекции, мукоза-ассоциированная лимфоидная ткань, микробиота, Bifidobacterium lactis ВВ-12, пробиотик.
E. V. Kanner1, M.L. Maximov2, A.S. Ermolaeva3, A.V. Gorelov1,3
1 Central Research Institute of Epidemiology, Moscow
2 Kazan State Medical Academy — Russian Medical Academy of Continuing Professional Education
3 Sechenov University, Moscow
Nowadays, acute respiratory infections (ARI), including influenza, are one of the most pressing medical and socio-economic problems. Therapy of acute respiratory infections (ARI) in children remains an important task of practical health care. The article presents data on the epidemiology, etiology and clinical picture of ARI. Interaction factors and mechanisms of a mucous membrane immune system of digestive and respiratory tracts are described in detail. It has been shown that an intestinal microbiota has a directly modulating effect on the immune response in relation to pathogens affecting the respiratory tract. The article discusses the results of studies on the effectiveness of probiotic microorganisms on the state of mucosal immunity and demonstrates clinical effects. The results of a number of studies demonstrating the clinical efficacy of the probiotic strain of bifidobacteria Bifidobacterium animalis subsp. lactis BB-12 are given. Probiotic products containing live microbial cultures with proven probiotic properties, the expediency of their inclusion in children diet are described.
Key words: acute respiratory infections, mucosal-associated lymphoid tissue, microbiota, Bifidobacterium lactis BB-12, probiotic.
For citation: Kanner E. V., Maximov M.L., Ermolaeva A.S., Gorelov A.V. Acute respiratory infections in children: features of the immune response and ways of correction // RMJ. Medical Review. 2018. № 8(II). P. 74–78.
В статье приведены данные по эпидемиологии, этиологии острых респираторных инфекций, представлена их клиническая картина. Подробно описаны факторы и механизмы взаимодействия иммунной системы слизистой оболочки пищеварительного и респираторного трактов. Приведены результаты ряда исследований, демонстрирующих клиническую эффективность пробиотического штамма бифидобактерий Bifidobacterium animalis subsp. lactis ВВ-12.
Актуальность
Грипп и острые респираторные инфекции (ОРИ) относятся к массовым инфекциям, поражающим в короткие сроки огромные массы людей. ОРИ прочно занимают основное место в структуре инфекционной заболеваемости во всем мире. Наибольшую актуальность проблема приобретает в педиатрической практике. Это обусловлено значительной распространенностью ОРИ в детской популяции, а также высоким риском развития серьезных осложнений и значительным удельным весом этих инфекций в структуре смертности среди детей первых трех лет жизни [1, 2]. В среднем каждый ребенок переносит от 3 до 5 эпизодов ОРВИ в год, но самые высокие показатели заболеваемости ОРВИ отмечаются у детей раннего возраста, дошкольников и младших школьников [3, 4]. Следует отметить, что данная группа инфекционных заболеваний, сходная по эпидемиологическим характеристикам, механизмам развития и клиническим проявлениям, имеет различную этиологию [5]. Возбудителями данной группы заболеваний являются более 200 вирусов, отличающихся выраженным тропизмом к эпителию слизистой оболочки (СО) респираторного тракта, что обусловливает высокую заболеваемость ОРИ и их быстрое распространение [6, 7]. К тому же постоянно происходят изменения штаммов возбудителей ОРИ, что делает практически невозможным создание вакцины, способной предупредить заболеваемость этими инфекциями. Так, на сегодня этиологически значимыми возбудителями ОРИ выступают риновирусы (до 30–50% случаев), вирусы парагриппа (16–18%), адено- (10–16%), коронавирусы (15%), вирусы гриппа (5–15%), вирусы простого герпеса (2,1–16%), бокавирус hBoV (1,5–8,2%). Появляются новые вирусы, еще 3–4 года назад не проявившие себя в качестве возбудителей ОРИ. К их числу следует отнести новый коронавирус (нКоВ), заражение которым с сентября 2012 г. зарегистрировано в 40 случаях, в т. ч. в 20 — с летальным исходом, а в мае 2013 г. описан внутрибольничный очаг этой инфекции(Саудовская Аравия) [8].
Патогенез и клиническая картина ОРИ
Большинство ОРИ объединены схожим симптомокомплексом, включающим насморк, лихорадку, боль в горле и др. Воспалительный процесс СО респираторного тракта является следствием воздействия повреждающего инфекционного фактора с развитием неспецифической воспалительной реакции. Компоненты воспаления в виде отека, гиперсекреции слизи, повышенной вязкости и бронхоспазма нарушают дренажную функцию дыхательных путей (ДП), а также важнейший механизм самоочищения — мукоцилиарный клиренс (МЦК). При этом создаются условия для присоединения новых патогенов, прогрессирования воспаления, развития осложнений. Вовлечение в воспаление новых отделов респираторного тракта приводит к нарастанию клинической симптоматики, появлению таких симптомов болезни, как кашель, проявления назальной и бронхиальной обструкции, инфекционно-токсический синдром, аускультативные изменения в легких [9]. Известно, что воспаление играет важную роль в ограничении вирулентных свойств возбудителя, элиминации продуктов клеточной деградации, а также формировании как местного, так и общего иммунного ответа. Воспалительная реакция организма может сопровождаться высокой функциональной активностью различных типов иммунокомпетентных клеток и/или выраженным синергизмом в действиях провоспалительных медиаторов (цитокинов); это сопровождается прогрессивной дисфункцией эндотелия, повышением сосудистой проницаемости, нарушением микроциркуляции, перераспределением кровотока и др.Иммунная система слизистых оболочек: факторы и механизмы взаимодействия
Иммунная система СО организма играет огромную роль в развитии, поддержании и регуляции иммунного гомеостаза, являясь важной составляющей многокомпонентной системы иммунитета, осуществляя защиту организма от генетически чуждых ему экзогенных и эндогенных элементов [10].Структурной основой местного иммунитета является лимфоидная ткань, ассоциированная с СО (mucosal-associated lymphoid tissue (MALT)). В MALT принято выделять несколько отделов (рис. 1): TALT (носоглотка, евстахиева труба, ухо; NALT (носовая полость, рот и ротоглотка, конъюнктивы), BALT (трахея, бронхи, легкие, грудные железы у женщин), GALT (пищевод, желудок, кишечник и урогенитальный тракт), SALT (дерма) [11].
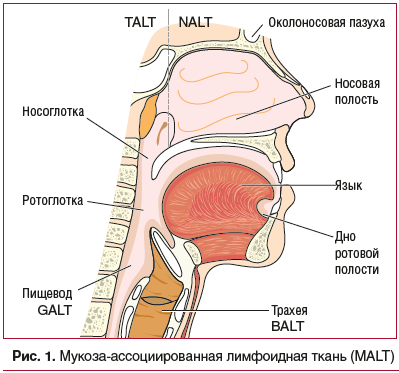
К факторам мукозальной иммунной системы относят сапрофитную микрофлору, защитный эпителий, слизеобразование, кератинизацию и слюнообразование, антимикробные пептиды (лизоцим, дефензины, лактоферрин, интерфероны, пропердин), фагоциты, комплемент, секреторный иммуноглобулин А (sIgA), IgG, врожденные лимфоидные клетки (ILC), включая NK-клетки, CD4+ и CD8+ Т-лимфоциты [10].
Несмотря на то, что в иммунной системе СО выделяют эффекторный и индуктивный отделы, это деление условно, потому что MALT-лимфоциты постоянно мигрируют, заселяя при этом характерные для каждой популяции зоны обитания. Такая закономерность получила название хоминг-эффекта [12]. Следствием этого является одновременное включение иммунного ответа во всех СО, вне зависимости от очага антигенного стимула.
В индуктивных зонах, к которым относят прежде всего пейеровы бляшки, происходит презентация антигена; антигенпрезентирующие клетки и антигенреактивные Т- и В-лимфоциты поступают в лимфу, затем в кровь, а оттуда мигрируют в собственную пластинку СО (эффекторный отдел). Направленная миграция осуществляется с помощью гуморальных факторов (интегрин α4b7, хемокиновый рецептор CCR9 и др.), а точками прикрепления являются хоминг-рецепторы клеток тканей [13]. В норме при отсутствии воспаления лимфоциты мигрируют предпочтительно в ту ткань, где они впервые обнаружили антиген, и поэтому их хоминг-рецепторы специфичны к лигандам, находящимся на клетках этих тканей [14]. Подобное взаимодействие именно между дыхательной и пищеварительной системами специфично, т. к. в экспериментах показано отсутствие такой взаимосвязи между другими органами [15].
Плазматические клетки собственной пластинки и пейеровых бляшек синтезируют димерную молекулу IgA, которая связывается на базальной поверхности эпителиальной клетки со специализированным трансмембранным белком, имеющим в своем составе гликопротеид — секреторный компонент. Пройдя с помощью трансцитоза эпителиальную клетку, димерная молекула IgA присоединяет секреторный компонент, превращается в sIgA, причем секреторный компонент делает молекулу иммуноглобулина устойчивой к протеолизу [16]; sIgA препятствует адгезии микроорганизмов, их токсинов, пищевых аллергенов на эпителии СО и тем блокирует их проникновение во внутреннюю среду организма. Адаптивный иммунитет СО обеспечивается главным образом антителами класса sIgA, в меньшей мере — IgM и IgG [17].
В настоящее время накоплены научные данные, свидетельствующие о том, что отделы СО различных систем организма тесно взаимодействуют между собой, подчиняясь единым регулирующим влияниям. Существует перекрестная регуляция иммунитета легких и кишечника, показано, что кишечная микробиота оказывает непосредственно модулирующее действие на иммунный ответ по отношению к патогенам, поражающим дыхательные пути [18, 19].
Теория единства иммунной системы анатомически не взаимодействующих СО была сформулирована J. Bienenstock около 40 лет назад [20]. Эта концепция предполагает, что различные отделы СО организма функционируют вместе как один системный орган, защищающий организм хозяина от чужеродных организмов. Стимуляция либо поражение слизистой одной системы в значительной мере влияет на СО другой системы. Подход к изучению иммунной системы слизистых как объединенного глобального органа является определяющим для дальнейших достижений в понимании иммунологии слизистых и в лечении многих заболеваний [21].
Особенно тесно такая взаимосвязь осуществляется между пищеварительным и респираторным трактом, т. к. они имеют общее эмбриональное происхождение, функционально сходны — их слизистые имеют контакт с внешней средой и осуществляют функцию первичной защиты от чужеродных патогенов, играя ключевую роль во врожденном и приобретенном иммунитете. В исследованиях было продемонстрировано, что вакцинация слизистой одного отдела ведет к повышению защитной функции слизистой другого отдела, инфицирование вирусом ведет к появлению вирусоспецифичных концентраций иммуноглобулинов в секрете слизистых другого отдела [19]. Также показано, что Т-клетки кишечника, зараженные ротавирусом, осуществляют защиту дыхательного тракта от ротавирусной инфекции [22].
Сообщается об увеличении числа нейтрофилов, эозинофилов и Т-клеток в мокроте пациентов с воспалительными заболеваниями кишечника (ВЗК) [23]. Микробиота ЖКТ играет защитную роль в отношении пневмококковой пневмонии [18].
На сегодняшний день нет точных доказательств существования единого медиатора, который выполнял бы роль связующего звена между кишечником и легкими, однако одним из кандидатов на эту роль является тимический стромальный лимфопоэтин (TSLP). TSLP является главным регулятором воспалительных процессов кожи и дыхательных путей, решающим фактором, регулирующим Th2-воспалительный ответ [24, 25]. Повышенная продукция TSLP в кератоцитах кожи ведет к появлению атопического дерматита с сопутствующим аллергическим воспалением в легких мышей [26].
Интерфероны (ИФН) I и III типа связываются с различными рецепторами на клеточной поверхности, но индуцируют сигналы сходной направленности, что приводит к экспрессии антивирусных эффекторных молекул-хозяев. Хотя было показано, что ИФН III типа (ИФН-λ) преимущественно воздействует на органы СО кишечника, в то же время отмечается и роль ИФН I типа (α), что сопровождается экспрессией рецепторов к нему на эпителиальных клетках, прежде всего дыхательной системы. ИФН-α оказывает влияние на дендритные клетки в лимфоэпителиальном глоточном кольце Пирогова — Вальдейера, активируя созревание незрелых дендритных клеток, стимулирующих, в свою очередь, созревание и пролиферацию В-клеток, а также способствует пролиферации СD4+ и CD8+ Т-23 клеток, усиливает цитотоксические свойства CD8+, макрофагов и NK-клеток [27].
Клетки эпителия кишечника, которые являются основными мишенями для ротавирусной инфекции, более сильно реагируют на ИФН III типа, чем на I тип. Таким образом, именно ИФН-λ (III тип) играет критическую роль в противовирусной защите эпителиальных клеток [28].
Сапрофитная микрофлора (в кишечнике и урогенитальном тракте это лактобактерии и бифидобактерии, в ротовой полости — сапрофитные нейссерии, в дерме — эпидермальный стафилококк) имеет определяющее значение для состояния мукозальной иммунной системы [11, 29]. Ее функции многообразны и включают антагонизм по отношению к патогенной микрофлоре за счет продукции органических кислот, перекиси водорода и бактериоцинов, синтез молочной кислоты и снижение рН, конкуренцию с патогенной флорой за адгезивные сайты (колонизационная резистентность), стимуляцию иммунных ответов за счет адъювантных свойств, стимуляцию муцинообразования [27, 30, 31].
И процессы возрастной эволюции, и закономерности реагирования на внедрение патогенов в биотопах кишечника и респираторного тракта во многом сходны. Так, количественный и качественный состав микробиоты приближается к схожему с таковым у взрослого человека в обоих биотопах к третьему году жизни. Известно, что существует перекрестная регуляция иммунитета легких и кишечника [18, 19, 32].
Это позволяет предположить, что воздействие на микробиоту кишечника может быть удобным инструментом для профилактики не только желудочно-кишечных, но и бронхолегочных заболеваний. Ряд исследований демонстрирует такой эффект при использовании диеты с высоким содержанием клетчатки, что стимулирует на реакцию дыхательных путей у мышей, или при приеме пробиотиков в дородовом или раннем послеродовом периоде для профилактики не только атопической экземы, но и бронхиальной астмы [33–36].
В биотопах человека функционируют устойчивые к инфекции молекулярно-клеточные компартменты, включающие пробиотические бактерии, синтезирующие лектиновые системы с разнообразным антипатогенным потенциалом [37]. Углубленное изучение механизмов участия микрофлоры биотопов в системе мукозального иммунитета позволило установить способность лектинов облигатных бактерий распознавать и связывать при развитии патологических состояний гликаны муцинов с остатками D-галактозамина или нейраминовой кислоты (NeuNAc, Neu5NAc) с участием системы комплемента [38, 39].
При совместном культивировании бифидобактерий и клеток кишечного мукозального барьера последние продуцируют повышенные уровни комплемента C3a, при этом бифидобактерии регулируют активность некоторых участвующих в воспалении генов. Bifidumbacterium breve IPLA20004 могут способствовать рекрутированию клеток врожденного иммунитета в мукозальную оболочку [40].
Пробиотики и иммунитет
В ряде работ отечественных и зарубежных авторов показано влияние отдельных пробиотических штаммов на состояние мукозального иммунитета, а также продемонстрированы клинические эффекты такого воздействия, приняты международные согласительные документы, закрепляющие целесообразность применения пробиотиков как у здоровых, так и у больных детей [41–44]. В частности, показано усиление фагоцитарной активности и выработки sIgA у детей, принимавших Lactobacillus ramnosus (LGG) и Bifidobacterium lactis (BB-12) [45]. Влияние штамма L. casei DN-114001 на мукозальный иммунитет детей доказано на примере статистически достоверного нарастания уровня sIgA в слюне [46].К настоящему времени известны 32 вида бифидобактерий и 56 видов лактобактерий, их эффекты различаются, более того, они штаммоспецифичны. Bifidobacterium lactis BB-12 является одним из наиболее клинически изученных. Основными механизмами действия Bifidobacterium BB-12 являются усиление иммунного ответа [47], влияние на врожденный иммунитет [48], модификация микробиоты [49]. Изучено влияние Bifidobacterium animalis подвида lactis BB-12 на риск острых инфекционных заболеваний у здоровых младенцев. Обнаружено снижение частоты респираторных инфекций при добавлении в терапию одного пробиотика BB-12 [50]. Исследования показали либо снижение частоты инфекций [51, 52], либо уменьшение продолжительности и/или тяжести инфекции [53] после потребления пробиотика.
Bifidobacterium lactis BB-12 используется в пищевой промышленности и в качестве пищевых добавок с 1985 г., описан в более чем 370 научных публикациях 180 клинических исследований, Bifidobacterium (BB-12) является лучшим в мире документально изученным штаммом.
Пути коррекции кишечной микробиоты у детей
По настоящий день постоянно совершаются открытия, уточняются генетические основы многих болезней, создаются новые лекарства, однако люди из года в год продолжают болеть гриппом и другими ОРИ. Следует обратить внимание на аспект питания, который нечасто обсуждают в медицинской литературе. Питание является одним из основных факторов внешней среды, определяющих здоровье человека, нормальный рост и развитие, физическую и умственную работоспособность, продолжительность жизни, сопротивляемость организма к инфекциям и вредным факторам окружающей среды. С этой точки зрения интерес представляют пробиотические продукты, содержащие живые микробные культуры с доказанными пробиотическими свойствами. Они могут выпускаться на основе ферментированного молока, на кисломолочной основе, на основе пресного молока, на основе продуктов прикорма. Так, на российском рынке представлена серия продуктов, содержащих пробиотический штамм бифидобактерий — Bifidobacterium animalis subsp. lactis ВВ-12. К числу таких продуктов принадлежат: питьевые йогурты (для детей старше 8 мес.) и биотворожки (для детей старше 6 мес.) под торговой маркой «ФрутоНяня», а также биолакт, обогащенный ацидофильной палочкой (для детей старше 8 мес.). Питьевой йогурт «ФрутоНяня» содержит в своем составе молоко цельное и молоко сухое обезжиренное, фруктовые наполнители (сахар, вода, пюре фруктовое, загуститель — крахмал кукурузный, сок лимонный концентрированный, ароматизатор натуральный, сок фруктовый или овощной концентрированный), пребиотики — инулин, закваску молочнокислых культур (L. bulgaricus и S. thermophilus). В состав биотворожков «ФрутоНяня» входят нормализованное молоко, закваска молочнокислых культур и пробиотическая культура Bifidobacterium animalis subsp. lactis ВВ-12. Биолакт «ФрутоНяня» содержит в своем составе нормализованное молоко, сахар, закваску термофильных стрептококков и ацидофильных молочнокислых палочек, пребиотик — инулин.Также следует помнить об активации обменных процессов, происходящей при повышении температуры тела, которое, как правило, сопровождает ОРИ и характеризуется дегидратацией вследствие значительных потерь воды при дыхании и потоотделении.
В качестве питья для оральной регидратации рекомендована «ФрутоНяня» детская вода», которая, по результатам экспертизы, по органолептическим, санитарно-химическим и санитарно-микробиологическим показателям полностью соответствует критериям эпидбезопасности. Содержание биологически необходимых микроэлементов (кальций, магний, бикарбонаты, калий), йода и фтора в воде «ФрутоНяня» детская вода» соответствует уровням физиологической потребности организма детей [54].
Заключение
Учитывая влияние факторов питания на метаболизм и иммунитет, профилактику и течение инфекционных заболеваний у детей, следует выстраивать рацион ребенка с включением пробиотических продуктов с доказанным положительным действием на показатели здоровья. Очевидно, что разные штаммы пробиотиков способны по-разному восприниматься иммунной системой, более того — восприятие каждого из них может быть индивидуально, поскольку зависит от состояния иммунной системы и собственной микробиоты хозяина.Таким образом, перспективы профилактики и лечения многих инфекционных заболеваний кроются в обоснованном и дифференцированном назначении пробиотических штаммов, что стимулирует иммунный ответ во всех отделах мукозальной иммунной системы, а использование пробиотических продуктов питания повышает клиническую эффективность лечения, снижает продолжительность основных симптомов заболевания.
Литература
1. Шаханина И.Л. Грипп и острые респираторные заболевания — приоритетная социально-экономическая проблема здравоохранения // Вакцинопрофилактика гриппа. М., 1998. С. 10–16 [Shahanina I.L. Gripp i ostrye respiratornye zabolevanija — prioritetnaja social’no-jekonomicheskaja problema zdravoohranenija // Vakcinoprofilaktika grippa. M., 1998. S. 10–16 (in Russian)].
2. Острые респираторные заболевания у детей: лечение и профилактика // Научно-практическая программа Союза педиатров России. М.: Международный фонд охраны здоровья матери и ребенка. 2002. 69 с. [Ostrye respiratornye zabolevanija u detej: lechenie i profilaktika // Nauchno-prakticheskaja programma Sojuza pediatrov Rossii. M.: Mezhdunarodnyj fond ohrany zdorov’ja materi i rebenka. 2002. 69 s. (in Russian)].
3. Блохин Б.М. Заболевания органов дыхания у детей. В кн.: Практическое руководство по детским болезням. Т. 9 / под общей редакцией В.Ф. Коколиной и А.Т. Румянцева. М.: Медпрактика, 2007. 616 с. [Blohin B.M. Zabolevanija organov dyhanija u detej. V kn.: Prakticheskoe rukovodstvo po detskim boleznjam. T. 9 / pod obshhej redakciej V.F. Kokolinoj i A.T. Rumjanceva. M.: Medpraktika, 2007. 616 s. (in Russian)].
4. Геппе Н.А. Комбинированная терапия бронхиальной обструкции у детей // Лечащий врач. 2009. № 6. С. 34–39 [Geppe N.A. Kombinirovannaja terapija bronhial’noj obstrukcii u detej // Lechashhij vrach. 2009. № 6. S. 34–39 (in Russian)].
5. Учайкин В.Ф. Диагностика, лечение и профилактика гриппа и острых респираторных заболеваний у детей. Пособие для врачей. М., 2001. 16 с. [Uchajkin V. F. Diagnostika, lechenie i profilaktika grippa i ostryh respiratornyh zabolevanij u detej. Posobie dlja vrachej. M., 2001. 16 s. (in Russian)].
6. Грипп (сезонный, птичий, пандемический) и другие ОРВИ / под ред. проф. В.П. Малого, проф. М.А. Андрейчина. М.: ГЭОТАР-Медиа, 2013. 319 с. [Gripp (sezonnyj, ptichij, pandemicheskij) i drugie ORVI / pod red. prof. V.P. Malogo, prof. M.A. Andrejchina. M.: GJeOTAR-Media, 2013. 319 s. (in Russian)].
7. Львов Д.К., Альховский С.В., Щетинин А.М., Щелканов М.Ю. Буньявирусы (Bunyaviridae) // Руководство по вирусологии. Вирусы и вирусные инфекции человека и животных / под ред. Д.К. Львова. М.: МИА, 2013. С. 279–298 [L’vov D.K., Al’hovskij S.V., Shhetinin A.M., Shhelkanov M.Ju. Bun’javirusy (Bunyaviridae) // Rukovodstvo po virusologii. Virusy i virusnye infekcii cheloveka i zhivotnyh / pod red. D.K. L’vova. M.: MIA, 2013. S. 279–298 (in Russian)].
8. Рекомендации «О мерах по профилактике в отношении предполагаемых или подтвержденных случаев заболеваний, вызванных новой коронавирусной инфекцией». Письмо от 6.03.2013 №01/2440-13-32 [Rekomendacii «O merah po profilaktike v otnoshenii predpolagaemyh ili podtverzhdennyh sluchaev zabolevanij, vyzvannyh novoj koronavirusnoj infekciej». Pis’mo ot 6.03.2013 №01/2440-13-32 (in Russian)].
9. Петрова С.И., Панютина Я.В. Патогенетическая терапия респираторных заболеваний у детей // Педиатрия. 2015. № 94(2). С. 193–198 [Petrova S.I., Panjutina Ja.V. Patogeneticheskaja terapija respiratornyh zabolevanij u detej // Pediatrija. 2015. № 94(2). S. 193–198 (in Russian)].
10. Ярилин А.А. Иммунология: учебник. М.: ГЭОТАР-Медиа, 2010. 752 с. [Jarilin А.А. Immunologija: uchebnik. M.: GJeOTAR-Media, 2010. 752 s. (in Russian)].
11. Климов В.В. Мукозальная иммунная система / Эл. доступ. http://ssmu.immunology.sibhost.ru/IM/MALT.pdf. Просмотрено 27.01.2018 [Klimov V.V. Mukozal’naja immunnaja sistema / Jel. dostup. http://ssmu.immunology.sibhost.ru/IM/MALT.pdf. Prosmotreno 27.01.2018 (in Russian)].
12. Ruane D., Brane L., Reis B.S. et al. Lung dendritic cells induce migration of protective T cells to the gastrointestinal tract // J Exp Med. 2013. Vol. 210. P. 1871–1888.
13. Eksteen B., Grant A.J., Miles A. et al. Hepatic endothelial CCL25 mediates the recruitment of CCR9 + gut-homing lymphocytes to the liver in primary sclerosing cholangitis // J Exp Med. 2004. Vol. 200. P. 1511–1517.
14. Campbell D.J., Butcher E.C. Rapid acquisition of tissue-specific homing phenotypes by CD4(+) T cells activated in cutaneous or mucosal lymphoid tissues // J Exp Med 2002. Vol. 195. P. 135–141.
15. Liu Y., Wang X.Y., Yang X. et al. Lung and intestine: a specific link in an ulcerative colitis rat model // Gastroenterol Res Practice. Vol. 2013. Article ID 124530. 13 p.
16. Kunkel E.J., Kim C.H., Lazarus N.H. et al. CCR10 expression is a common feature of circulating and mucosal epithelial tissue IgA Ab-secreting cells // J Clin Invest 2003. Vol. 111. P. 1001–1010.
17. Цывкина А.А., Лусс Л.В., Царев С.В. Мукозальный иммунитет при патологии верхних дыхательных путей // Российский аллергологический журнал. 2011. № 2. С. 22–26 [Cyvkina A.A., Luss L.V., Carev S.V. Mukozal’nyj immunitet pri patologii verhnih dyhatel’nyh putej // Rossijskij Allergologicheskij Zhurnal. 2011. № 2. S. 22–26 (in Russian)].
18. Schuijt T.J., Lankelma J.M., Scicluna B.P. et al. The gut microbiota plays a protective role in the host defence against pneumococcal pneumonia // Gut. 2016. Vol. 65(4). P. 575–583.
19. Samuelson D.R., Welsh D.A., Shellito J.E. Regulation of lung immunity and host defense by the intestinal microbiota // Frontiers Microbiol. 2015. Vol. 6. P. 1085.
20. Bienenstock J., McDermott M., Befus D., O’Neill M. A common mucosal immunologic system involving the bronchus, breast and bowel // Adv. Exp. Med. Biol. 1978. Vol. 107. P. 53–59.
21. Tulic M.K., Piche T., Verhasselt V. Lung–gut cross-talk: evidence, mechanisms and implications for the mucosal inflammatory diseases // Clinical and Experimental Allergy. 2016. Vol. 46. P. 519–528.
22. Zuercher A.W., Jiang H.Q., Thurnheer M.C. et al. Distinct mechanisms for cross-protection of the upper versus lower respiratory tract through intestinal priming // J Immunol 2002. Vol. 169. P. 3920–3925.
23. Fireman Z., Osipov A., Kivity S. et al. The use of induced sputum in the assessment of pulmonary involvement in Crohn’s disease // Am J Gastroenterol. 2000. Vol. 95. Р. 730–734.
24. Liu Y.J. Thymic stromal lymphopoietin: master switch for allergic inflammation // J Exp Med. 2006. Vol. 203. P. 269–273.
25. Ichinohe T., Pang I.K., Kumamoto Y. et al. Microbiota regulates immune defense against respiratory tract influenza A virus infection // PNAS. 2011. Vol. 108. P. 5354–5359.
26. Zhang Z., Hener P., Frossard N. et al. Thymic stromal lymphopoietin overproduced by keratinocytes in mouse skin aggravates experimental asthma // PNAS. 2009. Vol. 106. P. 1536–1541.
27. Хаитов Р.М. Иммунология. М.: ГЭОТАР-Медиа, 2013. 521 с. [Haitov R.M. Immunologija. M.: GJeOTAR-Media, 2013. 521 s. (in Russian)].
28. Potta J., Mahlakõiv T., Mordstein M. IFN-λ determines the intestinal epithelial antiviral host defense // PNAS. 2011. Vol. 108. № 19. P. 7944–7949.
29. Извин А.И., Катаева Л.В. Микробный пейзаж слизистой оболочки верхних дыхательных путей в норме и патологии // Вестник оториноларингологии. 2009. № 2. С. 65–68 [Izvin A.I., Kataeva L.V. Mikrobnyj pejzazh slizistoj obolochki verhnih dyhatel’nyh putej v norme i patologii // Vestnik otorinolaringologii. 2009. № 2. S. 65–68 (in Russian)].
30. Алешкин В.А., Афанасьев С.С., Караулов А.В. Микробиоценозы и здоровье человека. М.: Династия, 2015. 548 с. [Aleshkin V.A., Afanas’ev S.S., Karaulov A.V. Mikrobiocenozy i zdorov’e cheloveka. M.: Dinastija, 2015. 548 s. (in Russian)].
31. Андрианова Е.Н., Снегирева Н.Ю., Рывкин А.И. Дисбиоз верхнего отдела респираторного тракта и изменения функционального состояния органов дыхания у часто болеющих детей // Педиатрия. 2009. № 2. С. 35–39 [Andrianova E.N., Snegireva N.Ju., Ryvkin A.I. Disbioz verhnego otdela respiratornogo trakta i izmenenija funkcional’nogo sostojanija organov dyhanija u chasto bolejushhih detej // Pediatrija. 2009. № 2. S. 35–39 (in Russian)].
32. Булатова Е.М., Богданова Н.М. Значение кишечной микробиоты и пробиотиков для формирования иммунного ответа и здоровья ребенка // Вопросы современной педиатрии. 2010. № 9(6). С. 37–44 [Bulatova E.M., Bogdanova N.M. Znachenie kishechnoj mikrobioty i probiotikov dlja formirovanija immunnogo otveta i zdorov’ja rebenka // Voprosy sovremennoj pediatrii. 2010. № 9 (6). S. 37–44 (in Russian)].
33. West C.E., Renz H., Jenmalm M.C. et al. The gut microbiota and inflammatory non-communicable diseases: associations and potentials for gut microbiota therapies // J Allergy Clin Immunol. 2015. Vol. 135. P. 3–13.
34. Marsland B.J., Salami O. Microbiome influences on allergy in mice and humans // Curr Opinion Immunol. 2015. Vol. 36. P. 94–100.
35. Chen Y.S., Jan R.L., Lin Y.L. et al. Randomized placebo-controlled trial of lactobacillus on asthmatic children with allergic rhinitis // Ped Pulmonol. 2010. Vol. 45. P. 1111–1120.
36. Zuccotti G., Meneghin F., Aceti A. et al. Probiotics for prevention of atopic diseases in infants: systematic review and meta-analysis // Allergy. 2015. Vol. P. 701356–701371.
37. Лахтин М.В., Лахтин В.М., Афанасьев С.С. Лектины: в растворах и сорбированные, активные и латентные, системные и сетевые, флюоресцентные и хемилюминесцентные, в регуляции сборок и деградации, синергистические и синбиотические // Здоровье и образование в XXI веке. 2014. Т. 16. № 3. С. 64–68 [Lahtin M.V., Lahtin V.M., Afanas’ev S.S. Lektiny: v rastvorah i sorbirovannye, aktivnye i latentnye, sistemnye i setevye, fljuorescentnye i hemiljuminescentnye, v reguljacii sborok i degradacii, sinergisticheskie i sinbioticheskie // Zdorov’e i obrazovanie v XXI veke. 2014. T. 16. № 3. S. 64–68 (in Russian)].
38. Лахтин М.В., Лахтин В.М., Афанасьев С.С, Алешкин В.А. Мукозальный иммунитет против патогенов и опухолей с участием системы «Лектины пробиотиков — Гликополимеры» // Бюллетень ВСНЦ СО РАМН. 2015. № 3. С. 62–69 ([Lahtin M.V., Lahtin V.M., Afanas’ev S.S, Aleshkin V.A. Mukozal’nyj immunitet protiv patogenov i opuholej s uchastiem sistemy «Lektiny probiotikov — Glikopolimery» // Byulleten’ VSNC SO RAMN. 2015. № 3. S. 62–69 (in Russian)].
39. Лахтин М.В., Лахтин В.М., Афанасьев С.С. Кофункционирование защитных систем: мукозальный иммунитет и система комплемента человека // Бюллетень ВСНЦ СО РАМН. 2015. № 5(105). С. 113–122 [Lahtin M.V., Lahtin V.M., Afanas’ev S.S. Kofunkcionirovanie zashhitnyh sistem: mukozal’nyj immunitet i sistema komplementa cheloveka // Bjulleten’ VSNC SO RAMN. 2015. № 5(105). S. 113–122 (in Russian)].
40. Sánchez B., González-Rodríguez I., Arboleya S. et al. The Effects of Bifidobacterium breve on Immune Mediators and Proteome of HT29 Cells Monolayers // BioMed Research International. Vol. 2015. Article ID 479140. 6 p.
41. Бондаренко В.М. Обоснование и тактика назначения в медицинской практике различных форм пробиотических препаратов // Фарматека. 2012. № 13. С. 77–87 [Bondarenko V.M. Obosnovanie i taktika naznachenija v medicinskoj praktike razlichnyh form probioticheskih preparatov // Farmateka. 2012. № 13. S. 77–87 (in Russian)].
42. Бондаренко В.М., Рыбальченко О.В. Анализ профилактического и лечебного действия пробиотических препаратов с позиций новых научных технологий // Журнал микробиологии, эпидемиологии и иммунобиологии. 2015. № 2. С. 90–104 [Bondarenko V.M., Rybal’chenko O.V. Analiz profilakticheskogo i lechebnogo dejstvija probioticheskih preparatov s pozicij novyh nauchnyh tehnologij // Zhurnal mikrobiologii, jepidemiologii i immunobiologii. 2015. № 2. S. 90–104 (in Russian)].
43. Корниенко Е.А., Мазанкова Л.Н., Горелов А.В., Ших Е.В., Намазова-Баранова Л.С., Беляева И.А. Применение пробиотиков в педиатрии: анализ лечебного и профилактического действия с позиций доказательной медицины // Лечащий врач. 2015. № 9. С. 52–61 [Kornienko E.A., Mazankova L.N., Gorelov A.V., Shih E.V., Namazova-Baranova L.S., Beljaeva I.A. Primenenie probiotikov v pediatrii: analiz lechebnogo i profilakticheskogo dejstvija s pozicij dokazatel’noj mediciny // Lechashhij vrach. 2015. № 9. S. 52–61 (in Russian)].
44. Guarino A., Ashkenazi S., Gendrel D. et al. ESPGHAN/European Pediatric Infectious Disease evidence-based guidelines for the management of acute gastroenteritis in children in Europe, update 2014 // J. Pediatr. Gastroenterol. Nutr. 2014. Vol. 59 (1). P. 132–152.
45. Корниенко Е.А., Дроздова С.Н., Серебряная Н.Б. Пробиотики как способ повышения эффективности эрадикации Helicobacter pylori у детей // Фарматека. 2005. № 7. С. 68–70 [Kornienko E.A., Drozdova S.N., Serebrjanaja N.B. Probiotiki kak sposob povyshenija jeffektivnosti jeradikacii Helicobacter pylori u detej // Farmateka. 2005. № 7. S. 68–70 (in Russian)].
46. Горелов А.В., Усенко Д.В., Елезова Л.И., Буркин А.В. Оценка эффективности пробиотического продукта, содержащего L. casei DN-114001, в терапии острых кишечных инфекций у детей // Эпидемиология и инфекционные болезни. 2005. № 4. С. 52–56 [Gorelov A.V., Usenko D.V., Elezova L.I., Burkin A.V. Ocenka jeffektivnosti probioticheskogo produkta, soderzhashhego L. casei DN-114001, v terapii ostryh kishechnyh infekcij u detej // Jepidemiologija i infekcionnye bolezni. 2005. № 4. S. 52–56 (in Russian)].
47. Mohan R., Koebnick C., Schildt J., Mueller M., Radke M., Blaut M. Effects of Bifidobacterium lactis Bb12 supplementation on body weight, fecal pH, acetate, lactate, calprotectin, and IgA in preterm infants // Pediatr. Res. 2008. Vol. 64(4). P. 418–422.
48. Ruiz P.A., Hoffmann M., Szcesny S., Blaut M., Haller D. Innate mechanisms for Bifidobacterium lactis to activate transient pro-inflammatory host responses in intestinal epithelial cells after the colonization of germ-free rats // Immunology. 2005. Vol. 115. P. 441–5010.
49. Mohan R., Koebnick C., Schildt J., Schmidt S., Mueller M., Possner M. et al. Effects of Bifidobacterium lactis Bb12 supplementation on intestinal microbiota of preterm infants: a double-blind, placebo-controlled, randomized study // J. Clin. Microbiol. 2006. Vol. 44(11). P. 4025–4031.
50. Miettinen M., Vuopio-Varkila J., Varkila K. Production of human tumor necrosis factor alpha, interleukin-6, and interleukin-10 is induced by lactic acid bacteria // Infect. Immun. 1996. Vol. 64. P. 5403–5405.
51. Leyer G.J., Li S., Mubasher M.E. et al. Probiotic effects on cold and influenza-like symptom incidence and duration in children // Pediatrics. 2009. 124. P. 172–179.
52. Merenstein D., Murphy M., Fokar A. et al. Use of a fermented dairy probiotic drink containing Lactobacillus casei (DN-114 001) to decrease the rate of illness in kids: the DRINK study. A patient-oriented, double-blind, clusterrandomized, placebo-controlled, clinical trial // Eur. J. Clin. Nutr. 2010. Vol. 64. P. 669–677.
53. Cox A.J., Pyne D.B., Saunders P.U. et al. Oral administration of the probiotic Lactobacillus fermentum VRI-003 and mucosal immunity in endurance athletes // Br. J. Sports Med. 2008. Vol. 44. P. 222–226.
54. Бородулина Т.В., Санникова Н.Е., Малямова Л.Н. Инновации в питании как фактор снижения риска алиментарно-зависимых заболеваний у детей раннего возраста // Вопросы современной педиатрии. 2011. № 4. С. 73–76 [Borodulina T.V., Sannikova N.E., Maljamova L.N. Innovacii v pitanii kak faktor snizhenija riska alimentarno-zavisimyh zabolevanij u detej rannego vozrasta // Voprosy sovremennoj pediatrii. 2011. № 4. S. 73–76 (in Russian)].
2. Острые респираторные заболевания у детей: лечение и профилактика // Научно-практическая программа Союза педиатров России. М.: Международный фонд охраны здоровья матери и ребенка. 2002. 69 с. [Ostrye respiratornye zabolevanija u detej: lechenie i profilaktika // Nauchno-prakticheskaja programma Sojuza pediatrov Rossii. M.: Mezhdunarodnyj fond ohrany zdorov’ja materi i rebenka. 2002. 69 s. (in Russian)].
3. Блохин Б.М. Заболевания органов дыхания у детей. В кн.: Практическое руководство по детским болезням. Т. 9 / под общей редакцией В.Ф. Коколиной и А.Т. Румянцева. М.: Медпрактика, 2007. 616 с. [Blohin B.M. Zabolevanija organov dyhanija u detej. V kn.: Prakticheskoe rukovodstvo po detskim boleznjam. T. 9 / pod obshhej redakciej V.F. Kokolinoj i A.T. Rumjanceva. M.: Medpraktika, 2007. 616 s. (in Russian)].
4. Геппе Н.А. Комбинированная терапия бронхиальной обструкции у детей // Лечащий врач. 2009. № 6. С. 34–39 [Geppe N.A. Kombinirovannaja terapija bronhial’noj obstrukcii u detej // Lechashhij vrach. 2009. № 6. S. 34–39 (in Russian)].
5. Учайкин В.Ф. Диагностика, лечение и профилактика гриппа и острых респираторных заболеваний у детей. Пособие для врачей. М., 2001. 16 с. [Uchajkin V. F. Diagnostika, lechenie i profilaktika grippa i ostryh respiratornyh zabolevanij u detej. Posobie dlja vrachej. M., 2001. 16 s. (in Russian)].
6. Грипп (сезонный, птичий, пандемический) и другие ОРВИ / под ред. проф. В.П. Малого, проф. М.А. Андрейчина. М.: ГЭОТАР-Медиа, 2013. 319 с. [Gripp (sezonnyj, ptichij, pandemicheskij) i drugie ORVI / pod red. prof. V.P. Malogo, prof. M.A. Andrejchina. M.: GJeOTAR-Media, 2013. 319 s. (in Russian)].
7. Львов Д.К., Альховский С.В., Щетинин А.М., Щелканов М.Ю. Буньявирусы (Bunyaviridae) // Руководство по вирусологии. Вирусы и вирусные инфекции человека и животных / под ред. Д.К. Львова. М.: МИА, 2013. С. 279–298 [L’vov D.K., Al’hovskij S.V., Shhetinin A.M., Shhelkanov M.Ju. Bun’javirusy (Bunyaviridae) // Rukovodstvo po virusologii. Virusy i virusnye infekcii cheloveka i zhivotnyh / pod red. D.K. L’vova. M.: MIA, 2013. S. 279–298 (in Russian)].
8. Рекомендации «О мерах по профилактике в отношении предполагаемых или подтвержденных случаев заболеваний, вызванных новой коронавирусной инфекцией». Письмо от 6.03.2013 №01/2440-13-32 [Rekomendacii «O merah po profilaktike v otnoshenii predpolagaemyh ili podtverzhdennyh sluchaev zabolevanij, vyzvannyh novoj koronavirusnoj infekciej». Pis’mo ot 6.03.2013 №01/2440-13-32 (in Russian)].
9. Петрова С.И., Панютина Я.В. Патогенетическая терапия респираторных заболеваний у детей // Педиатрия. 2015. № 94(2). С. 193–198 [Petrova S.I., Panjutina Ja.V. Patogeneticheskaja terapija respiratornyh zabolevanij u detej // Pediatrija. 2015. № 94(2). S. 193–198 (in Russian)].
10. Ярилин А.А. Иммунология: учебник. М.: ГЭОТАР-Медиа, 2010. 752 с. [Jarilin А.А. Immunologija: uchebnik. M.: GJeOTAR-Media, 2010. 752 s. (in Russian)].
11. Климов В.В. Мукозальная иммунная система / Эл. доступ. http://ssmu.immunology.sibhost.ru/IM/MALT.pdf. Просмотрено 27.01.2018 [Klimov V.V. Mukozal’naja immunnaja sistema / Jel. dostup. http://ssmu.immunology.sibhost.ru/IM/MALT.pdf. Prosmotreno 27.01.2018 (in Russian)].
12. Ruane D., Brane L., Reis B.S. et al. Lung dendritic cells induce migration of protective T cells to the gastrointestinal tract // J Exp Med. 2013. Vol. 210. P. 1871–1888.
13. Eksteen B., Grant A.J., Miles A. et al. Hepatic endothelial CCL25 mediates the recruitment of CCR9 + gut-homing lymphocytes to the liver in primary sclerosing cholangitis // J Exp Med. 2004. Vol. 200. P. 1511–1517.
14. Campbell D.J., Butcher E.C. Rapid acquisition of tissue-specific homing phenotypes by CD4(+) T cells activated in cutaneous or mucosal lymphoid tissues // J Exp Med 2002. Vol. 195. P. 135–141.
15. Liu Y., Wang X.Y., Yang X. et al. Lung and intestine: a specific link in an ulcerative colitis rat model // Gastroenterol Res Practice. Vol. 2013. Article ID 124530. 13 p.
16. Kunkel E.J., Kim C.H., Lazarus N.H. et al. CCR10 expression is a common feature of circulating and mucosal epithelial tissue IgA Ab-secreting cells // J Clin Invest 2003. Vol. 111. P. 1001–1010.
17. Цывкина А.А., Лусс Л.В., Царев С.В. Мукозальный иммунитет при патологии верхних дыхательных путей // Российский аллергологический журнал. 2011. № 2. С. 22–26 [Cyvkina A.A., Luss L.V., Carev S.V. Mukozal’nyj immunitet pri patologii verhnih dyhatel’nyh putej // Rossijskij Allergologicheskij Zhurnal. 2011. № 2. S. 22–26 (in Russian)].
18. Schuijt T.J., Lankelma J.M., Scicluna B.P. et al. The gut microbiota plays a protective role in the host defence against pneumococcal pneumonia // Gut. 2016. Vol. 65(4). P. 575–583.
19. Samuelson D.R., Welsh D.A., Shellito J.E. Regulation of lung immunity and host defense by the intestinal microbiota // Frontiers Microbiol. 2015. Vol. 6. P. 1085.
20. Bienenstock J., McDermott M., Befus D., O’Neill M. A common mucosal immunologic system involving the bronchus, breast and bowel // Adv. Exp. Med. Biol. 1978. Vol. 107. P. 53–59.
21. Tulic M.K., Piche T., Verhasselt V. Lung–gut cross-talk: evidence, mechanisms and implications for the mucosal inflammatory diseases // Clinical and Experimental Allergy. 2016. Vol. 46. P. 519–528.
22. Zuercher A.W., Jiang H.Q., Thurnheer M.C. et al. Distinct mechanisms for cross-protection of the upper versus lower respiratory tract through intestinal priming // J Immunol 2002. Vol. 169. P. 3920–3925.
23. Fireman Z., Osipov A., Kivity S. et al. The use of induced sputum in the assessment of pulmonary involvement in Crohn’s disease // Am J Gastroenterol. 2000. Vol. 95. Р. 730–734.
24. Liu Y.J. Thymic stromal lymphopoietin: master switch for allergic inflammation // J Exp Med. 2006. Vol. 203. P. 269–273.
25. Ichinohe T., Pang I.K., Kumamoto Y. et al. Microbiota regulates immune defense against respiratory tract influenza A virus infection // PNAS. 2011. Vol. 108. P. 5354–5359.
26. Zhang Z., Hener P., Frossard N. et al. Thymic stromal lymphopoietin overproduced by keratinocytes in mouse skin aggravates experimental asthma // PNAS. 2009. Vol. 106. P. 1536–1541.
27. Хаитов Р.М. Иммунология. М.: ГЭОТАР-Медиа, 2013. 521 с. [Haitov R.M. Immunologija. M.: GJeOTAR-Media, 2013. 521 s. (in Russian)].
28. Potta J., Mahlakõiv T., Mordstein M. IFN-λ determines the intestinal epithelial antiviral host defense // PNAS. 2011. Vol. 108. № 19. P. 7944–7949.
29. Извин А.И., Катаева Л.В. Микробный пейзаж слизистой оболочки верхних дыхательных путей в норме и патологии // Вестник оториноларингологии. 2009. № 2. С. 65–68 [Izvin A.I., Kataeva L.V. Mikrobnyj pejzazh slizistoj obolochki verhnih dyhatel’nyh putej v norme i patologii // Vestnik otorinolaringologii. 2009. № 2. S. 65–68 (in Russian)].
30. Алешкин В.А., Афанасьев С.С., Караулов А.В. Микробиоценозы и здоровье человека. М.: Династия, 2015. 548 с. [Aleshkin V.A., Afanas’ev S.S., Karaulov A.V. Mikrobiocenozy i zdorov’e cheloveka. M.: Dinastija, 2015. 548 s. (in Russian)].
31. Андрианова Е.Н., Снегирева Н.Ю., Рывкин А.И. Дисбиоз верхнего отдела респираторного тракта и изменения функционального состояния органов дыхания у часто болеющих детей // Педиатрия. 2009. № 2. С. 35–39 [Andrianova E.N., Snegireva N.Ju., Ryvkin A.I. Disbioz verhnego otdela respiratornogo trakta i izmenenija funkcional’nogo sostojanija organov dyhanija u chasto bolejushhih detej // Pediatrija. 2009. № 2. S. 35–39 (in Russian)].
32. Булатова Е.М., Богданова Н.М. Значение кишечной микробиоты и пробиотиков для формирования иммунного ответа и здоровья ребенка // Вопросы современной педиатрии. 2010. № 9(6). С. 37–44 [Bulatova E.M., Bogdanova N.M. Znachenie kishechnoj mikrobioty i probiotikov dlja formirovanija immunnogo otveta i zdorov’ja rebenka // Voprosy sovremennoj pediatrii. 2010. № 9 (6). S. 37–44 (in Russian)].
33. West C.E., Renz H., Jenmalm M.C. et al. The gut microbiota and inflammatory non-communicable diseases: associations and potentials for gut microbiota therapies // J Allergy Clin Immunol. 2015. Vol. 135. P. 3–13.
34. Marsland B.J., Salami O. Microbiome influences on allergy in mice and humans // Curr Opinion Immunol. 2015. Vol. 36. P. 94–100.
35. Chen Y.S., Jan R.L., Lin Y.L. et al. Randomized placebo-controlled trial of lactobacillus on asthmatic children with allergic rhinitis // Ped Pulmonol. 2010. Vol. 45. P. 1111–1120.
36. Zuccotti G., Meneghin F., Aceti A. et al. Probiotics for prevention of atopic diseases in infants: systematic review and meta-analysis // Allergy. 2015. Vol. P. 701356–701371.
37. Лахтин М.В., Лахтин В.М., Афанасьев С.С. Лектины: в растворах и сорбированные, активные и латентные, системные и сетевые, флюоресцентные и хемилюминесцентные, в регуляции сборок и деградации, синергистические и синбиотические // Здоровье и образование в XXI веке. 2014. Т. 16. № 3. С. 64–68 [Lahtin M.V., Lahtin V.M., Afanas’ev S.S. Lektiny: v rastvorah i sorbirovannye, aktivnye i latentnye, sistemnye i setevye, fljuorescentnye i hemiljuminescentnye, v reguljacii sborok i degradacii, sinergisticheskie i sinbioticheskie // Zdorov’e i obrazovanie v XXI veke. 2014. T. 16. № 3. S. 64–68 (in Russian)].
38. Лахтин М.В., Лахтин В.М., Афанасьев С.С, Алешкин В.А. Мукозальный иммунитет против патогенов и опухолей с участием системы «Лектины пробиотиков — Гликополимеры» // Бюллетень ВСНЦ СО РАМН. 2015. № 3. С. 62–69 ([Lahtin M.V., Lahtin V.M., Afanas’ev S.S, Aleshkin V.A. Mukozal’nyj immunitet protiv patogenov i opuholej s uchastiem sistemy «Lektiny probiotikov — Glikopolimery» // Byulleten’ VSNC SO RAMN. 2015. № 3. S. 62–69 (in Russian)].
39. Лахтин М.В., Лахтин В.М., Афанасьев С.С. Кофункционирование защитных систем: мукозальный иммунитет и система комплемента человека // Бюллетень ВСНЦ СО РАМН. 2015. № 5(105). С. 113–122 [Lahtin M.V., Lahtin V.M., Afanas’ev S.S. Kofunkcionirovanie zashhitnyh sistem: mukozal’nyj immunitet i sistema komplementa cheloveka // Bjulleten’ VSNC SO RAMN. 2015. № 5(105). S. 113–122 (in Russian)].
40. Sánchez B., González-Rodríguez I., Arboleya S. et al. The Effects of Bifidobacterium breve on Immune Mediators and Proteome of HT29 Cells Monolayers // BioMed Research International. Vol. 2015. Article ID 479140. 6 p.
41. Бондаренко В.М. Обоснование и тактика назначения в медицинской практике различных форм пробиотических препаратов // Фарматека. 2012. № 13. С. 77–87 [Bondarenko V.M. Obosnovanie i taktika naznachenija v medicinskoj praktike razlichnyh form probioticheskih preparatov // Farmateka. 2012. № 13. S. 77–87 (in Russian)].
42. Бондаренко В.М., Рыбальченко О.В. Анализ профилактического и лечебного действия пробиотических препаратов с позиций новых научных технологий // Журнал микробиологии, эпидемиологии и иммунобиологии. 2015. № 2. С. 90–104 [Bondarenko V.M., Rybal’chenko O.V. Analiz profilakticheskogo i lechebnogo dejstvija probioticheskih preparatov s pozicij novyh nauchnyh tehnologij // Zhurnal mikrobiologii, jepidemiologii i immunobiologii. 2015. № 2. S. 90–104 (in Russian)].
43. Корниенко Е.А., Мазанкова Л.Н., Горелов А.В., Ших Е.В., Намазова-Баранова Л.С., Беляева И.А. Применение пробиотиков в педиатрии: анализ лечебного и профилактического действия с позиций доказательной медицины // Лечащий врач. 2015. № 9. С. 52–61 [Kornienko E.A., Mazankova L.N., Gorelov A.V., Shih E.V., Namazova-Baranova L.S., Beljaeva I.A. Primenenie probiotikov v pediatrii: analiz lechebnogo i profilakticheskogo dejstvija s pozicij dokazatel’noj mediciny // Lechashhij vrach. 2015. № 9. S. 52–61 (in Russian)].
44. Guarino A., Ashkenazi S., Gendrel D. et al. ESPGHAN/European Pediatric Infectious Disease evidence-based guidelines for the management of acute gastroenteritis in children in Europe, update 2014 // J. Pediatr. Gastroenterol. Nutr. 2014. Vol. 59 (1). P. 132–152.
45. Корниенко Е.А., Дроздова С.Н., Серебряная Н.Б. Пробиотики как способ повышения эффективности эрадикации Helicobacter pylori у детей // Фарматека. 2005. № 7. С. 68–70 [Kornienko E.A., Drozdova S.N., Serebrjanaja N.B. Probiotiki kak sposob povyshenija jeffektivnosti jeradikacii Helicobacter pylori u detej // Farmateka. 2005. № 7. S. 68–70 (in Russian)].
46. Горелов А.В., Усенко Д.В., Елезова Л.И., Буркин А.В. Оценка эффективности пробиотического продукта, содержащего L. casei DN-114001, в терапии острых кишечных инфекций у детей // Эпидемиология и инфекционные болезни. 2005. № 4. С. 52–56 [Gorelov A.V., Usenko D.V., Elezova L.I., Burkin A.V. Ocenka jeffektivnosti probioticheskogo produkta, soderzhashhego L. casei DN-114001, v terapii ostryh kishechnyh infekcij u detej // Jepidemiologija i infekcionnye bolezni. 2005. № 4. S. 52–56 (in Russian)].
47. Mohan R., Koebnick C., Schildt J., Mueller M., Radke M., Blaut M. Effects of Bifidobacterium lactis Bb12 supplementation on body weight, fecal pH, acetate, lactate, calprotectin, and IgA in preterm infants // Pediatr. Res. 2008. Vol. 64(4). P. 418–422.
48. Ruiz P.A., Hoffmann M., Szcesny S., Blaut M., Haller D. Innate mechanisms for Bifidobacterium lactis to activate transient pro-inflammatory host responses in intestinal epithelial cells after the colonization of germ-free rats // Immunology. 2005. Vol. 115. P. 441–5010.
49. Mohan R., Koebnick C., Schildt J., Schmidt S., Mueller M., Possner M. et al. Effects of Bifidobacterium lactis Bb12 supplementation on intestinal microbiota of preterm infants: a double-blind, placebo-controlled, randomized study // J. Clin. Microbiol. 2006. Vol. 44(11). P. 4025–4031.
50. Miettinen M., Vuopio-Varkila J., Varkila K. Production of human tumor necrosis factor alpha, interleukin-6, and interleukin-10 is induced by lactic acid bacteria // Infect. Immun. 1996. Vol. 64. P. 5403–5405.
51. Leyer G.J., Li S., Mubasher M.E. et al. Probiotic effects on cold and influenza-like symptom incidence and duration in children // Pediatrics. 2009. 124. P. 172–179.
52. Merenstein D., Murphy M., Fokar A. et al. Use of a fermented dairy probiotic drink containing Lactobacillus casei (DN-114 001) to decrease the rate of illness in kids: the DRINK study. A patient-oriented, double-blind, clusterrandomized, placebo-controlled, clinical trial // Eur. J. Clin. Nutr. 2010. Vol. 64. P. 669–677.
53. Cox A.J., Pyne D.B., Saunders P.U. et al. Oral administration of the probiotic Lactobacillus fermentum VRI-003 and mucosal immunity in endurance athletes // Br. J. Sports Med. 2008. Vol. 44. P. 222–226.
54. Бородулина Т.В., Санникова Н.Е., Малямова Л.Н. Инновации в питании как фактор снижения риска алиментарно-зависимых заболеваний у детей раннего возраста // Вопросы современной педиатрии. 2011. № 4. С. 73–76 [Borodulina T.V., Sannikova N.E., Maljamova L.N. Innovacii v pitanii kak faktor snizhenija riska alimentarno-zavisimyh zabolevanij u detej rannego vozrasta // Voprosy sovremennoj pediatrii. 2011. № 4. S. 73–76 (in Russian)].

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
