Клинические особенности хронического гепатита В у детей в зависимости от ответа на терапию
DOI: 10.32364/2587-6821-2020-4-11-682-686
Введение: хронические гепатиты являются распространенной инфекцией во всех возрастных группах. Оптимизация терапевтических подходов является актуальной медико-социальной проблемой.
Цель исследования: выявить клинико-лабораторные особенности хронического гепатита В (ХГВ) у детей в зависимости от эффективности противовирусной терапии.
Материал и методы: в исследование включен 31 ребенок в возрасте от 3 до 17 лет с НBeAg-негативным ХГВ, пациенты находились на стационарном лечении на базе детского инфекционного отделения ГБУЗ СО «СГКБ № 2 имени Н.А. Семашко» г. Самары, затем оставались на диспансеризации в детском гепатологическом центре. Дети ранее не получали противовирусной терапии (ПВТ). Проанализирована эффективность ПВТ и исходы ХГВ в течение 6-летнего периода.
Результаты исследования: рассмотрена динамика клинических, биохимических показателей у детей с ХГВ в зависимости от ответа на ПВТ. Больным назначалась ПВТ согласно «Протоколу диагностики и лечения больных вирусными гепатитами В и С» (2010). У 14 детей (45,2%), получавших терапию, через 48 нед. достигнут устойчивый вирусологический ответ (УВО). В ходе 6-летнего наблюдения в этой группе детей с УВО формирования фиброза печени не наблюдалось. В группе без УВО (n=17) после ПВТ ХГВ за 6-летний период наблюдения выявлен 1 случай фиброза 1-й степени и цирроз печени класса А у 2 больных.
Заключение: несмотря на проводимую вакцинацию населения страны против вируса гепатита В, заболеваемость ХГВ остается актуальной проблемой, поэтому сохраняется необходимость разработки новых подходов к его диагностике и терапии.
Ключевые слова: хронический гепатит В, дети, противовирусная терапия, вирусологический ответ.
Для цитирования: Чурбакова О.В., Акимкин В.Г., Печкуров Д.В. Клинические особенности хронического гепатита В у детей в зависимости от ответа на терапию. РМЖ. Медицинское обозрение. 2020;4(11):682-686. DOI: 10.32364/2587-6821-2020-4-11-682-686.
O.V. Churbakovа1, V.G. Akimkin2, D.V. Pechkurov1
1Samara State Medical University, Samara, Russian Federation
2Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being, Moscow, Russian Federation
Background: chronic hepatitis is a common infection in all age groups. The optimization of therapeutic approaches is an important medical social and national economic issue.
Aim: to describe the clinical and laboratory features of chronic hepatitis B (CHB) in children depending on the efficacy of antiviral therapy.
Patients and Methods: 31 children aged 3–17 years with НBeAg-negative CHB who were treated in the Children’s Infectious Department of N.A. Semashko Samara City Clinical Hospital No. 2 and then monitored in a children’s hepatological center were enrolled. These children received no prior antiviral treatment. The efficacy of antivirals and CHB outcomes over a 6-year period were evaluated.
Results: the changes in clinical and biochemical parameters in children with CHB depending on treatment response were analyzed. All children were prescribed with antiviral therapy according to Diagnosis and Treatment Protocol for Hepatitis B and C (2010). In 14 (45.2%) children who received antiviral therapy, sustained virologic response was achieved after 48 weeks. In these children, no cases of liver fibrosis were reported over a 6-year period. Meanwhile, in the group without sustained virologic response after antiviral therapy (n=17), 1 patient was diagnosed with liver fibrosis stage 1 and 2 patients were diagnosed with Child class A cirrhosis.
Conclusion: despite countrywide HBV vaccination, the incidence of CHB is still high thus requiring the development of novel diagnostic and therapeutic strategies.
Keywords: chronic hepatitis B, children, differential therapy, viral host response, prognosis.
For citation: Churbakovа O.V., Akimkin V.G., Pechkurov D.V. Clinical features of chronic B hepatitis in children depending on treatment response. Russian Medical Inquiry. 2020;4(11):682–686. DOI: 10.32364/2587-6821-2020-4-11-682-686.
Введение
Вирусный гепатит по распространенности занимает 2-е место в мире после гриппа и острых респираторных инфекций [1]. По данным Всемирной организации здравоохранения, около 325 млн человек в мире живут с хронической инфекцией, вызванной вирусом гепатита B (ВГВ) или вирусом гепатита C [2]. Хронический гепатит В (ХГВ) остается одной из основных проблем здравоохранения как в Российской Федерации, так и во всем мире [3]. Сложность лечения ХГВ связана с невозможностью полного подавления вирусной репликации, т. к. ДНК ВГВ внедряется в геном больного человека [4]. Перспективы применения новых терапевтических подходов позволяют надеяться на существенное улучшение результатов лечения [5]. По сей день продолжаются поиски эффективных методов лечения хронического гепатита, способных позитивно влиять на регенерацию гепатоцитов и уменьшать степень фиброза печени [6]. В настоящее время установлен целый ряд различных факторов, позволяющих прогнозировать ответ на терапию и контролировать естественное течение болезни, что, безусловно, расширяет возможности успешного лечения [7].
Цель исследования: выявить клинико-лабораторные особенности ХГВ у детей в зависимости от эффективности противовирусной терапии (ПВТ).
Материал и методы
В исследовании принял участие 31 ребенок в возрасте от 12 до 17 лет — НBeAg-негативные больные ХГВ, которые впервые находились на лечении в детском инфекционном отделении ГБУЗ СО «СГКБ № 2 имени Н.А. Семашко» г. Самары с 2012 по 2014 г. и не получали ранее ПВТ. Средний возраст больных составил 15,4±0,74 года. Так как общепринятый «Стандарт медицинской помощи больным хроническим гепатитом В, хроническим гепатитом С» (2004) не предусматривает различия в критериях диагностики, лечения, дозах и курсе препаратов для разных возрастов, в нашем исследовании не было разделения на группы по возрастному признаку.
Диагноз ХГВ устанавливался на основании жалоб, осмотра, с учетом данных комплексных лабораторных исследований (методами иммуноферментного анализа и полимеразной цепной реакции), уровня ДНК ВГВ в крови согласно «Протоколу диагностики и лечения больных вирусными гепатитами В и С» (2010) [8].
Критериями включения пациентов в исследование были установление диагноза ХГВ, длительность наблюдения не менее 1 года, отсутствие противовирусного лечения в анамнезе, согласие родителей на ПВТ.
Критерии исключения: отказ родителей от участия в исследовании, психические заболевания, аутоиммунный гепатит или другое аутоиммунное заболевание, заболевания щитовидной железы; возраст до 3 лет, гиперчувствительность к препаратам базисной терапии, гемоглобинопатии (например, талассемия, серповидно-клеточная анемия), хроническая почечная недостаточность, цирроз печени с наличием печеночной недостаточности (индекс Чайлд — Пью ≥6).
Детям назначалась ПВТ: интерферон (ИФН) α-2b в дозе 3 млн МЕ 3 р/нед. согласно «Протоколу диагностики и лечения больных вирусными гепатитами В и С» (2010) [8]. Через 24 нед. оценивали ранний вирусологический ответ, при отсутствии вирусной нагрузки терапия ИФН α-2b продолжалась до 48 нед. Через 24 нед. при положительном уровне ДНК ВГВ больным назначался ИФН α-2b в дозе 3 млн МЕ 3 р/нед. + ламивудин 100 мг. Эффективность лечения больных оценивалась через 48 нед. по достижению устойчивого вирусологического ответа (УВО). Проводилась оценка переносимости терапии и частоты возникновения нежелательных явлений (НЯ) на фоне ПВТ.
Статистический анализ проводился при помощи современных инструментов Statgraphics Plus for Windows версии 4.0 (США) и Statistica for Windows версии 8.0 (США). Для оформления результатов исследований применялись пакеты из системы Microsoft Officе, 2010 (США). Достоверность различий между данными в группах проверялась на основе расчета критерия Стьюдента. Определялись основные вероятностные показатели: среднеквадратическое отклонение, доверительный интервал (по критерию Стьюдента). Вычисляли средние величины М, среднюю ошибку стандартного отклонения m, критерий Стьюдента t, вероятность различия р. Разницу считали достоверной при р<0,05. За достоверные результаты принимались результаты с уровнем значимости ≤0,05 (95% доверительный интервал).
Результаты исследования
Основной целью назначения терапии при ХГВ является подавление репликации ДНК ВГВ и нормализация уровня аланинаминотрансферазы (АЛТ). Достижение пациентом УВО ассоциируется с практически полным выздоровлением и предотвращает дальнейшее прогрессирование заболевания [9–11].
Было отмечено, что на фоне ПВТ, особенно в начале лечения, у детей проявлялись НЯ (рис. 1).
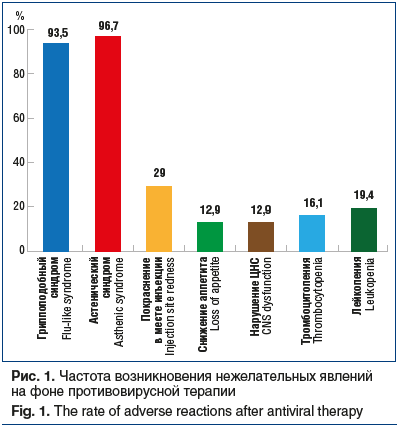
Наиболее часто среди НЯ наблюдались астеновегетативный и гриппоподобный синдромы (93,5% и 96,7% соответственно). Гриппоподобный синдром (лихорадка) купировался приемом нестероидных противовоспалительных препаратов и не требовал отмены ПВТ. Среди прочих НЯ у детей отмечались изменения кожных покровов: сухость, зуд, покраснение в месте инъекций, а также тошнота, рвота, диарея. НЯ при ПВТ у большинства детей были обратимы.
После проведения терапии в течение 24 нед. у больных оценивали вирусологический ответ. На 24-й нед. ПВТ уровень ДНК ВГВ в крови не определялся у 9 больных (29,0%), не достигли ответа на терапию 22 больных (71,0%). 9 пациентов с ранним вирусологическим ответом продолжили стандартную терапию ИФН α-2b (3 млн МЕ 3 р/нед.) до 48 нед.
Согласно «Протоколу диагностики и лечения больных вирусными гепатитами В и С» (2010) [8] при отсутствии раннего вирусологического ответа (уровень ДНК ВГВ ≥2000 МЕ/мл, не достигнут биохимический ответ — уровень АЛТ больше нормы) тактика ведения таких пациентов предполагает дополнение или переход на более активный противовирусный препарат. 22 пациентам с положительным анализом на ДНК ВГВ был назначен рекомбинантный ИФН α-2b в дозе 3 млн МЕ 3 р/нед. и ламивудин 100 мг/сут (или 3 мг на 1 кг веса) в течение еще 24 нед.
Через 48 нед. от начала противовирусной терапии УВО наблюдался у 14 (45,2%) детей, в т. ч. у 5 (16,1%) пациентов, получавших ИФН α-2b + ламивудин в течение 24 нед.
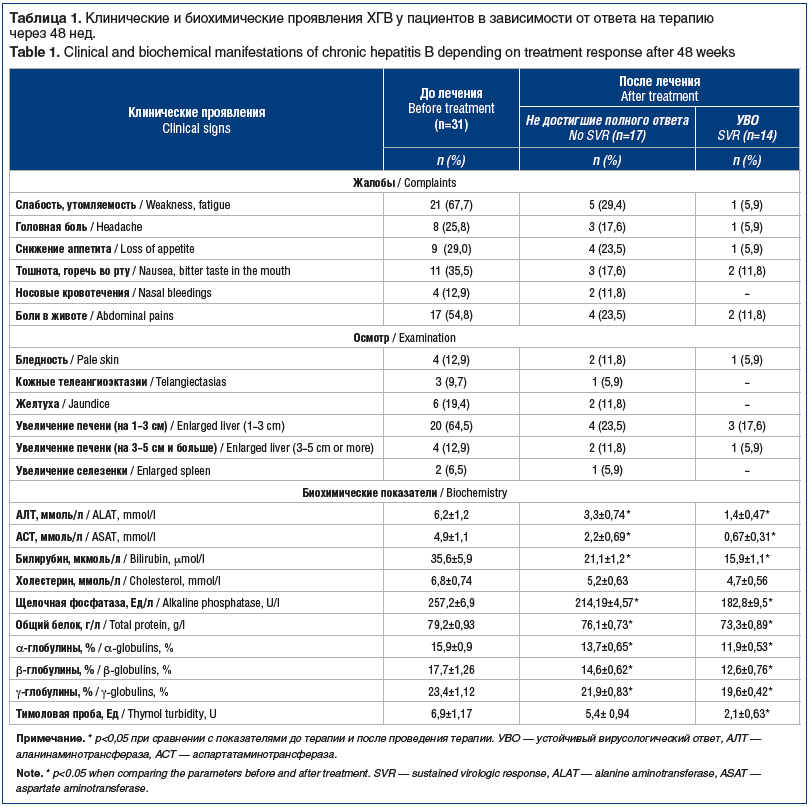
Между группами проводилось сравнение по клиническим и биохимическим параметрам. Нами было проведено сравнение клинических и биохимических проявлений в зависимости от ответа на ПВТ (табл. 1).
Из 31 ребенка высокая вирусная нагрузка ДНК ВГВ ≥2000 МЕ/мл отмечалась у 25 человек (80,6%), низкая вирусная нагрузка ДНК ВГВ ≤2000 МЕ/мл — у 6 детей (19,4%).
Можно отметить положительную динамику клинических и биохимических показателей у больных ХГВ, как достигших, так и не достигших УВО. У достигших УВО отмечалось более значимое снижение показателей АЛТ, АСТ после проведения ПВТ (р<0,05). В целом полученные данные позволяют сделать вывод о том, что ПВТ в любом случае способствует клиническому улучшению.
Более чувствительными маркерами ответа на ПВТ оказались биохимические тесты. При рассмотрении биохимических показателей снижение частоты отклонений от нормы отмечено по всем биохимическим показателям, кроме холестерина. Достоверное снижение тимоловой пробы имело место только в группе детей, достигших полного вирусологического ответа.
Несмотря на то, что большинство клинических симптомов и в случае отсутствия УВО купировались или их выраженность уменьшилась, снизилась активность АЛТ, воспалительный процесс в печени по типу холестатического и мезенхимально-воспалительного синдрома сохраняется.
Через 3 года после завершения противовирусной терапии ХГВ УВО сохранился у 10 (71,4%) детей из 14, а у 4 детей (28,6%) отмечался рецидив заболевания. ДНК ВГВ был повышен у этих 4 детей от 5550 МЕ/л до 8,2 млн МЕ/л. Биохимические отклонения наблюдались у 4 детей с рецидивом ХГВ: уровень АЛТ выше 2 норм и повышение показателей щелочной фосфатазы отмечались у 3 детей, тимоловая проба повышена у всех 4. Формирование фиброза печени в группе больных с УВО в течение 6 лет не наблюдалось.
За период 6-летнего наблюдения из группы детей (n=17), не ответивших на терапию, наблюдалось формирование фиброза 1-й степени у 1 больного. Уровень ДНК ВГВ на момент констатации фиброза достиг 1 млн МЕ/л, биохимические показатели были повышены: билирубин — 28,5 мкмоль/л (норма — 8,6–20,5 мкмоль/л), тимоловая проба — 4 Ед (норма 0–5 Ед), щелочная фосфатаза — 175 Ед/л (норма — 20–120 Ед/л). Цирроз печени в исходе ХГВ наблюдался у 2 больных через 6 лет после ПВТ. Диагноз цирроза выставлен согласно «Классификации тяжести цирроза печени по шкале Child — Pugh». По лабораторным критериям цирроз печени был класса А. У этих пациентов был повышен билирубин — 26,1 мкмоль/л и 24,8 мкмоль/л (норма — 8,6–20,5 мкмоль/л), содержание альбумина составило 56% и 59% (норма — 56–66%), протромбиновый индекс был в пределах нормы — 86% и 89%. У 2 больных выявлялась ДНК ВГВ в количестве 1000 МЕ/л. По результатам УЗИ выявлены повышение эхогенности и неоднородность печени, спленомегалия.
Заключение
Таким образом, через 48 нед. после окончания после ПВТ ХГВ уровень ДНК ВГВ в крови не определялся у 14 больных из 31 (45,2%), рецидив болезни наблюдался у 4 (28,6%) детей. Через 6 лет после лечения УВО отмечался у 10 (32,3%) из группы получавших ПВТ (n=31). Формирование фиброза и цирроза печени наблюдалось только в группе без вирусологического ответа. За 6-летний период наблюдения выставлен диагноз F-1 1 больному, 2 пациентам — цирроз печени в исходе врожденного ХГВ.
Несмотря на проводимую вакцинацию населения страны против ВГВ, заболеваемость ХГВ остается актуальной проблемой, поэтому сохраняется необходимость разработки новых подходов к диагностике и терапии этого заболевания. Продолжается поиск эффективных противовирусных препаратов для терапии ХГВ у детей и подростков.
Сведения об авторах:
Чурбакова Ольга Владимировна — к.м.н., ассистент кафедры управления качеством здравоохранения института профессионального образования ФГБОУ ВО СамГМУ Минздрава России; 443099, Россия, г. Самара, ул. Чапаевская, д. 89; ORCID iD 0000-0003-3723-1542.
Акимкин Василий Геннадьевич — д.м.н., профессор, академик РАН, директор ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, 111123, Россия, г. Москва, ул. Новогиреевская, д. 3А; ORCID iD 0000-0003-4228-9044.
Печкуров Дмитрий Владимирович — д.м.н., профессор, заведующий кафедрой детских болезней ФГБОУ ВО
СамГМУ Минздрава России; 443099, Россия, г. Самара, ул. Чапаевская, д. 89; ORCID iD 0000-0002-5869-2893.
Контактная информация: Чурбакова Ольга Владимировна, е-mail: o_churbakova@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 27.05.2020, поступила после рецензирования 14.06.2020, принята в печать 21.07.2020.
About the authors:
Olga V. Churbakova — Cand. of Sci. (Med.), assistant of the Department of Health Care Quality Management of the Institute of Professional Education, Samara State Medical University, 89, Chapaevskaya str., Samara, 443099, Russian Federation; ORCID iD 0000-0003-3723-1542.
Vasiliy G. Akimkin — Doct. of Sci. (Med.), Professor, Full-Member of RAS, Director, Central Research Institute of Epidemiology of the Russian Federal Service for Supervision of Consumer Rights Protection and Human Well-Being, 3A, Novogireevskaya str., Moscow, 111123, Russian Federation; ORCID iD 0000-0003-4228-9044.
Dmitriy V. Pechkurov — Doct. of Sci. (Med.), Professor, Head of the Department of Children’s Diseases, Samara State Medical University, 89, Chapaevskaya str., Samara, 443099, Russian Federation; ORCID iD 0000-0002-5869-2893.
Contact information: Olga V. Churbakova, е-mail:
o_churbakova@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 27.05.2020, revised 14.06.2020, accepted 21.07.2020.
2. Сковородина С.А., Пасечник О.А., Вайтович М.А. Характеристика заболеваемости вирусными гепатитами В и С населения Омской области. Журнал инфектологии. 2019;11(1):38–39.
3. Шапиева Н.Т., Понежева Ж.Б., Макашова В.В. и др. Современные аспекты хронического гепатита В. Лечащий врач. 2019;5:82–87.
4. Макашова В.В., Омарова Х.Г. Реактивация хронического гепатита В после отмены терапии. РМЖ. 2019;10:50–52.
5. Богомолов П.О., Дубинина Н.В., Буеверов А.О. и др. Критерии отбора больных хроническим гепатитом С с 1 генотипом вируса на терапию стандартным интерфероном альфа. Клинические перспективы в гастроэнтерологии, гепатологии. 2013;5:22–28.
6. Приходько Е.М., Селиверстов П.В., Радченко В.Г. Возможности регенеративной терапии у пациентов с хроническим гепатитом. Материалы 18-го Международного медицинского Славяно-Балтийского научного форума «Санкт-Петербург — Гастро-2016» (16–18 мая 2016 г.). Санкт-Петербург; 2016.
7. Сапронов Г.В., Николаева Л.И. Новые перспективы персонифицированной терапии хронического вирусного гепатита С. Эпидемиология и инфекционные болезни. 2013;3:27–36.
8. Ющук Н.Д., Климова Е.А., Знойко О.О. и др. Протокол диагностики и лечения больных вирусными гепатитами В и С. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2010;6:4–60.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
