Болезнь Уиппла: обзор литературы и клиническое наблюдение
Рубрика:
Инфекционные болезни
Иммунология
Болезнь Уиппла (БУ) — редкое хроническое системное заболевание инфекционного генеза, вызванное грамположительной бактерией Tropheryma whipplei (TW). Первичное инфицирование TW происходит фекально-оральным или орально-
оральным путем в раннем детстве и протекает бессимптомно или с клиникой быстро купируемого гастроэнтерита, пневмонии, с последующей элиминацией возбудителя. В статье представлен клинический случай диагностированной БУ. Проведено сопоставление собственного клинического наблюдения с данными литературы. Особенность БУ у больного 36 лет выразилась в лихорадке, резком похудании, генерализованной лимфаденопатии, в т. ч. забрюшинных лимфатических узлов, при отсутствии суставного и гастроинтестинального синдромов. Это требовало проведения дифференциальной диагностики с инфекционными, лимфопролиферативными заболеваниями. Диагноз был установлен через год от начала болезни при выявлении PAS-положительных макрофагов в слизистой оболочке тонкой кишки. Своевременно начатая терапия цефтриаксоном в течение 14 дней, поддерживающая терапия триметоприм-сульфаметоксазолом (160 мг/800 г в сутки) внутрь привели к положительной клинико-лабораторной динамике за 9 мес., уменьшению PAS-положительных макрофагов в кишечнике.
Ключевые слова: болезнь Уиппла, лимфаденопатия забрюшинных лимфатических узлов, PAS-положительные макрофаги.
оральным путем в раннем детстве и протекает бессимптомно или с клиникой быстро купируемого гастроэнтерита, пневмонии, с последующей элиминацией возбудителя. В статье представлен клинический случай диагностированной БУ. Проведено сопоставление собственного клинического наблюдения с данными литературы. Особенность БУ у больного 36 лет выразилась в лихорадке, резком похудании, генерализованной лимфаденопатии, в т. ч. забрюшинных лимфатических узлов, при отсутствии суставного и гастроинтестинального синдромов. Это требовало проведения дифференциальной диагностики с инфекционными, лимфопролиферативными заболеваниями. Диагноз был установлен через год от начала болезни при выявлении PAS-положительных макрофагов в слизистой оболочке тонкой кишки. Своевременно начатая терапия цефтриаксоном в течение 14 дней, поддерживающая терапия триметоприм-сульфаметоксазолом (160 мг/800 г в сутки) внутрь привели к положительной клинико-лабораторной динамике за 9 мес., уменьшению PAS-положительных макрофагов в кишечнике.
Ключевые слова: болезнь Уиппла, лимфаденопатия забрюшинных лимфатических узлов, PAS-положительные макрофаги.
Kupriyanova I.N.1, Berdnikov R.B.2, Bozrov R.M.3
1 Ural State Medical University, Yekaterinburg
2 Ural Research Institute of Phthisiopulmonology, Yekaterinburg
3 «354 Military Clinical Hospital», the Ministry of Defense of Russia, Yekaterinburg
Whipple’s syndrome (WS) is a rare chronic systemic infectious disease caused by the gram-positive bacterium Tropheryma whipplei (TW). Primary TW infection occurs in the fecal-oral or oral-oral route in early childhood and proceeds asymptomatically or with the clinic of rapidly jugulated gastroenteritis, pneumonia, followed by elimination of the pathogen. The article presents the clinical case of the diagnosed WS. Comparison of own clinical observation with literature data is carried out. The features of WS in a patient of 36 years were the fever, severe weight loss, generalized lymphadenopathy, including retroperitoneal lymph nodes, with the absence of joint and gastrointestinal syndromes. This required differential diagnostics with infectious, lymphoproliferative diseases. The diagnosis was established after one year from the onset of the disease when PAS-positive macrophages were detected in the small intestine mucosa. The use of ceftriaxone therapy for 14 days, maintenance therapy with trimethoprim-sulfamethoxazole (160 mg / 800 g per day), led to a positive clinical and laboratory dynamics in 9 months, a decrease in PAS-positive macrophages in the intestine.
Key words: Whipple’s disease, lymphadenopathy of retroperitoneal lymph nodes, PAS-positive macrophages.
For citation: Kupriyanova I.N., Berdnikov R.B., Bozrov R.M. Whipple’s syndrome: literature review and case report //
RMJ. Medical Review. 2018. № 1(II). P. 85–92.
В статье представлен клинический случай диагностированной болезни Уиппла. Проведено сопоставление собственного клинического наблюдения с данными литературы.
Болезнь Уиппла (БУ) — редкое хроническое системное заболевание инфекционного генеза, вызванное грамположительной бактерией Tropheryma whipplei (TW), приводящее к летальному исходу без длительной антимикробной терапии [1]. Заболевание было впервые описано в 1907 г. американским патологом Джорджем Х. Уипплом как кишечная липодистрофия [2].Данные различных исследований показали, что классическая БУ отмечается у 73–87% мужчин среднего возраста (48–54 лет), преимущественно белой расы. Соотношение между мужчинами и женщинами составляет 8:1 [3, 4]. Ранние исследования на жителях Франции и Северной Европы оценивали заболеваемость БУ как 1:1 000 000 [5], однако последнее исследование 2015 г. на северо-западе Италии оценило распространенность данного заболевания как 3:1 000 000 [6]. Уровень заболеваемости составляет 1–6 новых случаев на 10 000 000 человек в год во всем мире [7, 8].
Tropheryma whipplei (от греч. trophe — питание, eryma — барьер) — грамположительная бацилла, относится к группе актиномицетов, комменсал. Исследователями из разных географических зон TW была обнаружена у здоровых носителей в 1,5–11% случаев в фекалиях; в 0,2–1,5% случаев — в слюне [9–11]. ДНК TW выявлена у 40% здоровых лиц в сублингвальных бляшках, десневых карманах, зубных протезах [12]. У 12–31,2% больных БУ был контакт со сточными водами [11, 13, 14], у 66% — с животными или почвой, т. е. чаще БУ поражает жителей сельской местности, 35% — фермеры [11]. Первичное инфицирование TW происходит фекально-оральным или орально-оральным путем в раннем детстве и протекает бессимптомно или с клиникой быстро купируемого гастроэнтерита, пневмонии, с последующей элиминацией возбудителя [15, 16]. Прямой путь передачи бактерии от человека к человеку либо нозокомиальный путь (например, при желудочно-кишечной эндоскопии) не зарегистрированы [17].
Патогенез
TW относится к медленно растущим организмам: деление клетки происходит за 18 дней (медленнее, чем M. tuberculo-sis) [18]. Культуральный метод диагностики TW-инфекции для рутинной практики не используется, т. к. среднее время приготовления культуры составляет 30 дней [19, 20]. Для визуализации TW в тканях применяют окрашивание кислотой Шиффа (PAS) [1]. В 2003 г. было установлено, что TW имеет укороченный геном (927 kb), является единственной бактерией с измененным метаболизмом тиреоидинредуктазы, сниженным синтезом тиоредоксина [21], которые связаны с иммунной и воспалительной регуляцией. TW — внутриклеточный возбудитель. БУ называют «болезнью макрофагов», т. к. бактерия поглощается макрофагами слизистой оболочки тонкой кишки, которые затем мигрируют в подслизистый слой [22].Отсутствие локальной активности тиреоидинредуктазы и снижение экспресии тиоредоксина в макрофагах, инфицированных TW, приводит к снижению CD11b, CD14 и Th1-ответов [23].
В результате происходит недостаточная дифференциация Th1-клеток, необходимых для эффективного ответа против TW. Бактерия препятствует дифференцировке наивных CD4+ клеток в Th2. Снижается Т-клеточное соотношение CD4+/CD8+. При этом макрофаги не способны лизировать бактерии из-за сниженной экспрессии CD11b, т. к. в них нарушается созревание фагосом. Это приводит к повышенной экспрессии интерлейкина (IL)-10, CCL-18 (хемокинового лиганда 18)
и TGF-β, низкой экспрессии IL-12 и интерферона (IFN)-γ. Иммунная система не может подавить инфекцию, бактерия использует ее для диссеминации в макрофагах по всему организму [24, 25]. Уровень иммуноглобулина (Ig) G и IgM при БУ низкий по сравнению с носителями инфекции [26]. TW создает противовоспалительную среду, тем самым предотвращая эффективный иммунологический ответ. Это приводит к репликации бактерий и распространению в слизистой оболочке тонкого кишечника. Затем TW проходят через лимфатические каналы и лимфатические узлы, оказываются в системе кровообращения, приводя к системному распространению в тонком кишечнике, головном мозге, сердце и его оболочках, легких, почках, костном мозге и коже [17].
Мультисистемность поражения до сих пор представляет диагностические сложности для постановки диагноза БУ из-за вариабельности клинических синдромов. В течение последних 100 лет в медицинской литературе опубликованы описания более 2000 клинических случаев БУ, отражающих поражения разных органов и разнообразные варианты течения. Maresi et al. в 2013 г. сделали подробный обзор 1000 клинических случаев, описанных с 1957 до 2012 г. [27]. В Марселе в Centre National de Référence Rickettsia, Coxiella, Bartonella с 2000 г. коллектив авторов занимается диагностикой и лечением БУ, систематизируя полученные данные в клинических обзорах [28, 29]. В последние годы появились клинические обзоры из различных центров, т. к. расширились методы диагностики TW [24, 30]. В отечественной литературе приводятся единичные клинические случаи [31–35] и обзорные лекции, посвященные БУ [8, 35]. Накопленный клинический опыт на современном этапе развития медицины позволил выделить несколько проявлений инфекции TW: классическая БУ, локальная (энцефалит, TW-эндокардит), острая инфекция (в 75% случаев у детей в виде гастроэнтерита, пневмонии, бактериемии) и бессимптомное носительство (у 1–38% лиц, контактирующих с канализационными сточными водами или у бездомных лиц) [15, 36–38].
Клиника
Классическая БУ характеризуется развитием симптомов с различной частотой: мигрирующая артралгия (73–80%), хронические нарушения пищеварения с диареей (72–81%), абдоминальная боль (23–60%), потеря веса (79–93%), лимфаденопатия (35–66%), гипоальбуминемия, анемия [28, 39].
Развитию этих симптомов предшествует ранняя, продромальная стадия, которая длится в среднем 6–8 лет [40]. На этой стадии первым признаком классической БУ в 80–90% случаев являются серонегативный артрит и/или артралгия, часто с лихорадкой, повышением белков острой фазы [28, 41]. Эта картина нередко становится причиной ошибочной диагностики палиндромного ревматизма [42], а в 50% случаев — ревматоидного артрита, анкилозирующего спондилоартрита, псориатического артрита. Для практического врача важно помнить, что наличие суставного синдрома, анемии и похудания у мужчины среднего возраста свидетельствует в пользу БУ [39].
Назначение иммуносупрессивной терапии (ИСТ) кортикостероидами или ингибиторами фактора некроза опухоли таким больным способствовало генерализации TW, в ряде случаев приводило к летальному исходу [40, 43]. У пациентов начиналась диарея вскоре после начала ИСТ, короткий курс антибиотикотерапии купировал клинические синдромы [40].
Для развернутой стадии болезни типичны гастроинтестинальные симптомы, т. к. при БУ поражены двенадцатиперстная кишка (ДПК), тощая и подвздошная кишка. В клинической картине типичны: диарея со стеатореей (60–85%); боль в параумбиликальной области по типу схваткообразной различной интенсивности, возникающая после еды (60–81%); прогрессирующая потеря веса вплоть до кахексии (79–93%), анорексия, признаки синдрома мальабсорбции. Могут возникать скрытые кровотечения из слизистой оболочки кишечника у 20–30% пациентов [35]. Объективно при пальпации выявляется болезненность в околопупочной области, гепатоспленомегалия, редко асцит (5%) [44]. Заболевание прогрессирует, возникают: стойкая фебрильная лихорадка с ознобом и последующим профузным потоотделением, тяжелый истощающий синдром (со значительной потерей веса, усталостью, слабостью, атрофией мышц и потерей аппетита), абдоминальная лимфаденопатия [45]. На этой стадии описаны клинические случаи эндокардита и неврологические проявления без симптомов поражения желудочно-кишечного тракта (ЖКТ) [46, 47]. При БУ редко поражаются печень, пищевод, желудок [48, 49]. При вовлечении толстой кишки описаны случаи ошибочной диагностики язвенного колита, что приводило к резкому прогрессированию БУ на фоне ИСТ с угрозой летального исхода [50, 51].
Поражение центральной нервной системы (ЦНС) является третьим по частоте проявлением БУ и составляет 6–63% [52, 53]. Неврологическая симптоматика может быть первым проявлением БУ в 10–15% случаев, а может развиться через несколько лет после манифестации других проявлений заболевания (в среднем через 8 лет). В зависимости от уровня поражения ЦНС отмечена вариабельность клиники: мозжечковая атаксия (в 25% случаев); миоклонии — синхронные сокращения жевательных или лицевых мышц; гиперсомния, кома, офтальмоплегия, синдром лобной доли и экстрапирамидные симптомы, нарушения чувствительности (в 10% случаев), судороги (парциальные и генерализованные в 25% случаев) [53]. В 30% случаев возникает поражение гипоталамической области (полидипсия, булимия, снижение либидо, аменорея, инсомния). У 50% больных отмечаются психические расстройства: депрессия, тревожность, психозы. У 71% пациентов возникает головная боль, когнитивные изменения вплоть до развития деменции (в 50% случаев) [54]. Очень редко (менее чем у 3% пациентов) имеются признаки поражения III, IV, V, VI, VII черепно-мозговых нервов. Бессимптомное поражение нервной системы при классической БУ было продемонстрировано путем обнаружения ДНК TW в спинномозговой жидкости методом полимеразной цепной реакции (ПЦР) [54]. Прогноз для пациентов с вовлечением ЦНС серьезный, т. к. основные осложнения наблюдаются у 25% пациентов и 4-летние показатели выживаемости составляют менее 75% [55].
У 17–55% пациентов с классической БУ поражается сердечно-сосудистая система. По данным аутопсии, PAS-положительные макрофаги обнаруживаются в 79% случаев в любой из оболочек сердца [3, 56]. Эндокардит с поражением аортального и митрального клапанов может возникнуть на поздней стадии у лиц без предшествующей клапанной патологии. Особенностями TW-эндокардита являются: отсутствие лихорадки, отрицательная гемокультура, типичные УЗИ-признаки поражения клапанов [5, 57, 58]. Развитию TW-эндокардита нередко предшествуют артралгия или артрит без желудочно-кишечных симптомов [28]. Кроме этого, могут развиться миокардит, плевроперикардит, коронариит с синдромом стенокардии, артериальная гипотензия, прогрессирующая сердечная недостаточность или внезапная смерть. Описан клинический случай с развитием плевроперикардиального фиброза, потребовавший оперативного вмешательства [59].
Поражение органов дыхания встречается у 30–40% пациентов с БУ в виде бронхита, сухого или хилезного плеврита, интерстициальной болезни легких, легочной гипертензии [60, 61]. Гранулематозная лимфоаденопатия лимфатических узлов (ЛУ) средостения приводит к сдавлению трахеи и проявляется сухим кашлем, одышкой, иногда удушьем.
На ранней стадии БУ может поражаться кожа, что нередко приводит больного к дерматологу. Возникает сухость, гиперпигментация кожи, панникулит, узловатая эритема [4, 62, 63]. В биопсийных образцах кожи определяются PAS-положительные макрофаги, характерные для БУ. Гиперпигментация может возникать из-за вторичного гиперпаратиреоза [64], гипоталамической дисфункции и недостаточности надпочечников, дефицита витамина B12 в результате мальабсорбции [65].
Диагностика
Поражение глаз, за исключением офтальмоплегии, встречается у 11% пациентов с классической БУ [66]. Наиболее часто наблюдаются: увеиты, ретиниты, иридоциклиты. Ухудшение остроты зрения наблюдается в 2% случаев. У 23% пациентов может быть односторонний птоз. У 18% больных обнаруживается анизокория.Общий анализ крови (ОАК) в 75% случаев показывает: анемию (обычно микроцитарную или нормоцитарную), лейкоцитоз, тромбоцитоз и повышенную скорость оседания эритроцитов (СОЭ) [3, 8, 35]. В ряде случаев возникает тромбоцитопения, которая быстро устраняется на фоне лечения [67]. В биохимическом анализе крови (БАК): повышение С-реактивного белка (СРБ), снижение железа, фолиевой кислоты, белка, альбумина, холестерина. Могут быть лабораторные маркеры мальабсорбции (снижение общего количества лимфоцитов, низкий сывороточный альбумин, преальбумин и трансферрин). Стеаторея до 50 г/сут отмечена у 90% пациентов [3, 8, 35]. У 15% пациентов с БУ нет классических признаков и симптомов заболевания [24]. На ранней стадии часто некоторые типичные проявления могут отсутствовать. Наличие TW можно диагностировать в различных тканях и жидкостях организма несколькими методами. Обнаруживают PAS-позитивные макрофаги при гистологическом исследовании или исследовании ДНК возбудителя методом ПЦР в биоптатах слизистой оболочки ЖКТ, ЛУ, сердечных клапанов, синовиальной или спинномозговой жидкости, мозге, слюне, кале [68]. ПЦР позволяет поставить правильный диагноз при отрицательной PAS-окраске в биоптатах кишечника из-за неравномерного расположения бактерий в слизистой оболочке [69]. При рентгенографии кишечника более чем у 50% больных отмечается расширение, грубый рельеф слизистой оболочки тонкой кишки; дефекты наполнения вследствие сдавления увеличенными мезентериальными ЛУ. Ультразвуковое исследование (УЗИ) и компьютерная томография (КТ) органов грудной клетки и брюшной полости позволяют обнаружить увеличенные забрюшинные, медиастинальные, мезентериальные ЛУ [70]. Для получения морфологического материала используется тонкоигольная биопсия под эндоскопическим ультразвуковым контролем при наличии лимфаденопатии брюшной полости [71]. Эзофагогастродуоденоскопия (ЭГДС) ДПК и проксимальных отделов тощей кишки не выявляют специфических признаков БУ. При дуоденоскопии можно обнаружить гиперемию, отечность и резкое неравномерное утолщение складок из-за лимфостаза, неровность рельефа в виде белесовато-желтых бляшек слизистой оболочки тонкой кишки. При эндоскопии обязательным является биопсия пяти и более участков постбульбарного отдела ДПК и проксимального отдела тощей кишки, что позволяет верифицировать диагноз БУ. В ходе световой микроскопии в слизистой оболочке тонкой кишки и в брыжеечных лимфатических сосудах выявляются включения жира (внутриклеточно и внеклеточно). Отмечается расширение брыжеечных лимфатических сосудов. Видна инфильтрация собственного слоя слизистой оболочки тонкой кишки крупными пенистыми макрофагами, содержащими гранулы с PAS-позитивным веществом: лизосомальным материалом распада бактерий, фагоцитированных макрофагами [68]. Ложноположительные результаты могут быть связаны с наличием других бактерий (Rhodococcus equi, Mycobacterium avium-intracellulare, Corynebacterium, Bacillus cereus, Histoplasma) или грибковой инфекцией, что требует проведения дифференциальной диагностики. TW может быть обнаружена в фиксированных образцах тканей с использованием иммуногистохимического метода. Это было показано, например, у двух пациентов с БУ с лимфаденопатией без признаков поражения ЖКТ [72].
Лечение
Инфекция прогрессирует очень медленно. БУ в 100% случаев приводила к летальному исходу до применения антибиотиков. До настоящего времени идет поиск оптимальных схем антибиотикотерапии на основании опубликованных клинических случаев. Были опробованы несколько схем лечения, включая пенициллин, амоксициллин/клавулановую кислоту, хлорамфеникол, стрептомицин и другие аминогликозиды, макролиды, цефалоспорины, тетрациклин, доксициклин, триметоприм-сульфаметоксазол, салазопирин и гидрохлорохин. TW естественным образом устойчивa к фторхинолонам [73]. С 1980-х годов тетрациклин считался терапией первой линии в лечении БУ. Однако это приводило к частоте рецидивов до 28% случаев, протекающих тяжело, с неврологическими осложнениями [74].В настоящее время рекомендуемая индукционная терапия основана на рандомизированном контролируемом исследовании, в котором участвовали 40 пациентов. Для индукционной терапии назначают на 14 дней цефтриаксон (2 г/сут однократно внутривенно) или меропенем (1 г 3 р./сут внутривенно) [75, 76]. При поражении ЦНС дозы препаратов удваивают или применяют прокаина бензилпенициллин 1,2 млн ЕД/сут внутримышечно (или калия бензилпенициллин 1,2 млн. ЕД/сут каждые 4 часа внутривенно) в сочетании со стрептомицином 1 г внутривенно однократно. Далее переходят на поддерживающую терапию 80 мг триметоприма / 400 мг сульфаметоксазола по 2 таблетки 2 р./сут внутрь в течение 12 мес. [77]. Альтернативой при непереносимости данной комбинации является доксициклин (100 мг 2 р./сут внутрь) и гидроксихлорохин (200 мг 3 р./сут внутрь) в течение одного года [78]. На фоне своевременной и активной терапии исход заболевания благоприятный. Клинические улучшения могут наступать уже после первых недель терапии, однако регресс морфологических изменений более медленный и не всегда полный.
Клинический случай
Пациент Р., 36 лет, русский, офисный работник, был госпитализирован в ЦГКБ № 1 Екатеринбурга 08.06.2017 с жалобами на слабость, утомляемость, лихорадку до 38–38,5 °С, плохой аппетит, потерю массы тела на 18 кг за год, снижение настроения, периодические головные боли, тупые боли в околопупочной области без связи с приемом пищи, метеоризм. Стул ежедневный, без патологических примесей, оформленный.Из анамнеза: считает себя больным с 03.05.2016, когда возникла ежедневная лихорадка до 37–38 °С, слабость; не лечился. 27.05.2016 обратился к ЛОР-врачу, по поводу боли в горле при глотании. С диагнозом «обострение хронического тонзиллита» лечился 7 дней кларитромицином (500 мг/сут). Боль в горле была купирована, осмотр зева не выявил патологических изменений; сохранялись лихорадка до 37,5 °С, слабость. ОАК от 25.05.2016 и 05.06.2016: впервые выявлены нарастание нормохромной анемии (гемоглобин 114–115 г/л), лейкоцитоза (с 12,83×109/л до 14,3×109/л), тромбоцитоза (с 398×109/л до 422×109/л), ускорение СОЭ 61–65 мм/ч. Консультация терапевтом 09.06.2016: при объективном осмотре патологических изменений со стороны ЛУ, костно-суставной системы, внутренних органов не выявлено. С диагнозом «Анемия, лихорадка неясного генеза. Хронический компенсированный тонзиллит» пациент был направлен на обследование для уточнения генеза имеющихся изменений. Больной частично прошел рекомендуемое обследование, при котором получены отрицательные результаты на наличие ВИЧ, вирусных гепатитов В и С, патологии органов брюшной полости. Самочувствие ухудшалось, не лечился, к врачам не обращался. В октябре 2016 г. из-за появления потливости на фоне постоянной лихорадки до 38 °С и выше, нарастающей слабости, похудания на 8 кг, снижения работоспособности пациент продолжил обследование. ЭГДС 23.10.2016 г.: Гастрит антрального отдела желудка. Дуоденит. Тест на Helicobacter pylori — отрицательный. Биопсия слизистой желудка и тонкого кишечника не сделана, гастроэнтерологом не консультирован. ОАК: усугубление анемии (гемоглобин 104 г/л), СОЭ 80 мм/ч, лейкоцитоз (12,87×109/л), тромбоцитоз (412×109/л). БАК: уровень белка крови, билирубина, АЛТ, АСТ — в пределах нормы. Исследование гормонов щитовидной железы: в норме (24.10.2016 ТТГ — 2,32 мЕд/л). Рентгенологическое исследование органов грудной клетки: без патологии, что позволило 29.10.2016 фтизиатру исключить туберкулез легких. В ноябре 2016 г. гематолог выявил увеличение задних и передних шейных, подмышечных, паховых ЛУ. Для исключения лимфопролиферативного заболевания выполнено обследование. ОАК: гемоглобин 103 г/л, MCV 72 фл, RDV — 15,1%, MCH — 22,9 пг, MCHC — 31,8 г/дл, тромбоциты 382×109/л, лейкоциты 13,66×109/л, ретикулоциты 4,0%, СОЭ 64 мм/ч. БАК: снижение сывороточного железа (2,02 мкмоль/л), фолиевой кислоты (2,8 нг/мл при норме 3,1–20,5 нг/мл), альбумина (29 г/л); повышение СРБ (115 мг/л при норме 0–5 мг/л); нормальные показатели ферритина, витамина В12, гомоцистеина, креатинина, антистрептолизина-О, ревматоидного фактора. Сделан электрофорез белков с иммунофиксацией сыворотки крови с поливалентной антисывороткой: отсутствие М-градиента сыворотки, гипоальбуминемия (28,53 г/л), снижение α1-глобулинов (4,20 г/л), α2-глобулинов (8,98 г/л) и γ-глобулинов (12,51 г/л). С учетом генерализованной лимфаденопатии 23.11.2016 выполнена мультиспиральная КТ (МСКТ) брюшной полости, забрюшинного пространства: на уровне L1–L3 позвонков, окутывая сосудистые ножки почек, больше слева, определяют множественные, увеличенные до 20 мм в диаметре сливающиеся ЛУ, также визуализируются множественные (диаметром 8–15 мм) мезентериальные ЛУ. Заключение: Аденопатия лимфоузлов брюшной полости, забрюшинного пространства (рис. 1). Небольшое количество выпота в брюшной полости.
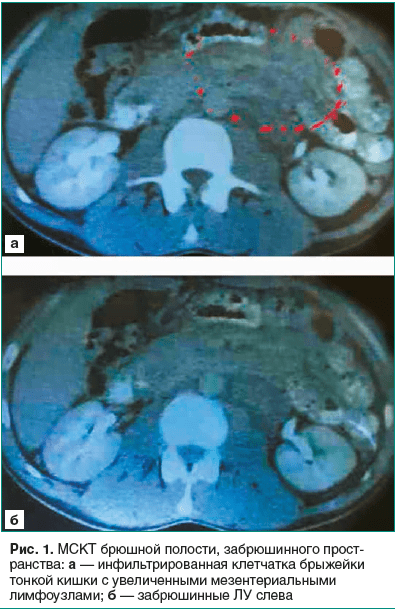
С диагнозом «лимфома с поражением периферических (шейных, подмышечных, паховых) и абдоминальных ЛУ» был направлен к онкологу. Проходил обследования до апреля 2017 г. в Свердловском областном онкологическом центре. 07.12.2016 произведена пункционная биопсия шейного и затылочного ЛУ слева: получен недостаточный объем биоптата. 12.12.2016 выполнена позитронно-эмиссионная томография всего тела (от затылочной кости до средней трети бедра): картина лимфоаденопатии шеи (до 13 мм), аксиллярных областей (до 21 мм), брюшной полости и забрюшинного пространства в виде конгломерата. Симптомы сохранялись, произошло постепенное увеличение в размерах периферических ЛУ, образование конгломератов мезентериальными ЛУ. Для уточнения генеза лимфаденопатии пациент был повторно обследован на ВИЧ, вирусы гепатита В, С, туберкулез: результаты отрицательные. Для исключения патологии кишечника 14.12.2016 сделана фиброколоноскопия, при которой органической патологии не выявлено. Биопсия слизистой кишечника не проводилась. ОАК 16.01.2017: снижение гемоглобина до 101 г/л, тромбоцитоз (353×109/л), лейкоцитоз (12,1×109/л) и ускорение СОЭ (60 мм/ч). БАК: билирубин, АЛТ, АСТ — в норме, уровень альбумина в динамике не проверяли. Биопсия пахового ЛУ слева 25.01.2017 с иммуногистохимическим исследованием: не выявлено достоверных признаков опухолевого роста, данные за синусный гистиоцитоз.
С 30.01.2017 по 10.02.2017 больной находился на лечении в хирургическом отделении с диагнозом «Нагноение послеоперационной раны (биопсия лимфоузла от 25.01.2017). Флегмона левой паховой области. Хроническая анемия легкой степени». Выполнена ревизия раны, вскрыт и дренирован гнойник. Послеоперационный период протекал гладко. ОАК: гемоглобин 90 г/л, лейкоциты 10,1×109/л, СОЭ 53 мм/ч. Получал терапию цефтриаксоном 2 г внутривенно 10 дней. Впервые отмечена нормализация температуры, улучшение общего самочувствия. Выписан в удовлетворительном состоянии. Наблюдался участковым врачом. На амбулаторном этапе назначен железа сульфат, при приеме которого у пациента появились отеки в области кистей. Ферротерапия более не проводилась.
Через 7 дней после выписки из хирургического стационара и временного улучшения состояние стало прогрессивно ухудшаться: вновь появилась лихорадка до 38 °С, выраженная слабость, потливость, снижение веса на 14 кг за весь период болезни, увеличение периферических ЛУ. С 15.02.2017 возобновилось обследование у онколога. По УЗИ ЛУ: забрюшинные ЛУ на уровне эпи- и мезогастрия до 18 мм. Свободная жидкость в брюшной полости и малом тазу в небольшом количестве. ЛУ по передней поверхности кивательной мышцы слева до 33 мм, ЛУ по задней поверхности кивательной мышцы слева до 8 мм. Сделано повторное исследование эксцизионного биоптата пахового ЛУ слева (25.01.2017): достоверных признаков опухолевого роста, включая лимфому, в объеме представленного материала нет. Иммуноморфологическая картина наиболее соответствует реактивной гранулематозной лимфаденопатии. Рекомендовано исключить токсоплазмоз, сифилис, микобактериоз (типа M. avium-intracellulare), токсокароз, проконсультировать инфекционистом. 22.02.2017 был обследован на Toxoplasma gondi (IgG, IgM), токсокароз, ВИЧ, сифилис, вирусы гепатитов В и С: результаты отрицательные. На микобактериоз обследование не проводилось. Инфекционист рекомендовал продолжить онкологический поиск. В отделении абдоминальной хирургии 13.03.2017 произведена лапароскопическая биопсия забрюшинного ЛУ, которая не выявила данных за онкологический процесс. ОАК: лейкоциты 20,3×109/л, эритроциты 4,35×1012/л, гемоглобин 97 г/л, тромбоциты 580×109/л, СОЭ 61 мм/ч. В течение последующего месяца состояние больного ухудшается: фебрильная температура ежедневно, слабость, выраженная потливость, генерализованная лимфаденопатия, в т. ч. мезентериальных ЛУ в виде конгломерата; похудание на 17 кг за весь период. 20.04.2017 проведен пересмотр гистопрепаратов эксцизионного биоптата ЛУ брыжейки тонкой кишки от 13.03.2017: достоверных признаков опухолевого роста в представленном материале нет. Иммуноморфологическая картина соответствует поражению брыжеечных лимфоузлов при болезни Уиппла. ОАК 27.04.2017: анемия (гемоглобин 98 г/л), тромбоцитоз (522×109/л), лейкоцитоз (18,5×109/л), СОЭ 64 мм/ч. БАК 14.05.2017: снижение уровня железа (2,57 мкмоль/л), фолиевой кислоты (2,4 нг/мл). Видео-ЭГДС с множественной биопсией 17.05.2017: складки слизистой среднего калибра, эластичные, при инсуффляции воздухом расправляются свободно. Угол желудка не изменен, слизистая тела, дна желудка, антрального отдела розового цвета, в антральном отделе у привратника несколько отечная, но без гиперемии. ДПК: луковица обычной формы, слизистая неярко гиперемирована. В ДПК отмечается отек, гиперемия и утолщение складок, неровность рельефа слизистой из-за многочисленных желтовато-белых укороченных, утолщенных на вершинах ворсинок, местами с отсутствием рисунка ворсинок, «лысые» участки слизистой (рис. 2). Биопсия в Д1, Д2, Д3, дистальнее провести эндоскоп не удалось. Заключение: Антральный гастрит. Дуоденит с атрофическими изменениями с выраженной лимфангиоэктазией слизистой ДПК. Дуоденогастральный рефлюкс (ДГР). Большой дуоденальный сосочек: без особенностей. Антральный гастрит. Дуоденит с выраженной лимфангиоэктазией слизистой ДПК.
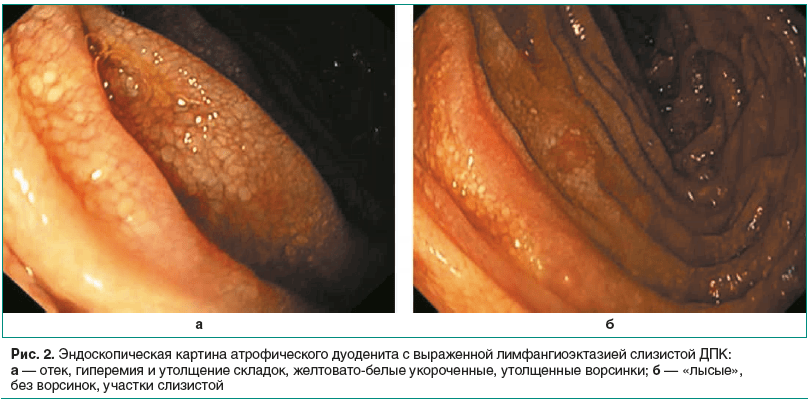
Гистологическое исследование биоптатов слизистой
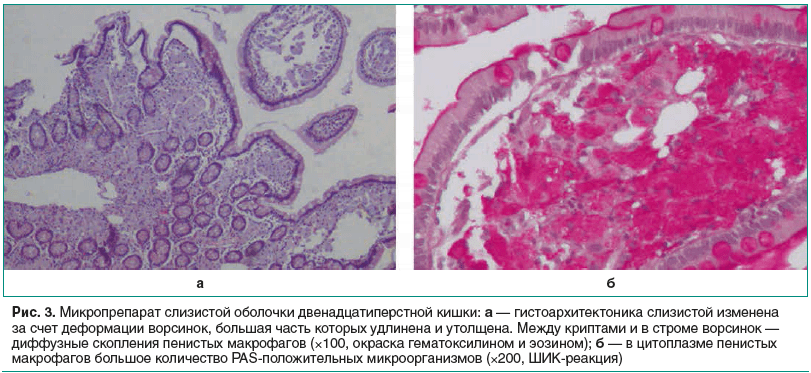
ДПК 31.05.2017: гистоархитектоника слизистой изменена за счет деформации ворсинок, большая часть которых укорочена и утолщена. В поверхностном и криптальном эпителии — очаговые реактивные изменения. В собственной пластинке слизистой — диффузная плотная макрофагальная инфильтрация с очаговой примесью нейтрофилов, эозинофилов и лимфоцитов. Макрофаги имеют амфофильную пенистую цитоплазму, содержащую плотно расположенные гранулярные PAS-позитивные структуры и мономорфные округлые и овальные ядра с мелкими нуклеолами. Заключение: Морфологические изменения соответствуют болезни Уиппла. Микобактериоз достоверно исключен (рис. 3).
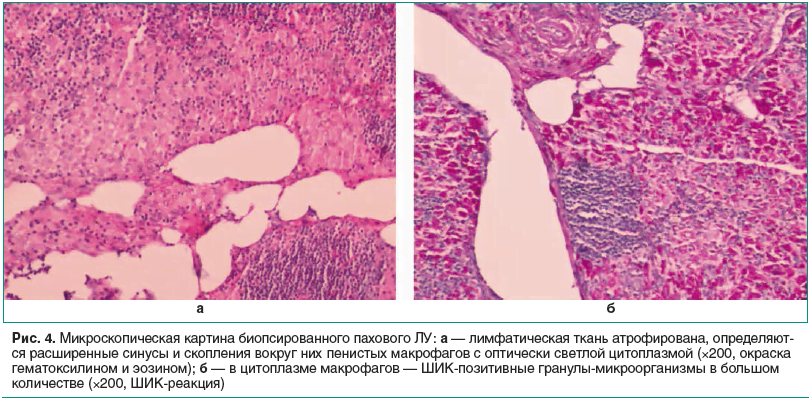
Проведено повторное исследование гистологических биоптатов левого пахового и мезентериального ЛУ: изменения преобладают в ткани мезентериального ЛУ, отмечается диффузное расширение синусов, заполненных макрофагами, аналогичных описанным. Лимфатическая ткань атрофирована. Определяется кистозная трансформация ЛУ за счет расширенных синусов. В цитоплазме макрофагов — ШИК-позитивные гранулы в большом количестве. Кислотоустойчивые микобактерии при окраске по Цилю — Нильсену не определяются. Реакция с альциановым синим слабоположительная в части клеток (рис. 4). Заключение: Изменения структуры ЛУ соответствуют болезни Уиппла. Данных за микобактериоз не получено.
Больной госпитализирован в терапевтическое отделение 07.06.2017. При поступлении состояние средней степени тяжести. Пониженного питания (вес 52 кг, индекс массы тела (ИМТ) 15,77 кг/м2), лихорадка 37,8 °С. Бледность кожи, шелушение, снижение тургора. Пальпируются шейные, затылочные, заушные, нижнечелюстные лимфоузлы размером 2,0–2,5 см, плотноэластичные, подвижные, безболезненные. Костно-мышечная система без патологических изменений. В легких дыхание везикулярное. ЧДД — 16 в минуту. Тоны сердца приглушены, систолический шум на верхушке. АД — 105/60 мм рт. ст., ЧСС — 72 уд/мин. Живот умеренно вздутый, активно участвует в акте дыхания. При пальпации безболезненный, в околопупочной области пальпируется плотное, безболезненное образование 15×10 см. Печень пальпируется у края реберной дуги, эластичная, безболезненная. Размеры по Курлову 8×6×4 см. Селезенка не пальпируется. В левой паховой области послеоперационный рубец. Диагноз: Болезнь Уиппла, обострение.
Проведено обследование 07.06.2017. ОАК: гемоглобин — 105 г/л, тромбоциты — 489×109/л, лейкоциты — 17,0×109/л, СОЭ — 50 мм/ч. БАК: общий белок — 68,9 г/л, альбумин — 38,8 г/л, холестерин — 3,0 ммоль/л, АЛТ/АСТ — 11,5/11,1 Ед/л, билирубин общий — 9,8 мкмоль/л, витамин В12 — 38,0 пмоль/л, фолиевая кислота — 179,9 нг/мл, железо — 5,6 мкмоль/л. Копрограмма без патологических изменений. УЗИ сердца: аортальная регургитация I степени, размеры камер сердца не увеличены, сократительная способность миокарда не нарушена. Получал лечение: цефтриаксон 2 г внутривенно 14 дней, фолиевая кислота 5 мг внутрь. На фоне проводимой терапии наступила положительная динамика: нормализовалась температура тела, улучшился аппетит, прошло ощущение тяжести в брюшной полости, прибавил в весе 3,5 кг. Стул ежедневный, без патологических примесей. Улучшился эмоциональный фон.
Последующие месяцы амбулаторно пациент принимал триметоприм-сульфаметоксазола 160 мг/800 мг/сут, фолиевой кислоты 5 мг/сут, симетикон ситуационно при метеоризме. На фоне приема триметоприм-сульфаметоксазола с фолиевой кислотой за 2 мес. восстановил вес (прибавка 15 кг).
Периферические ЛУ перестали пальпироваться через 2 мес. При контрольном УЗИ органов брюшной полости отмечена положительная динамика: 05.08.2017 — лимфаденопатия брыжеечных ЛУ до 15×10 мм, а 01.11.2017 — лимфаденопатия в брюшной полости не определяется. Уровень гемоглобина, тромбоцитов восстановился в течение 3-х месяцев. Сохранялся лейкоцитоз с тенденцией к нормализации (с 13,9×109/л до 11,4×109/л), относительный лимфоцитоз. СОЭ постепенно снижалась (с 81–62 мм/ч до 35 мм/ч). БАК: уровень белка и альбумина восстановился в течение первого месяца; сохраняется снижение уровня железа, но с положительной динамикой роста (с 2,02 мкмоль/л на 08.11.2017 до 7,6 мкмоль/л на 15.03.2018). К девятому месяцу наблюдается слабость к вечеру, прибавка веса 21 кг. ОАК: лейкоциты 11,4×109/л, лимфоциты 56,6%, гемоглобин 134 г/л, тромбоциты 227×109/л, СОЭ 20 мм/ч. При повторной ЭГДС с множественными биопсиями 15.02.2018: слизистая оболочка пищевода, желудка без видимых воспалительных изменений, луковица обычной формы, слизистая розовая; в ДПК складчатость сохранена, слизистая розовая; при детальном рассмотрении в водной среде рисунок ворсинок четко прослеживается, ворсинки местами широкие по вершинам (рис. 5а).
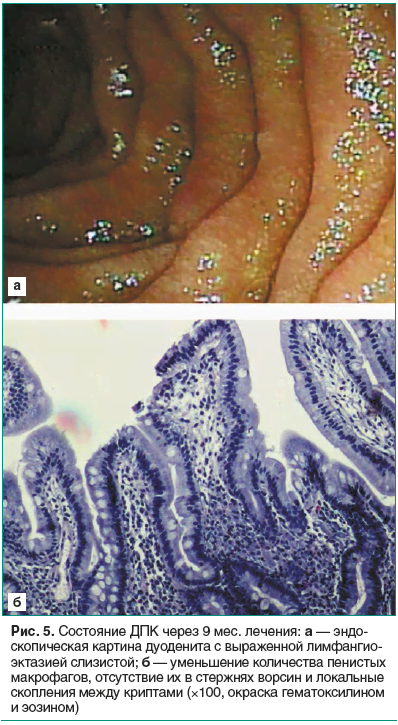
Гистологическое исследование биоптатов слизистой ДПК 15.02.2018: в собственной пластинке определяются лимфо-плазмоцитарный инфильтрат и очаговые скопления макрофагов с пенистой цитоплазмой и эксцентрично расположенными ядрами. Скопления макрофагов определяются в строме ворсин, в зоне Бруннеровых желез и занимают от 30 до 70% объема в разных полях зрения. В стержнях некоторых ворсин указанные макрофаги не определяются. При ШИК-реакции в цитоплазме макрофагов определяется большое количество плотно расположенных PAS-позитивных палочек, которые не поддаются подсчету (рис. 5б).
Обсуждение
В представленном клиническом наблюдении заболевание дебютировало лихорадкой, связанной с обострением «тонзиллофарингита». Семидневный курс кларитромицина купировал боли в горле, но не лихорадку, которая сохранялась на протяжении года до начала терапии цефтриаксоном. ОАК показал нормохромную анемию, лейкоцитоз, тромбоцитоз, ускоренную СОЭ. Диагностический поиск начался с исключения причин лихорадки неясного генеза и анемии. Были исключены туберкулез, ВИЧ, вирусы гепатитов В и С. Развилась генерализованная лимфаденопатия с увеличением забрюшинных ЛУ. Данный клинический случай представляет интерес для практикующих врачей, поскольку в медицинской литературе описаны лишь несколько случаев БУ с брыжеечным лимфаденитом [31,70]. В ретроспективном исследовании, проведенном во французском центре Марселя, распространенность брыжеечной лимфаденопатии при БУ составляла 17% [28]. Генерализованная лимфаденопатия в сочетании с гематологическими изменениями в 90% типична для лимфатических опухолевых заболеваний, в 10% — для атипично протекающих лимфопролиферативных заболеваний либо для реактивных «неопухолевых лимфоаденопатий», подтвержденных повторной биопсией ЛУ [79]. При подозрении на лимфому показана ЭГДС с биопсией. Биоптаты кишечника следует получить для тестирования TW, даже если слизистая оболочка окажется визуально не измененной при ЭГДС, как это произошло в нашем случае, поскольку макроскопически нормальная кишка не исключает БУ [35]. Отказ от гистологического исследования путем множественной биопсии не позволил поставить диагноз болезни Уиппла вовремя. Это потребовало исключения инфекционных заболеваний (тонзиллогенной инфекции, вызванной β-гемолитическим стрептококком, ВИЧ, туберкулеза, вирусного гепатита В и С, сифилиса, токсокароза), системных болезней соединительной ткани (исследование ревматоидного фактора), лимфопролиферативных заболеваний, лимфомы, опухоли с метастазами из неизвестного очага. Больной консультирован гематологом, онкологом, инфекционистом, фтизиатром. Проводились множественные методы исследования: УЗИ, МСКТ, ПЭТ/КТ, биопсия пахового ЛУ слева, лапароскопическая биопсия мезентериального ЛУ с целенаправленным поиском онкологической патологии иммуногистохимическим методом. Иммуноморфологическая картина биоптатов ЛУ не соответствовала лимфопролиферативному заболеванию. После проведения биопсии пахового ЛУ у пациента развилась флегмона левой паховой области. Терапия цефтриаксоном 2 г внутривенно 10 дней привела к нормализации температуры, улучшению общего самочувствия. Однако данные изменения не были грамотно оценены лечащим врачом. После отмены цефтриаксона быстро началось прогрессирование болезни. Больной оставался диагностически неясным, лечение не проводилось. Снижение массы тела в целом на 18 кг, тупые боли в околопупочной области без связи с приемом пищи, метеоризм за счет мезентериального лимфаденита потребовали пересмотра биоптатов пахового ЛУ слева, мезентериального ЛУ, при которых было высказано предположение о наличии БУ. Проведенное 17.05.2017 ЭГДС с множественной биопсией из ДПК, выявление PAS-позитивных макрофагов позволили поставить диагноз БУ через год от начала клинических проявлений. Начатая терапия первой линии цефтриаксоном 2 г внутривенно 14 дней с переходом на поддерживающую терапию триметоприм-сульфаметоксазолом (160 мг/800 г в сутки) внутрь позволила добиться существенной положительной динамики. Нормализовалась температура, восстановилась масса тела, работоспособность, нормализовался уровень гемоглобина, альбумина, исчез лимфаденит, в т. ч. мезентериальный, нормализовалась эндоскопическая картина и существенно уменьшилось количество PAS-положительных макрофагов в тонкой кишке через 9 мес. терапии.Заключение
Особенностями клинического течения БУ у больного 36 лет явились: атипичная картина продромального периода с лихорадкой, генерализованной лимфаденопатией, в т. ч. забрюшинных ЛУ, резкое похудание при отсутствии суставного и гастроинтестинального синдромов. Решающим для постановки диагноза через год от начала болезни послужило повторное проведение ЭГДС с множественной биопсией тонкой кишки, что позволило гистологически выявить PAS-положительные макрофаги в слизистой оболочке тонкой кишки. Своевременно начатая терапия цефтриаксоном в течение 14 дней, триметоприм-сульфаметоксазолом (160 мг/800 г в сутки) внутрь привели к положительной клинико-лабораторной динамике за 9 мес., уменьшению PAS-положительных макрофагов в кишечнике. По данным литературы, возможно добиться полного исчезновения PAS-положительных макрофагов в кишечнике через 3–6 мес. терапии, говоря о ремиссии заболевания [31, 77]. Однако в нашем случае мы констатируем клинико-лабораторное улучшение, необходимость продолжить терапию до 12 мес. Вопрос о дальнейшем продолжении терапии триметоприм-сульфаметоксазолом будет решаться индивидуально по динамике морфологической картины. Предполагается, что данный вариант продромального периода БУ потребует более длительного лечения.
Литература
1. la Scola B., Fenollar F., Fournier P-E. et al. Description of Tropheryma whipplei gen. nov., sp. nov., the Whipple’s disease bacillus // International Journal of Systematic and Evolutionary Microbiology. 2001. Vol. 51(4). P. 1471–1479.
2. Whipple G.H. A hitherto undescribed disease characterized anatomically by deposits of fat and fatty acids in the intestinal and mesenteric lymphatic tissues // Bulletin of the Johns Hopkins Hospital. 1907. Vol. 18. Р. 382–393.
3. Durand D.V., Lectomte C., Cathebras P. et al. Whipple disease. Clinical review of 52 cases. The SNFMI research group on Whipple disease // Societe Nationale Francaise de Medecine Interne. 1997. Vol. 76. P. 170.
4. Schneider T., Moos V., Loddenkemper C. et al. Whipple’s Disease: new aspects of pathogenesis and treatment // Lancet. Infect. Dis. 2008. Vol. 8. P. 179–190.
5. Fennollar F., Lepidi H., Raoult D. Whipple’s endocarditis: review of the literature and comparisons with Q fever, Bartonella infection, and blood culture-positive endocarditis // Clin Infect Dis. 2001. Vol. 33. P. 1309.
6. Biagi F, Balduzzi D., Delvino P. et al. Prevalence of Whipple’s disease in north-western Italy // Eur J Clin Microbiol Infect Dis. 2015. Vol. 34. P. 347–1348.
7. Von Herbay A., Otto H.F., Stolte M. et al. Epidemiology of Whipple’s disease in Germany. Analysis of 110 patients diagnosed in 1965–95 // Scand J Gastroenterol. 1997. Vol. 32. P. 52–57.
8. Корой П.В. Болезнь Уиппла // Вестник молодого ученого. 2017. №3(17). C. 36–40 [Koroj P.V. Bolezn Uippla//Vestnik molodogo uchenogo. 2017. № 3(17). P. 36–40. (in Russian)].
9. Fénollar F. Value of Tropheryma whipplei quantitative polymerase chain reaction assay for the diagnosis of Whipple disease: usefulness of saliva and stool specimens for first-line screening // Clin Infect Dis. 2008. Vol. 47. P. 659–667.
10. Fenollar F., Trani M., Davoust B. et al. Prevalence of asymptomatic Tropheryma whipplei carriage among humans and nonhuman primates // J Infec Dis. 2008. Vol. 197(6). Р. 880–887.
11. Schöniger-Hekele M., Petermann D., Weber B. et al. Tropheryma Whippelii in the environement: survey of sewage plant influxes and sewage plant workers // Appl Environ Microbiol. 2007. Vol. 73. Р. 2033–2035.
12. Zinkernagel A. S. Marginal and subgingival plaque — a natural habitat of Tropheryma whipplei? // Infection. 2003. Vol. 31. P. 86–91.
13. Maiwald M., Schuhmacher F., Ditton H.J. et al. Environmental occurence of the Whipple’s disease bacterium (Tropheryma Whippelii) // Appl Environment microbiol. 1998. Vol. 64. Р. 760–762.
14. Keita A.K., Bassene H., Tall A. et al. Tropheryma whipplei: a common bacterium in rural Senegal // PLoS Negl Trop Dis. 2011. Vol. 5 (12). Р. 1403.
15. Raoult D., Fenollar F., Rolain J.M. et al. Tropheryma whipplei in children with gastroenteritis // Emerg Infect Dis. 2010. Vol. 16. P. 776–782.
16. Keita A.K., Dubot-Peres A., Phommasone K. et al. High prevalence of Tropheryma whipplei in Lao kindergarten children // PLoS Negl Trop Dis. 2015. Vol. 9 (10). P. 1371.
17. Textbook of Gastroenterology, 5th edition / Fantry G.T., Fantry L.E., James S.P., Yamada T. Chichester. UK: Willey- Blackwell. 2009. P. 1225–1244.
18. Raoult D., Birg M.L., La Scola B. et al. Cultivation of the bacillus of Whipple’s disease // N Engl J Med. 2000. Vol. 342. P. 620–625.
19. La Scola B., Fenollar F., Perreal C., Raoult D. Epidemiologic implications of the first isolation and cultivation of Tropheryma whipplei from a saliva sample // Ann Intern Med. 2011. Vol. 154. P. 443–444.
20. Fenollar F., Ponge T., La Scola B. et al. First isolation of Tropheryma whipplei from bronchoalveolar fluid and clinical implications // J Infect. 2012. Vol. 65. P. 275–278.
21. Dutly F., Altwegg M. Whipple’s disease and «Tropheryma whippelii» // Clin Microbiol Rev. 2001. Vol. 14. P. 561–583.
22. Desnues B., Ihrig M., RaoultD. Mege J.-L. Whipple’s Disease: a Macrophage // Disease Clin Vaccine Immunol. 2006. Vol. 13(2). P. 170–178.
23. Peters S.E., Paterson G.K., Bandularatne E.S. et al. Salmonella enterica serovar typhimurium trxA mutants are protective against virulent challenge and induce less inflammation than the live-attenuated vaccine strain SL3261 // Infect Immun. 2010. Vol. 78. P. 326–336.
24. Ruben A., Dolmans V., Boel C.H.E. et al. Clinical manifestations, treatment, and diagnosis of Tropheryma whipplei infections // Clin Microbiol Rev. 2017. Vol. 30. P. 529–555.
25. Moos V., Schmidt C., Geelhaar A. et al. Impaired immune functions of monocytes and macrophages in Whipple’s disease // Gastroenterology. 2010. Vol. 138. P. 210–220.
26. Fenollar F., Amphoux B., Raoult D. A paradoxical Tropheryma whipplei Western blot differentiates patients with Whipple disease from asymptomatic carriers // Clin Infect Dis. 2009. Vol. 49. P. 717–723.
27. Maresi E., Argo A., Portelli F. et al. Rare occurrence of Whipple Disease in a young female patient with a fatal outcome // J Forensic Sci. 2013. Vol. 3(3). P. 85–91.
28. Lagier J.C., Lepidi H., Raoult D., Fenollar F. Systemic Tropheryma whipplei: clinical presentation of 142 patients with infections diagnosed or confirmed in a reference center // Medicine (Baltimore). 2010. Vol. 89 (5). Р. 337–334.
29. Fenollar, F., Lagier J., Raoult D. Tropheryma whipplei and Whipple’s disease // J Infection. 2014. Vol. 69. Р. 103–112.
30. Bureš J., Kopáčová М., Douda T. et al. Whipple’s Disease: Our Own Experience and Review of the Literatura // Gastroenterol Res Pract. 2013. Article ID 478349. doi: 10.1155/2013/478349.
31. Маев И.В., Жиляев Е.В., Дичива Д.Т. и др. Болезнь Уиппла // Рос. журн. гастроэнтерол. гепатол. колопроктол. 2008. №5. С. 80–85 [Maev I.V., ZHilyaev E.V., Dichiva D.T. i dr. Bolezn’ Uippla // Ross. zhurn. gastroehnterol. gepatol. koloproktol. 2008. №5. P. 80–85 (in Russian)].
32. Крумс А.М., Сабельникова Е.А., Голованова Е.В. и др. Болезнь Уиппла у больного детским церебральным параличом и циррозом печени В-вирусной этиологии // Тер. архив. 2014. №2. С. 69–71 [Krums A.M., Sabel’nikova E.A., Golovanova E.V. i dr. Bolezn’ Uippla u bol’nogo detskim cerebral’nym paralichom i cirrozom pecheni V-virusnoj ehtiologii // Ter. arhiv. 2014. №2. P. 69–71 (in Russian)].
33. Дорофеев А. Болезнь Уиппла: клиника, диагностика, лечение // Новости медицины и фармации. Гастроэнтерология. 2011. №358. С. 3–4 [Dorofeev A.EH. Bolezn’ Uippla: klinika, diagnostika, lechenie // Novosti mediciny i farmacii. Gastroehnterologiya. 2011. №358. P. 3–471 (in Russian)].
34. Ягур В.Е. Болезнь Уиппла // Медицинский журнал. 2016. №1. С. 76–81 [Yagur V.E. Bolezn’ Uippla // Medicinskij zhurnal. 2016. №1. P. 76–81 (in Russian)].
35. Белов Б.С. Болезнь Уиппла // РМЖ. 2014. №28. С. 2063 [Belov B.S. Bolezn’ Uippla // RMJ. 2014. №28. P. 2063. (in Russian)].
36. Fenollar F., Keita A.K., Buffet S., Raoult D. Intrafamilial circulation of Tropheryma whipplei, France // Emerg Infect Dis. 2012. Vol. 18. P. 949–955.
37. Moos V., Schneider T. Changing paradigms in Whipple’s disease and infection with Tropheryma whipplei // Eur J Clin Microbiol Infect Dis. 2011. Vol. 30. P. 1151–1158.
38. Fenollar F., Mediannikov O., Socolovschi C. Tropheryma whipplei bacteremia during fever in rural West Africa // Clin Infect Dis. 2010. Vol. 51. P. 515–521.
39. Lagier J.C., Fenollar F., Raoult D. Whipple’s disease and Tropheryma whipplei infections in internal medicine. When to think about it? How to treat? // Rev Med Interne. 2014. Vol. 35. P. 801–807.
40. Marth T. Systematic review: Whipple’s disease (Tropheryma whipplei infection) and its unmasking by tumour necrosis factor inhibitors // Aliment Pharmacol Ther. 2015. Vol. 41(8). P. 709–724.
41. Puechal X. Whipple disease and arthritis // Curr Opin Rheumatol. 2001. Vol. 13. P. 74–79.
42. Krol C.G., de Meijer P.H. Palindromic rheumatism: consider Whipple’s disease // Int J Rheum Dis. 2013. Vol. 16. P. 475–476.
43. Mahnel R., Kalt A., Ring S. et al. Immunosuppressive therapy in Whipple’s disease patients is associated with the appearance of gastrointestinal manifestations // Am J Gastroenterol 2005. Vol. 100. P. 1167–1173.
44. Whipple’s disease / Dobbins W.O. Springfield, IL. 1987. 242 p.
45. Schwartzman S., Schwartzman M. Whipple’s disease // Rheum Dis Clin North Am. 2013. Vol. 39. P. 313–321.
46. Love S.M., Morrison L., Appleby C., Modi P. Tropheryma whipplei endocarditis without gastrointestinal involvement // Interact Cardiovasc Thorac Surg. 2012. Vol. 15. P. 161–163.
47. Rusina R., Keller O., Sima R., Zamecnik J. Peripheral neuropathy in Whipples disease: a case report // Cesk Patol. 2012. Vol. 48. P. 97–99.
48. Gran J.T., Husby G. Joint manifestations in gastrointestinal diseases. 2. Whipple’s disease, enteric infections, intestinal bypass operations, gluten-sensitive enteropathy, pseudomembranous colitis and collagenous colitis // Dig Dis. 1992. Vol. 10. P. 295–312.
49. Smyth C., Kelleher D., Keeling P.W. Hepatic manifestations of gastrointestinal diseases: inflammatory bowel disease, celiac disease, and Whipple’s disease // Clin Liver Dis. 2002. Vol. 6. P. 1013–1032.
50. Marcial M.A., Villafaña M. Whipple’s disease with esophageal and colonic involvement: endoscopic and histopathologic findings // Gastrointestinal Endoscopy. 1997. Vol. 46(3). P. 263–266.
51. Klochan С., Anderson T. A., Rose D. et al. Nearly Fatal Case of Whipple’s Disease in a Patient Mistakenly on Anti-TNF TherapyACG // Case Rep J. 2013. Vol. 1(1). P. 25–28.
52. Black D.F., Aksamit A.J., Morris J.M. MR imaging of central nervous system Whipple disease: a 15-year review // AJNR Am J Neuroradiol. 2010. Vol. 31. P. 1493–1497.
53. Compain C., Sacre K., Puechal X. et al. Central nervous system involvement in Whipple disease: clinical study of 18 patients and long-term follow-up // Medicine (Baltimore). 2013. Vol. 92. P. 324–330.
54. Louis E.D., Lynch T., Kaufmann P. et al. Diagnostic guidelines in central nervous system Whipple’s disease // Ann Neurol. 1996. Vol. 40. P. 561–568.
54. Panegyres P.K. Diagnosis and management of Whipple’s disease of the brain // Pract Neurol. 2008. Vol. 8. P. 311–317.
55. Black D.F., Aksamit A.J., Morris J.M. MR imaging of central nervous system Whipple disease: a 15-year review // AJNR Am J Neuroradiol. 2010. Vol. 31. P. 1493–1497.
56. Enzinger F.M., Helwig E.B. Whipple’s disease: a review of the literature and report fifteen patients // Virchows Arch Pathol Anat Physiol Klin Med. 1963. Vol. 336. P. 238–269.
57. Geissdorfer W., Moos V., Moter A. et al. High frequency of Tropheryma whipplei in culture-negative endocarditis // J Clin Microbiol. 2012. Vol. 50. P. 216–222.
58. Fenollar F., Célard M., Lagier J.C. et al. Tropheryma whipplei endocarditis // Emerg Infect Dis. 2013. Vol. 19 (11). Р. 1721–1730.
59. Stojan G., Melia M.T., Khandhar S.J. et al. Constrictive pleuropericarditis: a dominant clinical manifestation in Whipple’s disease // BMC Infect Dis. 2013. Vol. 13. P. 579.
60. Urbanski G., Rivereau P., Artru L. et al. Whipple disease revealed by lung involvement: a case report and literature review // Chest. 2012. Vol. 141. P. 1595–1598.
61. Baloira A., Nunez M., Tumbeiro M. et al. Pulmonary hypertension associated with Whipple disease // Eur Respir Rev. 2014. Vol. 23. P. 533–536.
62. Friedmann A.C., Perera G.K., Jayaprakasam A. et al. Whipple’s disease presenting with symmetrical panniculitis // Br J Dermatol. 2004. Vol. 151. P. 907–911.
63. Paul J., Schaller J., Rohwedder A., Carlson J.A. Treated Whipple disease with erythema nodosum leprosum-like lesions: cutaneous PAS-positive macrophages slowly decrease with time and are associated with lymphangiectases: a case report // Am J Dermatopathol. 2012. Vol. 34. P. 182–187.
64. Alzahrani A.S., Al Sheef M. Severe primary hyperparathyroidism masked by asymptomatic celiac disease // Endocrine Practice. 2008. Vol. 14(3). P. 347–350.
65. Mori K., Ando I., Kukita A. Generalized hyperpigmentation of the skin due to vitamin B12 deficiency // Journal of Dermatology. 2001. Vol. 28(5). P. 282–285.
66. Drancourt M., Raoult D., Lepidi H. et al. Culture of Tropheryma whippelii from the vitreous fluid of a patient presenting with unilateral uveitis // Ann Intern Med. 2003. Vol. 139. P. 1046–1047.
67. Loughran D., Beale L., Lodge F. et al. Whipple’s in the valleys: a case of Whipple’s with thrombocytopenia and endocarditis // J Clin Pathol. 2014. Vol. 67. P. 445–448.
68. Edouard S., Fenollar F., Raoult D. The rise of Tropheryma whipplei: a 12-year retrospective study of PCR diagnoses in our reference center // J Clin Microbiol. 2012. Vol. 50(12). P. 3917–3920.
69. Edouard S., Fenollar F., Raoult D. The Rise of Tropheryma whipplei: a 12-Year Retrospective Study of PCR Diagnoses in Our Reference Center //J. Clin. Microbiol. 2012. Vol. 50(12). P. 3917–3920.
70. Chizinga M., Schiliro D., Mullin B., Barrie R. Mesenteric lymphadenitis as a presenting feature of Whipple’s disease // IDCases. 2017. Vol. 9. P. 50–52.
71. Gornals J.B., Baixeras N., Pales M.J. et al. Diagnosis of Whipple’s disease by EUS-guided-FNA and endoscopic biopsy at the same procedure // Gastrointestinal Endoscopy. 2012. Vol. 75(4). P. 895–896.
72. Lepidi H., Costedoat N., Piette J.C. et al. Immunohistological detection of Tropheryma whipplei (Whipple bacillus) in lymph nodes // Am J Med. 2002. Vol. 113. P. 334–336.
73. Boulos A., Rolain J-M., Raoult D. Antibiotic susceptibility of Tropheryma whipplei in MRC5 cells // Antimicrobial Agents and Chemotherapy. 2004. Vol. 48(3). P. 747–752.
74. Keinath R.D., Merrell D.E., Vlietstra R., Dobbins W.O. Antibiotic treatment and relapse in Whipple’s disease: long term follow-up of 88 patients // Gastroenterology. 1985. Vol. 88. P. 1867–1873.
75. Feurle G.E., Junga N.S., Marth T. Efficacy of ceftriaxone or meropenem as initial therapies in Whipple’s disease // Gastroenterology. 2010. Vol. 138(2). P. 478–486.
76. Apstein M.D., Schneider T. Whipple’s disease. UpToDate. [Электронный ресурс] //Wolters Kluwer, Waltham, MA. 2016. URL: http://www.uptodate.com/contents/whipples-disease.
77. Feurle G.E., Moos V., Bläker H. et al. Intravenous ceftriaxone, followed by 12 or three months of oral treatment with trimethoprim-sulfamethoxazole in Whipple’s disease // Journal of Infection. 2013. Vol. 66(3). P. 263–270.
78. Lagier J.C., Fenollar F., Lepidi H. et al. Treatment of classic Whipple’s disease: from in vitro results to clinical outcome // J Antimicrob Chemother. 2014. Vol. 69. P. 219–227.
79. Меликян А.Л., Ковригина А.М., Никитин Е.А. Клин. рекоменд. по диагностике лимфаденопатий. М. 2014. 38 с. [Melikyan A.L., Kovrigina A.M., Nikitin E.A. Klin. rekomend. po diagnostike limfadenopatij. M. 2014. 38 р. (in Russian)].
2. Whipple G.H. A hitherto undescribed disease characterized anatomically by deposits of fat and fatty acids in the intestinal and mesenteric lymphatic tissues // Bulletin of the Johns Hopkins Hospital. 1907. Vol. 18. Р. 382–393.
3. Durand D.V., Lectomte C., Cathebras P. et al. Whipple disease. Clinical review of 52 cases. The SNFMI research group on Whipple disease // Societe Nationale Francaise de Medecine Interne. 1997. Vol. 76. P. 170.
4. Schneider T., Moos V., Loddenkemper C. et al. Whipple’s Disease: new aspects of pathogenesis and treatment // Lancet. Infect. Dis. 2008. Vol. 8. P. 179–190.
5. Fennollar F., Lepidi H., Raoult D. Whipple’s endocarditis: review of the literature and comparisons with Q fever, Bartonella infection, and blood culture-positive endocarditis // Clin Infect Dis. 2001. Vol. 33. P. 1309.
6. Biagi F, Balduzzi D., Delvino P. et al. Prevalence of Whipple’s disease in north-western Italy // Eur J Clin Microbiol Infect Dis. 2015. Vol. 34. P. 347–1348.
7. Von Herbay A., Otto H.F., Stolte M. et al. Epidemiology of Whipple’s disease in Germany. Analysis of 110 patients diagnosed in 1965–95 // Scand J Gastroenterol. 1997. Vol. 32. P. 52–57.
8. Корой П.В. Болезнь Уиппла // Вестник молодого ученого. 2017. №3(17). C. 36–40 [Koroj P.V. Bolezn Uippla//Vestnik molodogo uchenogo. 2017. № 3(17). P. 36–40. (in Russian)].
9. Fénollar F. Value of Tropheryma whipplei quantitative polymerase chain reaction assay for the diagnosis of Whipple disease: usefulness of saliva and stool specimens for first-line screening // Clin Infect Dis. 2008. Vol. 47. P. 659–667.
10. Fenollar F., Trani M., Davoust B. et al. Prevalence of asymptomatic Tropheryma whipplei carriage among humans and nonhuman primates // J Infec Dis. 2008. Vol. 197(6). Р. 880–887.
11. Schöniger-Hekele M., Petermann D., Weber B. et al. Tropheryma Whippelii in the environement: survey of sewage plant influxes and sewage plant workers // Appl Environ Microbiol. 2007. Vol. 73. Р. 2033–2035.
12. Zinkernagel A. S. Marginal and subgingival plaque — a natural habitat of Tropheryma whipplei? // Infection. 2003. Vol. 31. P. 86–91.
13. Maiwald M., Schuhmacher F., Ditton H.J. et al. Environmental occurence of the Whipple’s disease bacterium (Tropheryma Whippelii) // Appl Environment microbiol. 1998. Vol. 64. Р. 760–762.
14. Keita A.K., Bassene H., Tall A. et al. Tropheryma whipplei: a common bacterium in rural Senegal // PLoS Negl Trop Dis. 2011. Vol. 5 (12). Р. 1403.
15. Raoult D., Fenollar F., Rolain J.M. et al. Tropheryma whipplei in children with gastroenteritis // Emerg Infect Dis. 2010. Vol. 16. P. 776–782.
16. Keita A.K., Dubot-Peres A., Phommasone K. et al. High prevalence of Tropheryma whipplei in Lao kindergarten children // PLoS Negl Trop Dis. 2015. Vol. 9 (10). P. 1371.
17. Textbook of Gastroenterology, 5th edition / Fantry G.T., Fantry L.E., James S.P., Yamada T. Chichester. UK: Willey- Blackwell. 2009. P. 1225–1244.
18. Raoult D., Birg M.L., La Scola B. et al. Cultivation of the bacillus of Whipple’s disease // N Engl J Med. 2000. Vol. 342. P. 620–625.
19. La Scola B., Fenollar F., Perreal C., Raoult D. Epidemiologic implications of the first isolation and cultivation of Tropheryma whipplei from a saliva sample // Ann Intern Med. 2011. Vol. 154. P. 443–444.
20. Fenollar F., Ponge T., La Scola B. et al. First isolation of Tropheryma whipplei from bronchoalveolar fluid and clinical implications // J Infect. 2012. Vol. 65. P. 275–278.
21. Dutly F., Altwegg M. Whipple’s disease and «Tropheryma whippelii» // Clin Microbiol Rev. 2001. Vol. 14. P. 561–583.
22. Desnues B., Ihrig M., RaoultD. Mege J.-L. Whipple’s Disease: a Macrophage // Disease Clin Vaccine Immunol. 2006. Vol. 13(2). P. 170–178.
23. Peters S.E., Paterson G.K., Bandularatne E.S. et al. Salmonella enterica serovar typhimurium trxA mutants are protective against virulent challenge and induce less inflammation than the live-attenuated vaccine strain SL3261 // Infect Immun. 2010. Vol. 78. P. 326–336.
24. Ruben A., Dolmans V., Boel C.H.E. et al. Clinical manifestations, treatment, and diagnosis of Tropheryma whipplei infections // Clin Microbiol Rev. 2017. Vol. 30. P. 529–555.
25. Moos V., Schmidt C., Geelhaar A. et al. Impaired immune functions of monocytes and macrophages in Whipple’s disease // Gastroenterology. 2010. Vol. 138. P. 210–220.
26. Fenollar F., Amphoux B., Raoult D. A paradoxical Tropheryma whipplei Western blot differentiates patients with Whipple disease from asymptomatic carriers // Clin Infect Dis. 2009. Vol. 49. P. 717–723.
27. Maresi E., Argo A., Portelli F. et al. Rare occurrence of Whipple Disease in a young female patient with a fatal outcome // J Forensic Sci. 2013. Vol. 3(3). P. 85–91.
28. Lagier J.C., Lepidi H., Raoult D., Fenollar F. Systemic Tropheryma whipplei: clinical presentation of 142 patients with infections diagnosed or confirmed in a reference center // Medicine (Baltimore). 2010. Vol. 89 (5). Р. 337–334.
29. Fenollar, F., Lagier J., Raoult D. Tropheryma whipplei and Whipple’s disease // J Infection. 2014. Vol. 69. Р. 103–112.
30. Bureš J., Kopáčová М., Douda T. et al. Whipple’s Disease: Our Own Experience and Review of the Literatura // Gastroenterol Res Pract. 2013. Article ID 478349. doi: 10.1155/2013/478349.
31. Маев И.В., Жиляев Е.В., Дичива Д.Т. и др. Болезнь Уиппла // Рос. журн. гастроэнтерол. гепатол. колопроктол. 2008. №5. С. 80–85 [Maev I.V., ZHilyaev E.V., Dichiva D.T. i dr. Bolezn’ Uippla // Ross. zhurn. gastroehnterol. gepatol. koloproktol. 2008. №5. P. 80–85 (in Russian)].
32. Крумс А.М., Сабельникова Е.А., Голованова Е.В. и др. Болезнь Уиппла у больного детским церебральным параличом и циррозом печени В-вирусной этиологии // Тер. архив. 2014. №2. С. 69–71 [Krums A.M., Sabel’nikova E.A., Golovanova E.V. i dr. Bolezn’ Uippla u bol’nogo detskim cerebral’nym paralichom i cirrozom pecheni V-virusnoj ehtiologii // Ter. arhiv. 2014. №2. P. 69–71 (in Russian)].
33. Дорофеев А. Болезнь Уиппла: клиника, диагностика, лечение // Новости медицины и фармации. Гастроэнтерология. 2011. №358. С. 3–4 [Dorofeev A.EH. Bolezn’ Uippla: klinika, diagnostika, lechenie // Novosti mediciny i farmacii. Gastroehnterologiya. 2011. №358. P. 3–471 (in Russian)].
34. Ягур В.Е. Болезнь Уиппла // Медицинский журнал. 2016. №1. С. 76–81 [Yagur V.E. Bolezn’ Uippla // Medicinskij zhurnal. 2016. №1. P. 76–81 (in Russian)].
35. Белов Б.С. Болезнь Уиппла // РМЖ. 2014. №28. С. 2063 [Belov B.S. Bolezn’ Uippla // RMJ. 2014. №28. P. 2063. (in Russian)].
36. Fenollar F., Keita A.K., Buffet S., Raoult D. Intrafamilial circulation of Tropheryma whipplei, France // Emerg Infect Dis. 2012. Vol. 18. P. 949–955.
37. Moos V., Schneider T. Changing paradigms in Whipple’s disease and infection with Tropheryma whipplei // Eur J Clin Microbiol Infect Dis. 2011. Vol. 30. P. 1151–1158.
38. Fenollar F., Mediannikov O., Socolovschi C. Tropheryma whipplei bacteremia during fever in rural West Africa // Clin Infect Dis. 2010. Vol. 51. P. 515–521.
39. Lagier J.C., Fenollar F., Raoult D. Whipple’s disease and Tropheryma whipplei infections in internal medicine. When to think about it? How to treat? // Rev Med Interne. 2014. Vol. 35. P. 801–807.
40. Marth T. Systematic review: Whipple’s disease (Tropheryma whipplei infection) and its unmasking by tumour necrosis factor inhibitors // Aliment Pharmacol Ther. 2015. Vol. 41(8). P. 709–724.
41. Puechal X. Whipple disease and arthritis // Curr Opin Rheumatol. 2001. Vol. 13. P. 74–79.
42. Krol C.G., de Meijer P.H. Palindromic rheumatism: consider Whipple’s disease // Int J Rheum Dis. 2013. Vol. 16. P. 475–476.
43. Mahnel R., Kalt A., Ring S. et al. Immunosuppressive therapy in Whipple’s disease patients is associated with the appearance of gastrointestinal manifestations // Am J Gastroenterol 2005. Vol. 100. P. 1167–1173.
44. Whipple’s disease / Dobbins W.O. Springfield, IL. 1987. 242 p.
45. Schwartzman S., Schwartzman M. Whipple’s disease // Rheum Dis Clin North Am. 2013. Vol. 39. P. 313–321.
46. Love S.M., Morrison L., Appleby C., Modi P. Tropheryma whipplei endocarditis without gastrointestinal involvement // Interact Cardiovasc Thorac Surg. 2012. Vol. 15. P. 161–163.
47. Rusina R., Keller O., Sima R., Zamecnik J. Peripheral neuropathy in Whipples disease: a case report // Cesk Patol. 2012. Vol. 48. P. 97–99.
48. Gran J.T., Husby G. Joint manifestations in gastrointestinal diseases. 2. Whipple’s disease, enteric infections, intestinal bypass operations, gluten-sensitive enteropathy, pseudomembranous colitis and collagenous colitis // Dig Dis. 1992. Vol. 10. P. 295–312.
49. Smyth C., Kelleher D., Keeling P.W. Hepatic manifestations of gastrointestinal diseases: inflammatory bowel disease, celiac disease, and Whipple’s disease // Clin Liver Dis. 2002. Vol. 6. P. 1013–1032.
50. Marcial M.A., Villafaña M. Whipple’s disease with esophageal and colonic involvement: endoscopic and histopathologic findings // Gastrointestinal Endoscopy. 1997. Vol. 46(3). P. 263–266.
51. Klochan С., Anderson T. A., Rose D. et al. Nearly Fatal Case of Whipple’s Disease in a Patient Mistakenly on Anti-TNF TherapyACG // Case Rep J. 2013. Vol. 1(1). P. 25–28.
52. Black D.F., Aksamit A.J., Morris J.M. MR imaging of central nervous system Whipple disease: a 15-year review // AJNR Am J Neuroradiol. 2010. Vol. 31. P. 1493–1497.
53. Compain C., Sacre K., Puechal X. et al. Central nervous system involvement in Whipple disease: clinical study of 18 patients and long-term follow-up // Medicine (Baltimore). 2013. Vol. 92. P. 324–330.
54. Louis E.D., Lynch T., Kaufmann P. et al. Diagnostic guidelines in central nervous system Whipple’s disease // Ann Neurol. 1996. Vol. 40. P. 561–568.
54. Panegyres P.K. Diagnosis and management of Whipple’s disease of the brain // Pract Neurol. 2008. Vol. 8. P. 311–317.
55. Black D.F., Aksamit A.J., Morris J.M. MR imaging of central nervous system Whipple disease: a 15-year review // AJNR Am J Neuroradiol. 2010. Vol. 31. P. 1493–1497.
56. Enzinger F.M., Helwig E.B. Whipple’s disease: a review of the literature and report fifteen patients // Virchows Arch Pathol Anat Physiol Klin Med. 1963. Vol. 336. P. 238–269.
57. Geissdorfer W., Moos V., Moter A. et al. High frequency of Tropheryma whipplei in culture-negative endocarditis // J Clin Microbiol. 2012. Vol. 50. P. 216–222.
58. Fenollar F., Célard M., Lagier J.C. et al. Tropheryma whipplei endocarditis // Emerg Infect Dis. 2013. Vol. 19 (11). Р. 1721–1730.
59. Stojan G., Melia M.T., Khandhar S.J. et al. Constrictive pleuropericarditis: a dominant clinical manifestation in Whipple’s disease // BMC Infect Dis. 2013. Vol. 13. P. 579.
60. Urbanski G., Rivereau P., Artru L. et al. Whipple disease revealed by lung involvement: a case report and literature review // Chest. 2012. Vol. 141. P. 1595–1598.
61. Baloira A., Nunez M., Tumbeiro M. et al. Pulmonary hypertension associated with Whipple disease // Eur Respir Rev. 2014. Vol. 23. P. 533–536.
62. Friedmann A.C., Perera G.K., Jayaprakasam A. et al. Whipple’s disease presenting with symmetrical panniculitis // Br J Dermatol. 2004. Vol. 151. P. 907–911.
63. Paul J., Schaller J., Rohwedder A., Carlson J.A. Treated Whipple disease with erythema nodosum leprosum-like lesions: cutaneous PAS-positive macrophages slowly decrease with time and are associated with lymphangiectases: a case report // Am J Dermatopathol. 2012. Vol. 34. P. 182–187.
64. Alzahrani A.S., Al Sheef M. Severe primary hyperparathyroidism masked by asymptomatic celiac disease // Endocrine Practice. 2008. Vol. 14(3). P. 347–350.
65. Mori K., Ando I., Kukita A. Generalized hyperpigmentation of the skin due to vitamin B12 deficiency // Journal of Dermatology. 2001. Vol. 28(5). P. 282–285.
66. Drancourt M., Raoult D., Lepidi H. et al. Culture of Tropheryma whippelii from the vitreous fluid of a patient presenting with unilateral uveitis // Ann Intern Med. 2003. Vol. 139. P. 1046–1047.
67. Loughran D., Beale L., Lodge F. et al. Whipple’s in the valleys: a case of Whipple’s with thrombocytopenia and endocarditis // J Clin Pathol. 2014. Vol. 67. P. 445–448.
68. Edouard S., Fenollar F., Raoult D. The rise of Tropheryma whipplei: a 12-year retrospective study of PCR diagnoses in our reference center // J Clin Microbiol. 2012. Vol. 50(12). P. 3917–3920.
69. Edouard S., Fenollar F., Raoult D. The Rise of Tropheryma whipplei: a 12-Year Retrospective Study of PCR Diagnoses in Our Reference Center //J. Clin. Microbiol. 2012. Vol. 50(12). P. 3917–3920.
70. Chizinga M., Schiliro D., Mullin B., Barrie R. Mesenteric lymphadenitis as a presenting feature of Whipple’s disease // IDCases. 2017. Vol. 9. P. 50–52.
71. Gornals J.B., Baixeras N., Pales M.J. et al. Diagnosis of Whipple’s disease by EUS-guided-FNA and endoscopic biopsy at the same procedure // Gastrointestinal Endoscopy. 2012. Vol. 75(4). P. 895–896.
72. Lepidi H., Costedoat N., Piette J.C. et al. Immunohistological detection of Tropheryma whipplei (Whipple bacillus) in lymph nodes // Am J Med. 2002. Vol. 113. P. 334–336.
73. Boulos A., Rolain J-M., Raoult D. Antibiotic susceptibility of Tropheryma whipplei in MRC5 cells // Antimicrobial Agents and Chemotherapy. 2004. Vol. 48(3). P. 747–752.
74. Keinath R.D., Merrell D.E., Vlietstra R., Dobbins W.O. Antibiotic treatment and relapse in Whipple’s disease: long term follow-up of 88 patients // Gastroenterology. 1985. Vol. 88. P. 1867–1873.
75. Feurle G.E., Junga N.S., Marth T. Efficacy of ceftriaxone or meropenem as initial therapies in Whipple’s disease // Gastroenterology. 2010. Vol. 138(2). P. 478–486.
76. Apstein M.D., Schneider T. Whipple’s disease. UpToDate. [Электронный ресурс] //Wolters Kluwer, Waltham, MA. 2016. URL: http://www.uptodate.com/contents/whipples-disease.
77. Feurle G.E., Moos V., Bläker H. et al. Intravenous ceftriaxone, followed by 12 or three months of oral treatment with trimethoprim-sulfamethoxazole in Whipple’s disease // Journal of Infection. 2013. Vol. 66(3). P. 263–270.
78. Lagier J.C., Fenollar F., Lepidi H. et al. Treatment of classic Whipple’s disease: from in vitro results to clinical outcome // J Antimicrob Chemother. 2014. Vol. 69. P. 219–227.
79. Меликян А.Л., Ковригина А.М., Никитин Е.А. Клин. рекоменд. по диагностике лимфаденопатий. М. 2014. 38 с. [Melikyan A.L., Kovrigina A.M., Nikitin E.A. Klin. rekomend. po diagnostike limfadenopatij. M. 2014. 38 р. (in Russian)].

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
