Аспергиллез головного мозга как осложнение новой коронавирусной инфекции (COVID-19) (клиническое наблюдение)
Плесневый сапрофитный грибок Aspergillus широко распространен в окружающей среде. Большинство людей вдыхают его споры ежедневно, но развивается аспергиллез преимущественно у иммунокомпрометированных лиц. Инвазивные микозы, в том числе аспергиллез, осложняя новую коронавирусную инфекцию (COVID-19), протекают тяжело и с высокой летальностью даже у пациентов, не имевших ранее факторов риска развития микотических поражений. В настоящей работе представлено клиническое наблюдение развития аспергиллеза на фоне перенесенного COVID-19 при отсутствии других факторов риска развития инвазивных микозов. Инфицирование плесневым грибком могло произойти двумя путями: аэрогенно через носовые ходы либо через глазное яблоко. Поражения легких, поджелудочной железы и органов иммунной системы на фоне перенесенного COVID-19 способствовали развитию аспергиллеза, диагностированного при патологоанатомическом исследовании.
Ключевые слова: аспергиллез, нейроаспергиллез, инвазивный микоз, коронавирусная инфекция, COVID-19, осложнения.
Для цитирования: Бусалаева Е.И., Башкова И.Б., Максимов Р.С., Щукина Т.В., Игнатьева Е.Н., Иванова Н.Е. Аспергиллез головного мозга как осложнение новой коронавирусной инфекции (COVID-19) (клиническое наблюдение). РМЖ. Медицинское обозрение. 2023;31(2):77-82.
Cerebral aspergillosis as a complication of COVID-19 (case report)
E.I. Busalaeva1,2, I.B. Bashkova1, R.S. Maksimov1,3, T.V. Shchukina1,3, E.N. Ignatieva4, N.E. Ivanova1,3
1Chuvash State University named after I.N. Ulyanov, Cheboksary
2Chuvash Republic Postgraduate Doctors’ Training Institute, Cheboksary
3City Clinical Hospital No. 1, Cheboksary
4Republican Bureau of Forensic Medical Examination, Cheboksary
Aspergillus fumigatus is a saprophytic fungus which is widespread in the environment. Most people inhale its spores daily, but aspergillosis develops mainly in immunocompromised persons. Invasive mycoses, including aspergillosis, complicating the COVID-19 course, are severe and have high mortality even in patients who had no previous risk factors for the mycotic lesions. This article presents a clinical case of the aspergillosis development in the setting of COVID-19 in the absence of other risk factors for invasive mycoses. Infection with fungal mold could occur in two ways: through the nasal passages (aerogenic way) or through the eyeball. Lesions of the lungs, pancreas and immune organs in the setting of COVID-19 contributed to the development of aspergillosis, diagnosed during postmortem study.
Keywords: aspergillosis, neuroaspergillosis, invasive mycosis, coronavirus infection, COVID-19, complications.
For citation: Busalaeva E.I., Bashkova I.B., Maksimov R.S. et al. Cerebral aspergillosis as a complication of COVID-19 (case report). RMJ. 2023;2:77–82.

Введение
Инвазивные грибковые инфекции остаются актуальной проблемой здравоохранения, поскольку характеризуются тяжелым клиническим течением и высокой летальностью. Традиционно в группу риска по развитию микозов входят пациенты с онкологическими и гематологическими заболеваниями в процессе полихимиотерапии, после трансплантации костного мозга и т. п. Это объясняется выраженным иммунодефицитом у этих пациентов, который усугубляется приемом глюкокортикоидов и иммуносупрессоров. Неконтролируемый сахарный диабет, трансплантация органов, массивная антибактериальная терапия препаратами широкого спектра действия, длительная нейтропения, инфекция, ассоциированная с вирусом иммунодефицита человека, также приводят к иммуносупрессии [1, 2]. Врачи, курирующие пациентов с этими заболеваниями, как правило, учитывают возможность развития инвазивных микозов. Компьютерная томография (КТ), магнитно-резонансная томография (МРТ), позитронно-эмиссионная томография, ультразвуковое исследование расширяют возможности диагностики этих заболеваний.
Понятие «аспергиллез» включает широкий спектр заболеваний, вызываемых грибками рода Aspergillus. Плесневые сапрофитные грибки Aspergillus spp. широко распространены в окружающей среде. Большинство людей вдыхают споры аспергилл ежедневно, но развивается аспергиллез преимущественно у иммунокомпрометированных лиц. Однако в последние годы инвазивный аспергиллез стал чаще встречаться у пациентов без типичных факторов риска, особенно в отделениях реанимации и интенсивной терапии [3, 4]. Инвазивные микозы — тяжелые осложнения новой коронавирусной инфекции (COVID-19) с высокой летальностью. Наиболее часто развиваются мукормикоз, инвазивный аспергиллез, инвазивный кандидоз [4–7]. С 2020 г. увеличивается число пациентов с инвазивными микозами, осложняющими течение и период реконвалесценции COVID-19, в том числе с поражением костей лицевого отдела черепа, полости носа и околоносовых пазух [8]. Обширные микотические поражения костей лицевого отдела черепа и околоносовых пазух относят к состояниям, угрожающим жизни вследствие анатомической близости к структурам головного мозга и высокого риска диссеминации патогенного грибка со смертельным исходом.
Иммуносупрессия, обусловленная инфекцией коронавирусом SARS-CoV-2, значительно увеличивает риск развития микозов. Кроме того, имеют значение лимфо- и нейтропения, сопровождающие заболевание, применение стероидных гормонов и генно-инженерных биологических препаратов. В литературе рассматривают и другие факторы, способствующие развитию микозов у данной категории пациентов, такие как сахарный диабет, повышение уровня сывороточного железа, высокопоточная оксигенотерапия, ангиопатические и тромботические эффекты коронавируса SARS-CoV-2 [9–11]. Характерно, что микозы могут развиваться в качестве коинфекции также у пациентов, не имевших до заболевания традиционных факторов риска, связанных с иммуносупрессией. Проанализировав данные литературы, В.В. Шкарин и Н.В. Саперкин [3] указывают на способность Aspergillus spp. участвовать в комплексной коморбидности не только у иммунокомпрометированных пациентов, но и у людей с нормальным состоянием иммунной системы.
В качестве иллюстрации приводим собственное клиническое наблюдение.
Клиническое наблюдение
Пациентка П., 61 год, хронические заболевания отрицала, никаких лекарственных препаратов постоянно не принимала. В июне 2021 г. заболела COVID-19, что было подтверждено обнаружением РНК SARS-CoV-2 в мазках из носо- и ротоглотки с помощью полимеразной цепной реакции. У пациентки развилась двусторонняя полисегментарная пневмония с поражением легких средней степени тяжести. Пациентку госпитализировали в специализированное отделение, где она получала лечение в соответствии с действующими на тот момент временными методическими рекомендациями по лечению COVID-19, в том числе дексаметазон 16 мг/сут, антибактериальную терапию. Через неделю впервые выявлена гипергликемия до 17,6 ммоль/л, назначен инсулин. Длительность госпитализации составила 15 дней.
Пациентка была выписана с улучшением и рекомендациями продолжить лечение в амбулаторных условиях. Через неделю после выписки значительно усилилась слабость в нижних конечностях, сохранялось снижение аппетита, похудание. Кроме того, пациентку особенно беспокоила потеря зрения на левый глаз и опущение левого верхнего века, в связи с чем она обратилась за медицинской помощью.
После исключения острого нарушения мозгового кровообращения (ОНМК) 10.08.2021 пациентку госпитализировали в эндокринологическое отделение городского стационара с диагнозом: впервые выявленный сахарный диабет 2 типа, осложненный мононевропатией n. оculomotorius.
Заключение по данным КТ органов грудной клетки: признаки остаточных изменений после перенесенной двусторонней полисегментарной вирусной пневмонии.
В ходе обследования офтальмолог диагностировал под-острый тромбоз центральной артерии сетчатки и субат-рофию зрительного нерва с обеих сторон, однако в связи с тяжестью состояния перевод в офтальмологическую клинику был сочтен нецелесообразным. В дальнейшем присое-динилась множественная краниальная невропатия.
Повторно выполнены МРТ и магнитно-резонансная венография головного мозга 16.08.2021. Выявлена зона острой лакунарной ишемии в медиобазальных отделах левой височной доли (рис. 1). Для дальнейшего лечения пациентка переведена в первичное сосудистое отделение для больных с ОНМК Городской клинической больницы № 1 г. Чебоксары.
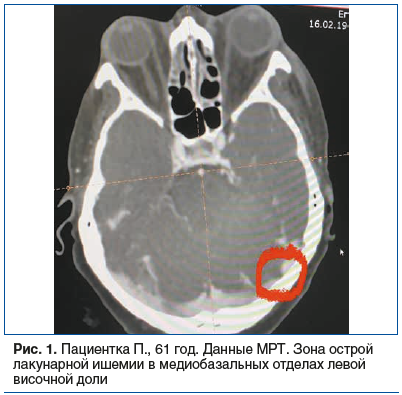
Объективный осмотр: кожные покровы сухие, множественные постинъекционные подкожные гематомы на тыльных поверхностях обеих кистей, в области локтевых сгибов, предплечья. ЧСС до 100 в 1 мин, АД 130/90 мм рт. ст., ЧДД в покое >20 в 1 мин, SpO2 94%. Неврологический статус: сознание ясное, контактна, ориентирована во времени и пространстве правильно. Память явно не снижена. Менингеальных симптомов нет. Парезов конечностей нет. Нормосмия, двусторонний птоз, двусторонний амавроз. Самостоятельно при усилии открыть глаза не может, слабости круговой мышцы глаза нет, зажмуривание полное, симметричное, фиксированный мидриаз с обеих сторон, фотореакции не определяются с обеих сторон. Движения правого глазного яблока несколько ограничены вверх, в остальном возможны; слева возможно минимальное отведение кнутри, небольшое вниз, парез взора кнаружи, вверх. Двусторонний экзофтальм. Точки выхода тройничного нерва безболезненные, отмечается снижение чувствительности первой и второй точек выхода слева, участок болевой гипестезии слева в области лба. Слух не нарушен. Глотание, фонация не нарушены. Язык по средней линии. Диффузная мышечная гипотрофия. При пробе Барре верхние и нижние конечности удерживает, мышечная сила снижена незначительно до четырех баллов. Гипотония конечностей. Активные движения в конечностях не ограничены. Гипорефлексия симметричная. Проприорефлексы с дистальных отделов конечностей: карпорадиальные и ахилловы рефлексы резко снижены одинаково с двух сторон. Выявляется положительный симптом Бабинского, более выраженный справа. Нарушений болевой чувствительности не выявлено. Пульсация на тыле стоп сохранена, равномерна, удовлетворительна.
По результатам лабораторного исследования — признаки системного воспаления: уровень С-реактивного белка увеличен более чем в 30 раз (206–313 мг/л) на фоне гипоальбуминемии (альбумин 22,9 г/л) и гипопротеинемии (общий белок 44,4 г/л); уровень прокальцитонина 17 нг/мл. При динамическом тестировании отмечалось нарастание нейтрофильного лейкоцитоза с 9,21 до 29,9×109/л, наблюдался сдвиг лейкоцитарной формулы влево до метамиелоцитов (1%) и палочкоядерных (20%) нейтрофилов с абсолютной лимфопенией (0,41–0,31×109/л) на фоне нормальной скорости оседания эритроцитов. Несмотря на проводимую инсулинотерапию, сохранялась гипергликемия на уровне 11,3–14,9 ммоль/л.
Клинический диагноз: ОНМК (лакунарный инфаркт мозга в бассейне средней мозговой артерии слева (от 16.08.2021) с выраженным неврастеническим синдромом).
Конкурирующий диагноз: множественная краниальная невропатия (nn. opticus, oculomotorius, abducens слева; nn. opticus, oculomotorius справа) смешанного генеза (диабетическая, ишемическая, постковидная). Полинейропатия конечностей смешанного генеза (постковидная, диабетическая), миодистрофический синдром: вялый легкий, преимущественно проксимальный тетрапарез. Тромбоз центральной артерии сетчатки с обеих сторон, подострая стадия. Двусторонний синдром Рошон-Дювиньо: тотальная офтальмоплегия, птоз, хемоз, преимущественно слева, экзофтальм, амавроз, гипестезия в зоне иннервации n. ophthalmicus.
Сопутствующий диагноз: сахарный диабет, впервые выявленный. Энцефалопатия дисциркуляторная, диабетическая, дисметаболическая, постинфекционная (CОVID-19). Реконвалесцент двусторонней полисегментарной вирусной пневмонии.
Исходя из диагноза, получала оксигенотерапию, двойную дезагрегантную терапию, инсулин короткого действия, антибактериальную терапию препаратами широкого спектра действия, нейрометаболическую и посиндромную терапию.
Несмотря на энтеральное питание специализированными смесями, усугублялись гипоальбуминемия (альбумин 16 г/л) и гипопротеинемия (общий белок 35,9 г/л). В дальнейшем у пациентки нарастали клинические и лабораторные признаки синдрома диссеминированного внутрисосудистого свертывания (ДВС) в виде множественных кровоизлияний в местах инъекций, снижения уровня протромбина, фибриногена (до 2,6–1,8 г/л). Уровень D-димера более чем в 12 раз превышал референсные значения (5794 нг/мл), активированное частичное тромбопластиновое время увеличилось с 60 до 200 с, отмечалась прогрессирующая тромбоцитопения с 111 до 59×109/л.
На рентгенограмме околоносовых пазух определялось утолщение слизистых оболочек, пристеночные теневые наслоения в обеих верхнечелюстных пазухах, возможно незначительное количество жидкого содержимого.
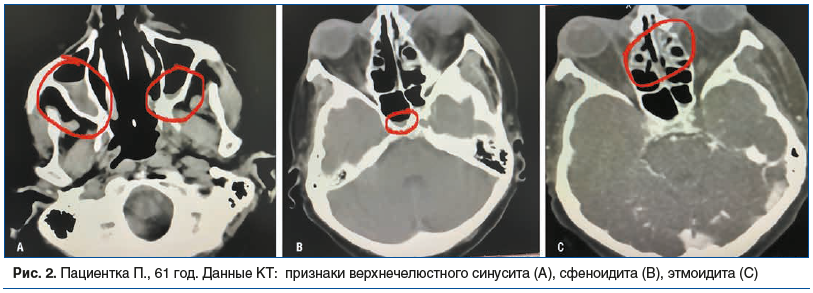
Заключение по результатам КТ головного мозга с контрастированием от 17.08.2021: убедительных признаков ОНМК на момент исследования не выявлено, однако нельзя исключить тромбоз сосудов левой глазницы и центральной артерии сетчатки справа. Кроме того, обнаружен пристеночный дефект наполнения в левом поперечном синусе предположительно за счет тромба. Выявлены признаки верхнечелюстного синусита, сфеноидита и этмоидита с обеих сторон (рис. 2).
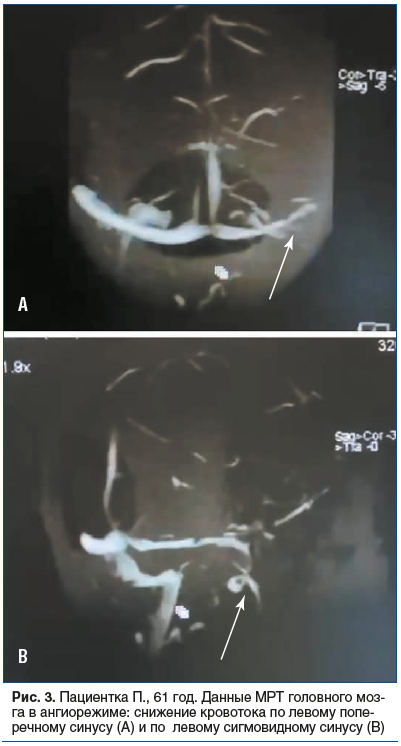
17.08.2021 выполнена МРТ головного мозга в ангиорежиме. Отмечено снижение кровотока по левым сигмовидному и поперечному синусам (рис. 3).
С целью коррекции лечения отменены низкомолекулярные гепарины с последующим переходом на гепарин в лечебных дозах, затем вновь возобновлено введение эноксапарина в промежуточной дозе (из расчета 0,1 мл на 1 кг массы тела) в связи с нарастанием объема подкожных гематом и тромбоцитопении. Учитывая увеличение уровня прокальцитонина в крови и признаки пансинусита, увеличили дозу антибактериального препарата. Также назначены препараты для восполнения белкового дефицита и вазопрессорная терапия.
В последующем при МРТ головного мозга отмечены циркулярное утолщение слизистой оболочки и неоднородный выпот в верхнечелюстной пазухе; признаки тромбоза сигмовидного и поперечного синусов слева; тромбоз сосудов левой глазницы. В медиобазальном отделе левой височной доли в белом веществе лоцировался участок размерами 0,5×0,5 см слабоповышенного сигнала со слабочетким контуром.
Верхнечелюстную пазуху не пунктировали ввиду крайне тяжелого состояния пациентки, выраженной тромбоцитопении и развившегося синдрома ДВС, поскольку риск осложнений превышал ожидаемый эффект вмешательства.
Состояние пациентки прогрессивно ухудшалось. Появились и нарастали признаки полиорганной недостаточности: активность печеночных трансаминаз превышала верхние границы нормы в 3,5–4 раза, уровень креатинина увеличился до 231 мкмоль/л, мочевины — до 11 ммоль/л, усугубились гипоальбуминемия и гипопротеинемия.
Проводимую интенсивную терапию корригировали в зависимости от клинических симптомов, однако состоя-ние продолжало ухудшаться, нарастал неврологический дефицит, присоединились бульбарные расстройства, угнетение сознания, и на 10-й день после поступления в стационар была констатирована биологическая смерть пациентки.
Патологоанатомическое исследование
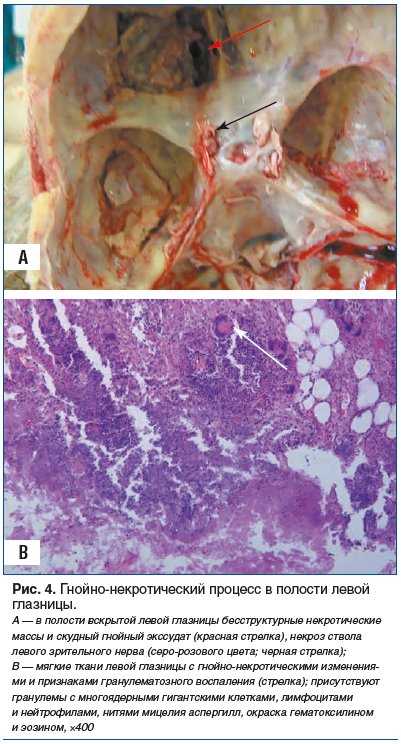
При вскрытии содержимое полости левой глазницы и решетчатой пазухи было представлено бесструктурными некротическими массами и скудным гнойным экссудатом (cкудный рост Acinetobacter spp. и Enterobacter cloace). Обнаружен гнойно-некротический сфеноидит и периостит стенки орбиты с формированием субпериостального абсцесса. Стенка орбиты — с гнойно-некротическими массами и нитями аспергилл (рис. 4). Отмечалась грибковая инвазия в некротизированный ствол левого зрительного нерва (рис. 4, 5).
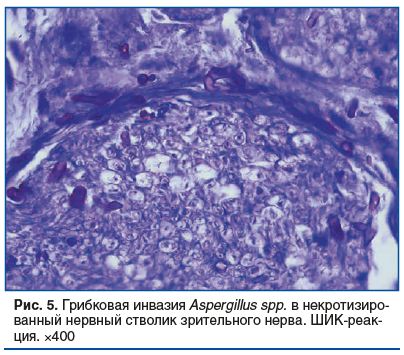
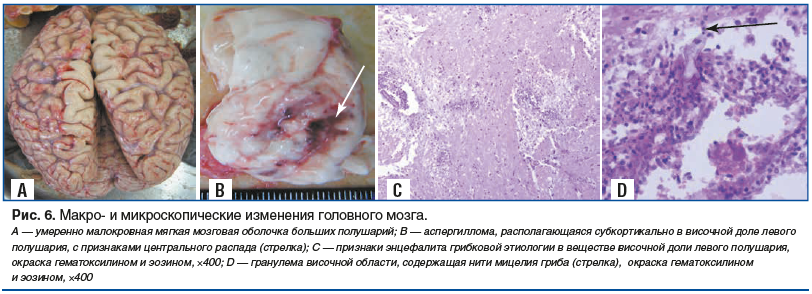
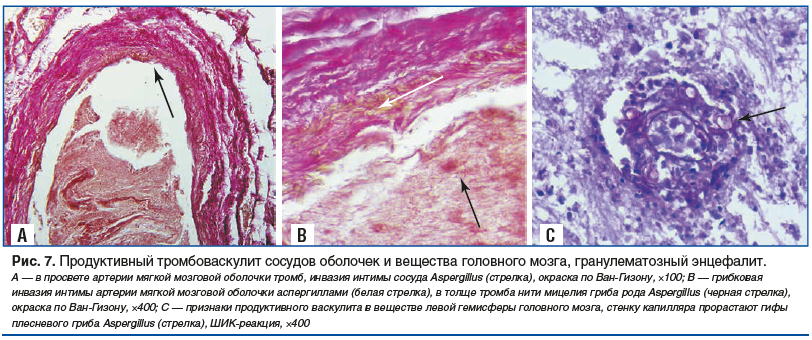
Мягкая мозговая оболочка умеренно малокровна. На миндалинах мозжечка четко выраженная странгуляционная борозда. На базальной поверхности височной доли левого полушария мягкая оболочка шероховатая на участке площадью 6 cм2. В височной доле левого полушария субкортикально располагается участок серого размягчения неправильной формы размерами 1,6×2,0×2,5 см с признаками центрального распада (аспергиллома) (рис. 6). Микроскопически обнаружен продуктивный тромбоваскулит сосудов оболочек и вещества головного мозга, гранулематозный энцефалит (рис. 7).
Масса легких в пределах возрастной нормы, отмечалось неравномерное полнокровие, обсеменение легких Klebsiella pneumoniае. Микроскопически определялись: межуточный пневмосклероз и склероз сосудов микроциркуляторного русла легких, неравномерное острое венозное полнокровие, отек легких. Кроме того, обнаружены интерстициальный панкреатит с многочисленными жировыми некрозами, неалкогольная жировая болезнь печени 2-й степени, делимфатизация лимфоидных фолликулов селезенки.
Обсуждение
Инвазивный аспергиллез — один из самых распространенных глубоких микозов с тяжелым клиническим течением и высокой летальностью (60–90%). В случае поражения центральной нервной системы и отсутствия прижизненной диагностики летальность достигает 99%. Необходимо подчеркнуть, что поражение головного мозга при аспергиллезе не имеет каких-либо специфических характеристик, что значительно затрудняет своевременную диагностику и назначение соответствующего лечения [12].
Грибы Aspergillus spp. принято считать ангиотропными, они способны проникать в сосуды, вызывая тромбоз с последующей (в 15–40% случаев) гематогенной диссеминацией с поражением различных внутренних органов (в том числе головного мозга с вероятностью 20%), кожи и подкожно-жировой клетчатки [13]. В представленном клиническом наблюдении у пациентки в дебюте заболевания развились подострый тромбоз центральной артерии сетчатки и субатрофия зрительного нерва с обеих сторон. При МРТ головного мозга, выполненной спустя 2–3 нед. от появления неврологической симптоматики, обнаружена лишь зона острой лакунарной ишемии в медиобазальных отделах левой височной доли, что было расценено как ОНМК. Однако уже спустя сутки, при повторной МРТ головного мозга, были отмечены признаки тромбоза сигмовидного и поперечного синусов слева, а также тромбоз сосудов левой глазницы. У пациентки нарастала картина множественной краниальной невропатии.
По данным литературы, внелегочный аспергиллез возникает при тяжелом иммунодефиците, начинается с поражения кожи, синусита или пневмонии. Вовлечение в процесс печени, почек, головного мозга и других органов, как правило, быстро приводит к летальному исходу.
Инвазивный аспергиллез чаще всего развивается у иммунокомпрометированных пациентов. Выделяют ряд состояний (факторов риска), при которых развитие аспергиллеза головного мозга наиболее вероятно: синдром приобретенного иммунодефицита; первичные иммунодефицитные состояния; глубокая нейтропения (количество нейтрофилов в крови менее 0,5×109/л), сохраняющаяся на протяжении >10 сут в период самого заболевания или в предшествующие 60 сут до болезни; длительное (>3 нед.) использование системных глюкокортикоидов в суточной дозе, превышающей 0,3 мг/кг массы тела, в пересчете на преднизолон; иммуносупрессивная терапия; реакция «трансплантат против хозяина» и цитомегаловирусная инфекция у реципиентов при аллогенной трансплантации кроветворных стволовых клеток [12, 13]. Однако в последние годы нарастает частота инвазивного аспергиллеза у пациентов в отсутствие типичных факторов риска развития глубокого микоза [3, 4]. В отделениях реанимации и интенсивной терапии частота инвазивного аспергиллеза достигает 4% [13], что может быть связано с внутрибольничной контаминацией Aspergillus spp. Т.Э. Вербах и соавт. [12] приводят клиническое наблюдение аспергиллеза головного мозга с неблагоприятным исходом, который развился у молодой пациентки в отсутствие хронических заболеваний, приводящих к тяжелому вторичному иммунодефициту. В нашем клиническом наблюдении у пациентки также не было значимых хронических заболеваний, которые могли бы сопровождаться развитием вторичного иммунодефицитного состояния.
В последние 3 года накапливаются данные, свидетельствующие о высокой частоте развития вторичных сис-темных микозов, нередко приводящих к серьезным осложнениям и фатальным исходам у госпитализированных пациентов с COVID-19. М. Albaji et al. [14] представили клиническое наблюдение инвазивного аспергиллеза с поражением легких и головного мозга, развившегося у молодого пациента вскоре после перенесенного COVID-19. Предполагается, что риск инвазивных грибковых инфекций высок не только из-за клинического статуса пациента, но и из-за иммунных изменений, вызванных коронавирусом SARS-CoV-2 [15–17].
Из всех возможных факторов риска инвазивных микозов у пациентки можно отметить манифестацию сахарного диабета и сохранение гипергликемии, несмотря на инсулинотерапию, в период COVID-19, массивную антибактериальную терапию и иммунные изменения, вызванные коронавирусом SARS-CoV-2.
В структуре локализаций инвазивного аспергиллеза на первом месте с частотой поражения около 90% стоит аспергиллез легких с вовлечением гортани, трахеи и бронхов с возможной диссеминацией во внутренние органы. Поражение головного мозга, с одной стороны, может развиться как осложнение инвазивного аспергиллеза легких. С другой стороны, входными воротами для развития аспергиллеза центральной нервной системы могут стать придаточные пазухи носа или орбита [18].
С учетом клинико-анамнестических данных в нашем клиническом наблюдении инфицирование плесневым грибком, вероятно, могло идти двумя путями: аэрогенно через носовые ходы (преимущественно с левой стороны) или через глазное яблоко (переднее и заднее решетчатые отверстия, где проходят ветви носоресничного нерва и глазной артерии). Инвазивный рост аспергилл из левой решетчатой пазухи и орбиты через отверстия в основание черепа путем гематогенного распространения привел к формированию продуктивного лептоменингита в левой базальной области. В результате тромбоза церебральной артерии на фоне инвазивного васкулита сформировался ишемический инфаркт в левой височной области. В последующем отек и набухание головного мозга в сочетании с синдромом ДВС и нозокомиальным обсеменением легких, полиорганная недостаточность привели к дислокации ствола и миндалин мозжечка в большое затылочное отверстие, что и стало непосредственной причиной летального исхода.
Заключение
Представленное клиническое наблюдение демонстрирует возможность развития инвазивного аспергиллеза с поражением головного мозга у пациентов даже в отсутствие диагностированных ранее первичных или вторичных иммунодефицитных состояний. COVID-19, вероятно, можно считать еще одним фактором риска развития инвазивных микозов вследствие гиперпродукции провоспалительных цитокинов, снижения экспрессии интерферонов, иммунного истощения.
2. Баранова И.Б., Яременко А.И., Зубарева А.А. и др. Мукормикоз костей лицевого черепа, полости носа и околоносовых пазух у пациентов, перенесших COVID-19. Клиническая микробиология и антимикробная химиотерапия. 2021;23(4):347–358. [Baranova I.B., Yaremenko A.I., Zubareva A.A. et al. Mucormycosis of the bones of the facial skull, nasal cavity and paranasal sinuses in patients with COVID-19. Clinical microbiology and antimicrobial chemotherapy. 2021;23(4):347–358 (in Russ.)]. DOI: 10.36488/cmac.2021.4.347-358.
3. Шкарин В.В., Саперкин Н.В. Роль оппортунистических микозов в комплексной коморбидности (обзор литературы). Проблемы медицинской микологии. 2020;22(1):15–23. [Shkarin V.V., Saperkin N.V. A role of opportunistic mycoses in the complex comorbidity (literature review). Problems in Medical Mycology. 2020;22(1):15–23 (in Russ.)]. DOI: 10.24412/1999-6780-2020-1-15-23.
4. Хостелиди С.Н., Шагдилеева Е.В., Шадривова О.В. и др. Случай генерализованного сочетанного микоза на фоне острой респираторной вирусной инфекции. Проблемы медицинской микологии. 2019;21(4):24–29. [Khostelidi S.N., Shagdileeva E.V., Shadrivova O.V. et al. The case of generalized combined mycosis on the background of acute respiratory viral infection. Problems in Medical Mycology. 2019;21(4):24–29 (in Russ.)]. DOI: 10.24412/1999-6780-2019-4-24-29.
5. Хостелиди С.Н., Зайцев В.А., Пелих Е.В. и др. Мукормикоз на фоне COVID-19: описание клинического случая и обзор литературы. Клиническая микробиология и антимикробная химиотерапия. 2021;3(3):255–262. [Khostelidi S.N., Zaytsev V.A., Pelikh E.V. et al. Mucormycosis following COVID-19: clinical case and literature review. Clinical microbiology and antimicrobial chemotherapy. 2021;3(3):255–262 (in Russ.)]. DOI: 10.36488/cmac.2021.3.255-262.
6. Нуртдинова Г.М., Сулейманов А.М., Баязитов Я.И. и др. Клинический случай мукормикоза у больной COVID-19. Терапевтический архив. 2022;94(11):1320–1325. [Nurtdinova G.M., Suleymanov A.M., Bayazitov Ian I. et al. Clinical case of mucormycosis in patient COVID-19. Case report. Therapevticheskii Arkhive (Ter. Arkh.). 2022;94(11):1320–1325 (in Russ.)]. DOI: 10.26442/00403660.2022.11.201942.
7. Paul M., Sasidharan J., Taneja J. et al. Invasive mucormycosis and aspergillosis coinfection associated with post-COVID-19 pneumonia in a tertiary care hospital. Med Mycol J. 2022;63(3):59–64. DOI: 10.3314/mmj.21-00019.
8. Zhu X., Ge Y., Wu T. et al. Co-infection with respiratory pathogens among COVID-2019 cases. Virus Res. 2020;285:198005. DOI: 10.1016/j.virusres.2020.198005.
9. Rudramurthy S.M., Hoenigl M., Meis J.F. et al. ECMM/ISHAM recommendations for clinical management of COVID-19 associated mucormycosis in low-and middle-income countries. Mycoses. 2021;64(9):1028–1037. DOI: 10.1111/myc.13335.
10. Singh A.K., Singh R., Joshi S.R., Misra A. Mucormycosis in COVID-19: a systematic review of cases reported worldwide and in India. Diabetes Metab Syndr. 2021;15(4):102146. DOI: 10.1016/j.dsx.2021.05.019.
11. John T.M., Jacob C.N., Kontoyiannis D.P. When uncontrolled diabetes mellitus and severe COVID-19 converge: the perfect storm for mucormycosis. J Fungi (Basel). 2021;7(4):298. DOI: 10.3390/jof704029813.
12. Воеводкина А.Ю., Хайтович А.Б. Аспергиллез центральной нервной системы. Успехи медицинской микологии. 2019;20:381–385. [Voevodkina A.Y., Khaytovich A.B. Aspergillosis of the central nervous system. Advances in Medical Mycology. 2019;20:381–385 (in Russ.)].
13. Васильева Н.В., Климко Н.Н., Цинзерлинг В.А. Диагностика и лечение инвазивных микозов: современные рекомендации. Вестник Санкт-Петербургской медицинской академии последипломного образования. 2010;2(4):5–19. [Vasilyeva N.V., Klimko N.N., Tsinzerling V.A. Modern recommendations for diagnosis and treatment of invasive mycoses. Bulletin St. Petersburg Medical Academy Postgraduate Education. 2010;2(4):5–19 (in Russ.)].
14. Albaji M., Fattahi M.R., Iranmehr A. Unusual manifestation of COVID-19-associated pulmonary aspergillosis: a case report. Clin Case Rep. 2022;10(8):e6188. DOI: 10.1002/ccr3.6188.
15. Ferrando C., Mellado-Artigas R., Gea A. et al. Patient characteristics, clinical course andfactors associated to ICU mortality in critically ill patientsinfected with SARS-CoV-2 in Spain: a prospective, cohort, mul-ticentre study. Rev Esp Anestesiol Reanim. 2020;67(8):425–437. DOI: 10.1016/j.redar.2020.07.003.
16. Suarez-de-la-Rica A., Serrano P., De-la-Oliva R. et al. Secondary infections in mechanically ventilated patients with COVID-19: an overlooked matter? Rev Esp Quimiote. 2021;34(4):330–336. DOI: 10.37201/req/031.2021.
17. Videla C.G., Agustina M., de la Iglesia Niveyro P.X., Cirrocchi Nicolas M. Brain death due to neuroaspergillosis in a patient with COVID-19. Rev Esp Anestesiol Reanim (Eng Ed). 2022;69(9):592–596. DOI: 10.1016/j.redare.2022.01.004.
18. Panda P.K., Mavidi S.K., Wig N. et al. Intracranial aspergillosis in an immunocompetent young woman. Mycopathologia. 2017;182(5–6):527–538. DOI: 10.1007/s11046-016-0106-4.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.

