XXI Всероссийский научно-образовательный форум «Мать и дитя — 2020». Инфекции мочевыводящих путей у женщин: что важно знать гинекологам? (Пост-релиз)
DOI: 10.32364/2618-8430-2020-3-4-282-289
28 сентября 2020 г. в рамках XXI Всероссийского научно-образовательного форума «Мать и дитя — 2020», прошедшего 28–30 сентября 2020 г. в Москве, состоялся круглый стол на тему «Инфекции мочевыводящих путей у женщин: что важно знать гинекологам?». Докладчиками отмечен рост частоты инфекций мочевыводящих путей (ИМП), в частности цистита, что связано с отсутствием единого подхода к диагностике и лечению данной патологии у врачей разных специальностей, самолечением пациенток с использованием случайно выбранных антибиотиков либо проведением низкодозной антибактериальной терапии. Представлены современные рекомендации по назначению препаратов для купирования эпизодов острого цистита. Особое внимание уделено проблеме увеличения доли резистентных к антибактериальным препаратам микроорганизмов. Обоснована необходимость поиска и более активного использования подходов, позволяющих избегать назначения антибиотиков с целью профилактики рецидивов ИМП.
Ключевые слова: цистит, инфекции мочевыводящих путей, рекомендации, иммунопрофилактика, клюква, D-манноза, витамин D.
Для цитирования: XXI Всероссийский научно-образовательный форум «Мать и дитя — 2020». Инфекции мочевыводящих путей у женщин: что важно знать гинекологам? (Пост-релиз). РМЖ. Медицинское обозрение. 2020;3(4):282-289. DOI: 10.32364/2618-8430-2020-3-4-282-289.
A round table on the topic “Urinary tract infections in women: what a gynecologist needs to know?” was organized within the framework of the 21st All-Russian Science Education Forum “Mother & Child” that was held on September 28–30, 2020, in Moscow. The speakers reported on an increasing incidence of urinary tract infections (UTIs), in particular, cystitis. This is accounted for by the lack of a common diagnostic and treatment approach to this disease among various medical specialties and self-medicating with randomly chosen or low-dose antibiotics. Current recommendations for the prescribing of medications to reduce the symptoms of acute cystitis are addressed. The increase in the prevalence of antibiotic resistance is highlighted. The development and more active implementation of the approaches avoiding the use of antibiotics to prevent UTI recurrences are required.
Keywords: cystitis, urinary tract infections, recommendations, immune prophylaxis, cranberry, D-mannose, vitamin D.
For citation: 21st All-Russian Science Education Forum “Mother & Child”. Urinary tract infections in women: what a gynecologist needs to know? (Post-release). Russian Journal of Woman and Child Health. 2020;3(4):282–288. DOI: 10.32364/2618-8430-2020-3-4-282-289.
В Москве 28–30 сентября 2020 г. прошел Всероссийский научно-образовательный форум «Мать и дитя — 2020». Руководил форумом академик РАН, профессор Г.Т. Сухих, организаторами выступили Министерство здравоохранения РФ, ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России, Российское общество акушеров-гинекологов и Лига акушерок России.
Форум был посвящен достижениям в оказании комплексной медицинской помощи беременным в условиях пандемии, вопросам рентгеновского томосинтеза в скрининговой программе женщин, опыту Перинатального центра в профилактике массивных акушерских кровотечений при врастании плаценты, организации маршрутизации беременных, рожениц и родильниц с большими акушерскими синдромами.
Программа мероприятия была ориентирована на специалистов более 10 направлений медицины: акушерства и гинекологии, неонатологии, анестезиологии-реаниматологии, детской онкологии, урологии-андрологии и эндокринологии, онкологии, педиатрии, сестринского дела, урологии, эстетической гинекологии, эндокринологии, ультразвуковой диагностики.
В рамках форума при поддержке компании «НПО Петровакс Фарм» 28 сентября 2020 г. прошел круглый стол на тему: «Инфекции мочевыводящих путей у женщин: что важно знать гинекологам?». Председателем круглого стола выступила И.А. Аполихина, д.м.н., профессор, руководитель отделения эстетической гинекологии и реабилитации ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России, профессор кафедры акушерства, гинекологии, перинатологии и репродуктологии ИПО ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), президент Ассоциации специалистов по эстетической гинекологии и Европейской ассоциации генитальной эстетической медицины и пластической хирургии. В рамках круглого стола прозвучали доклады на темы: «Взгляд уролога на лечение и профилактику ИМП», «Современные парадигмы в тактике ведения женщин с неосложненными инфекциями мочевыводящих путей», «Факторы, влияющие на риск развития цистита у женщин от менархе до менопаузы», «Новые аспекты в политике ИМП».
Леонид Григорьевич Спивак, д.м.н., профессор института урологии и репродуктивного здоровья человека ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет), в своем выступлении представил взгляд уролога на лечение и профилактику ИМП у женщин.
Л.Г. Спивак подчеркнул, что лечение ИМП сопряжено с рядом трудностей. Это связано с отсутствием у врачей разных специальностей единого подхода к диагностике и лечению данной патологии, самолечением пациенток с использованием случайно выбранных антибиотиков либо проведением низкодозной антибактериальной терапии, что способствует формированию резистентности микроорганизмов к антибактериальным препаратам. Одним из наиболее частых хронических инфекционно-воспалительных заболеваний мочеполовой системы, представляющих серьезную медицинскую проблему, является цистит, который характеризуется вялым, рецидивирующим течением и устойчивостью к этиотропной терапии.
Приступая к терапии нарушений мочеиспускания, в первую очередь необходимо понять, чем именно они вызваны у конкретной пациентки. Так, в 40% случаев учащенное болезненное мочеиспускание обусловлено острым циститом или обострением хронического, в 15% — вагинитом, в 5–10% — атрофией эпителия мочевых путей в постменопаузе, в 40% — уретритом и уретральным синдромом.
В соответствии с европейскими и российскими рекомендациями для подтверждения диагноза острого неосложненного цистита у женщин необходимо наличие двух или более клинических симптомов и изменений в лабораторных анализах мочи при отсутствии патологических выделений из влагалища. По мнению Л.Г. Спивака, в большинстве случаев острые неосложненные ИМП у женщин не требуют проведения посева мочи, так как характер микрофлоры и ее антибактериальная чувствительность легко предсказуемы.
Посев показан в следующих случаях:
подозрение на пиелонефрит;
сохранение или возобновление симптомов в течение 4 нед. с момента окончания терапии;
атипичные симптомы;
беременность.
Более высокая частота развития цистита у женщин объясняется анатомическими особенностями: короткой и широкой уретрой, близостью уретры к естественным резервуарам инфекции — анусу и влагалищу; аномалиями развития — дистопией, гипермобильностью уретры.
Сексуальная активность, наличие инфекций, передаваемых половым путем, частая смена половых партнеров и характер применяемых контрацептивов способствуют развитию ИМП у женщин детородного возраста. Частые сопутствующие гинекологические заболевания — воспалительные процессы во влагалище, гормональные нарушения (в т. ч. гипоэстрогенемия), приводящие к дисбиозу влагалища, повышают риск развития ИМП у женщин в постменопаузе.
Как отмечено профессором Л.Г. Спиваком, значимой проблемой последних лет стало увеличение числа уропатогенных штаммов, устойчивых к широко используемым в настоящее время антибактериальным препаратам. В условиях ограниченности разработок новых антибиотиков единственным способом избежать резистентности к уже имеющимся является их рациональное применение. Причем при резистентности к антибиотику в популяции более чем у 10–20% штаммов микроорганизмов его эмпирический прием нецелесообразен в связи с недостаточной эффективностью.
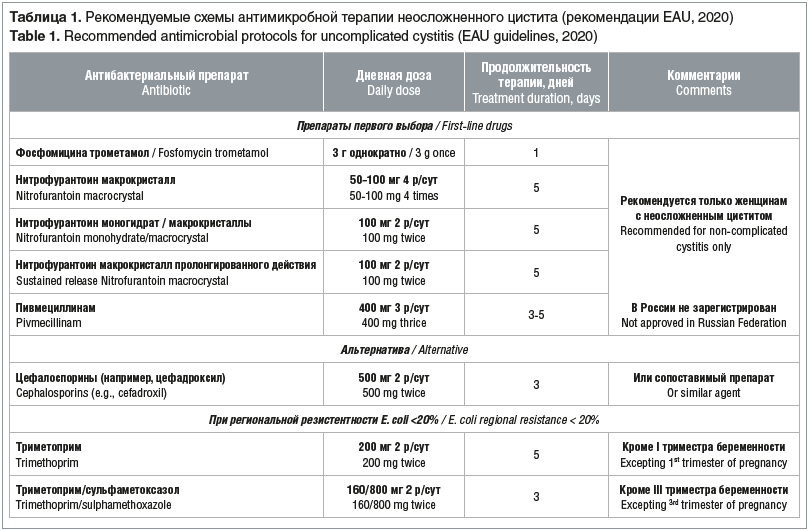
Терапия цистита складывается из этиотропного/патогенетического и симптоматического лечения. Согласно рекомендациям Европейской ассоциации урологов (EAU, 2020) в качестве этиотропного лечения показана противомикробная терапия (табл. 1), так как эффективность терапии значительно выше по сравнению с плацебо. При выборе противомикробной терапии следует учитывать: спектр и особенности восприимчивости этиологических патогенов; эффективность препарата для конкретных показаний, установленную в клинических исследованиях; переносимость и побочные реакции; неблагоприятные экологические эффекты; затраты; доступность.
Причинами недостаточной эффективности консервативного лечения могут выступать анатомические особенности: влагалищная эктопия и гипермобильность уретры, уретрогименальные спайки, псевдополипы в шейке мочевого пузыря. Они становятся патогенетическими причинами развития рецидивирующего цистита и могут способствовать формированию воспаления, поскольку обусловливают появление остаточной мочи. Выходом в таком случае является оперативное вмешательство.
Профессор Л.Г. Спивак подчеркнул, что использовать аминопенициллины или фторхинолоны для лечения неосложненного цистита не следует из-за риска серьезных побочных эффектов и высокой глобальной резистентности.
Препаратом выбора для стартовой эмпирической терапии неосложненной ИМП является фосфомицин. Достаточная терапевтическая концентрация фосфомицина в моче может сохраняться до 72 ч после перорального приема 3 г, что позволяет назначать препарат однократно.
К препаратам первой линии относятся нитрофураны, привлекательность которых определяется высокой природной активностью против всех значимых возбудителей неосложненной ИМП, связанной с многофакторным механизмом действия. Он состоит в повреждении рибосомальных белков бактерий, что приводит к нарушению многих параметров их жизнедеятельности — подавлению синтеза белка, аэробного энергетического метаболизма, синтеза нуклеиновых кислот и клеточной стенки.
Результаты исследования «ДАРМИС-2018» свидетельствуют о росте резистентности к большинству антимикробных препаратов среди внебольничных штаммов Enterobacterales, и в частности E. coli, в России. Особую тревогу с практической точки зрения вызывают высокая резистентность к фторхинолонам и резкий рост продукции β-лактамаз расширенного спектра у энтеробактерий. Поскольку в большинстве случаев терапия внебольничных ИМП проводится эмпирически, в рекомендуемых схемах лечения следует учитывать вышеописанные данные, а также актуальные результаты локального мониторинга чувствительности уропатогенов.
Практикующим специалистам важно помнить о сохраняющей актуальность проблеме рецидивирующего цистита, о котором говорят при наличии двух обострений в течение полугода или трех — в течение года.
Л.Г. Спивак напомнил о мероприятиях, направленных на профилактику развития рецидивирующих ИМП, среди которых выделил следующие:
иммунопрофилактика лиофилизированным лизатом бактерий E. coli у пациенток с частыми рецидивами бактериального цистита;
посткоитальная антибиотикопрофилактика (например, нифурантел 200 мг) при неэффективности прочих, неантибактериальных методов при рецидивах цистита, связанных с половым актом;
инстилляции препаратов гиалуроновой кислоты в мочевой пузырь вне стадии обострения при рецидивирующем цистите;
антибактериальное лечение только обострений цистита (т. е. острого цистита) или профилактика обострений фосфомицина трометамолом монодозой 3 г 1 р/сут через 10 дней на протяжении 3 мес. при рецидивирующем цистите;
использование локальной (во влагалище) эстрогензаместительной терапии при рецидивирующем цистите у женщин в постменопаузе.
Существующая проблема устойчивости к противомикробным препаратам заставляет искать методы неантимикробной профилактики, которые могут быть рекомендованы при ИМП. Эффективность некоторых таких методов подтверждена клиническими исследованиями. Среди них стоит отметить поведенческую терапию, использование препаратов клюквы и D-маннозы, локальную заместительную терапию эстрогенсодержащими препаратами, иммунопрофилактику, нестероидные противовоспалительные препараты, пробиотики, внутрипузырные инстилляции гликозаминогликанов, вакцины и инокуляцию менее патогенными бактериями.
Механизм профилактического и лечебного действия препаратов клюквы связан с проантоцианидинами группы А (ПАЦ), обладающими ингибирующим потенциалом в отношении адгезивной способности Р-фимбрий E. coli к клеткам уротелия. ПАЦ ингибируют связывание уропатогенов с фимбриями Р-типа посредством маннозоспецифичных, лектиноподобных структур с маннозоподобными остатками на клетках слизистой оболочки (ингибирование Р-фимбрий обратимо). По некоторым данным, ПАЦ способствуют отделению Р-фимбрий от бактерий. В то же время другие исследователи утверждают, что плотность Р-фимбрий не меняется. Еще одним возможным механизмом действия ПАЦ рассматривается ингибирование I-фимбрий.
Эффективным и безопасным направлением в лечении цистита и других ИМП, как подчеркнул Л.Г. Спивак, является использование D-маннозы — эндогенного моносахарида, необходимого для N-гликозилирования около 30% белков протеома человека. Участвуя в «тонкой настройке» структур и функций белков протеома, N-гликозилирование поддерживает функционирование иммуноглобулинов классов E, M, D, A и G и других рецепторов иммунной системы. Экзогенная D-манноза, поступающая с пищей, частично усваивается микробиотой и организмом. Неусвоенная фракция экзогенной D-маннозы выводится с мочой, что является определяющим фактором в терапии и профилактике бактериального цистита, так как в моче, насыщенной D-маннозой, снижается адгезия уропатогенных бактерий (E. coli, Klebsiella, Proteus и др.) к уротелию почечных лоханок, мочеточников, мочевого пузыря и уретры. При этом терапия D-маннозой намного безопаснее антибиотикотерапии, эффективно снижает выраженность симптомов цистита и может применяться у пациенток с сахарным диабетом, гипертонией и во время беременности.
D-манноза, Cran-Maх (запатентованный экстракт североамериканской клюквы с повышенной эффективностью) в оптимальных дозах, а также витамин D3 входят в состав комплексного средства для защиты от ИМП Уронекст®. Витамин D3 способствует восстановлению барьерной функции и активации собственных защитных сил за счет синтеза антимикробных пептидов. Посредством этих механизмов обеспечивается комплексная и полноценная защита от цистита всего за 7 дней приема.
Инна Анатольевна Аполихина, д.м.н., профессор, выступила с докладом, в котором представила современные парадигмы в тактике ведения женщин с неосложненными ИМП.
И.А. Аполихина отметила, что цистит является одной из актуальных проблем урологии и гинекологии в связи с его высокой распространенностью, частыми рецидивами и влиянием не только на физическое здоровье женщины, но и на эмоциональную сферу и качество жизни в целом. Установлено, что у 27% молодых женщин рецидив цистита развивается в течение 6 мес., а у 50% женщин — в течение года, причем в 50% случаев рецидивы отмечаются более трех раз в год.
Согласно Федеральным клиническим рекомендациям по антимикробной терапии и профилактике инфекций почек, мочевыводящих путей и мужских половых органов (2020) пришло время смены парадигмы в диагностике и лечении ИМП. Теперь определение бессимптомной бактериурии (БСБ) звучит так: наличие одного или более видов бактерий, растущих в моче с указанным количеством 105 КОЕ/мл и более, независимо от наличия пиурии, при отсутствии симптомов, присущих ИМП. Лечение рекомендуется проводить только в случае доказанной пользы для пациентки, если польза превышает риски селекции резистентных микроорганизмов. Скрининг и лечение БСБ целесообразно проводить у беременных женщин: рекомендован фосфомицина трометамол (3 г — монодоза и/или через каждые 10 дней в течение 3 мес.) или цефиксим (400 мг 1 р/сут в течение 5 дней). При выявленной чувствительности применяют амоксициллин + клавулановую кислоту (625 мг через 12 ч в течение 3–5 дней), а также фитопрепарат, содержащий траву золототысячника, корень любистока, листья розмарина обыкновенного (по 2 драже 3 р/сут или по 50 капель 3 р/сут в течение 1–3 мес).
Помимо рационализации применения антибактериальных препаратов, основной задачей сегодняшнего времени является сдерживание антимикробной резистентности — одной из основных угроз здоровью населения.
Ограничение применения фторхинолонов обусловлено, с одной стороны, серьезными побочными эффектами этих препаратов (кардиотоксичностью, диареей, рвотой, повреждением сухожилий, суставов, мышц, нервов, отслойкой сетчатки, аневризмой аорты, нарушениями со стороны центральной нервной системы), с другой — селекцией резистентных штаммов, приводящих к росту антибиотикорезистентности E. coli и Micobacterium tuberculosis, суперинфекции — в результате резистентности Clostridium difficile.
Как подчеркнула И.А. Аполихина в своем выступлении, помимо основной терапии острого неосложненного бактериального цистита с применением препаратов выбора — фосфомицина трометамола (внутрь 3 г однократно), или фуразидина (внутрь 100 мг 3 р/сут в течение 5–7 дней), или нитрофурантоина (внутрь 100 мг 3 р/сут в течение 5 дней), усилия специалистов должны быть направлены на профилактику рецидивов ИМП, подразумевающую коррекцию гигиенических и сексуальных факторов: употребление большого количества жидкости, принудительное мочеиспускание сразу после полового акта, отказ от использования спермицидов и диафрагмы в качестве метода контрацепции, ограничение половых контактов.
С одной стороны, современная эмпирическая терапия острого неосложненного цистита короткими курсами антимикробных препаратов позволяет добиться эрадикации возбудителей и клинического выздоровления у 90–98% пациенток. С другой стороны, у 50% женщин, перенесших острый неосложненный цистит, в течение последующего года заболевание рецидивирует. Более того, половина этих женщин переносят за год 3 и более рецидивов, что, по всей видимости, обусловлено несколькими причинами, и одна из них — недостаточная эффективность терапии первичного эпизода.
Лечение больных с рецидивирующими ИМП трудное, требующее исключения многих урологических и сопутствующих факторов, поддерживающих заболевание. Трудность лечения таких пациенток обусловливает необходимость поиска и назначения альтернативных методов профилактики, которые следует использовать в первую очередь, и только при их неэффективности рекомендовано антибактериальное лечение.
Альтернативными видами терапии могут быть иммуноактивная профилактика препаратом, представляющим собой лиофилизированный бактериальный лизат 18 штаммов E. coli, использование фитопрепаратов, пробиотиков, препаратов клюквы, D-маннозы.
Результаты метаанализа (2017) показали, что экстракт клюквы сокращает риск ИМП на 26% (ОР 0,74; 95% ДИ 0,55–0,98; I2 = 54%).
В повседневной практике рекомендуется ежедневное употребление экстракта клюквы, содержащего 36 мг/сут ПАЦ (в пересчете на активное вещество) (уровень доказательности 1b, класс рекомендаций C). Входящий в состав Уронекста® Cran-Max, высокоочищенный 100% натуральный экстракт клюквы, обладает стандартизированной активностью (36 мг ПАЦ) и благодаря запатентованному способу высвобождения — большей биодоступностью и эффективностью. Было показано снижение частоты рецидивов ИМП в 4 раза у женщин, получавших капсулу Cran-Max однократно в течение 6 ч после полового акта, по сравнению с результатами лечения пациенток, которым давали сухой клюквенный порошок. В исследовании, проведенном О.А. Громовой и соавт. (2019), экстракты клюквы, стандартизированные по антоцианинам, эффективно дополняли терапевтическое действие D-маннозы при цистите и других ИМП. Блокируя взаимодействие фимбрий уропатогенных бактерий с уротелием, D-манноза и антоцианины клюквы предотвращают заселение мочеполового тракта патогенными бактериями. Такая терапия и профилактика ИМП — наилучшая врачебная стратегия.
Таким образом, Уронекст®, обладающий антиадгезивным, мочегонным, противовоспалительным, противомикробным эффектом, а также укрепляющий иммунитет, может быть рекомендован при первых симптомах ИМП с целью профилактики: по 1 саше 1 р/сут в течение
7 дней, предварительно растворенный в 100 мл воды комнатной температуры. Удобная форма выпуска препарата в виде саше позволяет ускорить всасывание продукта и его действие, а высокий профиль безопасности делает возможным его использование беременными, кормящими, а также пациентками с сахарным диабетом.
Продолжил круглый стол Андрей Владимирович Зайцев, д.м.н., профессор кафедры урологии ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России, выступивший с докладом о факторах, влияющих на риск развития цистита у женщин от менархе до менопаузы.
Как и предыдущие докладчики, А.В. Зайцев отметил значительное влияние рецидивирующих ИМП на качество жизни женщин. Так, анонимный веб-опрос, проведенный в 5 странах (Германии, Швейцарии, Польше, России и Италии) среди взрослых женщин, перенесших рецидив ИМП и острую ИМП, показал, что 47,4% женщин наблюдали более 6 эпизодов ИМП, 14,4% — более 12 эпизодов в течение года. Несмотря на то что 74% участниц проводили профилактику, рецидив был обычным явлением и сопровождался стрессом у значительной части женщин.
Основной путь инфицирования нижних мочевыводящих путей у женщин — восходящий. Микрофлора интроитуса и дистального отдела уретры идентична у 80% больных с ИМП. В 75–90% случаев половой акт — причина развития ИМП у сексуально активных женщин. В исследовании, проведенном в штате Мичиган в 1996–1999 гг., у 166 (74%) женщин с ИМП и 26% — без ИМП в моче и пробах из прямой кишки имелись генетически идентичные штаммы Е. coli.
На протяжении всей жизни влагалищный микробиом женщины кардинально меняется одновременно с гормональными и микроанатомическими перестройками влагалищного эпителия (рис. 1). Как подчеркнул А.В. Зайцев, влагалище — ключевое анатомическое звено в патогенезе ИМП и потенциальный резервуар уропатогенных микроорганизмов. Микробиота влагалища — динамический и нередко критический патогенетический фактор, ее изменение или потеря нормальной защитной роли Lactobacillus spp. увеличивает риск ИМП. При этом нарушение нормоциноза может быть результатом дефицита эстрогенов, антимикробной терапии, применения контрацептивов и самих эпизодов ИМП.
![Рис. 1. Изменение влагалищного микробиома в раз- личные периоды жизни женщины [Muhleisen A.L., Herbst-Kralovetz M.M. Menopause and the vaginal microbiome. Maturitas. 2016;91:42–50. DOI: 10.1016/j. maturitas.2016.05.01530] Fig. 1. Changes in vaginal microb Рис. 1. Изменение влагалищного микробиома в раз- личные периоды жизни женщины [Muhleisen A.L., Herbst-Kralovetz M.M. Menopause and the vaginal microbiome. Maturitas. 2016;91:42–50. DOI: 10.1016/j. maturitas.2016.05.01530] Fig. 1. Changes in vaginal microb](/upload/medialibrary/dd8/282-2.png)
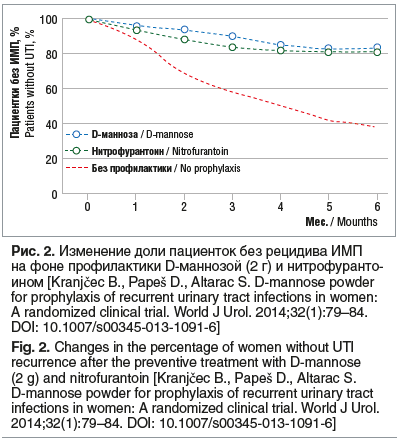
А.В. Зайцев отметил целесообразность использования профилактических методов лечения рецидивов ИМП без антибиотиков для снижения риска появления у пациенток резистентных микроорганизмов и последующей трудно поддающейся лечению клинической инфекции. Эффективным и безопасным направлением профилактики цистита и других ИМП является использование D-маннозы, препаратов клюквы, внутрипузырных инстилляций (введение гиалуроновой кислоты и хондроитинсульфата практикуется при интерстициальном и постлучевом цистите, гиперактивном мочевом пузыре, ИМП). Например, эффективность D-маннозы в дозе 2000 мг в профилактике обострений цистита сходна с таковой нитрофурантоина (рис. 2). D-манноза 2000 мг, входящая в данной дозировке в состав Уронекста®, вызывает интерес у европейского урологического сообщества и, как отмечено выше, была упомянута в последних руководствах и рекомендациях как перспективное средство при лечении и профилактике ИМП.
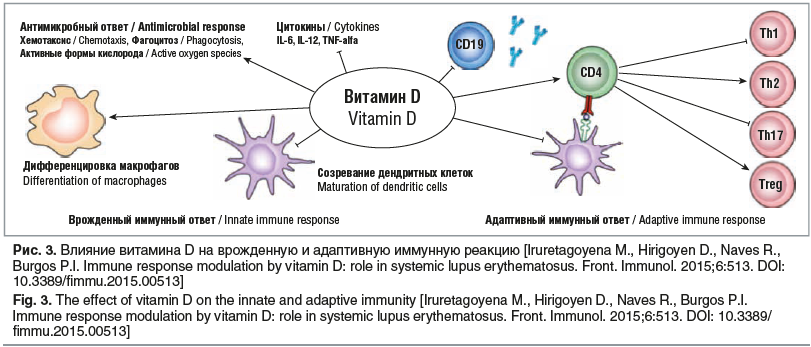
В заключение своего выступлении А.В. Зайцев остановился на обоснованности назначения витамина D3 в лечении и профилактике ИМП, отметив многообразие его функций (рис. 3). Применение препарата, сочетающего несколько компонентов, эффективность которых доказана клиническими исследованиями, обеспечивает более эффективную профилактику ИМП.
Завершила круглый стол Любовь Алексеевна Ходырева, д.м.н., профессор кафедры урологии ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России с докладом о новых аспектах профилактики ИМП.
Л.А. Ходырева отметила, что ИМП встречаются в практике урологов и врачей других специальностей, нередко осложняя течение различных заболеваний. По данным EAU, каждая вторая женщина в мире по меньшей мере 1 раз в жизни переносит эпизод ИМП, из них у 25–40% женщин в течение ближайших 6–12 мес. отмечается рецидив заболевания. По данным статистики, частота ИМП увеличивается с возрастом и при хронических заболеваниях, снижающих общий и местный иммунитет. Также к этому приводит миграция и старение населения. Тенденция к значительному повышению устойчивости микрофлоры к незащищенным пенициллинам, ко-тримоксазолу, фторхинолонам, а также распространение уропатогенов, способных продуцировать β-лактамазы широкого спектра, подталкивают к поиску альтернативного подхода в терапии, исключающего применение антибактериальных препаратов.
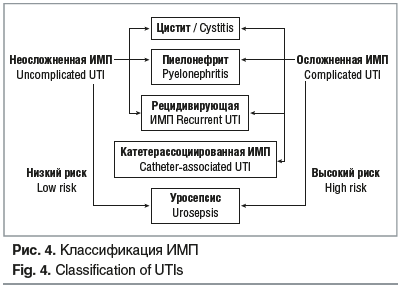
Согласно классификации EAU выделяют неосложненную и осложненную формы ИМП, при которых имеются факторы, поддерживающие течение и рецидивы инфекционно-воспалительного процесса в мочевыводящих путях (рис. 4).
В 2017 г. ВОЗ впервые опубликовала список бактерий с уже выработанной или растущей устойчивостью к большинству антибиотиков. Рейтинг бактерий заслуженно возглавляют грамотрицательные микроорганизмы семейства Enterobacteriaceae — возбудители, устойчивые к карбапенемам и цефалоспоринам III поколения, среди которых регистрируется высокая частота детекции продуцентов β-лактамаз расширенного спектра, достигающая 43%.
Среди большого разнообразия патогенных факторов можно выделить основные, которые в тех или иных комбинациях присутствуют у патогенных энтеробактерий, обеспечивая патогенетические механизмы вызываемого ими заболевания. К ним относят: эндотоксин, пили IV типа, секреторную систему 3-го типа, белковые токсины специфического действия (цито- и энтеротоксины). Следует отметить, что синтез факторов патогенности опосредован генами, локализованными на островках патогенности, плазмидах, конвертирующих бактериофагах. Факторы патогенности бактерий традиционно разделяют на три группы: определяющие взаимодействие с мембранами клеток организма-хозяина; обусловливающие устойчивость к действию защитных факторов макроорганизма; токсические продукты, повреждающие клетки и собственно вызывающие развитие клинически выраженного инфекционного процесса. Известно, что любой инфекционный процесс начинается с адгезии возбудителя на клетках-мишенях. Все энтеробактерии обладают выраженной способностью прикрепляться к органическим и неорганическим субстратам, что обеспечено наличием не менее 15 типов адгезинов, расположенных в особых структурах — фимбриях и пилях.
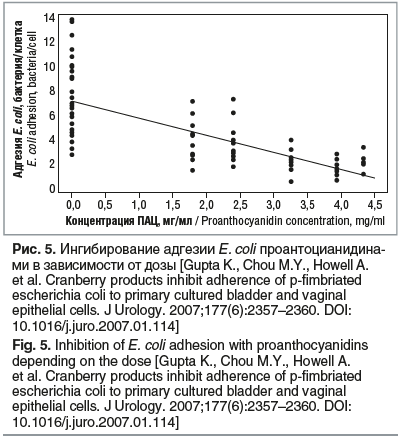
Исследование K. Gupta et al. (2017) показало, что ингибирование адгезии E. coli проантоцианидинами является дозозависимым и статистически высокозначимым: с увеличением их дозы линейно снижается адгезия (рис. 5).
В целом всеми докладчиками отмечена высокая медицинская и социальная значимость проблемы ИМП у женщин, важность взвешенного подхода к лечению и профилактике данного заболевания, целесообразность сокращения по возможности использования антибактериальных препаратов в условиях постоянного роста резистентности микроорганизмов. Благодаря доказанной способности клюквы и D-маннозы ингибировать бактериальную адгезию к клеткам уроэндотелия Уронекст® способствует снижению риска прикрепления уропатогенных бактерий, поддерживает здоровое состояние мочевыводящих путей и предупреждает развитие рецидивирующих ИМП, поэтому может использоваться при ведении рассматриваемой категории пациенток.
Симпозиум проходил при поддержке ООО «НПО Петровакс Фарм».
The symposium was supported by LLC “Petrovax Pharm”.
2. Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов. Федеральные клинические рекомендации. 2020.
3. European Association of Urology. Guidelines on Urological Infections. 2019. (Electronic resource.) URL: www.uroweb.org (access date: 28.08.2020).
4. Зайцев А.В., Касян Г.Р., Спивак Л.Г. Цистит. В кн.: Аляев Ю.Г., Глыбочко П.В., Пушкарь Д.Ю., ред. Урология. Российские клинические рекомендации. М.: Медфорум; 2017:501–518.
5. EAU Guidelines. Edn. presented at the EAU Annual Congress Amsterdam the Netherlands 2020.
6. Falagas M.E., Kotsantis I.K., Vouloumanou E.K. et al. Antibiotics versus placebo in the treatment of women with uncomplicated cystitis: a meta-analysis of randomized controlled trials. J Infect. 2009;58(2):91–102. DOI: 10.1016/j.jinf.2008.12.009.
7. Gagyor I., Bleidorn J., Kochen M.M. et al. Ibuprofen versus fosfomycin for uncomplicated urinary tract infection in women: randomised controlled trial. BMJ. 2015;351:h6544. DOI: 10.1136/bmj.h6544.
8. Vik I., Bollestad M., Grudeet N. al. Ibuprofen versus pivmecillinam for uncomplicated urinary tract infection in women-A double-blind, randomized non-inferiority trial. PLoS Med. 2018;15:e1002569. DOI: 10.1371/journal.pmed.1002569.
9. Kronenberg A., Bütikofe L., Odutayoet A. et al. Symptomatic treatment of uncomplicated lower urinary tract infections in the ambulatory setting: randomised, double blind trial. BMJ. 2017;359: j4784. DOI: 10.1136/bmj.j4784.
10. Wagenlehner F.M., Abramov-Sommariva D., Höller M. et al. Non-Antibiotic Herbal Therapy (BNO 1045) versus Antibiotic Therapy (Fosfomycin Trometamol) for the Treatment of Acute Lower Uncomplicated Urinary Tract Infections in Women: A Double-Blind, Parallel-Group, Randomized, Multicentre, Non-Inferiority Phase III Trial. Urol Int. 2018;101(3):327–336. DOI: 10.1159/000493368.
11. Wagenlehner F.M., Hoyme U., Kaase M. et al. Uncomplicated urinary tract infections. Dtsch Arztebl Int. 2011;108(24):415–423. DOI: 10.3238/arztebl.2011.0415.4.
12. Казюлин А.Н. Лечение неосложненных инфекций мочевыводящих путей. Место препаратов нитрофуранового ряда в современных условиях. Лечащий врач. 2017;3:84–90.
13. Палагин И.С., Сухорукова М.В., Дехнич А.В. и др. Исследовательская группа «ДАРМИС-2018». Антибиотикорезистентность возбудителей внебольничных инфекций мочевых путей в России: результаты многоцентрового исследования «ДАРМИС-2018». Клиническая микробиология и антимикробная химиотерапия. 2019;21(2):134–146. DOI: 10.36488/cmac.2019.2.134-146.
14. Клинические рекомендации. Цистит бактериальный у взрослых. 2019.
15. Sihra N., Goodman A., Zakri R. et al. Nonantibiotic prevention and management of recurrent urinary tract infection. Nat Rev Urol. 2018;15:750–776. DOI: 10.1038/s41585-018-0106-x.
16. Gupta K., Chou M.Y., Howell A. et al. Cranberry products inhibit adherence of p-fimbriated Escherichia coli to primary cultured bladder and vaginal epithelial cells. J. Urol. 2007;177(6):2357–2360.
17. Medus M.L., Gomez G.E., Zacchi L.F. et al. N-glycosylation triggers a dual selection pressure in eukaryotic secretory proteins. Sci Rep. 2017;7(1):8788. DOI: 10.1038/s41598-017-09173-6.
18. Громова О.А., Торшин И.Ю., Тетруашвили Н.К. Систематический анализ исследований по D-маннозе и перспективы ее применения при рецидивирующих инфекциях мочеполовых путей у женщин репродуктивного возраста. Акушерство, гинекология и репродукция. 2019;13(2):119–131. DOI: 10.17749/2313-7347.2019.13.2.119-131.
19. Hooton T.M. Recurrent urinary tract infection in women. Int J Antimicrob. Agents. 2001;17(4):259–268.
20. Nicolle L.E. Managing recurrent urinary tract infections in women. Womens Health. 2005;1(1):39–50.
21. Локшин К.Л., Геворкян А.Р., Евдокимов М.Е., Демидко Ю.Л. Лечение острого неосложненного цистита у женщины — чего ожидать от современных антимикробных препаратов? Эффективная фармакотерапия. 2012;4:30–34.
22. Перепанова Т.С. Федеральные клинические рекомендации «Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов — 2015 г.». Терапевтический архив. 2016;88(4):100–104. DOI: 10.17116/terarkh2016884100-104.
23. Fu Z., Liska D., Talan D., Chung M. Cranberry Reduces the Risk of Urinary Tract Infection Recurrence in Otherwise Healthy Women: A Systematic Review and Meta-Analysis. J Nutr. 2017;147(12):2282–2288. DOI: 10.3945/jn.117.254961.
24. Bohbot J. Results of a randomised, double-blind study on the prevention of recurrent cystitis wtih GynDelta. The Gynaecologist’s and Obstetrician’s Journal. 2007.
25. Wagenlehner F., Wullt B., Ballarini S. et al. Social and economic burden of recurrent urinary tract infections and quality of life: a patient web-based study (GESPRIT). Expert Rev Pharmacoecon Outcomes Res. 2018;18(1):107–117. DOI: 10.1080/14737167.2017.1359543.
26. Czaja C.A., Stamm W.E., Stapleton A.E. et al. Prospective cohort study of microbial and inflammatory events immediately preceding Escherichia coli recurrent urinary tract infection in women. J Infect Dis. 2009;200(4):528–536. DOI: 10.1086/600385.
27. Foxman B., Manning S.D., Tallman P. et al. Uropathogenic Escherichia coli are more likely than commensal E. coli to be shared between heterosexual sex partners. Am J Epidemiol. 2002;156(12):1133–1140. DOI: 10.1093/aje/kwf159.
28. Carda-Diéguez M., Cárdenas N., Aparicio M. et al. Variations in Vaginal, Penile, and Oral Microbiota After Sexual Intercourse: A Case Report. Front. Med. 2019;6:178. DOI: 10.3389/fmed.2019.00178.
29. Muhleisen A.L., Herbst-Kralovetz M.M. Menopause and the vaginal microbiome. Maturitas. 2016;91:42–50. DOI: 10.1016/j.maturitas.2016.05.015.
30. Stapleton A. The Vaginal Microbiota and Urinary Tract Infection. Microbiol Spectrum. 2016;4(6):UTI-0025–2016. DOI: 10.1128/microbiolspec.UTI-0025-2016.
31. Kranjčec B., Papeš D., Altarac S. D-mannose powder for prophylaxis of recurrent urinary tract infections in women: A randomized clinical trial. World J Urol. 2014;32(1):79–84. DOI: 10.1007/s00345-013-1091-6.
32. Iruretagoyena M., Hirigoyen D., Naves R., Burgos P.I. Immune response modulation by vitamin D: role in systemic lupus erythematosus. Front Immunol. 2015;6:513. DOI: 10.3389/fimmu.2015.00513.
33. Chen Y.H., Ko W.C., Hsueh P.R. The role of fluoroquinolones in the management of urinary tract infections in areas with high rates of fluoroquinolone-resistant uropathogens. Eur J Clin Microbiol Infect Dis. 2012;31(8):1699–1704. DOI: 10.1007/s10096-011-1457-x.
34. Tratselas A., Iosifidis E., Ioannidou M. et al. Outcome of urinary tract infections caused by extended spectrum β-lactamase-producing Enterobacteriaceae in children. Pediatr Infect Dis J. 2011;30:707–710. DOI: 10.1097/INF.0b013e31820d7ec4.
35. Зайцев А.В., Перепанова Т.С., Гвоздев М.Ю., Арефьева О.А. Инфекции мочевыводящих путей: методические рекомендации. М.; 2017.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.

