Морфологические особенности доброкачественной дисплазии молочной железы у женщин с эндометриоз-ассоциированным бесплодием
Рубрика:
Гинекология
Цель исследования: оценить морфологические особенности у женщин с доброкачественной дисплазией молочной железы (ДДМЖ) при эндометриоз-ассоциированном бесплодии.
Материал и методы: был выполнен анализ 53 морфологических биоптатов ДДМЖ у женщин (от 23 до 40 лет). Диагноз эндометриоза у каждой пациентки был морфологически верифицирован. У всех женщин в анамнезе было первичное или вторичное бесплодие. При ультразвуковом исследовании были выявлены признаки ДДМЖ. Диагноз ДДМЖ был установлен согласно МКБ-10. Интерпретация и протоколирование заключения о наличии или отсутствии патологических признаков ткани молочной железы проводились с использованием категорий BI-RADS (Breast Imaging Reporting and Data System). По показаниям выполнялось маммографическое исследование. Группе женщин с категорией BI-RADS IV проводилась трепан-биопсия подозрительного участка под контролем УЗИ.
Результаты исследования: у женщин с эндометриоз-ассоциированным бесплодием преобладал фибросклероз молочной железы (N60.3) — 29 случаев (54,72%). Диффузная кистозная форма ДДМЖ (N60.1) диагностирована у 10 больных, что соответствовало 18,87% случаев. Фиброаденоз ДДМЖ (N60.2) установлен у 5 пациенток (9,43%). Неуточненная форма ДДМЖ (N60.9) представлена 3 (5,66%) случаями. Воспалительные болезни молочной железы (N61) диагностированы у 5 больных (9,43%). Фиброаденома молочной железы (D24) подтверждена морфологически у 1 пациентки (1,89%). Морфологическое исследование ткани молочной железы позволило выявить гетерогенность форм ДДМЖ с преобладанием фибросклероза и диффузной формы кистозной мастопатии.
Выводы: согласно результатам проведенного исследования выявлена морфологическая гетерогенность ДДМЖ у пациенток с эндометриоз-ассоциированным бесплодием, представленная следующими формами: фибросклероз молочной железы, диффузная кистозная форма ДДМЖ, фиброаденоз ДДМЖ, неуточненная форма ДДМЖ. Наибольшая доля ДДМЖ при эндометриоз-ассоциированном бесплодии проявляется фибросклерозом и составляет 54,72% случаев. Фибросклероз молочных желез у женщин с эндометриозом, возможно, связан с отсутствием дифференциации ткани молочной железы в связи с нереализованной репродуктивной функцией.
Ключевые слова: эндометриоз, эндометриоз-ассоциированное бесплодие, доброкачественная дисплазия молочной железы, ультразвуковое исследование, фибросклероз.
Материал и методы: был выполнен анализ 53 морфологических биоптатов ДДМЖ у женщин (от 23 до 40 лет). Диагноз эндометриоза у каждой пациентки был морфологически верифицирован. У всех женщин в анамнезе было первичное или вторичное бесплодие. При ультразвуковом исследовании были выявлены признаки ДДМЖ. Диагноз ДДМЖ был установлен согласно МКБ-10. Интерпретация и протоколирование заключения о наличии или отсутствии патологических признаков ткани молочной железы проводились с использованием категорий BI-RADS (Breast Imaging Reporting and Data System). По показаниям выполнялось маммографическое исследование. Группе женщин с категорией BI-RADS IV проводилась трепан-биопсия подозрительного участка под контролем УЗИ.
Результаты исследования: у женщин с эндометриоз-ассоциированным бесплодием преобладал фибросклероз молочной железы (N60.3) — 29 случаев (54,72%). Диффузная кистозная форма ДДМЖ (N60.1) диагностирована у 10 больных, что соответствовало 18,87% случаев. Фиброаденоз ДДМЖ (N60.2) установлен у 5 пациенток (9,43%). Неуточненная форма ДДМЖ (N60.9) представлена 3 (5,66%) случаями. Воспалительные болезни молочной железы (N61) диагностированы у 5 больных (9,43%). Фиброаденома молочной железы (D24) подтверждена морфологически у 1 пациентки (1,89%). Морфологическое исследование ткани молочной железы позволило выявить гетерогенность форм ДДМЖ с преобладанием фибросклероза и диффузной формы кистозной мастопатии.
Выводы: согласно результатам проведенного исследования выявлена морфологическая гетерогенность ДДМЖ у пациенток с эндометриоз-ассоциированным бесплодием, представленная следующими формами: фибросклероз молочной железы, диффузная кистозная форма ДДМЖ, фиброаденоз ДДМЖ, неуточненная форма ДДМЖ. Наибольшая доля ДДМЖ при эндометриоз-ассоциированном бесплодии проявляется фибросклерозом и составляет 54,72% случаев. Фибросклероз молочных желез у женщин с эндометриозом, возможно, связан с отсутствием дифференциации ткани молочной железы в связи с нереализованной репродуктивной функцией.
Ключевые слова: эндометриоз, эндометриоз-ассоциированное бесплодие, доброкачественная дисплазия молочной железы, ультразвуковое исследование, фибросклероз.
E.N. Vandeeva1, A.E. Protasova1–5, G.A. Raskin2,3, M.I. Yarmolinskaya4,6
1 Almazov St. Petersburg Research Medical Center, Saint Petersburg
2 St. Petersburg State University, Saint Petersburg
3 Granov Russian Research Center of Radiology and Surgical Technologies, Saint Petersburg
4 Mechnikov North-Western State Medical University, Saint Petersburg
5 LLC AVA-PETER, Saint Petersburg
6 Ott Research Institute of Obstetrics, Gynecology and Reproductive Medicine, Saint Petersburg
Aim: to assess the morphological features in women with benign mammary dysplasia (BMD) with endometriosis-associated infertility.
Patients and Methods: 53 morphological biopsy specimens of BMD in women (from 23 to 40 years) were analyzed. The diagnosis of endometriosis in each patient was morphologically verified. All women in a personal history had primary or secondary infertility. An ultrasound revealed signs of BMD. The diagnosis of BMD was established according to ICD-10. Interpretation and recording of the conclusion about the presence or absence of pathological signs of the MT was carried out using the BI-RADS categories (Breast Imaging Reporting and Data System). Mammography was performed according to indications. A group of women with the category BI-RADS IV underwent a core needle biopsy of the suspicious area under ultrasound control.
Results: in women with endometriosis-associated infertility, fibrosclerosis of the mammary gland (MG) predominated (N60.3) — 29 cases (54.72%). Diffuse cystic form of BMD (N60.1) was diagnosed in 10 patients, which corresponded to 18.87% of cases. Fibroadenosis of BMD (N60.2) was manifested in 5 patients (9.43%). Unspecified form of BMD (N60.9) is represented in 3 (5.66%) cases. Inflammatory diseases of the MG (N61) were diagnosed in 5 patients (9.43%). MG fibroadenoma (D24) was morphologically confirmed in 1 patient (1.89%). A morphological study of the MT revealed the heterogeneity of the BMD forms with the prevalence of fibrosclerosis and diffuse forms of cystic mastopathy.
Conclusion: according to the results of the study, the morphological heterogeneity of BMD in patients with endometriosis-associated infertility was revealed, which is represented by the following forms: MG fibrosclerosis, diffuse cystic form of BMD, fibroadenosis of BMD, unspecified BMD form. The largest rate of BMD in endometriosis-associated infertility is manifested by fibrosclerosis and is of 54.72% of cases. MG fibrosclerosis in women with endometriosis may be due to the lack of differentiation of the MT in connection with unrealized reproductive function.
Key words: endometriosis, endometriosis-associated infertility, benign mammary dysplasia, ultrasound, fibrosclerosis.
For citation: Vandeeva E.N., Protasova A.E., Raskin G.A., Yarmolinskaya M.I. Morphological features of benign mammary dysplasia in women with endometriosis-associated infertility // RMJ. Medical Review. 2018. № 10. P. 22–25.
В статье представлены результаты оригинального исследования, посвященного оценке морфологических особенностей у женщин с доброкачественной дисплазией молочной железы при эндометриоз-ассоциированном бесплодии.
Введение
Эндометриоз — хроническое, дисгормональное, иммунозависимое и генетически детерминированное заболевание, характеризующееся доброкачественным разрастанием ткани, сходной по морфологическому строению и функции с эндометрием, но находящейся за пределами матки [1–3].По данным Федеральной службы государственной статистики, заболеваемость эндометриозом в России за последние 10 лет возросла на 72,9% [4]. Эндометриоз чаще всего встречается у женщин в возрасте 15–49 лет [5]. Дебют заболевания приходится на возраст 20–22 года. Распространенность эндометриоза составляет 10–18%, а интервал между возникновением первых симптомов и клиническим диагнозом достигает 8,6 года [6]. Поскольку эндометриоз ранее требовал морфологической верификации, фактическая распространенность заболевания, скорее всего, значительно выше [1].
Симптомами наружного генитального эндометриоза являются хроническая тазовая боль, дисменорея, диспареуния, а также бесплодие и невынашивание беременности [6–9].
Эндометриоз как причина инфертильности занимает второе место в структуре бесплодия после воспалительных заболеваний матки и придатков [10, 11].
По данным S. Ozkan et al., у женщин с бесплодием эндометриоз встречается в 25–40% случаев [11].
Согласно Международной классификации болезней
10-го пересмотра (МКБ-10), бесплодие, ассоциированное с эндометриозом, относится к группе невоспалительных болезней женских половых органов (N80 — N98) и кодируется как N96 (относительное бесплодие) [12].
Оценивая связь эндометриоза с другими заболеваниями органов репродуктивной системы, О. Uimari et al. (2011) показали связь эндометриоза и лейомиомы матки. Лейомиома матки была обнаружена у 25,8% (47/182) пациенток с эндометриозом. Эндометриоз установлен у 19,6% (47/240) женщин с лейомиомой матки. При этом авторы в своем исследовании показали значительную связь с бесплодием у данных групп пациенток как с лейомиомой матки, так и с эндометриозом (ОР: 3,8, 95% ДИ 2,3–6,5; ОР: 6,8, 95% ДИ 4,0–11,6 соответственно) [13].
K.D. Ballard et al. (2008) продемонстрировали сочетание эндометриоза с болезнями мочевыделительной системы
(ОР: 2,1, 95% ДИ: 2,0–2,3), синдромом раздраженного кишечника (ОР: 3,5, 95% ДИ: 3,1–3,9) и воспалительными заболеваниями органов малого таза (ОР: 6,4, 95% ДИ: 5,6–7,4). При этом относительный риск развития доброкачественной дисплазии молочной железы (ДДМЖ) у данной группы больных составил 2,2 (95% ДИ: 1,9–2,5) [14].
По определению Всемирной организации здравоохранения (ВОЗ), ДДМЖ (синонимы: фиброзно-кистозная болезнь, фиброзно-кистозная мастопатия) — это дисгормональный гиперпластический процесс в молочной железе (МЖ), характеризующийся широким спектром пролиферативных и регрессивных изменений с нарушением соотношения эпителиального и соединительнотканного компонентов [16].
На общность патогенетической связи ДДМЖ и эндометриоза указывалось в работе Farland et al. в 2016 г. [15].
Регуляция нормального роста, развития и функции МЖ происходит под влиянием комплексного взаимодействия между половыми стероидами, гормонами гипофиза, в т. ч. фолликулостимулирующим гормоном, лютеинизирующим гормоном, пролактином, гормонами надпочечников, щитовидной железы и т. д. [16]. Е. Samoli et al. (2013) описали повышение уровней стероидных гормонов, особенно
эндогенных эстрогенов, у женщин с ДДМЖ, в сравнении с популяционной группой [17].
Тканевой гомеостаз в МЖ поддерживается за счет процессов пролиферации, дифференцировки и апоптоза. Избыточная и/или атипическая пролиферация эпителиальных клеток считается в настоящее время важнейшей характеристикой фиброзно-кистозной болезни, имеющей прогностическое значение [16, 18, 19].
МЖ женщины, не реализовавшей репродуктивную функцию (отсутствие беременности и родов в анамнезе), сформирована наименее дифференцированными дольками I порядка до 60% и представлена кластерами из 6–11 протоков. В этой же группе женщин старше 40 лет в ткани МЖ происходит дальнейшее увеличение количества долек I порядка до 80%. Дольки II порядка эволюционируют из долек I порядка и содержат до 47 протоков.
На фоне беременности происходит дальнейшая дифференциация ткани МЖ с последующим развитием альвеол и протоков до 80, что является характеристикой долек
III порядка. Дольки IV порядка (содержат до 120 протоков) формируются только в период лактации и регрессируют в дольки III типа после ее завершения.
В послеродовом периоде дольки МЖ содержат гиалинизированную строму, а у женщин, нереализовавших репродуктивную функцию, — внутридольковую строму, которая представлена соединительной тканью, подверженной избыточной пролиферации [16, 18, 20].
Полагают, что клинические проявления мастопатии встречаются у 60% женщин, а гистологические — у 90% женщин старше 30 лет [16].
Связь эндометриоза и ДДМЖ продемонстрирована в ряде научных работ.
Одними из первых Alonzo-Sosa et al. (1996) в исследовании с участием 43 пациенток с эндометриозом в 37% случаев (17 пациенток) выявили ДДМЖ [20]. А.М. Дощанова (2015) отметила наличие ДДМЖ у больных эндометриозом в 89,6% случаев. При этом преобладала диффузная фиброзно-кистозная мастопатия, которая составила 66,4%, узловая наблюдалась в 23,2% случаев [21]. Farland et al. (2016) в исследовании с участием 76 393 женщин c эндометриозом показали умеренно повышенный риск ДДМЖ (ОР: 1,33, 95% ДИ: 1,09–1,63). При этом авторы отмечают, что эндометриоз характеризуется повышенным риском как пролиферативных, так и непролиферативных форм ДДМЖ. Риск пролиферативных форм ДДМЖ был выше среди женщин с эндометриозом, не реализовавших репродуктивную функцию (ОР: 1,50, 95% ДИ: 1,12–2,03) [15].
И.Ю. Коган и соавт. (2012) оценили частоту ДДМЖ с выраженностью клинической картины при железистом, фиброзном и смешанном вариантах мастопатии, выявленных методом ультразвуковой диагностики. Согласно проведенному исследованию, у женщин с 19 до 45 лет наблюдалась наибольшая степень циклических изменений толщины фиброгладулярной зоны МЖ. Причем у пациенток с мастопатией циклические изменения были более выражены, чем в контрольной группе. При этом было показано, что имеется прямая взаимосвязь между степенью выраженности паренхимы МЖ и интенсивностью болевого синдрома в МЖ [19].
Однако в доступной литературе исследований морфологических особенностей ДДМЖ у женщин с эндометриоз-
ассоциированным бесплодием нет, такое исследование и явилось целью нашей работы.
Материал и методы
Был проведен анализ 53 морфологических исследований ткани МЖ у пациенток с эндометриоз-ассоциированным бесплодием.
Критерии включения в группу исследования: возраст 23–40 лет; морфологически верифицированный диагноз эндометриоза; бесплодие (первичное или вторичное) в анамнезе; ультразвуковые признаки ДДМЖ.
Критерии невключения: подтвержденная злокачественная опухоль МЖ или любой другой локализации; бесплодие, связанное с такими этиопатогенетическими факторами, как трубный и/или перитонеальный фактор; беременность; лактация; послеродовой период; использование средств комбинированной оральной контрацепции в течение последних 3 мес.; тяжелая экстрагенитальная патология (сахарный диабет 1 и 2 типа, гепатиты и т. д.).
Обследование МЖ проводилось всем пациенткам ультразвуковым методом исследования (УЗИ) на аппарате LogicE9 XD clear, GE.
Диагноз ДДМЖ установлен согласно МКБ-10. Интерпретация и протоколирование заключения о наличии или отсутствии патологических признаков ткани МЖ проводились с использованием категорий BI-RADS (Breast Imaging Reporting and Data System — система описания и обработки данных лучевых исследований МЖ). По показаниям выполнялось маммографическое исследование. Группе женщин с категорией BI-RADS IV проводилась трепан-биопсия подозрительного участка под контролем УЗИ. Морфологический анализ биоптатов выполнен в Российском научном центре радиологии и хирургических технологий им. акад. А.М. Гранова.
Результаты и обсуждение
При анализе результатов морфологических исследований ткани МЖ оценено 53 случая ДДМЖ у женщин с эндометриоз-ассоциированным бесплодием (табл. 1).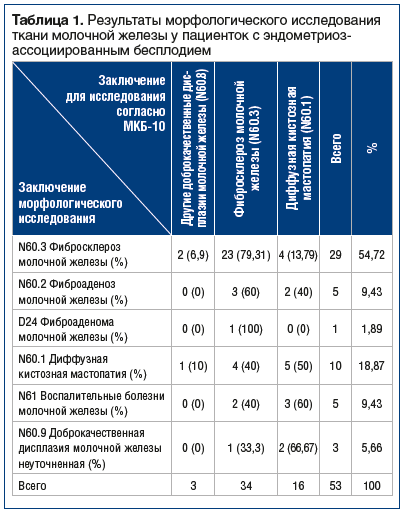
У женщин с эндометриоз-ассоциированным бесплодием преобладал фибросклероз МЖ (N60.3) — 29 случаев (54,72%) (рис. 1).
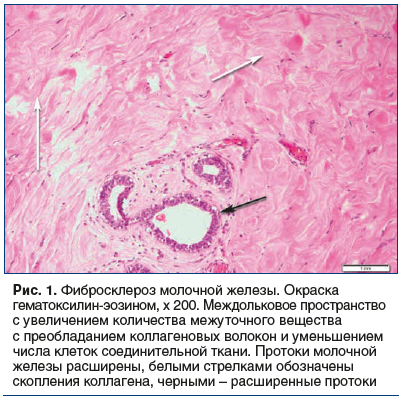
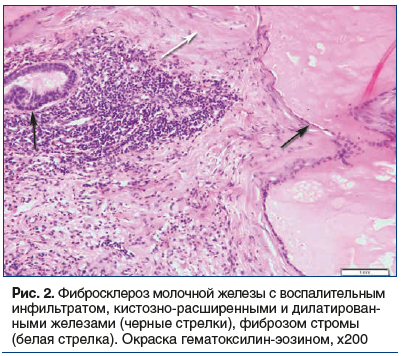
Диффузная кистозная форма ДДМЖ (N60.1) диагностирована у 10 больных, что соответствовало 18,87% случаев. Фиброаденоз ДДМЖ (N 60.2) установлен у 5 пациенток (9,43%). Неуточненная форма ДДМЖ (N60.9) представлена 3 (5,66%) случаями. Воспалительные болезни МЖ (N61) диагностированы у 5 больных (9,43%). Фиброаденома МЖ (D24) подтверждена морфологически у 1 пациентки (1,89%). Морфологическое исследование ткани МЖ позволило выявить гетерогенность форм ДДМЖ с преобладанием фибросклероза и диффузной формы кистозной мастопатии (см. рис. 1). В 1 случае фибросклероз сочетался с участками нормальной ткани МЖ, воспалением, лимфоцитарной инфильтрацией и кистозно-расширенными железами (рис. 2).
Возникновение кисты обусловлено обтурацией млечных протоков фиброзной тканью, как следствие, отмечается расширение их со скоплением секрета.
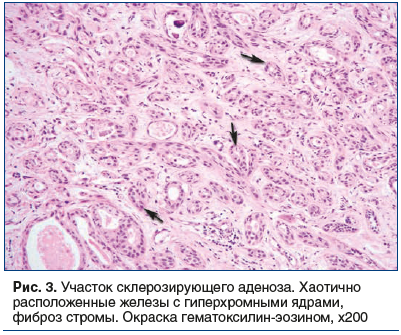
При аденозе МЖ наблюдается пролиферация ацинарных и тубулярных структур, состоящих из эпителия и миоэпителия, окруженных базальной мембраной. Ацинусы могут быть удлиненными, а междольковая нормальная соединительная ткань замещена более плотной фиброзной тканью с компрессией и деформацией ацинарных структур (рис. 3).
функцией.

При аденозе МЖ наблюдается пролиферация ацинарных и тубулярных структур, состоящих из эпителия и миоэпителия, окруженных базальной мембраной. Ацинусы могут быть удлиненными, а междольковая нормальная соединительная ткань замещена более плотной фиброзной тканью с компрессией и деформацией ацинарных структур (рис. 3).

Заключение
Согласно результатам проведенного исследования выявлена морфологическая гетерогенность ДДМЖ у пациенток с эндометриоз-ассоциированным бесплодием, представленная следующими формами: фибросклероз МЖ, диффузная кистозная форма ДДМЖ, фиброаденоз ДДМЖ, неуточненная форма ДДМЖ. Наибольшая доля ДДМЖ при эндометриоз-ассоциированном бесплодии проявляется фибросклерозом и составляет 54,72% случаев. Фибросклероз МЖ у женщин с эндометриозом, возможно, связан с отсутствием дифференциации ткани МЖ в связи с нереализованной репродуктивнойфункцией.
Литература
1. Working group of ESGE, ESHRE and WES, Saridogan E., Becker C.M., Feki A. et al. Recommendations for the Surgical Treatment of Endometriosis. Part 1: Ovarian Endometrioma // Human Reproduction Open, 2017. Vol. 4(1). https://doi.org/10.1093/hropen/hox016.
2. Bruner-Tran K.L., Herington J.L., Duleba A.J. et al. Medical management of endometriosis: emerging evidence linking inflammation to disease pathophysiology // Minerva Ginecol. 2013. Vol. 65. P. 199–213.
3. Parente Barbosa C., Bentes De Souza A.M., Bianco B., Christofolini D.M. The effect of hormones on endometriosis development // Minerva Ginecol. 2011. Vol. 63(4). P. 375–386.
4. Основные показатели здоровья матери и ребенка, деятельность службы охраны детства и родовспоможения в Российской Федерации. М., 2013. C. 164 [The main indicators of maternal and child health, the activities of the service of protection of children and obstetrics in the Russian Federation. M., 2013. S. 164 (in Russian)].
5. Theobald P., Cottenet J., Iacobelli S., Quantin C. Epidemiology of Endometriosis in France: A Large, Nation-Wide Study Based on Hospital Discharge Data // Biomed Res Int. 2016. Vol. 4. Р. 3260952. DOI: 10.1155/2016/3260952.
6. Robert L. Barbieri Why are there deleys in the diagnosis of endometriosis? // OBG Manag. 2017. Vol. 29(3). P. 10–11.
7. Triolo O., Laganà A. S., Sturlese E. Chronic pelvic pain in endometriosis: an overview // Journal of Clinical Medicine Research. 2013. Vol. 5(3). P. 153–163. DOI: 10.4021/jocmr1288w.
8. Chapron C., Bourret A., Chopin N. et al. Surgery for bladder endometriosis: long-term results and concomitant management of associated posterior deep lesions // Human Reproduction. 2010. Vol. 25(4). P. 884–889. DOI: 10.1093/humrep/deq017.
9. Butticè S., Laganà A.S., Mucciardi G. et al. Different patterns of pelvic ureteral endometriosis. What is the best treatment? Results of a retrospective analysis // Archivio Italiano di Urologia, Andrologia. 2016. Vol. 88(4). P. 266–269. DOI: 10.4081/aiua.2016.4.266.
10. Чернуха Г.Е., Ильина Л.М., Павлович С.В., Адамян Л.В. Глубокий инфильтративный эндометриоз: послеоперационные рецидивы и возможные пути их профилактики // Акушерство и гинекология. 2015. № 8. С. 39–46 [Chernuha G.E., Il’ina L.M., Pavlovich S.V., Adamjan L.V. Glubokij infil’trativnyj jendometrioz: posleoperacionnye recidivy i vozmozhnye puti ih profilaktiki // Akusherstvo i ginekologija. 2015. № 8. S. 39–46 (in Russian)].
11. Филиппова Е.С., Козаченко И.Ф., Быков А.Г. Современный взгляд на овариальный резерв у женщин репродуктивного возраста с эндометриоидными кистами яичников (обзор литературы) // Проблемы репродукции. 2017. Т. 23. № 2. С. 72–80. DOI: 10.17116/repro201723272-80 [Filippova E.S., Kozachenko I.F., Bykov A.G. Sovremennyj vzgljad na ovarial’nyj rezerv u zhenshhin reproduktivnogo vozrasta s jendometrioidnymi kistami jaichnikov (obzor literatury) // Problemy reprodukcii. 2017. № 23(2). S. 72–80. DOI: 10.17116/repro201723272-80 (in Russian)].
12. Ozkan S., Murk W., Arici A. Endometriosis and infertility: epidemiology and evidence-based treatments// Ann N Y Acad Sci. 2008. Vol. 1127. P. 92–100. DOI: 10.1196/ annals.1434.007.
13. Международная статистическая классификация болезней и проблем, связанных со здоровьем (10-й пересмотр). Всемирная организация здравоохранения. М., 1998. C. 2466 [Mezhdunarodnaia statisticheskaia klassifikatsiia boleznei i problem, sviazannykh so zdorov’em (10-i peresmotr). Vsemirnaia organizatsiia zdravookhraneniia. M., 1998. S. 2466 (in Russian)].
14. Uimari О., Järvelä I., Ryynänen M. Do symptomatic endometriosis and uterine fibroids appear together? // J Hum Reprod Sci. 2011. Vol. 4(1). P. 34–38. DOI: 10.4103/0974-1208.82358
15. Ballard K., Seaman H., de Vries C., Wright J. Can symptomatology help in the diagnosis of endometriosis? Findings from a national case–control study. Part 1 // BJOG. 2008. Vol. 115. P. 1382–1391.
16. Farland L.V., Tamimi R.M., Eliassen A.H. et al. A Prospective study of Endometriosis and Risk of Benign Breast Disease // Breast Cancer Res Treat. 2016. Vol. 159(3). P. 545–552. DOI: 10.1007/s10549-016-3957-y.
17. Кулагина Н.В. Доброкачественные заболевания молочных желез: Учебное пособие. 2-е изд., доп. М.: ООО «Типография «Печатных дел мастер», 2012. 64 с. [Kulagina N.V. Dobrokachestvennye zabolevanija molochnyh zhelez: Uchebnoe posobie. 2-e izd., dop. M.: OOO «Tipografija «Pechatnyh del master», 2012. 64 s. (in Russian)].Samoli E., Trichopoulos D., Lagiou A. et al. The hormonal profile of benign breast disease // Br J Cancer. 2013. Vol. 108. P. 199–204. DOI: 10.1038/bjc.2012.493.
18. Russo J., Russo I.H. Role of hormones in human breast development: The menopausal breast. In: Progress in the management of menopause. London: Parthenon Publishing, 1997. P. 184–193.
19. Коган И.Ю., Мясникова М.О., Мусина Е.В. Прогестерон в лечении мастопатии / под ред. академика Э.К. Айламазяна. М.: ООО «Типография «Печатных дел мастер», 2012. 68 с. [Kogan I.Ju., Mjasnikova M.O., Musina E.V. Progesteron v lechenii mastopatii / pod red. akademika Je.K. Ajlamazjana. M.: OOO «Tipografija «Pechatnyh del master», 2012. 68 s. (in Russian)].
20. Alonzo-Sosa J.E., Cárdenas-Bazan M.A., Dávila-Velazquez J. Prevalence of fibrocystic disease of breast in patients with endometriosis // Ginecol Obstet Mex. 1996. Vol. 64. P. 283–285. PMID: 8754730.
21. Дощанова А.М. Гормональная терапия эндометриоза и состояние молочных желез // Вестник Кыргызско-Российского славянского университета. 2015. Т. 15. № 4. С. 32–35 [Doshhanova A.M. Gormonal’naja terapija jendometrioza i sostojanie molochnyh zhelez // Vestnik Kyrgyzsko-Rossijskogo slavjanskogo universiteta. 2015. Vol. 15 (4). S. 32–35 (in Russian)].
2. Bruner-Tran K.L., Herington J.L., Duleba A.J. et al. Medical management of endometriosis: emerging evidence linking inflammation to disease pathophysiology // Minerva Ginecol. 2013. Vol. 65. P. 199–213.
3. Parente Barbosa C., Bentes De Souza A.M., Bianco B., Christofolini D.M. The effect of hormones on endometriosis development // Minerva Ginecol. 2011. Vol. 63(4). P. 375–386.
4. Основные показатели здоровья матери и ребенка, деятельность службы охраны детства и родовспоможения в Российской Федерации. М., 2013. C. 164 [The main indicators of maternal and child health, the activities of the service of protection of children and obstetrics in the Russian Federation. M., 2013. S. 164 (in Russian)].
5. Theobald P., Cottenet J., Iacobelli S., Quantin C. Epidemiology of Endometriosis in France: A Large, Nation-Wide Study Based on Hospital Discharge Data // Biomed Res Int. 2016. Vol. 4. Р. 3260952. DOI: 10.1155/2016/3260952.
6. Robert L. Barbieri Why are there deleys in the diagnosis of endometriosis? // OBG Manag. 2017. Vol. 29(3). P. 10–11.
7. Triolo O., Laganà A. S., Sturlese E. Chronic pelvic pain in endometriosis: an overview // Journal of Clinical Medicine Research. 2013. Vol. 5(3). P. 153–163. DOI: 10.4021/jocmr1288w.
8. Chapron C., Bourret A., Chopin N. et al. Surgery for bladder endometriosis: long-term results and concomitant management of associated posterior deep lesions // Human Reproduction. 2010. Vol. 25(4). P. 884–889. DOI: 10.1093/humrep/deq017.
9. Butticè S., Laganà A.S., Mucciardi G. et al. Different patterns of pelvic ureteral endometriosis. What is the best treatment? Results of a retrospective analysis // Archivio Italiano di Urologia, Andrologia. 2016. Vol. 88(4). P. 266–269. DOI: 10.4081/aiua.2016.4.266.
10. Чернуха Г.Е., Ильина Л.М., Павлович С.В., Адамян Л.В. Глубокий инфильтративный эндометриоз: послеоперационные рецидивы и возможные пути их профилактики // Акушерство и гинекология. 2015. № 8. С. 39–46 [Chernuha G.E., Il’ina L.M., Pavlovich S.V., Adamjan L.V. Glubokij infil’trativnyj jendometrioz: posleoperacionnye recidivy i vozmozhnye puti ih profilaktiki // Akusherstvo i ginekologija. 2015. № 8. S. 39–46 (in Russian)].
11. Филиппова Е.С., Козаченко И.Ф., Быков А.Г. Современный взгляд на овариальный резерв у женщин репродуктивного возраста с эндометриоидными кистами яичников (обзор литературы) // Проблемы репродукции. 2017. Т. 23. № 2. С. 72–80. DOI: 10.17116/repro201723272-80 [Filippova E.S., Kozachenko I.F., Bykov A.G. Sovremennyj vzgljad na ovarial’nyj rezerv u zhenshhin reproduktivnogo vozrasta s jendometrioidnymi kistami jaichnikov (obzor literatury) // Problemy reprodukcii. 2017. № 23(2). S. 72–80. DOI: 10.17116/repro201723272-80 (in Russian)].
12. Ozkan S., Murk W., Arici A. Endometriosis and infertility: epidemiology and evidence-based treatments// Ann N Y Acad Sci. 2008. Vol. 1127. P. 92–100. DOI: 10.1196/ annals.1434.007.
13. Международная статистическая классификация болезней и проблем, связанных со здоровьем (10-й пересмотр). Всемирная организация здравоохранения. М., 1998. C. 2466 [Mezhdunarodnaia statisticheskaia klassifikatsiia boleznei i problem, sviazannykh so zdorov’em (10-i peresmotr). Vsemirnaia organizatsiia zdravookhraneniia. M., 1998. S. 2466 (in Russian)].
14. Uimari О., Järvelä I., Ryynänen M. Do symptomatic endometriosis and uterine fibroids appear together? // J Hum Reprod Sci. 2011. Vol. 4(1). P. 34–38. DOI: 10.4103/0974-1208.82358
15. Ballard K., Seaman H., de Vries C., Wright J. Can symptomatology help in the diagnosis of endometriosis? Findings from a national case–control study. Part 1 // BJOG. 2008. Vol. 115. P. 1382–1391.
16. Farland L.V., Tamimi R.M., Eliassen A.H. et al. A Prospective study of Endometriosis and Risk of Benign Breast Disease // Breast Cancer Res Treat. 2016. Vol. 159(3). P. 545–552. DOI: 10.1007/s10549-016-3957-y.
17. Кулагина Н.В. Доброкачественные заболевания молочных желез: Учебное пособие. 2-е изд., доп. М.: ООО «Типография «Печатных дел мастер», 2012. 64 с. [Kulagina N.V. Dobrokachestvennye zabolevanija molochnyh zhelez: Uchebnoe posobie. 2-e izd., dop. M.: OOO «Tipografija «Pechatnyh del master», 2012. 64 s. (in Russian)].Samoli E., Trichopoulos D., Lagiou A. et al. The hormonal profile of benign breast disease // Br J Cancer. 2013. Vol. 108. P. 199–204. DOI: 10.1038/bjc.2012.493.
18. Russo J., Russo I.H. Role of hormones in human breast development: The menopausal breast. In: Progress in the management of menopause. London: Parthenon Publishing, 1997. P. 184–193.
19. Коган И.Ю., Мясникова М.О., Мусина Е.В. Прогестерон в лечении мастопатии / под ред. академика Э.К. Айламазяна. М.: ООО «Типография «Печатных дел мастер», 2012. 68 с. [Kogan I.Ju., Mjasnikova M.O., Musina E.V. Progesteron v lechenii mastopatii / pod red. akademika Je.K. Ajlamazjana. M.: OOO «Tipografija «Pechatnyh del master», 2012. 68 s. (in Russian)].
20. Alonzo-Sosa J.E., Cárdenas-Bazan M.A., Dávila-Velazquez J. Prevalence of fibrocystic disease of breast in patients with endometriosis // Ginecol Obstet Mex. 1996. Vol. 64. P. 283–285. PMID: 8754730.
21. Дощанова А.М. Гормональная терапия эндометриоза и состояние молочных желез // Вестник Кыргызско-Российского славянского университета. 2015. Т. 15. № 4. С. 32–35 [Doshhanova A.M. Gormonal’naja terapija jendometrioza i sostojanie molochnyh zhelez // Vestnik Kyrgyzsko-Rossijskogo slavjanskogo universiteta. 2015. Vol. 15 (4). S. 32–35 (in Russian)].

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
