Возможности использования пробиотиков в эрадикации Helicobacter pylori
Рубрика:
Гастроэнтерология
Микробиота желудка разнообразна. Инфекция Helicobacter pylori (HP) меняет ее состав в целом, что может способствовать более быстрому прогрессированию хронического гастрита. Пробиотики могут быть эффективны в коррекции микробиома желудка.
Цель исследования: изучить эффективность использования Lactobacillus reuteri DSMZ17648 (Lr) при лечении HP-ассоциированного гастрита у детей и эрадикации HP.
Материал и методы: проведено двойное слепое рандомизированное плацебо-контролируемое исследование эффективности применения убитых Lr как в виде монотерапии, так и на фоне эрадикационной схемы (омепразол + амоксициллин + метронидазол + висмут в течение 10 дней) у 103 HP(+) пациентов от 9 до 17 лет. Курс применения Lr в подгруппах А составил 28 дней, в подгруппах В – 56 дней. Для контроля проводили эндоскопическое, гистологическое исследование, быстрый уреазный тест, дыхательный аммиачный тест (АВТ), подсчитывали количество HP в биоптате, определяли воспалительный и атрофический индексы.
Результаты исследования: при значительной обсемененности HP в желудке отмечалось снижение микробного разнообразия. Это сопровождалось более выраженным воспалением, очаговой атрофией слизистой оболочки. При слабой обсемененности HP окружающая микробиота сохраняла разнообразие, воспаление было выражено минимально. Эрадикация HP была достигнута при монотерапии Lr у 50% детей через 28 и у 60% — через
56 дней, при адъювантном назначении Lr — у 60% через 28 и у 77,8% через 56 дней, в группе плацебо — у 68,8% через
28 и 56 дней.
Заключение: клиническое улучшение на фоне применения Lr было более ранним, снижение показателей АВТ — стабильным, достоверно снизились воспалительные и атрофические изменения слизистой оболочки желудка.
Монотерапия с применением Lr сравнима по эффективности со стандартной схемой, включающей 2 антибиотика. Пробиотики могут быть альтернативой традиционной терапии HP.
Ключевые слова: Helicobacter pylori, HP-ассоциированный гастрит, нехеликобактерная микробиота желудка, рак желудка, пробиотики, Lactobacillus reuteri.
Цель исследования: изучить эффективность использования Lactobacillus reuteri DSMZ17648 (Lr) при лечении HP-ассоциированного гастрита у детей и эрадикации HP.
Материал и методы: проведено двойное слепое рандомизированное плацебо-контролируемое исследование эффективности применения убитых Lr как в виде монотерапии, так и на фоне эрадикационной схемы (омепразол + амоксициллин + метронидазол + висмут в течение 10 дней) у 103 HP(+) пациентов от 9 до 17 лет. Курс применения Lr в подгруппах А составил 28 дней, в подгруппах В – 56 дней. Для контроля проводили эндоскопическое, гистологическое исследование, быстрый уреазный тест, дыхательный аммиачный тест (АВТ), подсчитывали количество HP в биоптате, определяли воспалительный и атрофический индексы.
Результаты исследования: при значительной обсемененности HP в желудке отмечалось снижение микробного разнообразия. Это сопровождалось более выраженным воспалением, очаговой атрофией слизистой оболочки. При слабой обсемененности HP окружающая микробиота сохраняла разнообразие, воспаление было выражено минимально. Эрадикация HP была достигнута при монотерапии Lr у 50% детей через 28 и у 60% — через
56 дней, при адъювантном назначении Lr — у 60% через 28 и у 77,8% через 56 дней, в группе плацебо — у 68,8% через
28 и 56 дней.
Заключение: клиническое улучшение на фоне применения Lr было более ранним, снижение показателей АВТ — стабильным, достоверно снизились воспалительные и атрофические изменения слизистой оболочки желудка.
Монотерапия с применением Lr сравнима по эффективности со стандартной схемой, включающей 2 антибиотика. Пробиотики могут быть альтернативой традиционной терапии HP.
Ключевые слова: Helicobacter pylori, HP-ассоциированный гастрит, нехеликобактерная микробиота желудка, рак желудка, пробиотики, Lactobacillus reuteri.
E.A. Kornienko1, N.I. Parolova1, S.V. Ivanov2, D.S. Polev3, P.A. Zykin3, Yu.D. Kondratenko3
1 St. Petersburg State Pediatric Medical University
2 Pavlov First St. Petersburg State Medical University
3 St. Petersburg State University
A gastric microbiota is diverse. Helicobacter pylori (HP) infection changes its composition as a whole, which may contribute to the more rapid progression of chronic gastritis. Probiotics can be effective in correcting the gastric microbiome.
Aim: to study the effectiveness of the use of Lactobacillus reuteri DSMZ17648 (Lr) in the treatment of HP-associated gastritis in children and HP eradication.
Patients and Methods: a double-blind, randomized, placebo-controlled study of the effectiveness of treatment with killed Lr both as monotherapy and on the background of the eradication scheme (omeprazole + amoxicillin + metronidazole + bismuth —
10 days) in 103 patients from 9 to 17 years old with HP(+), Lr course in subgroups A was 28 days, in subgroups B — 56 days.
For the control, endoscopic, histological studies, rapid urease test, ammonia breath test (ABT) were performed, the number of HP
in the biopsy, inflammatory and atrophic indices were calculated.
Results: with significant HP contamination in the stomach, there was a decrease in microbial diversity, the suppression of other microbes. This was accompanied by a more pronounced inflammation, focal atrophy of the mucous membrane. With low HP contamination, the surrounding microbiota preserved diversity, inflammation was minimal. HP eradication was achieved with Lr monotherapy in 50% of children after 28 days and 60% — after 56 days, with adjuvant Lr prescribing, in 60% — after 28 days and 77.8% — after 56 days, in the placebo group 68.8% — after 28 days and 56 days.
Conclusion: clinical improvement on the background of Lr was earlier, the decline in ABT indications was stable, inflammatory and atrophic changes in the gastric mucosa decreased significantly. According to the effectiveness, Lr monotherapy
is comparable to the standard dual antibiotic regimen, probiotics can be an alternative to traditional HP therapy.
Key words: Helicobacter pylori, HP-associated gastritis, non-Helicobacter gastric microbiota, gastric cancer, probiotics, Lactobacillus reuteri.
For citation: Kornienko E.A., Parolova N.I., Ivanov S.V. et al. Possibilities of using probiotics in Helicobacter pylori eradication //
RMJ. Medical Review. 2018. № 7(II). P. 51–58.
Статья посвящена возможностям использования пробиотиков в эрадикации Helicobacter pylori. Представлены результаты исследования эффективности использования Lactobacillus reuteri DSMZ17648 (Lr) при лечении Helicobacter pylori-ассоциированного гастрита у детей и эрадикации Helicobacter pylori.

Введение
Клинические исследования, а также исследования на животных показали, что колонизация желудка Helicobacter pylori (HP), особенно длительная, влияет на состав желудочного микробиома в целом [1, 2]. Измененная микрофлора и ее метаболиты, в свою очередь, оказывают влияние на состояние слизистой желудка, определяя течение его заболеваний и повышая риск канцерогенеза [3–6]. Логично предположить, что, достигнув изменений микробиоты, например, с помощью пробиотиков, можно облегчить течение имеющихся заболеваний желудка и снизить риск возникновения новых.Пробиотики могут оказывать прямое антагонистическое воздействие на HP за счет своих метаболитов. Количество молочной кислоты, выделяемое Lactobacillus, Bifidobacterium и Pediococcus (50–156 ммоль), коррелирует с интенсивностью ингибирующего действия на HP [7].
Поэтому микробы, продуцирующие молочную кислоту в большом количестве, — Lactobacillus salivarius и Lactobacillus casei Shirota — подавляют HP и снижают активность воспаления в желудке, что было продемонстрировано в эксперименте на мышах [8].
Антихеликобактерное действие оказывают и бактериоцины — мелкие термостабильные белки, которые синтезируются некоторыми бактериями, в частности лактобациллами. Kim et al. [9] оценили антихеликобактерную активность семи бактериоцинов, продуцируемых молочнокислыми бактериями (низин А, педиоцин РО2, леукоцин К и разные типы лактицинов). Лактицины А164 и ВН5, продуцируемые Lactobacillus lactis, отличались наибольшей ингибирующей активностью в отношении некоторых штаммов НР, т. е. была показана штаммовая специфичность бактериоцинов. Лизаты Lactobacillus acidophilus CRL639 за счет содержащихся в них бактериоцинов полностью убивали НР после 48-часовой экспозиции [10].
Супернатант культуры пробиотического штамма Lactobacillus johnsonii La1 ингибирует и уреазную активность, и рост HP [11]. Это обусловлено продукцией
L. johnsonii бактериоцина — лактицина F и происходит, даже когда HP адгезирован к культуре эпителиальных клеток, не зависит от токсигенности HP и наличия островка патогенности. Назначение супернатанта L. johnsonii La1 взрослым HP(+) пациентам значительно снижало показатели 13С-уреазного дыхательного теста.
Похожие результаты получили Coconnier et al. [12], которые инкубировали HP с супернатантом L. acidophilus LB: выживаемость HP, его уреазная активность и адгезия к эпителию снижались в соответствии с дозой L. acidophilus LB. Этот эффект не зависел от молочной кислоты и рН, не снижался после кипячения. Бактерии HP выглядели морфологически дефектными после инкубации с супернатантом
L. acidophilus LB, меняя спиралевидную форму на U-образную и уменьшаясь в размерах, что соответствует прекокковидной модификации HP. Но антихеликобактерное действие пробиотических бактерий штаммоспецифично. Так, супернатант L. rhamnosus GG не оказывал никакого воздействия на HP [12].
Пробиотики уменьшают активность воспаления в желудке. Это было отмечено в отношении L. acidophilus LB и L. johnsonii La, L. salivarius WB1004, L. rhamnosus R0011, L. acidophilus R0052 и L. gasseri OLL2716. Прием йогурта, содержащего L. gasseri, защищал экспериментальных животных от развития острого химического гастрита, в отличие от приема молока [13]. Прием йогурта сопровождался увеличением количества простагландина E2 в слизистой оболочке желудка. Протективное действие за счет повышения количества простагландинов и ростовых факторов (EGF и bEGF) было продемонстрировано также у пробиотических штаммов бифидобактерий: Bifidobacterium breve и B. bifidum, их прием препятствовал ульцерации слизистой оболочки желудка у крыс [14]. Даже назначение полисахаридов бифидобактерий имело аналогичное антиульцерогенное действие, этот эффект зависел от количества полисахаридов, содержащих рамнозу.
Попытки улучшить результативность эрадикации с помощью пробиотиков были предприняты в целом ряде работ. Большинство исследований посвящено оценке терапии пробиотиками на фоне стандартных схем. Метаанализ 10 рандомизированных исследований, включавших 963 пациента, получавших продукты функционального питания с пробиотиками на фоне стандартной терапии HP, и 465 пациентов группы сравнения, показал, что пробиотики повышают уровень эрадикации HP на 5–15% и снижают выраженность побочных реакций основной терапии [15].
Несколько исследований было посвящено оценке эффективности монотерапии инфекции HP пробиотиками. M. Gotteland et al. [16] сравнили эффективность монотерапии Saccharomyces boulardii, монотерапии L. acidophilus LB и стандартной 7-дневной тройной схемы эрадикации HP у школьников. Пробиотики назначали дважды в день на протяжении 2 мес. Эрадикация НР была достигнута у 66% детей, получавших тройную схему, у 12% — получавших монотерапию S. boulardii и у 6,5% — получавших монотерапию L. acidophilus LB. У 50 бессимптомных добровольцев с хроническим гастритом, принимавших кисломолочный продукт, содержащий L. johnsonii La1 (LC1), в течение 16 нед., наблюдалось достоверное снижение активности воспаления в слизистой оболочке желудка и плотности колонизации HP. Отмечено также утолщение слизистого слоя на фоне приема LC1 [17].
Многообещающие результаты продемонстрировало исследование эффективности высушенных распылением Lactobacillus reuteri DSMZ17648 (Lr), в котором приняли участие 22 человека, зараженных HP. Уровень обсемененности HP был определен с помощью стандартного 13C-уреазного дыхательного теста до лечения и через 14 дней после начала лечения. В основной группе было достигнуто значительное снижение уровня обсемененности HP, в контрольной плацебо-группе результат не отличался от исходного [18]. Lr, в отличие от других штаммов, специфически коагрегирует с HP в опытах in vitro и сохраняет эту способность даже после лиофилизации.
Мы провели двойное слепое рандомизированное плацебо-контролируемое исследование эффективности Lr при HP-ассоциированном гастрите у детей как при монотерапии продолжительностью 28 и 56 дней, так и при дополнительной терапии на фоне применения традиционной эрадикационной схемы.
Материал и методы
Дизайн исследования
Исследование проводилось в гастроэнтерологическом отделении Детской городской клинической больницы № 5 Санкт-Петербурга в 2015–2017 гг. у детей, направленных на эндоскопическое исследование в связи с симптомами диспепсии (рецидивирующие боли и дискомфорт в верхних отделах живота). После проведения верхней эндоскопии и уточнения HP-статуса 103 ребенка (55 мальчиков и 48 девочек) в возрасте от 9 до 17 лет с подтвержденным HP-ассоциированным хроническим гастритом были рандомизированы на 3 группы с определенной схемой лечения в каждой группе. Дизайн исследования представлен на рисунке 1.
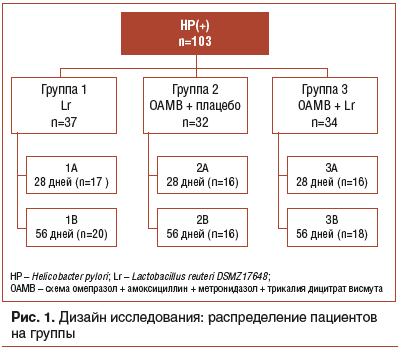
1-я группа (n=37) получала монотерапию Lr по 1 капсуле (200 мг) 2 р./сут во время еды. Эта группа была разделена на 2 подгруппы: 1А и 1В. Пациенты подгруппы 1А (n=17) получали лечение в течение 28 дней, подгруппы 1В (n=20) — в течение 56 дней.
2-я группа (n=32) получала лечение по схеме: омепразол + амоксициллин + метронидазол + трикалия дицитрат висмута (ОАМВ) продолжительностью 10 дней. Препараты назначали в средней возрастной дозировке в соответствии с рекомендациями ESPGHAN [19]. С первого дня лечения пациенты получали также плацебо в виде капсул, не содержащих пробиотика, но внешне аналогичных ему,
по 1 капсуле 2 р./сут во время еды. Эта группа также была разделена на 2 подгруппы: 2А и 2В. Пациенты подгруппы 2А (n=16) получали плацебо в течение 28 дней, подгруппы 2В (n=16) — в течение 56 дней.
3-я группа (n=34) получала лечение по схеме: ОАМВ продолжительностью 10 дней в средних возрастных дозах, на фоне которой с первого дня лечения параллельно пациенты получали Lr по 1 капсуле (200 мг) 2 р./сут во время еды. Эта группа также была разделена на 2 подгруппы: 3А и 3В. Пациенты подгруппы 3А (n=16) получали пробиотик Lr в течение 28 дней, подгруппы 3В (n=16) — в течение 56 дней.
Методы исследования
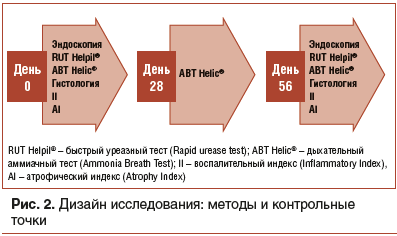
Перед проведением терапии и после завершения (через 56 дней) всем детям была выполнена эзофагогастродуоденоскопия по общепринятой методике со взятием биоптатов слизистой оболочки антрального отдела, тела желудка с последующим проведением быстрого уреазного теста Хелпил® (Rapid urease test — RUT Helpil®) на основе твердого носителя (ООО «АМА», Санкт-Петербург, Россия), позволяющего в течение 3 мин оценить наличие HP по уреазной активности биоптатов, оценивая изменение цвета индикаторной композиции теста с желтого на синий [20]. Наш многолетний (более 10 лет) опыт применения RUT Helpil® у детей демонстрирует высокую чувствительность (87,3%) и специфичность (93,6%) теста. Ряд авторов также отмечают высокие показатели чувствительности и специфичности RUT Helpil ® [21, 22].При гистологической оценке определяли степень (легкую, умеренную, выраженную) мононуклеарной и нейтрофильной инфильтрации, атрофии желез, кишечной метаплазии. На основании полученных данных у всех обследованных проводили балльную оценку воспалительных изменений с подсчетом воспалительного индекса (Inflammatory Index — II), атрофического индекса (Atrophy Index — AI), а также проводили количественную оценку обсемененности слизистой оболочки HP.
Для динамической интегративной оценки уреазной активности в желудке, которая соответствует обсемененности HP, трижды (перед лечением, на 28-й и 56-й день от начала терапии) выполняли дыхательный аммиачный тест (Ammonia Breath Test — ABT Helic®). Тест позволяет в течение 15 мин по изменению цвета индикаторной трубки с желтого на синий определить общую уреазную активность в желудке, выраженную в нарастании длины окрашенного столбика в трубке (в мм) после приема мочевины обычного изотопного состава [23, 24]. Наш опыт применения ABT Helic® у детей показывает, что при строгом соблюдении методики его чувствительность составляет 94–97%, а специфичность — 92–96% [25].
Использование нескольких валидных методов оценки обсемененности слизистой оболочки желудка HP позволило более объективно оценить эффективность терапии. Дизайн исследования представлен на рисунке 2.
Статистическая обработка результатов исследования
Статистический анализ данных исследования проводили с помощью пакета статистических программ SPSS 17.0 (SPSS Inc., USA).Проверку соответствия фактического распределения количественных данных нормальному (гауссовскому) проводили с помощью критерия Шапиро — Уилка. Так как во всех группах фактическое распределение количественных данных существенно отличалось от нормального, для описательной статистики использовали медиану и квартили, а для статистического анализа — непараметрические критерии.
Для сравнения независимых (несвязанных) наблюдений использовали критерий Манна — Уитни, для сравнения парных наблюдений — критерий Вилкоксона.
Для оценки быстроты наступления эффекта терапии (купирование абдоминальных болей) использовали метод Каплана — Майера, сравнение графиков функций выживаемости проводили с помощью логрангового критерия, критерия Бреслоу, критерия Tarone — Ware. Для сравнения частоты нежелательных явлений в группах использовали критерий χ2 Пирсона.
Биоинформатическая обработка результатов секвенирования проведена с применением пакета QIIME, для оценки распределения микробиоты использован кластерный анализ.
Результаты
Согласно результатам двойного слепого рандомизированного плацебо-контролируемого исследования, проведенного нами, наиболее высокий процент эрадикации HP был достигнут у больных, получавших лечение по схеме ОАМВ продолжительностью 10 дней в комбинации с пробиотиком Lr курсом 56 дней (3В) (табл. 1). Эрадикация HP была достигнута у детей этой подгруппы в 77,8% случаев. Эффективность сочетания классической схемы эрадикации с плацебо, независимо от продолжительности приема последнего (28 или 56 дней), составила 68,8%.Монотерапия Lr продолжительностью 28 дней была эффективна в 50% случаев, увеличение продолжительности монотерапии Lr до 56 дней увеличило процент эрадикации HP до 60% (см. табл. 1).
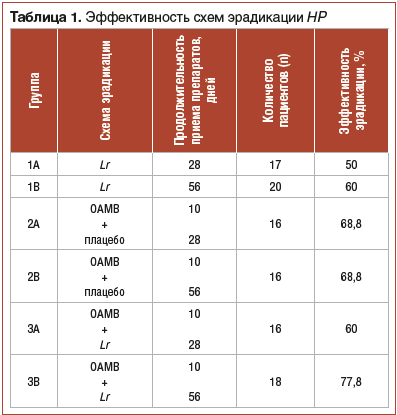
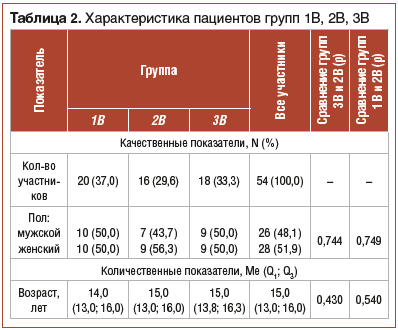
Таким образом, пролонгированный курс применения пробиотика Lr оказался более эффективным как при монотерапии (60%), так и в случае адъювантной терапии на фоне стандартной эрадикационной схемы (77,8%). Поэтому именно эти подгруппы были далее проанализированы более детально. Характеристика пациентов из подгрупп 1В, 2В, 3В представлена в таблице 2. Группы были сопоставимы по гендерному и возрастному составу и не имели статистически значимых различий.
Результаты тестов на выявление HP и данных гистологического исследования биоптатов слизистой оболочки желудка представлены в таблице 3 (визит 1 соответствует моменту перед началом исследования, визит 2 — 26-му дню от начала терапии, визит 3 — 56-му дню от начала терапии, т. е. завершению лечения).
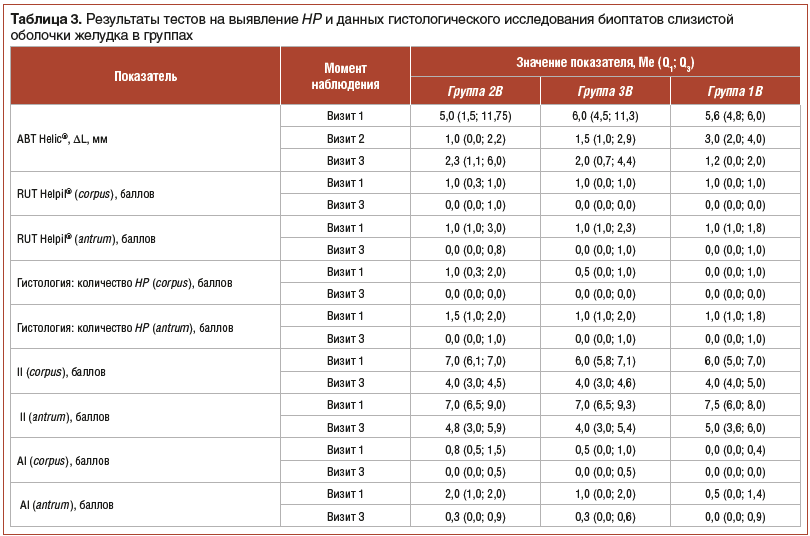
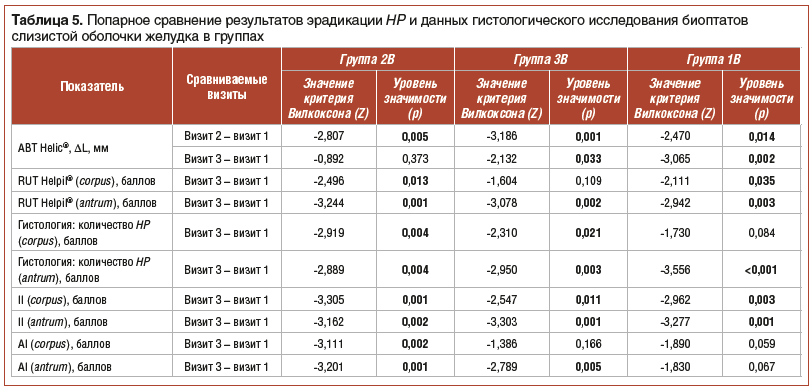
Как представлено в таблицах 3–5, при анализе данных RUT Helpil® во всех трех группах было отмечено снижение к 56-му дню количества HP как в теле (corpus) желудка, так и в антральном отделе (antrum). Cтатистически значимых различий в динамике данного показателя в группах не было. При попарном сравнении результатов эрадикации на момент начала и момент окончания лечения статистически значимое снижение обсемененности антрума отмечено во всех трех группах, а тела желудка — только в подгруппах 2B и 1B.
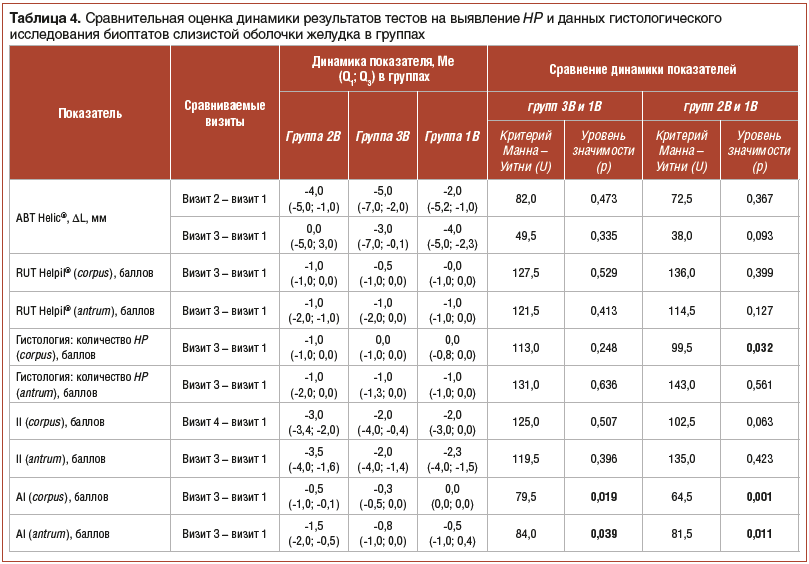
По результатам ABT Helic®, во всех трех группах к 28-му дню отмечено снижение нарастания концентрации аммиака в воздухе ротовой полости, что свидетельствует об уменьшении количества HP, но в подгруппах 2B и 3B затем наблюдалось некоторое нарастание уровня аммиака к 56-му дню, в то время как у пациентов подгруппы 1B к 56-му дню показатели ABT Helic® продолжали улучшаться.
Попарное сравнение результатов ABT Helic® в подгруппах показало, что к 28-му дню статистически значимое снижение прироста аммиака отмечено во всех трех группах, но к 56-му дню дальнейшее снижение сохранялось только в подгруппах 3В и 1В, т. е. там, где дети получали пробиотик. В подгруппе 2В, получавшей плацебо, показатели статистически не отличались от исходных.
Таким образом, и прямая (гистологическая), и косвенная (по уреазной активности и дыхательному тесту) оценка обсемененности слизистой оболочки желудка HP показала ее снижение во всех группах. По данным гистологического исследования в антральном отделе статистически значимых различий между группами не выявлено. В теле желудка у пациентов подгруппы 1В количество HP в динамике было достоверно меньше, чем в подгруппе 2В. То есть монотерапия Lr столь же или даже более эффективно, чем стандартная схема с плацебо, уменьшала обсемененность HP.
Оценка характера и тяжести патоморфологических изменений слизистой оболочки желудка показала, что воспалительный индекс (II) в обоих отделах желудка снизился во всех трех группах, причем динамика его между группами статистически не различалась. Попарное сравнение групп по исходному и конечному индексу показало статистически значимое снижение данного показателя. Снижение атрофического индекса (AI) также наблюдалось во всех группах.
С клинической точки зрения существенное значение имеет быстрота купирования симптомов заболевания. Оценка быстроты купирования абдоминальных болей у участников исследования представлена в таблице 6.
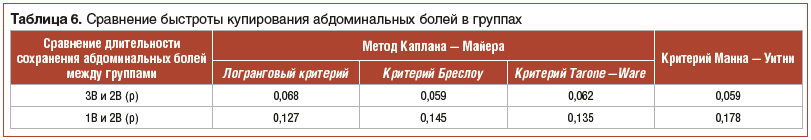
У пациентов подгрупп 3В и 1В медиана времени, в течение которого наступало купирование абдоминального болевого синдрома, была ниже, чем у пациентов подгруппы 2В. Анализ времени наступления эффекта по методу Каплана — Майера и по критерию Манна — Уитни показал близкие к статистически значимым различия между подгруппой 3В и подгруппой 2В.
Длительность сохранения абдоминальных болей в среднем в подгруппах составляла: 1В — 3,0 (3,0; 4,0) дня (95% ДИ: 2,5; 3,5); 2В — 4,0 (3,0; 4,0) дня (95% ДИ: 3,6; 4,4); 3В — 3,0 (3,0; 4,0) дня (95% ДИ: 2,4; 3,6).
В течение периода наблюдения зафиксированы случаи возникновения диареи, которая наблюдалась только в группах, где пациенты получали антибиотики:
у 3 пациентов подгруппы 2В и у 1 пациента подгруппы 3В, в то время как в группе 1В диареи не было ни у одного из детей. Статистическое сравнение частоты развития диареи между подгруппами 2В и 3В показало отсутствие статистически значимых различий (p=0,323), в то время как различия между подгруппами 2В и 1В были близки к статистически значимым (p=0,078).
Обсуждение
Эрадикация HP до настоящего времени остается единственным видом лечения, которое может прервать патологический каскад прогрессирования хронического гастрита и устранить риск дальнейшего развития атрофии, кишечной метаплазии и аденокарциномы. Стандартная терапия инфекции HP предполагает назначение схем эрадикации, включающих 2 антибиотика и ингибитор протонной помпы (тройная схема), возможно назначение препаратов висмута, что повышает результативность терапии (квадротерапия). Несмотря на использование в стандартных схемах двух антибиотиков одновременно в высоких дозах и пролонгирование лечения до 14 дней, результаты эрадикационной терапии оставляют желать лучшего. Это обусловлено, прежде всего, нарастающей антибиотикорезистентностью HP, особенно к кларитромицину и метронидазолу.Последние данные о значении не только HP, но и нехеликобактерной микробиоты в прогрессировании патологического процесса в желудке побуждают к поиску альтернативных методов лечения, направленных на коррекцию микробиоценоза в целом. Использование пробиотиков может быть перспективным и многообещающим направлением терапии, учитывая их возможности безопасного и комплексного воздействия на состав микробиоты желудка, защитный слизистый барьер, иммунную систему.
Мы провели двойное слепое рандомизированное плацебо-контролируемое исследование эффективности терапии инфицированных HP детей с хроническим
гастритом с применением высушенных Lr, которые назначали как на фоне стандартной эрадикационной схемы, так и в виде монотерапии. Исследование показало, что длительная пробиотическая терапия Lr (в течение 56 дней) имеет результативность, приближающуюся к традиционной квадротерапии с двумя антибиотиками и висмутом (соответственно 60 и 68,8% эрадикации HP), а назначение Lr на фоне традиционной схемы повышает ее эффективность на 9% (с 68,8 до 77,8%). Процент эрадикации HP повышается по мере увеличения длительности монотерапии пробиотиком: 50% после 28 дней и 60% после 56 дней лечения.
Наше исследование показало, что назначение Lr позволило достичь стойкого снижения показателей дыхательного теста, которые снизились к 28-му дню и сохранялись таковыми к 56-му, в то время как в группе плацебо показатели, снизившиеся к 28-му дню, к 56-му дню снова возросли, достигнув значений, статистически не отличающихся от исходных. Это свидетельствует об устойчивом уменьшении обсемененности или полной эрадикации HP при назначении пробиотика, а возможно, отражает и метаболическую активность микробиома желудка в целом.
При назначении Lr как в качестве адъювантной терапии, так и в качестве монотерапии снизилась вероятность развития диареи на фоне приема антибактериальных препаратов, отмечена более высокая скорость купирования абдоминального болевого синдрома.
Еще более важно, с нашей точки зрения, что назначение пробиотика сопровождается значительным снижением воспаления в слизистой оболочке желудка. Это отмечено как на фоне монотерапии, так и при адъювантном назначении Lr. Даже у больных, у которых на фоне назначения Lr эрадикация HP не была достигнута, отмечено клиническое, эндоскопическое и гистологическое улучшение. Это косвенно свидетельствует о том, что пробиотик, влияя на микробиологический состав обитателей желудка в целом, создает более благоприятные условия для восстановления нарушенных иммунологических, метаболических и защитных процессов. Как известно, именно воспаление ответственно за прогрессирование патологического каскада при хроническом гастрите. В инициации хронического воспаления в желудке лидирующая роль принадлежит HP, но в дальнейшем для прогрессирования процесса важно влияние и окружающей микробиоты, поскольку в ее составе есть виды с более или менее выраженным воспалительным потенциалом.
Как уже отмечалось выше, антихеликобактерное действие пробиотиков штаммоспецифично. До настоящего времени коагрегационное действие с HP доказано только у Lr, и только этот штамм продемонстрировал столь высокий показатель эрадикации HP при монотерапии. Безусловно, наше исследование слишком ограниченно по объему, чтобы говорить убедительно о решении важной проблемы лечения HP-ассоциированной патологии у детей.
Вывод
Показатели эрадикации HP при монотерапии Lr, полученные нами, недостаточны в сравнении с рекомендуемыми для эрадикационных схем. Но если взвешивать пользу и риск разных видов терапии, то, учитывая безопасность пробиотической терапии и ее вероятное положительное влияние на весь микробиом желудка в совокупности, она выглядит гораздо более целесообразной, чем постоянное увеличение доз и длительности антибиотикотерапии. Мы считаем, что при поверхностном гастрите монотерапия Lr имеет преимущества перед стандартной тройной терапией, поскольку лучше купирует клиническую симптоматику и морфологические изменения слизистой оболочки желудка, что, вероятнее всего, связано с коррекцией состояния микробиоты желудка в целом.
Литература
1. Osaki T., Matsuki T., Asahara T. et al. Comparative analysis of gastric bacterial microbiota in Mongolian gerbils after long-term infection with Helicobacter pylori // Microb. Pathog. 2012. Vol. 53. P.12–18.
2. Maldonado-Contreras A., Goldfarb K.C., Godoy-Vitorino F. et al. Structure of the human gastric bacterial community in relation to Helicobacter pylori status // ISME J. 2011. Vol. 5. P.574–579.
3. Yu G., Gail M.H., Shi J. et al. Association between upper digestive tract microbiota and cancer-predisposing states in the esophagus and stomach // Cancer Epidemiol. Biomarkers Prev. 2014. Vol. 23 (5). P.735–741.
4. Dicksved J., Lindberg M., Rosenquist M. et al. Molecular characterization of the stomach microbiota in patients with gastric cancer and in controls // J. Med. Microbiol. 2009. Vol. 58 (Pt 4). P.509–516.
5. Aviles-Jimenez F., Vazquez-Jimenez F., Medrano-Guzman R. et al. Stomach microbiota composition varies between patients with non-atrophic gastritis and patients with intestinal type of gastric cancer // Sci. Rep. 2014. Vol. 4. P.4202.
6. Yang I., Woltemate S., Piazuelo M.B. et al. Different gastric microbiota compositions in two human populations with high and low gastric cancer risk in Colombia // Sci. Rep. 2016. Vol. 6. P.18594.
7. Midolo P.D., Lambert J.R., Hull R. et al. In vitro inhibition of Helicobacter pylori NCTC 11637 by organic acids and lactic acid bacteria // J. Appl. Bacteriol. 1995. Vol. 79. P.475–479.
8. Aiba Y., Suzuki N., Kabir A.M. et al. Lactic acid-mediated suppression of Helicobacter pylori by the oral administration of Lactobacillus salivarius as a probiotic in a gnotobiotic model // Am J. Gastroenterol. 1998. Vol. 93. P.2097–2101.
9. Kim T.S., Hur J.W., Yu M.A. et al. Antagonism of Helicobacter pylori by bacteriocins of lactic acid bacteria // J. Food Prot. 2003. Vol. 66. P.3–12.
10. Lorca G.L., Wadstrom T., Valdez G.F., Ljungh A. Lactobacillus acidophilus autolysins inhibit Helicobacter pylori in vitro // Curr Microbiol 2001. Vol. 42. P.39–44.
11. Michetti P., Dorta G., Wiesel P.H. et al. Effect of whey-based culture supernatant of Lactobacillus acidophilus (johnsonii) La1 on Helicobacter pylori infection in humans // Digestion. 1999. Vol. 60. P.203–209.
12. Coconnier M.H., Lievin V., Hemery E., Servin A.L. Antagonistic activity against Helicobacter infection in vitro and in vivo by the human Lactobacillus acidophilus strain LB // Appl. Environ Microbiol. 1998. Vol. 64. P.4573–4580.
13. Uchida M., Kurakazu K. Yogurt containing Lactobacillus gasseri OLL2716 exerts gastroprotective action against acute gastric lesion and antral ulcer in rats // J. Pharmacol. Sci. 2004. Vol. 96. P.84–90.
14. Nagaoka M., Hasimoto S., Watanabe T. et al. Anti-ulcer effects of lactic acid bacteria and their cell wall polysaccharides // Biol. Pharm. Bull. 1994. Vol. 17. P.1012–1017.
15. Sachdeva A., Nagpal J. Effect of fermented milk-based probiotic preparations on Helicobacter pylori eradication: a systematic review and meta-analysis of randomized-controlled trials // Eur. J. Gastroenterol. Hepatol. 2009. Vol. 21 (1). P. 45–53.
16. Gotteland M., Poliak L., Cruchet S., Brunser O. Effect of regular ingestion of Saccharomyces boulardii plus inulin or Lactobacillus acidophilus in children colonised by Helicobacter pylori // Acta Paediatr. 2005. Vol. 94. P. 1747–1751.
17. Pantoflickova D., Corthesy-Theulaz I., Dorta G. et al. Favourable effect of regular intake of fermented milk containing Lactobacillus johnsonii on Helicobacter pylori associated gastritis // Aliment. Pharmacol. Ther. 2003. Vol. 18. P.805–813.
18. Holz C., Busjahn A., Mehling H. et al. Significant reduction in HP load in humans with non-viable L.reuteri DSM17648: a pilot study // Probiotics Antimicrob Proteins. 2015. Vol. 7 (2). P.91–100. DOI: 10.1007/s12602–014–9181–3.
19. Jones N.L., Koletzko S., Goodman K. et al. Joint ESPGHAN/NASPGHAN guidelines for the management of Helicobacter pylori in children and adolescents (update 2016) // J. Pediatr. Gastroenterol. Nutr. 2017. Vol. 64. P.991–1003.
20. Корниенко Е.А., Милейко В.Е., Гольбиц С.В. О диагностике инфекции Helicobacter pylori у детей // Рос. вестник перинатологии и педиатрии. 1998. Т.5. С.34–38 [Kornienko E.A., Milejko V.E., Gol’bic S.V. O diagnostike infekcii Helicobacter pylori u detej // Ros. vestnik perinatologii i pediatrii. 1998. T.5. S.34–38 (in Russian)].
21. Леонтьева Н.И. Клинико-патогенетические аспекты хеликобактериоза, диагностика и тактика лечения: дис. ... д.м.н. Москва. 2012. С.25 [Leont’eva N.I. Kliniko-patogeneticheskie aspekty helikobakterioza, diagnostika i taktika lecheniya: dis. ... d.m.n. Moskva. 2012. S.25 (in Russian)].
22. Конорев М.Р., Матвеенко М.Е., Крылов Ю.В. и др. Сравнительная оценка эффективности быстрого уреазного теста ХЕЛПИЛ® для диагностики Helicobacter pylori в желудке и двенадцатиперстной кишке // Иммунопатология, аллергология, инфектология. 2012. Т.3. С.63–71 [Konorev M.R., Matveenko M.E., Krylov Yu.V. i dr. Sravnitel’naya ocenka ehffektivnosti bystrogo ureaznogo testa HELPIL® dlya diagnostiki Helicobacter pylori v zheludke i dvenadcatiperstnoj kishke // Immunopatologiya, allergologiya, infektologiya. 2012. T.3. S.63–71 (in Russian)].
23. Konorev M.R., Komleva E.N., Matveenko M.E. Evaluation of efficiency of HELIC ammonia breath test for diagnostics of HP infection in stomach in rheumatoidartritis patients taking NSAIDS // Helicobacter. 2014. Vol. 19 (S.1). Р.123.
24. Baryshnikova N.V., Belousova L.N., Loeva I.A. et al. Comparative Analysis of efficacy of noninvasive ammonium “HELIC-test” and histological method in diagnostic of Helicobacter pylori infection // Helicobacter. 2014. Vol. 19 (S.1). Р.122.
25. Паролова Н.И. Сравнительная оценка эффективности эрадикационной терапии инфекции Helicobacter pylori у детей: дис. … к.м.н. СПб. 2008. 9 с. [Parolova N.I. Sravnitel’naya ocenka ehffektivnosti ehradikacionnoj terapii infekcii Helicobacter pylori u detej: dis. … k.m.n. SPb. 2008. 9 s. (in Russian)].
2. Maldonado-Contreras A., Goldfarb K.C., Godoy-Vitorino F. et al. Structure of the human gastric bacterial community in relation to Helicobacter pylori status // ISME J. 2011. Vol. 5. P.574–579.
3. Yu G., Gail M.H., Shi J. et al. Association between upper digestive tract microbiota and cancer-predisposing states in the esophagus and stomach // Cancer Epidemiol. Biomarkers Prev. 2014. Vol. 23 (5). P.735–741.
4. Dicksved J., Lindberg M., Rosenquist M. et al. Molecular characterization of the stomach microbiota in patients with gastric cancer and in controls // J. Med. Microbiol. 2009. Vol. 58 (Pt 4). P.509–516.
5. Aviles-Jimenez F., Vazquez-Jimenez F., Medrano-Guzman R. et al. Stomach microbiota composition varies between patients with non-atrophic gastritis and patients with intestinal type of gastric cancer // Sci. Rep. 2014. Vol. 4. P.4202.
6. Yang I., Woltemate S., Piazuelo M.B. et al. Different gastric microbiota compositions in two human populations with high and low gastric cancer risk in Colombia // Sci. Rep. 2016. Vol. 6. P.18594.
7. Midolo P.D., Lambert J.R., Hull R. et al. In vitro inhibition of Helicobacter pylori NCTC 11637 by organic acids and lactic acid bacteria // J. Appl. Bacteriol. 1995. Vol. 79. P.475–479.
8. Aiba Y., Suzuki N., Kabir A.M. et al. Lactic acid-mediated suppression of Helicobacter pylori by the oral administration of Lactobacillus salivarius as a probiotic in a gnotobiotic model // Am J. Gastroenterol. 1998. Vol. 93. P.2097–2101.
9. Kim T.S., Hur J.W., Yu M.A. et al. Antagonism of Helicobacter pylori by bacteriocins of lactic acid bacteria // J. Food Prot. 2003. Vol. 66. P.3–12.
10. Lorca G.L., Wadstrom T., Valdez G.F., Ljungh A. Lactobacillus acidophilus autolysins inhibit Helicobacter pylori in vitro // Curr Microbiol 2001. Vol. 42. P.39–44.
11. Michetti P., Dorta G., Wiesel P.H. et al. Effect of whey-based culture supernatant of Lactobacillus acidophilus (johnsonii) La1 on Helicobacter pylori infection in humans // Digestion. 1999. Vol. 60. P.203–209.
12. Coconnier M.H., Lievin V., Hemery E., Servin A.L. Antagonistic activity against Helicobacter infection in vitro and in vivo by the human Lactobacillus acidophilus strain LB // Appl. Environ Microbiol. 1998. Vol. 64. P.4573–4580.
13. Uchida M., Kurakazu K. Yogurt containing Lactobacillus gasseri OLL2716 exerts gastroprotective action against acute gastric lesion and antral ulcer in rats // J. Pharmacol. Sci. 2004. Vol. 96. P.84–90.
14. Nagaoka M., Hasimoto S., Watanabe T. et al. Anti-ulcer effects of lactic acid bacteria and their cell wall polysaccharides // Biol. Pharm. Bull. 1994. Vol. 17. P.1012–1017.
15. Sachdeva A., Nagpal J. Effect of fermented milk-based probiotic preparations on Helicobacter pylori eradication: a systematic review and meta-analysis of randomized-controlled trials // Eur. J. Gastroenterol. Hepatol. 2009. Vol. 21 (1). P. 45–53.
16. Gotteland M., Poliak L., Cruchet S., Brunser O. Effect of regular ingestion of Saccharomyces boulardii plus inulin or Lactobacillus acidophilus in children colonised by Helicobacter pylori // Acta Paediatr. 2005. Vol. 94. P. 1747–1751.
17. Pantoflickova D., Corthesy-Theulaz I., Dorta G. et al. Favourable effect of regular intake of fermented milk containing Lactobacillus johnsonii on Helicobacter pylori associated gastritis // Aliment. Pharmacol. Ther. 2003. Vol. 18. P.805–813.
18. Holz C., Busjahn A., Mehling H. et al. Significant reduction in HP load in humans with non-viable L.reuteri DSM17648: a pilot study // Probiotics Antimicrob Proteins. 2015. Vol. 7 (2). P.91–100. DOI: 10.1007/s12602–014–9181–3.
19. Jones N.L., Koletzko S., Goodman K. et al. Joint ESPGHAN/NASPGHAN guidelines for the management of Helicobacter pylori in children and adolescents (update 2016) // J. Pediatr. Gastroenterol. Nutr. 2017. Vol. 64. P.991–1003.
20. Корниенко Е.А., Милейко В.Е., Гольбиц С.В. О диагностике инфекции Helicobacter pylori у детей // Рос. вестник перинатологии и педиатрии. 1998. Т.5. С.34–38 [Kornienko E.A., Milejko V.E., Gol’bic S.V. O diagnostike infekcii Helicobacter pylori u detej // Ros. vestnik perinatologii i pediatrii. 1998. T.5. S.34–38 (in Russian)].
21. Леонтьева Н.И. Клинико-патогенетические аспекты хеликобактериоза, диагностика и тактика лечения: дис. ... д.м.н. Москва. 2012. С.25 [Leont’eva N.I. Kliniko-patogeneticheskie aspekty helikobakterioza, diagnostika i taktika lecheniya: dis. ... d.m.n. Moskva. 2012. S.25 (in Russian)].
22. Конорев М.Р., Матвеенко М.Е., Крылов Ю.В. и др. Сравнительная оценка эффективности быстрого уреазного теста ХЕЛПИЛ® для диагностики Helicobacter pylori в желудке и двенадцатиперстной кишке // Иммунопатология, аллергология, инфектология. 2012. Т.3. С.63–71 [Konorev M.R., Matveenko M.E., Krylov Yu.V. i dr. Sravnitel’naya ocenka ehffektivnosti bystrogo ureaznogo testa HELPIL® dlya diagnostiki Helicobacter pylori v zheludke i dvenadcatiperstnoj kishke // Immunopatologiya, allergologiya, infektologiya. 2012. T.3. S.63–71 (in Russian)].
23. Konorev M.R., Komleva E.N., Matveenko M.E. Evaluation of efficiency of HELIC ammonia breath test for diagnostics of HP infection in stomach in rheumatoidartritis patients taking NSAIDS // Helicobacter. 2014. Vol. 19 (S.1). Р.123.
24. Baryshnikova N.V., Belousova L.N., Loeva I.A. et al. Comparative Analysis of efficacy of noninvasive ammonium “HELIC-test” and histological method in diagnostic of Helicobacter pylori infection // Helicobacter. 2014. Vol. 19 (S.1). Р.122.
25. Паролова Н.И. Сравнительная оценка эффективности эрадикационной терапии инфекции Helicobacter pylori у детей: дис. … к.м.н. СПб. 2008. 9 с. [Parolova N.I. Sravnitel’naya ocenka ehffektivnosti ehradikacionnoj terapii infekcii Helicobacter pylori u detej: dis. … k.m.n. SPb. 2008. 9 s. (in Russian)].

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
