Влияние полиморфизма гена PNPLA3 на течение неалкогольной жировой болезни печени
Цель исследования: оценить влияние полиморфизма I148M гена PNPLA3 на течение неалкогольной жировой болезни печени (НАЖБП) у жителей Санкт-Петербурга.
Материал и методы: в исследование включено 60 пациентов (женщин — 31, мужчин — 29) в возрасте от 29 до 83 лет с установленным диагнозом НАЖБП. Пациентам выполняли стандартные лабораторные и инструментальные исследования, а также проводили оценку структурных изменений печени при помощи транзиентной эластометрии с оценкой контролируемого затухания ультразвука (САР). Определяли полиморфизм гена PNPLA3 I148M (rs738409 C>G) в образцах слюны пациентов методом real-time ПЦР.
Результаты исследования: гомозиготный тип мутации гена PNPLA3 (1-я группа) выявлен у 8 человек (13,3%), гетерозиготный вариант (2-я группа) — у 29 человек (48,3%), не обнаружено мутации (3-я группа) у 23 человек (38,3%). Статистически значимых различий между исследуемыми группами при оценке основных параметров метаболического синдрома не выявлено. Повышение уровня аланинаминотрансферазы (АЛТ) чаще встречалось при наличии патологического аллеля I148M гена PNPLA3 (р<0,05). У носителей гомозиготного варианта мутации отмечался более высокий уровень АЛТ по сравнению с носителями гетерозиготного варианта мутации и без нее (р<0,05). Средний показатель САР в 1-й группе составил 321±30,8 дБ/м, во 2-й группе — 295,8±37,5 дБ/м, в 3-й группе — 287,5±22,5 дБ/м. Таким образом, при гомозиготном варианте мутации гена PNPLA3 выявлены более высокие показатели стеатоза печени, чем у пациентов без мутации (р<0,05).
Заключение: у пациентов с НАЖБП из Санкт-Петербурга полиморфизм гена PNPLA3 определяет более агрессивное течение заболевания, проявляющееся развитием лабораторного синдрома цитолиза и выраженного стеатоза печени, особенно в случае гомозиготного варианта мутации. Дальнейшее изучение на больших выборках пациентов и в различных популяциях позволит уточнить эти данные и, возможно, разработать методы скрининга, позволяющие своевременно выявлять лиц с высоким риском неблагоприятного течения НАЖБП.
Ключевые слова: ген PNPLA3, неалкогольная жировая болезнь печени, фиброз, стеатоз.
Для цитирования: Райхельсон К.Л., Ковязина В.П., Сидоренко Д.В., Назаров В.Д., Лапин С.В., Эмануэль В.Л., Марченко Н.В., Пальгова Л.К., Кондрашина Э.А., Барановский А.Ю. Влияние полиморфизма гена PNPLA3 на течение неалкогольной жировой болезни печени. РМЖ. Медицинское обозрение. 2019;27(12):85-88.
PNPLA3 gene polymorphism impact on the nonalcoholic fatty liver disease course
K.L. Raikhelson1, V.P. Kovyazina1, D.V. Sidorenko2, V.D. Nazarov2, S.V. Lapin2, V.L. Emanuel2, N.V. Marchenko1, L.K. Palgova1,
E.A. Kondrashina1, A. Yu. Baranovsky1
1Saint Petersburg State University
2Pavlov First St. Petersburg State Medical University
Aim: to assess the PNPLA3 I148M gene polymorphism impact on the nonalcoholic fatty liver disease (NAFLD) course in St. Petersburg residents.
Patients and Methods: the study included 60 patients (women — 31, men — 29) aged 29 to 83 years with an established diagnosis of NAFLD. Standard laboratory and instrumental studies were performed, as well as an assessment of hepatic structural changes using transient elastography with controlled attenuation parameter (CAP). The PNPLA3 I148M (rs738409 C>G) gene polymorphism was determined in saliva samples of patients by real-time PCR.
Results: the PNPLA3 homozygous genotype mutation (group 1) was detected in 8 people (13.3%), heterozygous genotype (group 2) — in 29 people (48.3%), no mutation (group 3) — in 23 people (38.3%). There were no statistically significant differences between the study groups in assessing the main parameters of the metabolic syndrome. Elevated alanine aminotransferase (ALT) level was more common in the presence of pathological I148M allele (PNPLA3 gene) (p<0.05). Homozygotes had a higher ALT level vs. carriers of the heterozygous genotype mutation and without it (p<0.05). The average CAP in group 1 was 321±30.8 dB/m, in group 2–295.8±37.5 dB/m, in group 3–287.5±22.5 dB/m. Thus, in the PNPLA3 homozygous genotype mutation, higher rates of hepatic steatosis were revealed vs. patients without the mutation (p<0.05).
Conclusion: in patients (from St. Petersburg) with NAFLD, the PNPLA3 gene polymorphism leads to a more aggressive disease course, manifested by the laboratory cytolysis syndrome and severe hepatic steatosis pathogenesis, especially with the homozygous mutation. Further study of large patient cohorts and different populations will clarify these data and possibly develop screening methods that allow timely detection of high-risk patients of adverse NAFLD course.
Keywords: PNPLA3 gene, nonalcoholic fatty liver disease, fibrosis, steatosis.
For citation: Raikhelson K.L., Kovyazina V.P., Sidorenko D.V. et al. PNPLA gene polymorphism impact on the nonalcoholic fatty liver disease course. RMJ. 2019;12:85–88.
Введение
Неалкогольная жировая болезнь печени (НАЖБП) является самым распространенным заболеванием печени в мире [1]. По данным Всероссийского эпидемиологического исследования распространенности НАЖБП (DIREG 1 и 2), в Российской Федерации (РФ) наблюдается рост заболеваемости [2]. Известно, что НАЖБП является многофакторным заболеванием, однако результаты исследований, проведенных в последнее десятилетие, свидетельствуют о значительном вкладе генетического звена в развитие и прогрессирование заболевания [3].
В 2008 г. в ходе исследования GWAS S. Romeo et al. обнаружили, что полиморфизм I148M (rs738409 C>G) гена PNPLA3 (Patatin-Like Phospholipase Domain Containing 3) ассоциирован с развитием НАЖБП [4]. Указанный ген экспрессируется в основном в гепатоцитах и звездчатых клетках печени, а также присутствует в сетчатке, коже, жировой ткани, почках, мозге и селезенке [5]. Мутация в гене приводит к замене изолейцина на метионин в 148 позиции аминокислотной последовательности, в результате чего возникает активное депонирование липидов в гепатоцитах, формируется макровезикулярный стеатоз. Кроме того, происходит активация печеночных звездчатых клеток с превращением их в секретирующие коллаген миофибробластоподобные, что способствует фиброгенезу в печени [6].
Влияние полиморфизма гена PNPLA3 на развитие и прогрессирование НАЖБП исследовали в ряде стран мира и в различных популяциях. Однако в РФ проводились лишь единичные исследования в отдельных регионах [7]. В настоящий момент отсутствуют данные о роли полиморфизма гена PNPLA3 I148M в формировании НАЖБП у жителей Северо-Запада РФ. С учетом генетической разнородности населения РФ нам представляется важным изучение этого фактора в различных регионах.
Цель исследования: проанализировать влияние полиморфизма I148M гена PNPLA3 на течение НАЖБП у жителей Санкт-Петербурга.
Материал и методы
В исследование включено 60 пациентов (женщин — 31, мужчин — 29) с НАЖБП, проживающих в Санкт-Петербурге. Средний возраст исследуемых составил 50±12,3 (29–83) года. Проводили общеклиническое обследование пациентов: оценивали анамнез, антропометрические данные (индекс массы тела (ИМТ), окружность талии (ОТ)). Исследовали сывороточные лабораторные маркеры состояния печени: активность аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ), щелочной фосфатазы (ЩФ), гамма-глутамилтрансферазы (ГГТ), уровень билирубина и его фракций, также оценивали углеводный и липидный обмен. Определение стадии фиброза и степени стеатоза проведено у 39 пациентов с помощью транзиентной эластометрии на аппарате «Фиброскан 502 TOUCH» (Echosens, Франция) с контролируемым параметром затухания ультразвука (САР). Полиморфизм гена PNPLA3 (I148M (rs738409 C>G) оценивали в образцах слюны пациентов методом real-time ПЦР (набор «ТестГен», Россия). В исследование не включали пациентов с наличием других заболеваний печени (вирусные, алкогольные, аутоиммунные, лекарственные, болезни накопления меди и железа), выявленных с помощью стандартных скрининговых методик. Статистический анализ полученных результатов проводили с применением программного пакета для статистического анализа Graphpad Prism 8. Достоверность различий оценивали непараметрическими методами Пирсона (χ2), Фишера. Достоверными считали различия при p<0,05.
Результаты исследования
Среди 60 исследуемых пациентов с НАЖБП патологический аллель гена PNPLA3 I148M в гомозиготном состоянии выявлен у 8 человек (13,3%), 29 человек (48,3%) являлись носителями гетерозиготного варианта мутации, у 23 пациентов (38,3%) мутации не выявлено (так называемый «дикий» тип). На основании этих данных выделены 3 группы: 1-я группа — носители гомозиготной мутации гена PNPLA3, 2-я группа — носители гетерозиготного варианта мутации, 3-я группа — пациенты без мутации. Пациенты в исследуемых группах были сопоставимы по полу и возрасту (табл. 1).
Поскольку НАЖБП тесно связана с метаболическим синдромом, проводили оценку влияния мутации в гене PNPLA3 на антропометрические показатели, уровень артериального давления, показатели углеводного и липидного обмена. Однако наличие мутантного гена не оказало достоверного влияния на показатели метаболического синдрома, статистически значимых различий между группами по указанным критериям не выявлено (табл. 1).
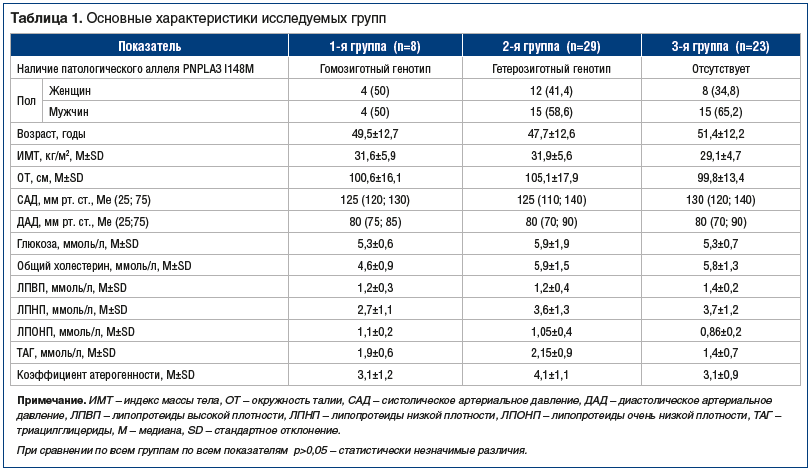
Установлено, что генотип PNPLA3 достоверно оказал влияние на повышение активности АЛТ в группах сравнения гетерозигот и гомозигот, а также гомозигот и неизмененного генотипа (p=0,022 и p=0,011 соответственно), в остальных группах значимой разницы обнаружено не было (p>0,05). При изучении взаимосвязей между аллелями гена и активностью АСТ не было обнаружено аналогичных достоверных различий (p>0,05). Полученные данные отображены на рисунке 1.
Наличие мутации в гене PNPLA3 не оказало значимого воздействия на показатели холестаза (ЩФ и ГГТ). У всех пациентов уровень ЩФ не превышал верхнюю границу нормы. У большинства пациентов отмечалось умеренное повышение уровня ГГТ (не более 2 норм), статически значимых различий не обнаружено. Уровень билирубина в исследуемых группах был в пределах референсных значений, без достоверных различий между группами.
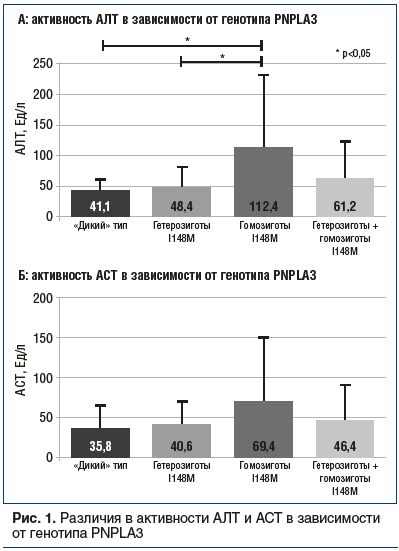
Была проведена оценка различий в степени выраженности стеатоза печени, определенная при помощи параметра СAP, между группами (рис. 2).
Повышение параметра САР, соответствующее стеатозу 1 степени (S1), выявлено у 6,7% пациентов, S2 — у 33,3%, у остальных соответствовало S3. Выраженность стеатоза печени была связана с генотипом при сравнении гомозигот и «дикого» генотипа (p=0,045). Кроме того, отмечалась тенденция к наличию различий, не достигавших достоверных значений (p=0,086) при сравнении гетерозигот и гомозигот. Показатели эластичности печени, соответствующие отсутствию фиброза (F0), наблюдались у 16 (58,9%) пациентов, фиброз 1 стадии (F1) отмечен у 11 (28,2%), F2 — у 5 (12,8%), F3 — у 1 (2,6%), F4 — у 6 (15,3%). При оценке стадии фиброза с помощью измерения эластичности печени не было зафиксировано достоверных различий между группами (p>0,05).
Обсуждение результатов
НАЖБП остается глобальной проблемой здравоохранения во всем мире. Только вовремя спрогнозировав развитие стеатогепатита, возможно верно разработать клиническую тактику и избежать формирования осложненных форм заболевания и сокращения продолжительности жизни пациента. Наиболее перспективными маркерами для достижения этой цели на данный момент являются молекулярно-генетические. C 2008 г. ген PNPLA3 в большинстве популяций зарекомендовал себя как наиболее эффективный предиктор формирования прогрессирующих форм НАЖБП.
Продемонстрировано, что мутация в гене PNPLA3 в группах сравнения гетерозигот и гомозигот, а также гомозигот и неизмененного генотипа связана с повышением активности АЛТ (p=0,022 и p=0,011 соответственно). Это может говорить о мутации как о провоцирующем факторе цитолитического синдрома в структуре НАЖБП, что также подтверждается опытом L. Valenti et al. (2010) [8]. При сопоставлении нормального генотипа с группами гетерозигот и совокупностью гетерозигот и гомозигот достоверной корреляции с уровнем АЛТ выявлено не было (p>0,05). Подобный результат мог быть получен вследствие малой выборки пациентов, участвовавших в исследовании. Эти данные противоречат работе S. Sookoianс et al. (2009) [9], где была продемонстрирована взаимосвязь уровня АЛТ и генотипов гена PNPLA3 во всех группах сравнения. В отношении повышения уровня АСТ мы не выявили достоверной корреляции с мутацией I148M (p>0,05). Это может быть связано с тем, что АСТ является менее чувствительным и специфичным маркером цитолиза по сравнению с АЛТ.
В проведенном нами исследовании выявлена статистически значимая связь между гомозиготным вариантом мутации гена PNPLA3 I148M и выраженным стеатозом печени у пациентов с НАЖБП, проживающих в Санкт-Петербурге. Эта ассоциация подтверждается и литературными данными. Так, в 2011 г. систематический обзор 16 исследований, проведенный S. Sookoian et al., продемонстрировал, что при наличии гомозиготного генотипа по rs738409 (C>G) отмечается склонность к более выраженному накоплению жира в печени и более агрессивное течение заболевания [10]. Продукт PNPLA3 — адипонутрин (1-ацилглицерол-3-фосфат-О-ацилтрансфераза) выполняет функции гидролазы триглицеридов, ацилтрансферазы лизофосфатидной кислоты и эстеразы ретинола пальмитата. При нарушениях в гене PNPLA3 мутантный белок теряет свою функцию, накапливается вокруг жировых капель в гепатоцитах и препятствует доступу липолитических ферментов [11]. Снижается интенсивность гидролиза триглицеридов, что ведет к нарушению их выведения из печени в виде ЛПНП и ЛПОНП. Происходит интрацеллюлярное накопление липидов, что морфологически проявляется как макровезикулярный стеатоз [12].
Ряд наблюдений выявил, что мутация в гене PNPLA3 оказывает значимое влияние на развитие и прогрессирование фиброза печени у пациентов с НАЖБП [8, 13–15]. Так, американскими учеными в 2010 г. проведено исследование, включавшее в себя пациентов с НАЖБП (894 взрослых и 223 детей), в котором продемонстрирована взаимосвязь между PNPLA3 I148M и гистологическими параметрами агрессивного течения заболевания [13]. Известно, что синтез PNPLA3 происходит в звездчатых клетках печени человека (клетки Ито) и белок, кодируемый геном PNPLA3, задействован в гидролизе сложных ретиноловых эфиров [5]. Носители полиморфизма гена PNPLA3 I148M имеют более низкие концентрации циркулирующего свободного ретинола и ретинол-связывающего белка 4, что, скорее всего, обусловлено нарушением гидролиза сложных ретиноловых эфиров в печени и их накоплением под воздействием гена [16]. В норме звездчатые клетки находятся в спокойном состоянии и выполняют функцию депо для ретиноидов. При хроническом воспалении клетки Ито изменяют свой фенотип, активируются и превращаются в миофибробластоподобные клетки. Основная функция миофибробластов — интенсивная выработка коллагена, вследствие чего и происходит стимуляция фиброгенеза печени [17]. Влияние PNPLA3 на этот процесс еще предстоит уточнить. В нашем наблюдении не выявлена связь между наличием мутантного гена и выраженностью фиброза. Возможно, это обусловлено малой выборкой пациентов, необходимы дальнейшие исследования на большей выборке.
Оценка наличия полиморфизма гена PNPLA3 I148M позволяет выделить группы пациентов, имеющих более высокие риски прогрессирования НАЖБП. Можно предполагать, что такие группы нуждаются в динамическом наблюдении, а также в разработке индивидуальной лечебной стратегии.
Заключение
Полиморфизм гена PNPLA3 у пациентов с НАЖБП из Санкт-Петербурга ассоциирован с повышенной активностью АЛТ, что отражает более агрессивное течение НАЖБП.
Пациенты с гомозиготным вариантом мутации гена PNPLA3 I148M имеют достоверно более высокие показатели стеатоза печени, однако без значимого влияния на развитие фиброза печени. Вероятно, это обусловлено небольшой выборкой пациентов, что требует дальнейшего изучения.
Предполагаем, что полиморфизм гена PNPLA3 I148M имеет значение для формирования неблагоприятного течения НАЖБП в популяции пациентов Северо-Западного региона РФ. Дальнейшее изучение на больших выборках пациентов и в различных популяциях позволит уточнить эти данные и, возможно, разработать методы скрининга, позволяющие своевременно выявлять лиц с высоким риском неблагоприятного течения НАЖБП. Все это поможет в будущем внести вклад в развитие персонифицированной медицины.
2. Ивашкин В.Т., Драпкина О.М., Маев И.В. и др. Распространенность неалкогольной жировой болезни печени у пациентов амбулаторно-поликлинической практики в Российской Федерации: результаты исследования DIREG 2. Российский журнал гастроэнтерологии, гепатологии и колопроктологии. 2015;25(6):31–41. [Ivashkin V.T., Drapkina O.M., Mayev I.V.et al. Prevalence of non-alcoholic fatty liver disease in out-patients of the Russian Federation: DIREG 2 study results. The Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2015;25(6):31–41 (in Russ.)].
3. Dongiovanni P., Anstee Q.M., Valenti L. Genetic predisposition in NAFLD and NASH: impact on severity of liver disease and response to treatment. Curr Pharmac Des. 2013;19(29):5219–5238.
4. Romeo S., Kozlitina J., Xing C. et al. Genetic variation in PNPLA3 confers susceptibility to nonalcoholic fatty liver disease. Nature Genet. 2008:40 (12):1461–1465.
5. Pirazzi C., Valenti L., Motta B.M. et al. PNPLA3 has retinyl-palmitate lipase activity in human hepatic stellate cells. Human Molecular Genetics. 2014;23(15):4077–4085.
6. Тихомирова А.С., Кисляков В.А., Байкова И.Е. и др. Клинико-морфологические параллели полиморфизма гена PNPLA3 у пациентов с неалкогольной жировой болезнью печени. Терапевтический архив. 2018;90(2):85–88. [Tikhomirova A.S., Kislyakov V.A., Baykova I.E. et al. Clinical-morphological parallels of the PNPLA3 gene polymorphism in patients with nonalcoholic fatty liver disease. Therapeutic Archive. 2018;90(2):85–88 (in Russ.)].
7. Кролевец Т.С., Ливзан М.А., Ахмедов В.А. и др. Исследование полиморфизма гена PNPLA3 у пациентов с неалкогольной жировой болезнью печени и различной стадией фиброза. Экспериментальная и клиническая гастроэнтерология. 2018;159(11):24–32. [Krolevets T.S., Livzan M.A., Akhmedov V.A. et al. Study of PNPLA3 gene polymorphism in patients with non-alcoholic fatty liver disease and various stages of fibrosis. Experimental and Clinical Gastroenterology Journal. 2018;159(11):24–32 (in Russ.)].
8. Valenti L., Al-Serri A., Daly A.K. et al. Homozygosity for the patatin-like phospholipase-3/adiponutrin I148M polymorphism influences liver fibrosis in patients with nonalcoholic fatty liver disease. Hepatol. 2010;51(4):1209–1217.
9. Sookoian S., Castaño G.O., Burgueño A.L. et al. A nonsynonymous gene variant in the adiponutrin gene is associated with nonalcoholic fatty liver disease severity. J Lipid Res. 2009;50(10):2111–2116.
10. Sookoian S., Pirola C.J. Meta-analysis of the influence of I148M variant of patatin-like phospholipase domain containing 3 gene (PNPLA3) on the susceptibility and histological severity of nonalcoholic fatty liver disease. Hepatol. 2011;53(6):1883–1894.
11. Mitsche M.A., Hobbs H.H., Cohen J.C. Patatin-like phospholipase domain-containing protein 3 promotes transfer of essential fatty acids from triglycerides to phospholipids in hepatic lipid droplets. J Biol Chem. 2018;293(18):6958–6968.
12. He S., McPhaul C., Li J.Z. A sequence variation (I148M) in PNPLA3 associated with nonalcoholic fatty liver disease disrupts triglyceride hydrolysis. J Biol Chem. 2010;285(9):6706–6715.
13. Rotman Y., Koh C., Zmuda J.M. et al. The Association of Genetic Variability in PNPLA3 with Histological Severity of NonAlcoholic Fatty Liver Disease. Hepatol. (Baltimore). 2010;52(3):894–903.
14. Krawczyk M., Grünhage F., Zimmer V. et al. Variant adiponutrin (PNPLA3) represents a common fibrosis risk gene: Non-invasive elastography-based study in chronic liver disease. Hepatol. 2011;55:299–306.
15. Valenti L., Alisi A., Galmozzi E. et al. I148M patatin-like phospholipase domain-containing 3 gene variant and severity of pediatric nonalcoholic fatty liver disease. Hepatol. 2010;52(4):1274–1280.
16. Mondul A., Mancina R.M., Merlo A. et al. PNPLA3 I148M variant influences circulating retinol in adults with nonalcoholic fatty liver disease or obesity. J Nutr. 2015;145:1687–1691.
17. Moreira R.K. Hepatic stellate cells and liver fibrosis. Arch Pathol Labor Med. 2007;131(11):1728–1734.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.

