Патогенетические аспекты коморбидного течения неалкогольной жировой болезни печени и желчнокаменной болезни: обзор и собственные данные
DOI: 10.32364/2587-6821-2022-6-5-278-285
В настоящем обзоре актуализированы сведения о патогенетических механизмах формирования и прогрессирования желчнокаменной болезни (ЖКБ) и неалкогольной жировой болезни печени (НАЖБП) и их коморбидном течении. Рассмотрены гендерные и анатомо-физио-логические особенности, влияние инсулинорезистентности, ожирения и гормонов жировой ткани, холецистэктомии на клиническо-морфологические изменения при сочетанном течении НАЖБП и ЖКБ. Коморбидное течение НАЖБП и ЖКБ характеризуется, наряду с нарушениями липидного обмена, изменениями количества и соотношения желчных кислот, гормональными нарушениями: гиперлептинемией и лептинорезистентностью вместе с инсулинорезистентностью. Холецистэктомия является неблагоприятным фактором прогрессирующего течения НАЖБП и развития фиброза печени, что требует разработки индивидуальных схем ведения таких пациентов. Представлены данные собственного исследования, включившего 183 пациента с НАЖБП. Они свидетельствуют о том, что коморбидное течение НАЖБП и ЖКБ имеет клинико-лабораторные особенности, а постхолецистэктомическое течение ЖКБ у пациентов с НАЖБП характеризуется повышением кардиоваскулярного риска и прогрессированием фиброза печени. Обсуждены аспекты применения комбинированного препарата урсодезоксихолевой кислоты и натрия глицирризината в такой клинической ситуации. Двухкомпонентная гепатопротективная терапия данным препаратом имеет патогенетически направленное действие при коморбидном течении НАЖБП и ЖКБ.
Ключевые слова: неалкогольная жировая болезнь печени, желчнокаменная болезнь, коморбидность, фиброз печени, холецистэктомия.
Для цитирования: Кролевец Т.С., Ливзан М.А., Сыровенко М.И., Черкащенко Н.А. Патогенетические аспекты коморбидного течения неалкогольной жировой болезни печени и желчнокаменной болезни: обзор и собственные данные. РМЖ. Медицинское обозрение. 2022;6(5):278-285. DOI: 10.32364/2587-6821-2022-6-5-278-285.
Введение
Неалкогольная жировая болезнь печени (НАЖБП) и желчнокаменная болезнь (ЖКБ) — хронические неинфекционные и метаболически-ассоциированные заболевания, распространенность которых во всем мире высока. Так, частота встречаемости НАЖБП в Европе достигает 25–26% с большой разницей в популяциях [1]. Заболеваемость ЖКБ в Европе и США составляет около 15–20% [2]. Российское же эпидемиологическое исследование DIREG-2 [3] демонстрирует встречаемость НАЖБП, достигающую 40% среди пациентов поликлинического звена.
Зачастую оба эти состояния одновременно выявляются у одного и того же пациента, что безусловно ассоциировано с общими факторами риска развития заболеваний (ожирение, инсулинорезистентность, гипер- и дислипидемия), а также анатомо-физиологическими особенностями [4–7]. Ассоциация этих двух заболеваний изучалась в нескольких крупных исследованиях [8–10]. Т. Koller et al. [8] обнаружили более высокую распространенность ЖКБ среди пациентов с НАЖБП, чем без таковой (47% и 26% соответственно). Кроме того, исследование, проведенное A.L. Fracanzani et al. [9], доказало, что вероятность образования камней в желчевыводящих протоках связана со степенью фиброза (при степени F0–1 вероятность равна 14%, при F2–3 — 23% и при F4 — 56%) и выраженностью воспаления. Имеются описания развития НАЖБП у пациентов, перенесших холецистэктомию [7]. Также известно, что НАЖБП связана с повышенным риском холангиокарциномы и рака желчного пузыря [10]. Интересными представляются данные об увеличении риска развития сердечно-сосудистых заболеваний (ССЗ) как у пациентов с НАЖБП, так и в период формирования конкрементов и после холецистэктомии, что предполагает суммацию рисков у пациентов в условиях коморбидности этих заболеваний [11, 12]. Сложная и, очевидно, двусторонняя взаимосвязь между этими заболеваниями представляется весьма актуальной для изучения.
Анатомо-физиологические особенности
Известно, что НАЖБП и ЖКБ имеют несколько общих факторов риска, включая возраст (достигая плато после 50 и 60 лет у женщин и мужчин соответственно), этническую принадлежность и метаболические факторы [10, 11].
Рассмотрим возможные патофизиологические механизмы коморбидного течения НАЖБП и ЖКБ (см. рисунок).
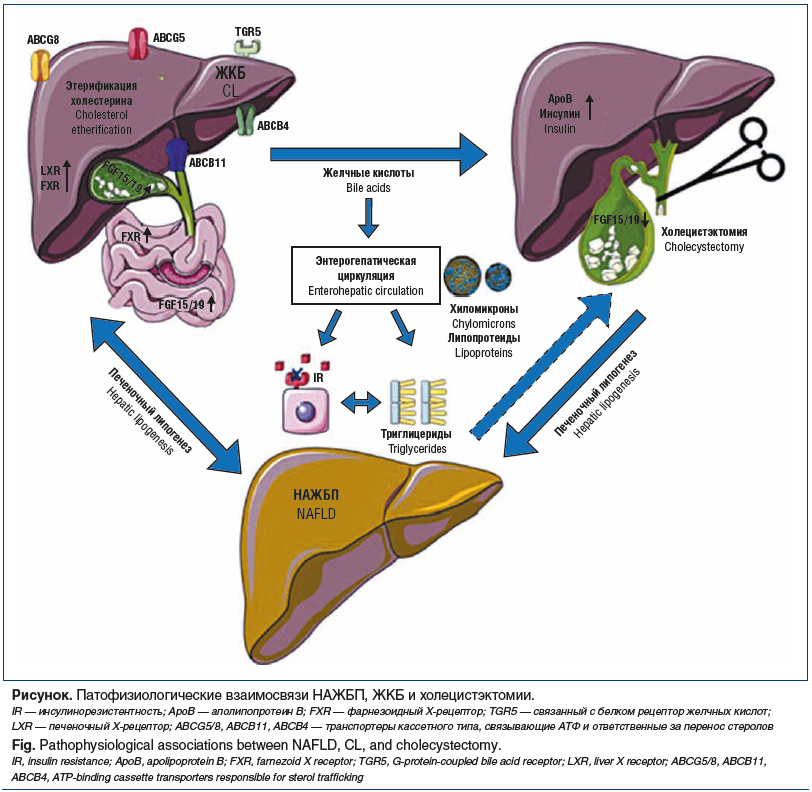
Желчные кислоты (ЖК) синтезируются гепатоцитами преимущественно по классическому пути из холестерина при участии фермента холестерин-7α-гидроксилазы. При избытке ЖК в случае нарушения энтерогепатической циркуляции или превращения первичных ЖК во вторичные данный путь синтеза будет заблокирован по механизму обратной связи. Основные первичные ЖК включают холевую и хенодезоксихолевую кислоты, которые после конъюгации с аминокислотами глицином и таурином для повышения их растворимости поступают в желчный пузырь, где хранятся до эвакуации в кишечник для реализации пищеварительной функции и усвоения жирорастворимых витаминов. Кроме того, ЖК активируют множество ядерных рецепторов, таких как фарнезоидные X-рецепторы (FXR), рецепторы витамина D и рецепторы pregnane X, а также поверхностные рецепторы, например TGR5, чтобы вызвать их сигнальные эффекты. FXR широко экспрессируются как в гепатоцитах, так и в энтероцитах. В энтероцитах ЖК индуцируют выработку фактора роста фибробластов-19 (FGF-19). Действуя на TGR5, ЖК вызывают высвобождение глюкагоноподобного пептида-1 [13]. Вероятно, таким способом реализуется метаболическая функция ЖК через регуляцию скорости и объема липолиза, глюконеогенеза и процесса насыщаемости как при формировании конкрементов, так и после удаления желчного пузыря [14]. Становится очевидно, что при заболеваниях печени и нарушении соотношения ЖК меняется микробный пейзаж в кишечнике в сторону провоспалительных бактерий типа Proteobacteria, особенно Enterobacteriaceae, что в свою очередь нарушает целостность интестинального мукозального барьера и дополнительно способствует прогрессированию гепатита и фиброза печени [15].
Желчные кислоты могут вызвать клеточный некроз, растворяя плазматическую мембрану или сигнализируя о запрограммированной гибели клеток. Исследование in vitro [16] гепатоцитов показало, что при внутриклеточном накоплении ЖК происходит олигомеризация рецепторов Fas и активация каспазы 8, что запускает апоптоз. Кроме того, реактивные формы кислорода, образующиеся в результате чрезмерного повреждения мембраны, вызванного ЖК (через фосфолипазу A2 и ядерные рецепторы), подавляют синтез глутатиона. Это увеличивает вероятность повреждения и некроза клеток. Таким образом, цитокины, высвобождающиеся при вызванном ЖК клеточном повреждении, активируют стеллатные клетки печени, что неминуемо приводит к фиброзу. В исследовании [17] было продемонстрировано увеличение в сыворотке уровня первичных глицин-конъюгированных холевых и хенодезоксихолевых ЖК при НАЖБП с фиброзом. Фекальный профиль ЖК при НАЖБП отличается у пациентов с ожирением и без ожирения. Установлено, что у пациентов с ожирением и НАЖБП количество первичных конъюгированных и неконъюгированных ЖК в кале увеличено, а количество вторичных ЖК постепенно уменьшается по мере прогрессирования фиброза [18]. Сравнительное исследование [19] пациентов с НАЖБП и с ЖКБ, проведенное коллегами из Ижевской государственной медицинской академии, продемонстрировало при проведении масс-спектрометрии желчи снижение общего количества свободных ЖК (холевой, хенодезоксихолевой, дезоксихолевой) и увеличение содержания конъюгированных ЖК (гликохолевой, гликодезоксихолевой, таурохолевой, тауродезоксихолевой, урсодезоксихолевой), а также увеличение уровня общего холестерина и маркеров цитолиза и холестаза. Наиболее выраженные изменения были выявлены у больных НАЖБП. Авторы предполагают, что снижение первичных ЖК и дисбаланс фосфолипидов нарушают стабилизацию желчи, что приводит к образованию камней в желчевыводящих путях у пациентов с НАЖБП.
Гендерные особенности
Исследование A. Kichloo et al. [20], показало, что сочетание НАЖБП и ЖКБ встречается у 64,3% женщин и 35,7% мужчин. Различие в частоте может быть обусловлено естественными изменениями в женской физио-логии, особенно в постменопаузальные годы, такими как повышение резистентности к инсулину, центральное ожирение, и изменениями в распределении жировой ткани в результате колебаний уровня эстрогена. Также было отмечено, что раннее менархе может стать причиной повышенного риска НАЖБП в более позднем возрасте [21]. В исследовании [22] с использованием экспериментальных моделей, а именно рыбок Данио-рерио с избыточным питанием, результаты гистологического анализа доказали, что старение яичников, вызывающее гипоэстрогенемию, способствует развитию стеатоза печени и прогрессированию фиброза. В этом же исследовании авторы продемонстрировали, что среди женщин в менопаузе имеется более высокая распространенность метаболических нарушений (высокий уровень общего холестерина, повышенный индекс инсулинорезистентности (HOMA-IR), сахарный диабет 2 типа и артериальная гипертензия), чем среди женщин репродуктивного возраста, и что менопаузальный статус увеличивает риск развития стадий F2–F4 фиброза печени. Понимание гендерных различий при оценке и лечении коморбидных НАЖБП и ЖКБ имеет большое значение, поскольку позволит разработать точные программы скрининга и профилактики.
Инсулинорезистентность
Гиперинсулинемия стимулирует активность гидрокси-3-метилглутарил-коэнзима А редуктазы и увеличивает насыщение желчи холестерином, что в свою очередь ведет к образованию холестериновых желчных камней и нарушению моторики желчного пузыря [20, 23]. Некоторые авторы [24] разделяют системную и печеночную инсулинорезистентность, печеночная считается более важной для образования конкрементов. Следует отметить, что системная инсулинорезистентность связана со снижением сократимости желчного пузыря у пациентов без ожирения и сахарного диабета [25]. В свою очередь, инсулинорезистентность признана ключевым фактором возникновения и прогрессирования НАЖБП. Оценка HOMA-IR рекомендована всем пациентам с подозрением на НАЖБП и в дальнейшем при динамическом наблюдении [12, 26]. В недавнем междисциплинарном обзоре [27], посвященном патогенетическим механизмам взаимовлияния НАЖБП и сахарного диабета 2 типа, подчеркнуто, что лечение НАЖБП должно быть частью стратегии лечения пациентов с диабетом и что данное заболевание имеет большое значение для стратификации риска осложнений диабета, а наличие НАЖБП у пациента следует учитывать для персонализации лечения, так как некоторые лекарственные препараты, используемые для контроля гликемии (метформин, пиоглитазоны и инкретины), могут быть частью лечения неалкогольного стеатогепатита и ассоциированного с ним фиброза.
У пациентов с метаболическим синдромом и сахарным диабетом 2 типа (группа высокого риска) комбинация НАЖБП и ЖКБ встречается чаще [28]. Однако эта связь не однонаправленная, так как нарушение моторики желчевыводящих путей может усугублять инсулинорезистентность [29]. Повышенный de novo липогенез активирует «липогенную ветвь» инсулинового сигнального пути в гепатоците, приводя к формированию стеатоза [30]. В регуляции печеночного липогенеза участвуют несколько транскрипционных факторов, в том числе печеночный X-рецептор (LXR). Он регулирует экспрессию АВС-транспортеров ABCG5/ABCG8, ответственных за каналикулярную экскрецию холестерина. Это приводит к усилению синтеза ЖК и ускорению этерификации холестерина. Другим важным транскрипционным фактором являются FXR, которые экспрессируются как в печени, так и в кишечнике и участвуют в обмене холестерина, триглицеридов и глюкозы, как было упомянуто ранее. FXR также регулирует экспрессию канальцевых транспортеров ABCB11 и ABCB4, которые транспортируют соответственно ЖК и фосфатидилхолин в желчь [31]. Недавнее исследование [6], проведенное с участием 4325 больных сахарным диабетом 2 типа с НАЖБП и без таковой, не продемонстрировало различий в распространенности ЖКБ, однако выявило методом логистического регрессионного анализа, что ЖКБ (отношение шансов (ОШ) 1,241, 95% ДИ 1,036–1,488, p=0,002) и холецистэктомия (OШ 1,946, 95% ДИ 1,546–2,445, p<0,001) были тесно связаны с НАЖБП. В свою очередь, бессимптомное течение ЖКБ (OШ 0,663, 95% ДИ 0,513–0,856, p=0,002) реже ассоциируется с НАЖБП.
Абдоминальное ожирение
Ожирение характеризуется увеличением массы жировой ткани, снижением чувствительности периферических тканей к инсулину и гиперинсулинемией, которые вызывают нарушения углеводного, липидного, пуринового обмена и артериальную гипертонию [32]. Как предиктор развития ЖКБ, ожирение связано с повышенным синтезом и выведением холестерина с желчью. При недостаточном потреблении клетчатки замедляется транзит кишечного содержимого, что способствует повышенному образованию и всасыванию вторичных ЖК и усилению литогенных свойств желчи [33]. С другой стороны, потеря веса сопровождается повышением уровня муцина и кальция в желчи, что приводит к формированию билиарного сладжа и камней в желчном пузыре. Кроме того, важную роль играет распределение жировой ткани, а не ее количество. Висцеральная жировая ткань ассоциирована с более частым развитием НАЖБП даже при более низком индексе массы тела. Очевидно, что данные эффекты связаны со способностью жировой ткани к активному синтезу провоспалительных цитокинов и адипокинов. Было показано, что адипокины оказывают воздействие на все патогенетические звенья НАЖБП и среди них особое значение имеет лептин, уровень которого у пациентов с НАЖБП значительно повышен [34]. Гиперлептин-емия и лептинорезистентность ассоциированы с более тяжелым течением НАЖБП и развитием фиброза [35]. Вместе с тем высокий уровень лептина в исследованиях коррелирует с риском развития и/или наличием ЖКБ у пациентов с ожирением и избыточной массой тела [36]. В экспериментальных моделях у мышей с индуцированной гиперлептинемией и лептинорезистентностью было обнаружено изменение качества желчи, а именно повышенное содержание холестерина в ней и способность его к кристаллизации, а также увеличение муцина в составе желчи — «литогенный эффект». Кроме того, лептин уменьшает уровень липопротеинов высокой плотности, т. е. способствует развитию дислипидемии [37]. Для пациентов с ЖКБ и избыточной массой тела характерен достоверно более высокий уровень лептина и одновременно более низкий уровень сывороточного адипонектина, чем у пациентов с ЖКБ и нормальной массой тела. Уровень сывороточного адипонектина обратно пропорционален уровню триглицеридов в сыворотке крови у больных с ЖКБ [38].
Холецистэктомия
Удаление желчного пузыря влечет за собой метаболические изменения, вызывающие развитие и прогрессирование НАЖБП. После удаления желчного пузыря желчь непрерывно выделяется в двенадцатиперстную кишку. Это приводит к более быстрой циркуляции ЖК и соответственно большей концентрации их в печени, что может запустить вышеописанные механизмы клеточного повреждения и индукции фиброгенеза в печени [39]. В исследовании F. Barrera et al. [40] было обнаружено, что холецистэктомия приводит к снижению уровня FGF-19 в сыворотке, что предрасполагает к развитию гипергликемии и гиперхолестеринемии, увеличивающих риск формирования стеатоза печени. Повышенный уровень триглицеридов и липопротеинов очень низкой плотности после холецистэктомии установлен и в другом исследовании [41]. Ряд исследований, проведенных в Европе, Корее, США и включивших в анализ до 20 тыс. человек, однозначно демонстрируют независимую от других метаболических факторов (массы тела, сахарного диабета, гиперлипидемии и гипертриглицеридемии) связь развития НАЖБП с предшествующей холецистэктомией, более сильную даже, чем связь с ЖКБ в стадии формирования и бессимптомного наличия камней в желчном пузыре [42]. Исследовательская группа Папского католического университета Чили провела двухлетнее сравнительное наблюдение пациентов с ЖКБ после холецистэктомии и здоровых лиц, оценивая у них содержание жира в печени с помощью магнитно-резонансной томографии и уровня инсулина. Авторы обнаружили статистически значимое увеличение уровня инсулина в крови и HOMA-IR у пациентов, перенесших холецистэктомию, а также значительное увеличение жира в печени у пациентов, перенесших хирургическую процедуру, по сравнению с пациентами без хирургического вмешательства, учитывая, что все они не страдали ожирением и сахарным диабетом на момент включения в исследование [43].
В предлагаемых стратегиях ведения пациентов с НАЖБП после холецистэктомии подчеркивается, что при отсутствии клинических проявлений ЖКБ, очаговой кальцификации стенки желчного пузыря и растущих в нем полипов размером более 10 мм целесообразно выбрать выжидательную тактику. Пациентам, перенесшим оперативное вмешательство, рекомендуется оценка липидного спектра, глюкозы, маркеров цитолиза и холестаза начиная со 2-й недели после операции и далее не реже 1 раза в 3 мес. в течение первого года, а также оценка фиброэластометрии через 6 и 12 мес. после операции [44].
Собственный опыт
На кафедре факультетской терапии и гастроэнтерологии ФГБОУ ВО ОмГМУ Минздрава России было проведено исследование, включившее 183 пациента, страдающих НАЖБП. Для определения диагностически ценных клинических признаков коморбидного течения НАЖБП и ЖКБ полученные результаты обследования изучались в группах и подгруппах: в основную группу вошли пациенты, страдающие НАЖБП и ЖКБ (n=88), из которых 53 пациента перенесли холецистэктомию, группу сравнения составили пациенты, страдающие НАЖБП без ЖКБ (n=95). Всем пациентам проводилось стандартное лабораторно-инструментальное обследование, а также измерение уровня лептина, его растворимого рецептора, инсулина, адипонектина в сыворотке крови. Фиброз печени оценивали с помощью транзиентной эластометрии.
При анализе пола и возраста лиц, страдающих НАЖБП и ЖКБ, было установлено, что женщин среди пациентов основной группы статистически значимо больше: 36 (40,9%) пациенток основной группы против 20 (21,1%) пациенток группы сравнения (χ2=8,48, р<0,01) — при отсутствии статистически значимых различий по возрасту. Достоверно чаще пациенты основной группы предъявляли жалобы на ощущение горечи во рту (χ2=11,66, р<0,01), при этом сила положительной взаимосвязи возрастала после холецистэктомии (χ2=0,231, р<0,01). Нами было выявлено, что у пациентов с НАЖБП и ЖКБ чаще была диагностирована ишемическая болезнь сердца (у 25% лиц основной группы и у 9,47% — группы сравнения, χ2=7,83, р<0,01, rs=0,207, р<0,01). Бóльшая распространенность ССЗ была отмечена у лиц с ЖКБ, перенесших холецистэктомию (rs=0,258, р<0,01). Также установлено, что при коморбидном течении НАЖБП и ЖКБ характерным было наличие сопутствующего сахарного диабета 2 типа, более высоких значений γ-глутамилтрансферазы и липопротеидов низкой плотности (р<0,01). Достоверно чаще были зафиксированы прогрессирующие стадии фиброза печени (F2–3) у пациентов с НАЖБП и ЖКБ, при этом стадия фиброза имела положительную достоверно значимую взаимосвязь с холецистэктомией (rs=0,366, р≤ 0,01), что говорит об увеличении риска прогрессирующего течения НАЖБП после удаления желчного пузыря. В целом для пациентов с НАЖБП и ЖКБ были характерны высокие значения инсулина, лептина и более низкие значения адипонектина. Вместе с тем было установлено, что у лиц с сохраненным желчным пузырем уровень лептина сопоставим с таковым у пациентов, страдающих НАЖБП без ЖКБ, а после перенесенной холецистэктомии отмечен скачкообразный, более чем двукратный рост уровня лептина по сравнению с лицами с ЖКБ до операции.
Для того чтобы оценить влияние рассматриваемых патологий на уровень риска развития фатальных ССЗ, мы провели оценку степени риска по шкале SCORE 2019 г. в наших группах сравнения (использовали шкалу для регионов с повышенным риском). В подгруппе пациентов с коморбидным течением и проведенной холецистэктомией выявлена достоверно бóльшая доля лиц с высоким уровнем риска ССЗ в течение следующих 10 лет (χ2=9,4140, p<0,01).
Таким образом, коморбидное течение НАЖБП и ЖКБ имеет клинико-лабораторные особенности. Постхолецистэктомическое течение ЖКБ у пациентов с НАЖБП характеризуется повышением кардиоваскулярного риска и прогрессированием фиброза печени.
Фармакотерапия при НАЖБП и ЖКБ
Для профилактики развития кардиоваскулярных заболеваний у пациентов с НАЖБП и ЖКБ необходимо использовать патогенетически обоснованную и высокоэффективную терапию. Урсодезоксихолевая кислота (УДХК) обладает мощным литолитическим эффектом и является препаратом первого выбора у пациентов с ЖКБ [2, 45]. Имеются неоспоримые данные о том, что монотерапия УДХК при лечении НАЖБП от 5 до 24 мес. достоверно снижает клинико-биохимическую активность заболевания и выраженность фиброза [46]. В исследовании [47] с участием 207 пациентов с НАЖБП, которые имели признаки раннего атеросклероза, было обнаружено, что прием УДХК в дозе 15 мг на 1 кг массы тела привел к статистически значимому уменьшению стеатоза печени (оценивался по индексу FLI) и толщины комплекса интима-медиа, это позволяет говорить о самостоятельном гиполипидемическом эффекте УДХК, который реализуется через уменьшение инсулинорезистентности и повышение уровня аполипопротеина А1 (липопротеида высокой плотности).
Представляет интерес также глицирризиновая кислота (ГК, глицирризин) — сапонин корня солодки. Солодка входит в состав препаратов традиционной китайской медицины, применяется в различных областях, и в частности в терапии ЖКБ с целью купирования воспаления и восстановления функции печени. Из всех известных эффектов ГК наиболее актуальны противовоспалительный (системный и местный), гепатопротективный, антифибротический и антиканцерогенный [48]. Так, в плацебо-контролируемом рандомизированном клиническом исследовании [49], включившем 66 пациентов с НАЖБП, назначение препарата солодки сопровождалось статистически значимым снижением активности аланинаминотрансферазы и аспартатаминотрансферазы. В группе плацебо такого эффекта зарегистрировано не было.
В 2019 г. впервые в России и в мире была зарегистрирована фиксированная комбинация ГК и УДХК (Фосфоглив® УРСО) в форме капсул, содержащих действующие вещества в количестве 35 мг и 250 мг соответственно. На доклиническом этапе исследований [50] на модели холестаза было установлено, что фиксированная комбинация в сравнении с монопрепаратом УДХК эффективнее влияет на активность аланинаминотрансферазы, аспартатаминотрансферазы, γ-глутамилтранспептидазы, щелочной фосфатазы, уровень прямого и непрямого билирубина, а также на гистологическую картину печени. Комбинированный препарат Фосфоглив® УРСО запатентован в качестве лекарственного средства для профилактики и лечения острого и хронического гепатита и холестаза. Учитывая его более выраженный плейотропный эффект в сравнении с монотерапией УДХК, препарат используют в лечении пациентов с сочетанной патологией — функциональными расстройствами, билиарным сладжем и НАЖБП. Препарат показал хорошую переносимость и минимальное количество побочных эффектов [51, 52].
Заключение
Клинические исследования и систематические обзоры демонстрируют связь между ЖКБ, холецистэктомией и НАЖБП, которая выражается в том, что, во-первых, НАЖБП является независимым фактором риска развития ЖКБ и наоборот, а во-вторых, после выполнения холецистэктомии развиваются метаболические нарушения и ассоциированная с ними НАЖБП. Коморбидное течение НАЖБП и ЖКБ характеризуется — наряду с нарушениями липидного обмена, изменениями количества и соотношения ЖК, гормональными расстройствами — гиперлептинемией, лептинорезистентностью и инсулинорезистентностью. Холецистэктомия выступает как неблагоприятный фактор прогрессирующего течения НАЖБП и развития фиброза печени. Вся эта взаимообусловленность коморбидных патологий и сопутствующих им факторов риска требует разработки индивидуальных схем ведения пациентов. Двухкомпонентный препарат Фосфоглив® УРСО применяется как гепатопротективное средство с патогенетически направленным действием при коморбидном течении НАЖБП и ЖКБ.
Сведения об авторах:
Кролевец Татьяна Сергеевна — к.м.н., доцент кафедры факультетской терапии и гастроэнтерологии ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0002-7452-7230.
Ливзан Мария Анатольевна — д.м.н., профессор, член-корреспондент РАН, заведующая кафедрой факультетской терапии и гастроэнтерологии, ректор ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0002-6581-7017.
Сыровенко Мария Игоревна — ординатор кафедры факультетской терапии и гастроэнтерологии ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0001-6300-367X.
Черкащенко Наталья Александровна — к.м.н., заведующая терапевтическим отделением ФГБУЗ ЗСМЦ ФМБА России; 644099, Россия, г. Омск, ул. Красный Путь, д. 127, корп. 1; ORCID iD 000-003-3743-143X.
Контактная информация: Кролевец Татьяна Сергеевна, e-mail: mts-8-90@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 31.03.2022.
Поступила после рецензирования 25.04.2022.
Принята в печать 24.05.2022.
About the authors:
Tatyana S. Krolevets — C. Sc. (Med.), associate professor of the Department of Faculty Therapy and Gastroenterology, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0002-7452-7230.
Maria A. Livzan — Dr. Sc. (Med.), Professor, Corresponding Member of the RAS, Head of the Department of Faculty Therapy and Gastroenterology, Chancellor Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0002-6581-7017.
Maria I. Syrovenko — resident of the Department of Faculty Therapy and Gastroenterology, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0001-6300-367X.
Natal’ya A. Cherkashchenko — C. Sc. (Med.), Head of the Therapeutic Department, West Siberian Medical Center of the Federal Medical Biological Agency of Russia; 127 build. 1, Krasnyy Put’ str., Omsk, 644099, Russian Federation; ORCID iD 000-003-3743-143X.
Contact information: Tatyana S. Krolevets, e-mail: mts-8-90@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 31.03.2022.
Revised 25.04.2022.
Accepted 24.05.2022.
2. European Association for the Study of the Liver (EASL). EASL Clinical Practice Guidelines on the prevention, diagnosis and treatment of gallstones. J Hepatol. 2016;65(1):146–181. DOI: 10.1016/j.jhep.2016.03.005.
3. Ивашкин В.Т., Драпкина О.М., Маев И.В. и др. Распространенность неалкогольной жировой болезни печени у пациентов амбулаторно-поликлинической практики в Российской Федерации: результаты исследования DIREG 2. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2015;6:31–41.
4. Гаус О.В., Ахмедов В.А. Оценка прогностических факторов развития желчнокаменной болезни у лиц с метаболическим синдромом. Экспериментальная и клиническая гастроэнтерология. 2014;11(111):46–50.
5. Kim Y.K., Kwon O.S., Her K.H. The grade of nonalcoholic fatty liver disease is an independent risk factor for gallstone disease: An observational Study. Medicine (Baltimore). 2019;98(27):e16018. DOI: 10.1097/MD.0000000000016018.
6. Lu Y., Hu L., Song J. et al. Gallstone disease and nonalcoholic fatty liver disease in patients with type 2 diabetes: a cross-sectional study. BMC Endocr Disord. 2021;231:21. DOI: 10.1186/s12902-021-00899-z.
7. Черкащенко Н.А., Ливзан М.А., Кролевец Т.С. Особенности течения желчнокаменной болезни у пациентов с неалкогольной жировой болезнью печени. Терапевтический архив. 2020;92(2):48–54. DOI: 10.26442/00403660.2020.02.000550.
8. Koller T., Kollerova J., Hlavaty T. et al. Cholelithiasis and markers of nonalcoholic fatty liver disease in patients with metabolic risk factors. Scand J Gastroenterol. 2012;47(2):197–203. DOI: 10.3109/00365521.2011.643481.
9. Fracanzani A.L., Valenti L., Russello M. et al. Gallstone disease is associated with more severe liver damage in patients with non-alcoholic fatty liver disease. PLoS One. 2012;7(7):e41183. DOI: 10.1371/journal.pone.0041183.
10. Park J.H., Hong J.Y., Kwon M. et al. Association between non-alcoholic fatty liver disease and the risk of biliary tract cancers: A South Korean nationwide cohort study. Eur J Cancer. 2021;150:73–82. DOI: 10.1016/j.ejca.2021.03.024.
11. Fan L.L., Chen B.H., Dai Z.J. The relation between gallstone disease and cardiovascular disease. Sci Rep. 2017;7(1):15104. DOI: 10.1038/s41598-017-15430-5.
12. Лазебник Л.Б., Голованова Е.В., Туркина С.В. и др. Неалкогольная жировая болезнь печени у взрослых: клиника, диагностика, лечение. Рекомендации для терапевтов, третья версия. Экспериментальная и клиническая гастроэнтерология. 2021;1(1):4–52. DOI: 10.31146/1682-8658-ecg-185-1-4-52.
13. Chiang J.Y.L., Ferrell J.M. Bile acid biology, pathophysiology, and therapeutics. Clin Liver Dis (Hoboken). 2020;15:91–94. DOI: 10.1002/cld.861.
14. Chen Y., Wu S., Tian Y. Cholecystectomy as a risk factor of metabolic syndrome: from epidemiologic clues to biochemical mechanisms. Lab Invest. 2018;98(1):7–14. DOI: 10.1038/labinvest.2017.95.
15. Zhou D., Fan J.G. Microbial metabolites in non-alcoholic fatty liver disease. World J Gastroenterol. 2019;25(17):2019–2028. DOI: 10.3748/wjg.v25.i17.2019.
16. Farooqui N., Elhence A., Shalimar A. Current Understanding of Bile Acids in Chronic Liver Disease. J Clin Exp Hepatol. 2022;12(1):155–173. DOI: 10.1016/j.jceh.2021.08.017.
17. Nimer N., Choucair I., Wang Z. et al. Bile acids profile, histopathological indices and genetic variants for non-alcoholic fatty liver disease progression. Metabolism. 2021;116:154457. DOI: 10.1016/j.metabol.2020.154457.
18. Lee G., You H.J., Bajaj J.S. et al. Distinct signatures of gut microbiome and metabolites associated with significant fibrosis in non-obese NAFLD. Nat Commun. 2020;11(1):4982. DOI: 10.1038/s41467-020-18754-5.
19. Вахрушев Я.М., Лукашевич А.П., Пенкина И.А., Сучкова Е.В. Сравнительный анализ спектра желчных кислот при неалкогольной жировой болезни печени и желчнокаменной болезни. Терапевтический архив. 2019;91(2):48–51. DOI: 10.26442/00403660.2019.02.000105.
20. Kichloo A., Solanki S., Haq K.F. et al. Association of non-alcoholic fatty liver disease with gallstone disease in the United States hospitalized patient population. World J gastrointestinal pathophysiology. 2021;12(2):14–24. DOI: 10.4291/wjgp.v12.i2.14.
21. Ballestri S., Nascimbeni F., Baldelli E. et al. NAFLD as a Sexual Dimorphic Disease: Role of Gender and Reproductive Status in the Development and Progression of Nonalcoholic Fatty Liver Disease and Inherent Cardiovascular Risk. Adv Ther. 2017;34(6):1291–1326. DOI: 10.1007/s12325-017-0556-1.
22. Turola E., Petta S., Vanni E. et al. Ovarian senescence increases liver fibrosis in humans and zebrafish with steatosis. Dis Model Mech. 2015;8(9):1037–1046. DOI: 10.1242/dmm.019950.
23. Lammert F., Gurusamy K., Ko C.W. et al. Gallstones. Nat Rev Dis Primers. 2016;2:16024. DOI: 10.1038/nrdp.2016.24.
24. Biddinger S.B., Haas J.T., Yu B.B. et al. Hepatic insulin resistance directly promotes formation of cholesterol gallstones. Nat Med. 2008;14(7):778–782. DOI: 10.1038/nm1785.
25. Nakeeb A., Comuzzie A.G., Al-Azzawi H. et al. Insulin resistance causes human gallbladder dysmotility. J Gastrointest Surg. 2006;10(7):940–948. DOI: 10.1016/j.gassur.2006.04.005.
26. EASL — EASD — EASO. Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatology. 2016;64(6):1388–1402. DOI: 10.1016/j.jhep.2015.11.004.
27. Stefan N., Cusi K. A global view of the interplay between non-alcoholic fatty liver disease and diabetes. Lancet Diabetes Endocrinol. 2022;10(4):284–296. DOI: 10.1016/S2213-8587(22)00003-1.
28. Nervi F., Miquel J.F., Alvarez M. et al. Gallbladder disease is associated with insulin resistance in a high risk Hispanic population. J Hepatol. 2006;45(2):299–305. DOI: 10.1016/j.jhep.2006.01.026.
29. Housset C., Chrétien Y., Debray D., Chignard N. Functions of the Gallbladder. Compr Physiol. 2016;6(3):1549–1577. DOI: 10.1002/cphy.c150050.
30. Rosso C., Mezzabotta L., Gaggini M. et al. Peripheral insulin resistance predicts liver damage in nondiabetic subjects with nonalcoholic fatty liver disease. Hepatology. 2016;63(1):107–116. DOI: 10.1002/hep.28287.
31. Tanaka N., Aoyama T., Kimura S., Gonzalez F.J. Targeting nuclear receptors for the treatment of fatty liver disease. Pharmacol Ther. 2017;179:142–157. DOI: 10.1016/j.pharmthera.2017.05.011.
32. Рекомендации экспертов Всероссийского научного общества кардиологов по диагностике и лечению метаболического синдрома. Второй пересмотр. (Электронный ресурс.) URL: https://cyberleninka.ru/article/n/rekomendatsii-ekspertov-vserossiyskogo-nauchnogo-obschestva-kardiologov-po-diagnostike-i-lecheniyu-metabolicheskogo-sindroma-vtoroy-1 (дата обращения: 24.02.2022).
33. Кролевец Т.С., Ливзан М.А. Неалкогольная жировая болезнь печени: дайджест. 2021. Доказательная гастроэнтерология. 2021;10(2):27–35. DOI: 10.17116/dokgastro20211002127.
34. Wree A., Kahraman A., Gerken G., Canbay A. Obesity affects the liver — the link between adipocytes and hepatocytes. Digestion. 2011;83(1–2):124–133. DOI: 10.1159/000318741.
35. Кролевец Т.С., Ливзан М.А. Клинико-лабораторные маркеры прогнозирования фиброза печени у лиц с неалкогольной жировой болезнью печени. Экспериментальная и клиническая гастроэнтерология. 2018;(7):43–51.
36. Méndez-Sánchez N., Bermejo-Martínez L.B., Viñals Y. et al. Serum leptin levels and insulin resistance are associated with gallstone disease in overweight subjects. World J Gastroenterol. 2005;11(39):6182–6187. DOI: 10.3748/wjg.v11.i39.6182.
37. Hyogo H., Roy S., Cohen D.E. Restoration of gallstone susceptibility by leptin in C57BL/6J ob/ob mice. J Lipid Res. 2003;44(6):1232–1240. DOI: 10.1194/jlr.M300029-JLR200.
38. Méndez-Sánchez N., Ponciano-Rodrigoez G., Chavez-Tapia N., Uribe M. Effects of leptin on biliary lipids: potential consequences for gallstone formation and therapy in obesity. Curr Drug Targets Immune Endocr Metabol Disord. 2005;5(2):203–208. DOI: 10.2174/1568008054064896.
39. Ruhl C.E., Everhart J.E. Relationship of non-alcoholic fatty liver disease with cholecystectomy in the US population. Am J Gastroenterol. 2013;108(6):952–958. DOI: 10.1038/ajg.2013.70.
40. Barrera F., Azócar L., Molina H. et al. Effect of cholecystectomy on bile acid synthesis and circulating levels of fibroblast growth factor 19. Ann Hepatol. 2015;14(5):710–721.
41. Amigo L., Husche C., Zanlungo S. et al. Cholecystectomy increases hepatic triglyceride content and very-low-density lipoproteins production in mice. Liver Int. 2011;31(1):52–64. DOI: 10.1111/j.1478-3231.2010.02361.x.
42. Rodríguez-Antonio I., López-Sánchez G.N., Garrido-Camacho V.Y. et al. Cholecystectomy as a risk factor for non-alcoholic fatty liver disease development. HPB (Oxford). 2020;22(11):1513–1520. DOI: 10.1016/j.hpb.2020.07.011.
43. Cortés V., Quezada N., Uribe S. et al. Effect of cholecystectomy on hepatic fat accumulation and insulin resistance in non-obese Hispanic patients: a pilot study. Lipids Health Dis. 2017;16(1):129. DOI: 10.1186/s12944-017-0525-3.
44. Мехтиев С.Н., Мехтиева О.А., Ухова М.В., Ибрагимова З.М. Современный взгляд на значение холецистэктомии в прогнозе пациента с неалкогольной жировой болезнью печени: алгоритм наблюдения и терапевтические подходы. РМЖ. Медицинское обозрение. 2021;5(6):438–445. DOI: 10.32364/2587-6821-2021-5-6-438-445.
45. Ивашкин В.Т., Маев И.В., Баранская Е.К. и др. Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению желчнокаменной болезни. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2016;26(3):64–80. DOI: 10.22416/1382-4376-2016-26-3-64-80.
46. Маевская М.В., Ивашкин В.Т., Ивашкин К.В. и др. Неалкогольная жировая болезнь печени как причина и следствие кардиометаболических осложнений. Особенности фармакотерапии. Место урсодезоксихолевой кислоты. Терапевтический архив. 2019;91(2):109–117. DOI: 10.26442/00403660.2019.02.000122.
47. Nadinskaia M., Maevskaya M., Ivashkin V. et al. Ursodeoxycholic acid as a means of preventing atherosclerosis, steatosis and liver fibrosis in patients with nonalcoholic fatty liver disease. World J Gastroenterol. 2021;27(10):959–975. DOI: 10.3748/wjg.v27.i10.959.
48. Никитин И.Г., Волнухин А.В. Желчнокаменная болезнь: эпидемиологические данные, ключевые аспекты патогенеза и коморбидности, актуальные терапевтические мишени. РМЖ. Медицинское обозрение. 2020;4(5):290–296. DOI: 10.32364/2587-6821-2020-4-5-290-296.
49. Hajiaghamohammadi A.A., Ziaee A., Samimi R. The Efficacy of Licorice Root Extract in Decreasing Transaminase Activities in Non-alcoholic Fatty Liver Disease: A Randomized Controlled Clinical Trial. Phytother Res. 2012;1:3728. DOI: 10.1002/ptr.3728.
50. Оковитый С.В., Райхельсон К.Л., Волнухин А.В., Кудлай Д.А. Гепатопротекторные свойства глицирризиновой кислоты. Экспериментальная и клиническая гастроэнтерология. 2020;184(12):96–108. DOI: 10.31146/1682-8658-ecg-184-12-96-108.
51. Мехтиев С.Н., Мехтиева О.А., Ибрагимова З.М. Функциональные расстройства желчного пузыря и неалкогольная жировая болезнь печени: клинические особенности и новые подходы к терапии. Медицинский совет. 2020;(15):54–64. DOI: 10.21518/2079-701X-2020-15-54-64.
52. Мехтиев С.Н., Мехтиева О.А., Ибрагимова З.М. и др. Возможности комбинированной терапии у пациентов с функциональным билиарным расстройством сфинктера Одди. Медицинский совет. 2021;(5):102–110. DOI: 10.21518/2079-701X-2021-5-102-110.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.