Особенности микробиоты у пациентов с болезнью Крона в зависимости от наличия синдрома избыточного бактериального роста
DOI: 10.32364/2587-6821-2022-6-5-221-226
Цель исследования: оценить особенности микробиоты у пациентов с болезнью Крона (БК) в зависимости от наличия или отсутствия синдрома избыточного бактериального роста (СИБР) в тонкой кишке.
Материал и методы: в исследование было включено 13 пациентов с БК с поражением тонкой кишки. Состав кишечной микробиоты был проанализирован с помощью 16S секвенирования. 16S ДНК-библиотеки готовились аналогично. Всем больным был проведен водородный дыхательный тест (ВДТ) для верификации СИБР на аппарате Gastro+ с использованием лактулозы. Положительный результат ВДТ свидетельствует о наличии СИБР.
Результаты исследования: по результатам ВДТ у 8 (61,5%) пациентов с БК с поражением тонкой кишки был диагностирован СИБР. Все пациенты с БК и наличием СИБР были женского пола (средний возраст составил 40,5 [34,5; 51,2] года). У 5 (38,5%) больных не был диагностирован СИБР, их средний возраст составил 32,4 [28,7; 36,5] года).
Исследование метагенома кишечных бактерий показало некоторые значимые различия состава микробиоты у пациентов с БК в зависимости от наличия или отсутствия СИБР. У пациентов с БК с поражением тонкой кишки наличие СИБР было ассоциировано с большей частотой встречаемости бактерий рода Chryseobacterium (р=0,045), рода Klebsiella (р=0,045), операционной таксономической единицы (ОТЕ) Phocaecola (р=0,045), ОТЕ Enterobacteriaceae (р=0,045), реже встречались порядок Pasteurellales (р=0,031), семейство Peptoniphilaceae (р=0,023), род Solobacterium (р=0,002), род Haemophilus (р=0,031), ОТЕ Lachnospiracea (р=0,045), штаммы Bifidobacterium (р=0,019).
Заключение: выявлен таксономический сдвиг со снижением содержания Firmicutes и Bifidobacterium и увеличением содержания некоторых представителей Proteobacteria (в частности, рода Klebsiella и ОТЕ Enterobacteriaceae) при наличии СИБР у пациентов с БК.
Ключевые слова: воспалительные заболевания кишечника, болезнь Крона, микробиота, синдром избыточного бактериального роста, водородный дыхательный тест.
Для цитирования: Кулыгина Ю.А., Осипенко М.Ф., Аликина Т.Ю. Особенности микробиоты у пациентов с болезнью Крона в зависимости от наличия синдрома избыточного бактериального роста. РМЖ. Медицинское обозрение. 2022;6(5):221-226. DOI: 10.32364/2587-6821-2022-6-5-221-226.
Yu.A. Kulygina1, M.F. Osipenko1, T.Yu. Alikina2
1Novosibirsk State Medical University, Novosibirsk, Russian Federation
2Institute of Chemical Biology and Fundamental Medicine of the Siberian Branch of the RAS, Novosibirsk, Russian Federation
Aim: to evaluate microbiota in Crohn’s disease depending on the presence/absence of small intestinal bacterial overgrowth (SIBO).
Patients and Methods: thirteen patients with Crohn’s disease affecting the small intestine were enrolled. Gut microbiota composition was analyzed using the 16S rRNA gene sequencing. 16S rDNA clone libraries were generated similarly. All patients underwent lactulose hydrogen breath test using Gastroplus+ monitor to establish SIBO. A positive lactulose hydrogen breath test indicated SIBO.
Results: hydrogen breath test revealed SIBO in 8 patients with Crohn’s disease affecting the small intestine (61.5%). All these patients were women (mean age 40.5 [34.5; 51.2] years). In 5 patients (mean age 32.4 [28.7; 36.5] years), SIBO was not detected. The metagenome analysis of intestinal bacteria identified certain significant differences in microbiota composition in patients with Crohn’s disease depending on the presence/absence of SIBO. In Crohn’s disease affecting the small intestine, SIBO was associated with greater occurrence of Chryseobacterium spp. (р=0.045), Klebsiella spp. (р=0.045), Phocaecola operational taxonomic unit (OTU) (р=0.045), Enterobacteriaceae OTU (р=0.045), Pasteurellales. (р=0.031), Peptoniphilaceae (р=0,023), Solobacterium spp. (р=0.002), Haemophilus spp. (р=0.031), Lachnospiracea OTU (р=0.045), and Bifidobacterium spp. (р=0.019).
Conclusions: a taxonomic shift with the reduction of Firmicutes and Bifidobacterium and increase of Proteobacteria (i.e., Klebsiella spp. and Enterobacteriaceae OTU) was revealed in patients with Crohn’s disease and SIBO.
Keywords: inflammatory bowel disease, Crohn’s disease, microbiota, small intestinal bacterial overgrowth, hydrogen respiratory test.
For citation: Kulygina Yu.A., Osipenko M.F., Alikina T.Yu. Microbiota pattern in Crohn’s disease depending on the presence of small intestinal bacterial overgrowth. Russian Medical Inquiry. 2022;6(5):221–226 (in Russ.). DOI: 10.32364/2587-6821-2022-6-5-221-226.
Введение
Воспалительные заболевания кишечника (ВЗК) — это группа воспалительных заболеваний, опосредованных нарушениями иммунной системы и поражающих желудочно-кишечный тракт (ЖКТ) [1–3]. Этиология ВЗК до сих пор остается не полностью изученной. Одна из ведущих гипотез связывает возникновение ВЗК с сочетанным влиянием генетических факторов, иммунной дисрегуляции и экологических триггеров [3–6]. В настоящее время общегеномные ассоциативные исследования (GWAS) [1, 7–9] идентифицировали более 230 однонуклео-тидных полиморфизмов (SNP), связанных с ВЗК. Большинство из этих генетических полиморфизмов восприимчивости к ВЗК связаны с барьерной функцией слизистой оболочки хозяина и участвуют во взаимодействиях хозяина и микробиома [1, 10, 11]. Изменения микробиома кишечника необходимы для запуска хронического воспаления [1, 5, 6, 12, 13]. Генетическим локусом риска, имеющим наиболее сильную ассоциацию с болезнью Крона (БК), является NOD2 (nucleotide-binding oligomerization domain containing 2), который кодирует рецептор распознавания и играет ключевую роль в иммунном ответе «хозяин — микроб» [1, 14, 15]. Он связывает мурамилдипептид (MDP) — часть пептидогликана бактериальной клеточной стенки. После связывания сборка олигомера NOD2 индуцирует активацию ядерного фактора «каппа-би» (NF-κB) и митоген-активируемой протеинкиназы и, следовательно, транскрипцию воспалительных цитокинов. Нарушенный ответ NOD2 на изменения микробиома может способствовать нарушениям гомеостаза между иммунной системой хозяина и микробиомом, что приводит к повышенному риску развития ВЗК [1, 16].
К особенностям кишечного микробиома при ВЗК относят: уменьшение количества видов Firmicutes (Clostridium cluster IX и IV), связанных со снижением количества короткоцепочечных жирных кислот, из которых бутират обладает способностью ингибировать провоспалительные цитокины; снижение содержания Faecalibacterium prausnitzii, введение которого оказывает противовоспалительное действие; уменьшение количества видов Bacteroides, включая «пространственную реорганизацию» его видов и повышение бактериальной адгезии; уменьшение количества видов Bifidobacterium adolescentis, Dialister invisus и увеличение частоты Ruminococcus gnavus; снижение количества видов Roseburia hominis, Lactobacillus, Bifidobacterium и Akkermansia; чрезмерный рост сульфатредуцирующих видов бактерий (Desulfovibrio spp.), особенно у пациентов с язвенным колитом (ЯК) и паучитом [17].
Одним из вариантов нарушения микробиома является синдром избыточного бактериального роста (СИБР) в тонкой кишке. В настоящее время большое внимание уделяется вкладу СИБР в клиническую картину органических заболеваний ЖКТ, а также признается его роль в генезе разных гастроинтестинальных симптомов, включая вздутие живота, метеоризм, диарею, абдоминальную боль, тошноту и потерю веса [3, 18].
Данных о взаимосвязях СИБР с ВЗК немного. Р. Rutgeerts et al. [19] впервые озвучили эту проблему у пациентов с БК тонкой кишки в 1981 г. По данным нескольких опубликованных исследований [4, 20], частота СИБР при БК в среднем составляет около 25%. При БК избыточный бактериальный рост может вызывать нарушения слизистой оболочки тонкой кишки с последующими дефектами щеточной каймы и деконъюгацией желчных солей, иногда вызывая или усугубляя мальабсорбцию жира, дефицит микроэлементов, анемию и потерю веса [21]. Согласно результатам исследования J. Klaus et al. [22] СИБР может имитировать обострение БК, включая увеличение частоты дефекаций и потерю массы тела.
Цель исследования: оценить особенности микробиоты у больных БК в зависимости от наличия или отсутствия СИБР в тонкой кишке.
Материал и методы
В исследование было включено 13 больных БК с поражением тонкой кишки, у которых был проанализирован состав кишечной микробиоты с помощью 16S секвенирования в ЦКП «Геномика» (ИХБФМ СО РАН). 16S ДНК-биб-лиотеки готовились аналогично.
Всем больным был проведен водородный дыхательный тест (ВДТ) для верификации СИБР на аппарате Gastro+ с использованием лактулозы. При проведении теста пациентам после измерения базального уровня водорода в выдыхаемом воздухе давали выпить лактулозу в дозе 15 мл (10 г), растворенную в 200 мл воды. Измерение концентрации водорода (H2) в выдыхаемом воздухе проводилось натощак, через 15, 30, 60, 90 и 120 мин. Североамериканский консенсус определяет рост H2 ≥20 частей на 1 млн (ppm) от исходного уровня в течение 90 мин после приема субстрата как положительный результат [23]. Положительный результат ВДТ свидетельствует о наличии СИБР.
Все статистические расчеты проводились в программе Rstudio (version 0.99.879 RStudio, Inc., США). Дескриптивные характеристики представлены как медиана (1-й квартиль; 3-й квартиль) для числовых данных, процент для категориальных данных с вычислением границ доверительных интервалов (ДИ) по формуле Вильсона. Для статистической проверки гипотез о равенстве числовых характеристик выборочных распределений в сравниваемых группах использовался непарный U-критерий Манна — Уитни. Проверка статистических гипотез проводилась при критическом уровне значимости р=0,05, т. е. различие считалось статистически значимым, если p<0,05. Биоинформатический анализ микробиоты проводился с помощью UPARSE скриптов, с использованием Usearch v10.0.240. Биоинформатическая обработка включала перекрывание парных рядов, фильтрацию по качеству и длине, учет одинаковых последовательностей, отбрасывание синглетонов, удаление химер и получение операционных таксономических единиц (ОТЕ) с помощью алгоритма кластеризации UPARSE/UNOISE. Таксономическая принадлежность последовательностей ОТЕ определялась с помощью SINTAX.
Результаты и обсуждение
У 8 (61,5%) больных из 13 был диагностирован СИБР по результатам ВДТ. Все больные с БК и наличием СИБР были женского пола, их средний возраст составил 40,5 [34,5; 51,2] года). У 5 (38,5%) больных СИБР не был диагностирован, их средний возраст — 32,4 [28,7; 36,5] года).
Исследование метагенома кишечных бактерий показало некоторые значимые различия состава микробиоты у больных БК в зависимости от наличия или отсутствия СИБР. Так, порядок Pasteurellales, относящийся к филотипу Proteobacteria, достоверно реже встречается у пациентов с БК и СИБР (рис. 1).
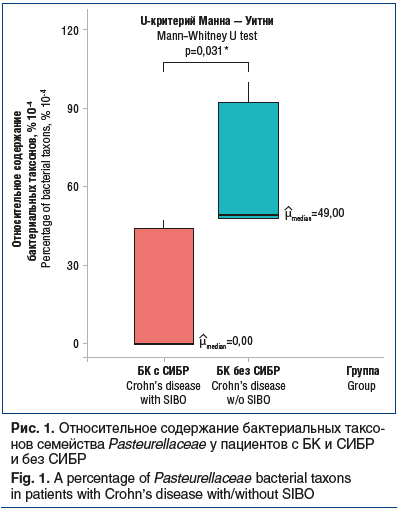
Была выявлена значимая разница среди нескольких бактериальных семейств у больных БК с СИБР по сравнению с пациентами с БК без СИБР. Семейство бактерий Peptoniphilaceae, относящееся к классу Clostridia (тип Firmicutes), реже встречается у больных с БК и СИБР (р=0,023). Так как семейство Pasteurellaceae является единственным представителем рода Pasteurellales, то оно также достоверно реже встречается у больных с БК и СИБР (р=0,031).
Ряд исследований [1, 4, 13, 24] задокументировали различия в составе микробиоты кишечника между пациентами с ВЗК и здоровыми людьми, особенно в отношении микробного разнообразия и относительного обилия конкретных бактериальных таксонов. Описаны как экспансия потенциальных патогенов, так и глобальные изменения состава (т. е. увеличение или уменьшение численности) индикаторных видов [4, 13]. Результаты исследований [1, 24], направленных на характеристику микробиоты пациентов, страдающих ВЗК, описывают снижение содержания специ-фических таксонов, включая Firmicutes и Bacteroidetes, Lactobacillus и Eubacterium. Также описывается таксономический сдвиг с относительным увеличением содержания Enterobacteria, включая Escherichia coli и Fusobacterium. M. Joosens et al. [25] наблюдали у пациентов с БК увеличение содержания Ruminococcus gnavus и снижение содержания Bifidobacterium adolescentis, Dialister invisus, Faecalibacterium prausnitzii наряду с неопределенным членом кластера Clostridium XIVa. В целом существует консенсус в отношении сокращения общего числа видов и уменьшения разнообразия микробиоты при ВЗК [26].
При сравнении групп больных по микробным родам выявлены некоторые различия. Так, род бактерий Chryseobacterium достоверно чаще встречается среди больных с БК и СИБР (р=0,045). Chryseobacterium представляют собой грамотрицательные бактерии палочковидной формы, относящиеся к филотипу Bacteroidetes. Наиболее распространенными клиническими проявлениями инфицирования бактериями рода Chryseobacterium являются пневмония, бактериемия, целлюлит, хирургические раневые инфекции, инфекции мочевыводящих путей, глазные инфекции, менингит вследствие шунтирования центральной нервной системы, перитонит вследствие перитонеального катетерного диализа, внутрибрюшные и другие катетерные инфекции [27, 28].
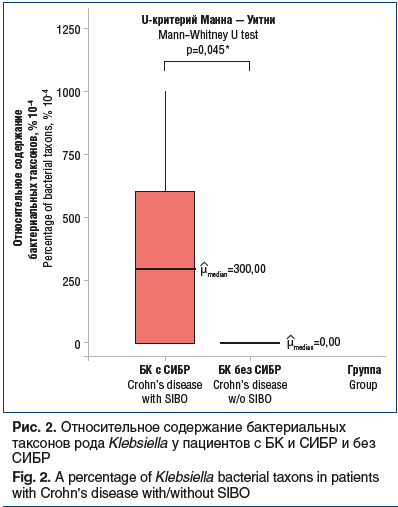
Также чаще у пациентов с БК и СИБР в кале встречался род Klebsiella (р=0,045), относящийся к Proteobacteria (рис. 2). В настоящее время широко обсуждается роль Klebsiella в патогенезе ВЗК. Существующие исследования показали, что микробы рода Klebsiella были выделены из образцов толстой кишки более чем у 25% больных БК и что рецидивы заболевания у больных БК были связаны с клебсиеллезным колитом [29, 30]. Также повышенные уровни антител к Klebsiella и иерсинии наблюдались у больных БК и ЯК по сравнению со здоровыми лицами из группы контроля [31, 32]. Было обнаружено, что класс-специфические антитела против микробов Klebsiella и кросс-реактивного коллагена типов I, II, III, IV и V значительно повышены у больных в ранних и запущенных случаях БК по сравнению со здоровыми испытуемыми. Согласно данным литературы [32, 33] образцы сыворотки крови больных БК показали положительную корреляцию между уровнем антител к Klebsiella и типами коллагена I, III и IV.
Род Solobacterium у пациентов с БК и СИБР встречается реже (р=0,002), чем у больных БК без СИБР. Solobacterium — грамположительный облигатный анаэробный род из семейства Erysipelotrichidae с одним известным видом (Solobacterium moorei), относящийся к Firmicutes. Было обнаружено, что этот род является частью микробиома слюны.
Также достоверно ниже частота встречаемости рода Haemophilus у пациентов с БК и СИБР (р=0,031). Haemophilus выделяются при синдроме раздраженного кишечника с диареей, эзофагите, пищеводе Барретта, бронхиальной астме [34]. Род Haemophilus входит в семейство Pasteurellaceae, филотип Proteobacteria.
В процессе биоинформатической обработки были получены различия групп больных по ОТЕ. Так, у пациентов с БК и СИБР в образцах кала ОТЕ Phocaecola выявляется значимо чаще по сравнению с больными без СИБР (р=0,045). ОТЕ Phocaeicola является единственным представителем рода Phocaeicola, относится к Bacteroidetes [35]. Бактерия была охарактеризована относительно недавно, в 2007 г., в микробиологической лаборатории France’s University Hospital La Timone.
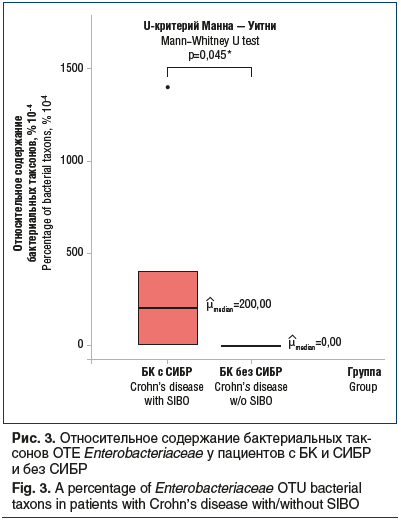
В образцах кала пациентов с БК и СИБР обнаружены ОТЕ Enterobacteriaceae (р=0,045) (рис. 3). Enterobacteriaceae — это семейство грамотрицательных палочек, в которое входят кишечная палочка, эшерихии, гафнии, клебсиеллы, иерсинии, шигеллы и сальмонеллы, протеи, энтеробактер и другие роды бактерий. Семейство Enterobacteriaceae входит в состав Proteobacteria. Недавно опубликованное исследование [36] микробиоты у 447 детей с БК выявило повышение содержания Enterobacteriaceae по сравнению с контрольной группой, в которую был включен 221 ребенок без ВЗК, но с диареей и абдоминальной болью.
ОТЕ Lachnospiracea достоверно реже встречаются у пациентов с БК и СИБР (р=0,045). Lachnospiraceae представляют собой семейство анаэробных спорообразующих бактерий, относящееся к Firmicutes. Эти бактерии являются одними из самых распространенных таксонов кишечной микробиоты человека. Члены этой семьи могут защитить человека от рака толстой кишки путем производства масляной кислоты [37, 38].
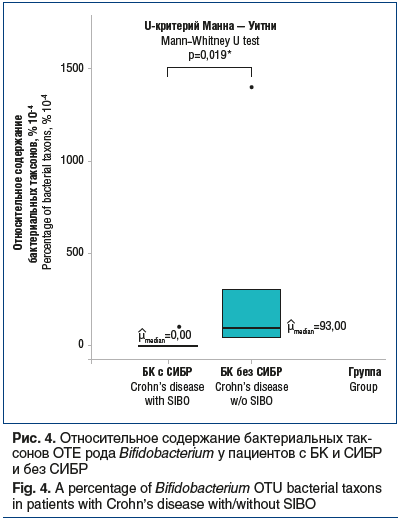
Штаммы Bifidobacterium встречались у пациентов с БК и СИБР значимо реже, чем у пациентов без СИБР (р=0,019) (рис. 4). Все представители рода Bifidobacterium — грамположительные, неподвижные, неспорообразующие, не образующие в процессе жизнедеятельности газы, анаэробные (однако некоторые виды могут быть аэротолерантными), каталазоотрицательные (кроме Bifidobacterium indicum и Bifidobacterium asteroides), сахаролитические микроорганизмы, входящие в состав Actinobacteria.
Заключение
Проведенные ранее исследования демонстрируют значимые изменения метагенома кишечных бактерий. В нашем исследовании был выявлен таксономический сдвиг со снижением содержания Firmicutes и Bifidobacterium и увеличением содержания некоторых представителей Proteobacteria (в частности, рода Klebsiella и ОТЕ Enterobacteriaceae) при наличии СИБР у больных БК. У пациентов с БК с поражением тонкой кишки наличие СИБР ассоциировано с достоверно большей частотой встречаемости бактерий рода Chryseobacterium, рода Klebsiella, ОТЕ Phocaecola, ОТЕ Enterobacteriaceae, достоверно реже встречались порядок Pasteurellales, семейство Peptoniphilaceae, род Solobacterium, род Haemophilus, ОТЕ Lachnospiracea и штаммы Bifidobacterium. Выявленные изменения могут способствовать более персонифицированному подходу к лечению пациентов с БК.
Сведения об авторах:
Кулыгина Юлия Александровна — ассистент кафедры пропедевтики внутренних болезней ФГБОУ ВО НГМУ Минздрава России; 630005, Россия, г. Новосибирск, Красный пр-т, д. 52; ORCID iD 0000-0002-4202-9130.
Осипенко Марина Федоровна — заведующая кафедрой пропедевтики внутренних болезней ФГБОУ ВО НГМУ Минздрава России; 630005, Россия, г. Новосибирск, Красный пр-т, д. 52; ORCID iD 0000-0002-9696-1302.
Аликина Татьяна Юрьевна — младший научный сотрудник ИХБФМ СО РАН; 630090, Россия, г. Новосибирск, ул. Академика Лаврентьева, д. 8; ORCID iD 0000-0003-2289-321X.
Контактная информация: Кулыгина Юлия Александровна, e-mail: yu_blinova@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 27.03.2022.
Поступила после рецензирования 19.04.2022.
Принята в печать 18.05.2022.
About the authors:
Yuliya A. Kulygina — assistant of the Department of the Propaedeutics of Internal Diseases, Novosibirsk State Medical University; 52, Krasnyi av., Novosibirsk, 630091, Russian Federation; ORCID iD 0000-0002-4202-9130.
Marina F. Osipenko — Head of the Department of the Propaedeutics of Internal Diseases, Novosibirsk State Medical University; 52, Krasnyi av., Novosibirsk, 630091, Russian Federation; ORCID iD 0000-0002-9696-1302.
Tatyana Yu. Alikina — junior researcher, Institute of Chemical Biology and Fundamental Medicine of the Siberian Branch of the RAS; 8, Academician Lavrentev str., Novosibirsk, 630090, Russian Federation; ORCID iD 0000-0003-2289-321X.
Contact information: Yuliya A. Kulygina, e-mail: yu_blinova@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 27.03.2022.
Revised 19.04.2022.
Accepted 18.05.2022.
2. Кулыгина Ю.А, Макарова Ю.В., Опре А.Е. и др. Частота синдрома избыточного бактериального роста у больных разных гастроэнтерологических групп. J Siberian Medical Sciences. 2014;3:68. [Kulygina Y.A., Makarova Y.V., Opre A.E. et al. Frequency of bacterial overgrowth syndrome in patients of different gastroenterological groups. J Siberian Medical Sciences. 2014;3:68 (in Russ.)].
3. Осипенко М.Ф., Скалинская М.И., Кулыгина Ю.А. и др. Что мы знаем о синдроме избыточного бактериального роста. Медицинский совет. 2016;9:70–74. [Osipenko M.F., Skalinskaya M.I., Kulygina Y.A. et al. What we know abОТЕ bacterial overgrowth sybdrome. Medical Council. 2016;9:70–74 (in Russ.)].
4. Dixon L.J., Kabi A., Nickerson K.P., McDonald C. Combinatorial effects of diet and genetics on inflammatory bowel disease pathogenesis. Inflamm Bowel Dis. 2015;21:912–922. DOI: 10.1097/MIB.0000000000000289.
5. Фадеева Н.А., Артыкова Г.Б., Филимонов А.Ю. и др. Трудности дифференциальной диагностики воспалительных заболеваний кишечника. Эффективная фармакотерапия. 2022;18(14):58–65. [Fadeeva N.A., Artycova G.B., Filimonova A.Y. et al. Difficulties of differential diagnosis of inflammatory bowel diseases. Effective pharmacotherapy. 2022;18(14):58–65 (in Russ.)].
6. Бикбавова Г.Р., Ливзан М.А., Шмурыгина Е.А. и др. Факторы риска и сопутствующая патология у больных воспалительными заболеваниями кишечника в городе Омске и Омской области. Свидетельство о регистрации базы данных 2021621160, 01.06.2021. Заявка № 2021621008 от 24.05.2021. [Bikbavova G.R., Livzan M.A., Shmuryfina E.A. et al. Risk factors and concomitant pathology in patients with inflammatory bowel diseases in the city of Omsk and the Omsk region. Certificate of registration of the database 2021621160, 01.06.2021. Request № 2021621008, 24.05.2021 (in Russ.)].
7. Turpin W., Goethel A., Bedrani L., Croitoru M.K. Determinants of IBD Heritability: Genes, Bugs, and More. Inflamm Bowel Dis. 2018;24:1133–1148. DOI: 10.1093/ibd/izy085.
8. De Lange K.M., Motesianas L., Lee J.C. et al. Genome-wide association study implicates immune activation of multiple integrin genes in inflammatory bowel disease. Nat Genet. 2017;49:256–261. DOI: 10.1038/ng.3760.
9. Luo Y., de Lange K.M., Jostins L. et al. Exploring the genetic architecture of inflammatory bowel disease by whole-genome sequencing identifies association at ADCY7. Nat Genet. 2017;49:186–192. DOI: 10.1038/ng.3761.
10. Dheer R., Santaolalla R., Davies J.M. et al. Intestinal Epithelial Toll-Like Receptor 4 Signaling Affects Epithelial Function and Colonic Microbiota and Promotes a Risk for Transmissible Colitis. Infect Immun. 2016;84:798–810. DOI: 10.1128/IAI.01374-15.
11. McGovern D.P.B., Jones M.R., Taylor K.D. et al. Fucosyltransferase 2 (FUT2) non-secretor status is associated with Crohn’s disease. Hum Mol Genet. 2010;19:3468–3476. DOI: 10.1093/hmg/ddq248.
12. Lane E.R., Zisman T.L., Suskind D.L. The microbiota in inflammatory bowel disease: Current and therapeutic insights. J Inflamm Res. 2017;10:63–73. DOI: 10.2147/JIR.S116088.
13. Сильвестрова С.Ю., Князев О.В., Беляков Н.И. Особенности микробного метаболизма в толстой кишке у больных язвенным колитом и болезнью Крона. Доказательная гастроэнтерология. 2018;7(1):62. [Selvestrova S.U., Knyazev O.V., Belyakov N.I. Features of microbial metabolism in the colon in patients with ulcerative colitis and Crohn disease. Dokazatelnaya gastroenterologiya. 2018;7(1):62 (in Russ.)].
14. Rosenstiel P., Fantini M., Bräutigam K. et al. TNF-alpha and IFN-gamma regulate the expression of the NOD2 (CARD15) gene in human intestinal epithelial cells. Gastroenterology. 2003;124:1001–1009. DOI: 10.1053/gast.2003.50157.
15. Zanello G., Goethel A., Forster K. et al. Nod2 activates NF-kB in CD4+ T cells but its expression is dispensable for T cell-induced colitis. PLoS ONE. 2013;82623. DOI: 10.1371/journal.pone.0082623.
16. Philpott D.J., Sorbara M.T., Robertson S.J. et al. NOD proteins: Regulators of inflammation in health and disease. Nat Rev Immunol. 2014;14:9–23. DOI: 10.1038/nri3565.
17. Haberman Y. Ulcerative colitis mucosal transcriptomes reveal mitochondriopathy and personalized mechanisms underlying disease severity and treatment response. Nat Commun. 2019;10:38. DOI: 10.1038/s41467-018-07841-3.
18. Pimente M. ACG Clinical Guideline: Small Intestinal Bacterial Overgrowth. Am J Gastroenterol. 2020;2:165–178. DOI: 10.14309/ajg.0000000000000501.
19. Rutgeerts P., Ghoos Y., Vantrappen G., Eyssen H. Ileal dysfunction and bacterial overgrowth in patients with Crohn’s disease. Eur J Clin Invest. 1981;11(3):199–206. DOI: 10.1111/j.1365-2362.1981.tb01841.x. DOI: 10.1111/j.1365-2362.1981.tb01841.x.
20. Sánchez-Montes C., Ortiz V., Bastida G. et al. Small intestinal bacterial overgrowth in inactive Crohn’s disease: influence of thiopurine and biological treatment. World J Gastroenterol. 2014;20(38):3999–4003. DOI: 10.3748/wjg.v20.i38.13999.
21. Bertges E.R., Fonseca J.M., Chebli. Prevalence and factors associated with small intestinal bacterial overgrowth in patients with Сrohn’s disease: a retrospective study at a referral center. Arq Gastroenterol. 2020;57(3):283–288. DOI: 10.1590/s0004-2803.202000000-64.
22. Jochen K., Ulrike S., Guido A. et al. Small intestinal bacterial overgrowth mimicking acute flare as a pitfall in patients with Crohn’s Disease. BMC Gastroenterol. 2009;9:61. DOI: 10.1186/1471-230X-9-61. DOI: 10.1186/1471-230X-9-61.
23. Takakura W., Pimentel M. Small Intestinal Bacterial Overgrowth and Irritable Bowel Syndrome — An Update. Front Psychiatry. 2020;11:664. DOI: 10.3389/fpsyt.2020.00664.
24. Frank D.N., St Amand A.L., Feldman R.A. et al. Molecular-phylogenetic characterization of microbial community imbalances in human inflammatory bowel diseases. Proc Nat Acad Sci USA. 2007;104:13780–13785. DOI: 10.1073/pnas.0706625104.
25. Joossens M., Huys G., Cnockaert M. et al. Dysbiosis of the faecal microbiota in patients with Crohn’s disease and their unaffected relatives. Gut. 2011;60:631–637. DOI: 10.1136/gut.2010.223263.
26. Lupp C., Robertson M.L., Wickham M.E. et al. Host-mediated inflammation disrupts the intestinal microbiota and promotes the overgrowth of Enterobacteriaceae. Cell Host Microbe. 2007;2:119–129. DOI: 10.1016/j.chom.2007.06.010.
27. Mukerji R., Kakarala R., Smith S.J., Kusz H.G. Chryseobacterium indologenes: an emerging infection in the USA. BMJ Case Rep. 2016;2016:22–25. DOI: 10.1136/bcr-2016-214486.
28. Afshar M., Nobakht E., Lew S.Q. Chryseobacterium indologenes peritonitis in peritoneal dialysis. BMJ Case Rep. 2013;2013:98–100. DOI: 10.1136/bcr-2013-009410.
29. Höring E., Göpfert D., Schröter G., von Gaisberg U. Frequency and spectrum of microorganisms isolated from biopsy specimens in chronic colitis. Endoscopy. 1991;23(6):325–327. DOI: 10.1055/s-2007-1010707.
30. Plessier A., Cosnes J., Gendre J.P., Beaugerie L. Intercurrent Klebsiella oxytoca colitis in a patient with Crohn’s disease. Gastroenterologie Clinique et Biologique. 2002;26(8–9):799–800.
31. Ibbotson J.P., Pease P.E., Allan R.A. Serological studies in Crohn’s disease. Europ J Clin Microbiol. 1987;6(3):286–290. DOI: 10.1007/BF02017614.
32. Rashid T., Wilson C., Ebringer A. The link between ankylosing spondylitis, Crohn’s disease, Klebsiella, and starch consumption. Clin Dev Immunol. 2013;3:1–9. DOI: 10.1155/2013/872632.
33. Tiwana H., Natt R.S., Benitez-Brito R. et al. Correlation between the immune responses to collagens type I, III, IV and V and Klebsiella pneumoniae in patients with Crohn’s disease and ankylosing spondylitis. Rheumatology. 2001;40(1):15–23. DOI: 10.1093/rheumatology/40.1.15.
34. Карпеева Ю.С., Новикова В.П., Хавкин А.И. и др. Микробиота и болезни человека: возможности диетической коррекции. Российский вестник перинатологии и педиатрии. 2020;65:(5):116–125. [Karpeeva Yu.S., Novikova V.P., Khavkin A.I., et al. Microbiota and human diseases: possibilities of dietary correction. Russian Bulletin of Perinatology and Pediatrics. 2020;65:(5):116–125 (in Russ.)].
35. Roux V., Robert C., Raoult D. Non-contiguous finished genome sequence of Phocaeicola abscessus type strain 7401987(T). Stand Genomic Sci. 2013;9(2):351–358. DOI: 10.4056/sigs.4428244.
36. Gevers D., Kugathasan S., Denson L.A. et al. The treatment-naive microbiome in new-onset Crohn’s disease. Cell Host Microbe. 2014;15(3):382–392. DOI: 10.1016/j.chom.2014.02.005.
37. Meehan C.J., Beiko R.G. A phylogenomic view of ecological specialization in the Lachnospiraceae, a family of digestive tract-associated bacteria Genome Biol Evol. 2014;6(3):703–713. DOI: 10.1093/gbe/evu050.
38. Ai D., Pan H., Li X. et al. Identifying Gut Microbiota Associated With Colorectal Cancer Using a Zero-Inflated Lognormal Model. Front Microbiol. 2019;10:826. DOI: 10.3389/fmicb.2019.00826.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.

