Метагеном и заболевания желудка: взаимосвязь и взаимовлияние
Рубрика:
Гастроэнтерология
С появлением современных молекулярно-генетических методов исследования удалось установить, что существуют микроорганизмы, приспособленные не только к выживанию в кислой среде желудка, но и колонизирующие именно этот отдел пищеварительного тракта. Микробиота желудка разнообразна: в нескольких современных исследованиях идентифицировано более 200 бактериальных филотипов. Наибольшего внимания заслуживает Helicobacter pylori (HP), поскольку во многих исследованиях выявлена взаимосвязь между наличием НР и развитием патологических процессов в желудке. Так, длительная HP-инфекция приводит к развитию атрофии слизистой оболочки желудка, что сопровождается снижением секреторной функции и повышением рН. Это способствует колонизации желудка различными микробами. Аммиак и бикарбонаты, образующиеся в результате гидролиза мочевины уреазой HP, могут быть использованы как субстраты другими микроорганизмами. Наконец, колонизация HP может нарушать моторику желудка, влияя таким образом на клиренс адгезированных к эпителию желудка бактерий.
Стратегия традиционной эрадикационной терапии нацелена на устранение НР, и это сопровождается дальнейшим нарушением микроэкологии желудка в целом. Применение концепции пробиотической терапии, особенно монотерапии, предполагает длительную и постепенную коррекцию микробиоты желудка. Главные итоги такого подхода — прерывание прогрессирования патологического каскада и восстановление слизистой оболочки желудка.
Ключевые слова: желудок, Helicobacter pylori, эрадикация, микробиота, метагеном, пробиотик.
Стратегия традиционной эрадикационной терапии нацелена на устранение НР, и это сопровождается дальнейшим нарушением микроэкологии желудка в целом. Применение концепции пробиотической терапии, особенно монотерапии, предполагает длительную и постепенную коррекцию микробиоты желудка. Главные итоги такого подхода — прерывание прогрессирования патологического каскада и восстановление слизистой оболочки желудка.
Ключевые слова: желудок, Helicobacter pylori, эрадикация, микробиота, метагеном, пробиотик.
E.A. Kornienko1, N.I. Parolova1, S.V. Ivanov2, M.M. Zakharchenko3, D.S. Polev4, P.A. Zykin4, Yu.D. Kondratenko4
1 St. Petersburg State Pediatric Medical University
2 Pavlov First St. Petersburg State Medical University
3 LLC “Kraft”, Saint Petersburg
4 St. Petersburg State University
With the advent of modern molecular genetic research methods, it was possible to establish that there are microorganisms that are adapted not only to the survival in the acidic environment of the stomach but also to colonize precisely this part of the digestive tract. A gastric microbiota is diverse: more than 200 bacterial phylotypes have been identified in several modern studies. Helicobacter pylori (HP) is worth of the most attention since many studies have found a correlation between the HP presence and the development of pathological processes in the stomach. Thus, prolonged HP infection leads to the development of the gastric mucosal atrophy, which is accompanied by a decrease in secretory function and an increase in pH. This contributes to the colonization of the stomach with various microbes. Ammonia and bicarbonates, formed as a result of the hydrolysis of urea by HP urease, can be used as substrates by other microorganisms. Finally, HP colonization can disrupt gastric motility, thus affecting the clearance of bacteria adhering to the gastric epithelium.
The strategy of traditional eradication therapy is aimed at eliminating HP, and this is accompanied by a further microecology disorder of the stomach as a whole. A concept of probiotic therapy, especially monotherapy, is aimed at the long-term and gradual correction of the gastric microbiota. The main result of this approach is an interruption of the progression of the pathological cascade and a restoration of the gastric mucosa.
Key words: stomach, Helicobacter pylori, eradication, microbiota, metagenome, probiotic.
For citation: Kornienko E.A., Parolova N.I., Ivanov S.V. et al. Gastric metagenome and diseases: interaction and mutual influence // RMJ. Medical Review. 2018. № 11. P. 37–44.
Статья посвящена вопросам взаимосвязи метагенома и заболеваний желудка.
Микробиота желудка
Желудок долгое время считался почти стерильным органом благодаря продукции соляной кислоты. Однако открытие Helicobacter pylori (HP) показало, что существуют микроорганизмы, не только приспособленные к выживанию в кислой среде, но и колонизирующие именно этот отдел пищеварительного тракта.Появление современных молекулярно-генетических методов исследования, основанных на амплификации бактериальных генов 16S рибосомальной РНК (рРНК), позволило получить более полную информацию о представителях микробного сообщества желудка. Оказалось, что микробиота желудка значительно более разнообразна, чем представлялось ранее: в нескольких современных исследованиях идентифицировано более 200 бактериальных филотипов. Несмотря на агрессивные условия среды, в желудке обнаружены представители тех же типов, которые доминируют и в других отделах желудочно-кишечного тракта (ЖКТ). Е.М. Bik et al. [1] впервые исследовали 16S-рДНК последовательности в биоптатах слизистой оболочки желудка 23 взрослых пациентов, направленных на эндоскопию. Они установили, что среди представителей желудочного бактериального сообщества доминируют 5 основных типов микробов: Proteobacteria; Firmicutes; Bacteroidetes; Actinobacteria и Fusobacteria. Остальные желудочные 16S-рДНК последовательности могут быть отнесены к Deferribacteres и Deinococcus. Из 128 филотипов, выявленных в этом исследовании, 64 (50%) относились к ранее не культивируемым бактериям. Из них 43 (67%) были ранее обнаружены в ротовой полости людей, что подтверждает вероятность формирования микробиома желудка не как абсолютно изолированного сообщества, а как физиологически связанного с соседними органами и пополняемого при попадании содержимого, в основном из вышележащих отделов. Среди не культивировавшихся ранее микробов в желудке были выявлены Caulobacter, Actinobacillus, Corynebacterium, Rothia, Gemella, Leptotrichia, Porphyromonas, Capnocytophaga, TM7, Flexistipes, Deinococcus [2].
HP в данном исследовании был единственным из рода Helicobacter и представлял собой наиболее многочисленный вид. Он был обнаружен у 19 из 23 пациентов и составлял 42% всей совокупности 16S-рДНК последовательностей. Следующими по частоте после Helicobacter родами бактерий в желудочном микробиоме были Streptococcus (299 клонов) и Prevotella (139 клонов) [2].
Максимальное богатство видов бактерий в желудочном микробиоме было обнаружено у пациентов (138,8±66,3), у которых не был выявлен H. pylori (HP(-)), у них же был выше индекс разнообразия микробов (индекс Shannon) — 3,1. У больных, имевших H. pylori (HP(+)), отмечено уменьшение видового богатства (81,2±15,1) и индекса Shannon (1,6). HP(+) больные демонстрировали значительное уменьшение численности всех микробных типов, кроме Proteobacteria, особенно снижена была численность Bacteroidetes. Сравнение состава микробиоты антрального отдела и тела желудка у обследованных пациентов не выявило достоверных отличий [2].
Исследования на животных показали, что колонизация желудка HP, особенно длительная, влияет на состав желудочного микробиома в целом. У HP(-) особей, в отличие от HP(+), в желудке обитает большое количество Eubacterium cylindroides и различных видов Prevotella, но отмечено относительно небольшое количество Bifidobacterium, Clostridium leptum и Clostridium coccoides [3]. У не инфицированных HP людей количество Proteobacteria было небольшим, но присутствовало значительно больше видов Prevotella и Streptococcus, чем у инфицированных [4]. У HP(+) пациентов было отмечено доминирующее представительство классов Proteobacteria, Spirochetes, Actinobacteria.
Подобные микробиологические изменения могут объясняться несколькими причинами. Длительная HP-инфекция приводит к развитию атрофии слизистой оболочки желудка, что сопровождается снижением секреторной функции и повышением рН. Это способствует колонизации желудка различными микробами. В дополнение аммиак и бикарбонаты, образующиеся в результате гидролиза мочевины уреазой HP, могут быть использованы как субстраты другими микроорганизмами. Наконец, колонизация HP может нарушать моторику желудка, влияя таким образом на клиренс адгезированных к эпителию желудка бактерий. В процессе прогрессирования хронического гастрита и развития выраженной атрофии снижается секреция, и локальные условия обитания НР настолько меняются, что могут уже не соответствовать его потребностям. Поэтому степень обсемененности НР может снижаться, но создаются благоприятные условия для менее устойчивых к кислоте и неконкурентоспособных видов бактерий. То есть НР создает условия и определенные ниши, которые в процессе прогрессирования атрофии заполняются другими микробами. Однако на ранних этапах развития хронического гастрита окружающая НР микробиота не претерпевает значительных изменений. В недавнем исследовании Khosravi et al. [5] подтвердили это, сравнив большие группы НР(+) (131 человек) и НР(-) (84 человека) пациентов. Вероятно, не само присутствие НР, а инициированные им изменения, такие как поддержание воспаления, наличие атрофии и кишечной метаплазии, их протяженность и локализация, а также длительность инфекции являются определяющими для изменения состава желудочного микробиома в целом [2].
В процессе прогрессирования хронического гастрита на фоне атрофии и снижения желудочной секреции микробная колонизация желудка усиливается, это коррелирует с увеличением продукции нитритов в желудке [6] благодаря нарастанию числа нитрат-редуцирующих бактерий. Haemophilus и Veillonella редуцируют нитраты быстрее, чем нитриты, поэтому именно они могут быть ответственны за накопление нитритов в желудке. Как известно, эндогенные N-нитрозосоединения в значительной степени ассоциированы с развитием рака желудка [7]. Окисляющие аммоний бактерии, обладающие аммоний-монооксидазой и гидроксиламин-оксидоредуктазой, катализируют образование нитритов из аммония в присутствии кислорода [8]. Эти бактерии в основном относятся к представителям класса Planctomycetes [9]. Логично было бы предположить, что не только НР, но и другая микробиота желудка может играть определенную роль в канцерогенезе. Исследования на животных и людях показали, что колонизация желудка бактериями, естественной средой обитания которых являются нижние отделы ЖКТ, усугубляет последствия НР-инфекции и риск развития рака желудка [2, 10].
Мыши одной и той же генетической модели C57BL/6N, но выращенные в разных лабораториях в различных условиях, а затем инфицированные одним и тем же штаммом НР, в итоге имели разную степень выраженности воспаления, атрофии и кишечной метаплазии слизистой оболочки желудка. Исследование нехеликобактерной микробиоты желудка этих двух групп показало существенные ее отличия, особенно в количестве лактобацилл [11], что подтверждает адъювантную роль сопутствующей микробиоты в развитии НР-ассоциированной патологии желудка.
В другом исследовании безмикробные трансгенные INS-GAS мыши, предрасположенные к развитию рака желудка вследствие гиперпродукции гастрина, были разделены на 2 группы: одна инфицирована НР, оставаясь в стерильных условиях, другая — в сочетании с колонизацией обычной кишечной микробиотой. Интраэпителиальная неоплазия развивалась значительно быстрее у мышей из второй группы [12]. Искусственная колонизация желудка кишечной микробиотой, включавшей виды Clostridium, Lactobacillus murinus и Bacteroidetes, повысила частоту развития неоплазий желудка у генетически предрасположенных мышей, и через 7 мес. после заражения НР неоплазия развилась практически у всех особей. У стерильных мышей после инфицирования НР опухоли развивались медленнее и значительно реже [2, 13].
Перекрестное исследование, включавшее 720 здоровых взрослых добровольцев в Китае, подтвердило предположение, что снижение микробного разнообразия может предрасполагать к развитию рака желудка. Этот вывод был сделан на основании оценки взаимосвязи микробного многообразия и соотношения пепсиноген I / пепсиноген II. Чем меньше было представлено видов, тем ниже соотношение пепсиногенов, что коррелирует с вероятностью атрофии слизистой оболочки тела желудка — предрасполагающего к развитию рака желудка состояния [14].
Недавно был прослежен постепенный сдвиг в профиле микробиоты желудка от неатрофического гастрита к кишечной метаплазии и затем кишечному типу рака желудка [15]. Было обнаружено различие в количестве, составе и разнообразии микробиоты желудка при этих трех состояниях, особенно при наличии НР. У больных раком желудка была значительно снижена представленность класса Epsilonproteobacteria и семейства Helicobacteriaceae, а численность Streptococcaceae, напротив, повышена. Плотность колонизации и разнообразие микробиоты у больных раком желудка возрастали. По мере прогрессирования от неатрофического гастрита через атрофию и кишечную метаплазию к раку отмечены снижение численности видов Porphyromonas, Neisseria, Bulleidia, Prevotella pallens, Streptococcus sinensis и Bergeriella denitrificans, повышение — Lactobacillus coleohominis и Lachnospiraceae [2].
В исследовании Yang et al. [16] проведено сравнение микробиоты желудка у двух генетически различных популяций людей в Колумбии, проживающих в городах Тукеррес и Тумако. У первых частота рака желудка была в 25 раз выше, чем у вторых, несмотря на одинаковую распространенность инфекции НР. Оказалось, что состав нехеликобактерной микробиоты желудка у них отличался: у жителей Тукерреса было обнаружено повышение численности Leptospira и Veillonella spp., а у людей из Тумако преобладали Staphylococcus spp.
Таким образом, НР и нехеликобактерная микробиота желудка в совокупности играют важную роль в процессе канцерогенеза. По мере прогрессирования морфологических изменений в желудке меняется и микробиологический состав его обитателей, что может ускорить реализацию предраковых изменений и канцерогенез.
С учетом этих данных можно предположить, что изменение микроэкологического окружения НР может повлиять на активность хронического гастрита, инициированного им, прогрессирование атрофии и риск развития рака желудка. Достичь изменений микробиоты желудка в целом возможно с помощью пробиотиков.
Собственное исследование
Целью нашего исследования стало изучение состава микробиоты желудка у НР-инфицированных детей в сравнении с неинфицированными, ранее не получавшими лечения.Материал и методы исследования
Исследование проводилось в гастроэнтерологическом отделении СПб ГБУЗ «ДГКБ № 5 им. Н.Ф. Филатова» в 2015–2017 гг. у 16 детей в возрасте от 9 до 17 лет, направленных на эндоскопическое исследование в связи с симптомами диспепсии (рецидивирующие боли и дискомфорт в верхних отделах живота). После проведения верхней эндоскопии у 8 НР(+) больных, ранее не получавших антибиотики и пробиотики, были взяты биоптаты слизистой оболочки желудка для оценки состава микробиоты методом секвенирования. Для сравнения состава микробиоты желудка при отсутствии НР в исследование включены также 8 детей, у которых после проведения верхней эндоскопии и уточнения НР-статуса не выявлен НР.Для изучения состава микробиоты желудка у НР(+) детей в сравнении с неинфицированными до начала терапии мы провели определение бактериального метагенома биоптатов слизистой оболочки желудка. У 16 детей (8 НР(+) и 8 НР(-)) во время проведения эндоскопии дополнительно были взяты по 1 биоптату из антрального отдела желудка, у 2 детей — еще и из тела желудка для изучения их бактериального состава методом секвенирования фрагмента гена 16S рРНК с парой олигонуклеотидных праймеров, специфичных для консервативных участков на секвенаторе Life Technologies Ion Torrent с использованием чипа 318v2. Исследование было выполнено в Ресурсном центре Санкт-Петербургского государственного университета.
Результаты исследования
Результаты анализа таксономических групп микробов в метагеноме желудка НР(+) детей
Анализ показал неоднородность таксономического состава микробиоты желудка у обследованных детей, что представлено на рисунке 1.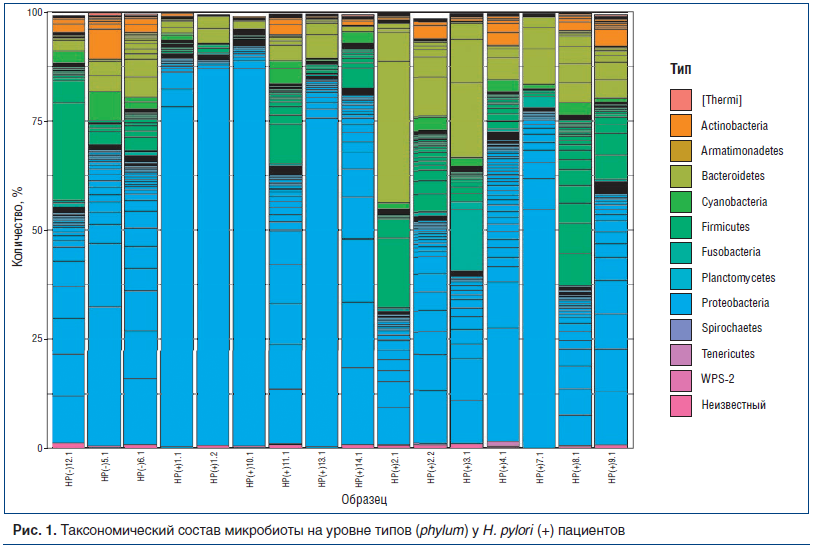
Доминирующими типами (phylum) бактерий в желудке детей с хроническим гастритом были Proteobacteria, Bacteroidetes, Firmicutes, в меньшей степени были представлены Actinobacteria, Cyanobacteria, Fusobacteria. У всех детей, независимо от наличия НР, превалировали представители Proteobacteria. Однако у НР(+) больных он составлял в среднем 64,1% всего микробиома, а среди Proteobacteria достигал 75–99%, количество клонов других бактерий при этом значительно сокращалось, а видовое разнообразие уменьшалось.
У 5 из 8 НР(+) пациентов НР существенно доминировал как среди всех микробов, так и среди Proteobacteria. Как представлено на рисунке 2, образцы 1.1, 1.2, 10.1, 13.1 и 7.1 отличаются высокой долей класса Epsilonproteobacteria. На уровне порядков у этих образцов сохраняется сдвиг в сторону Campylobacterales, на уровне семейств — Helicobacteraceae, на уровне родов — Helicobacter. Микробный состав слизистой оболочки желудка одного из таких пациентов представлен на рисунке 3, заметно доминирование в микробиоме НР (образец 10.1).
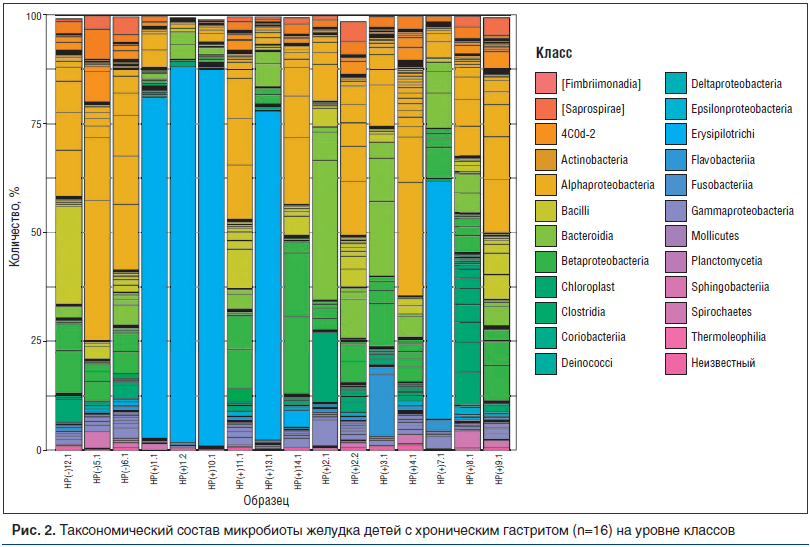
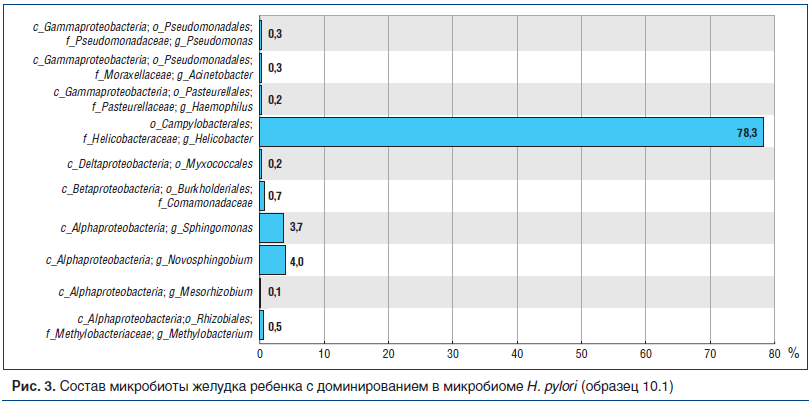
Следует отметить, что эндоскопически у всех 5 пациентов с доминированием НР отмечалась выраженная нодулярность (nodularity) в антральном отделе желудка, а по данным гистологического обследования — высокая степень обсемененности НР (более 50 микробных тел в поле зрения). У этих больных отмечена высокая активность воспаления, у всех — выраженная лимфоидная гиперплазия, у 3 из 5 — признаки очаговой атрофии в антральном отделе желудка.
У 3 НР(+) больных, по данным секвенирования, НР не был доминирующим микробом, представительство других микробов было более разнообразным, в т. ч. внутри группы Proteobacteria. Эндоскопически и гистологически признаки воспаления в желудке были незначительными, гистологически отмечалась низкая степень обсемененности НР (менее 20 микробных тел в поле зрения) с преобладанием кокковых форм в ямках. Микробный состав слизистой оболочки желудка одного из таких пациентов представлен на рисунке 4 (образец 14.1).
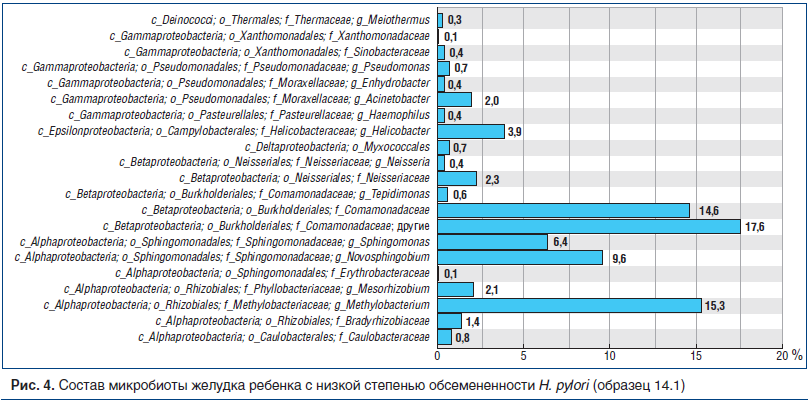
Результаты анализа таксономических групп микробов в метагеноме желудка НР(-) детей
В эндоскопической картине 8 НР(-) пациентов доминировал поверхностный гастрит, гистологически хроническое воспаление имело умеренную или низкую активность.Микробиологический состав биоптатов желудка HР(-) больных несущественно отличался от биоптатов HР(+) больных с минимальной степенью обсемененности HР, но значительно отличался от биоптатов больных с высокой степенью обсемененности HР. Это особенно очевидно при анализе состава микробиоты на уровне порядков (рис. 5).
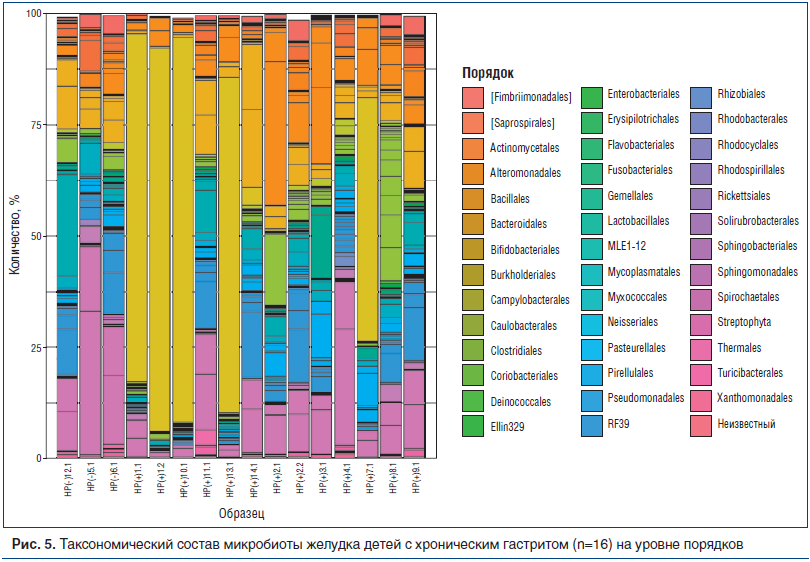
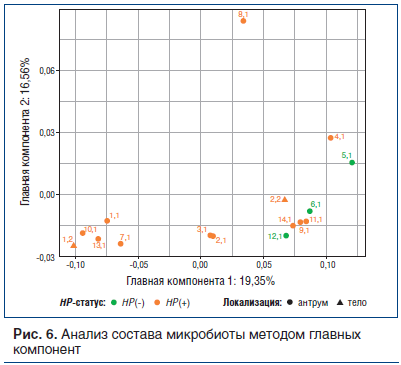
Кластерный анализ, представленный на рисунке 6, демонстрирует, что состав микробиоты НР(+) пациентов образует два кластера: один — отдельный (больные с доминированием НР), другой — близкий к НР(-) пациентам — пациенты со слабой степенью обсемененности НР. Можно предположить, что дети со слабой степенью обсемененности имеют меньшую продолжительность НР-инфекции, поэтому окружающий микробиом еще не успел претерпеть существенные изменения, а морфологические признаки хронического гастрита пока минимальны.
Взаимосвязь состава микробиоты и выраженности морфологических изменений слизистой оболочки желудка
Наше исследование состава микробиоты желудка у детей с хроническим гастритом подтвердило существующие данные, полученные у взрослых, о том, что инфицирование НР меняет весь микробиологический состав желудка в целом. Эти изменения нарастают по мере увеличения длительности заболевания и коррелируют с выраженностью морфологических изменений слизистой оболочки желудка — воспалением и атрофией. У НР(+) детей, подобно взрослым [1], нами выявлены снижение видового разнообразия бактерий желудка, доминирование Proteobacteriae. Известно, что и НР, и другие представители Proteobacteriae обладают значительной провоспалительной активностью, усиливают процессы пролиферации и апоптоза. Поэтому у больных с высокой степенью обсемененности НР отмечены большая степень подавления другой микробиоты желудка и более выраженные воспалительные изменения слизистой оболочки, в ряде случаев — начальные признаки атрофии. У детей с незначительной степенью обсемененности НР окружающая микробиота желудка была более сохранна и разнообразна (возможно, в результате недавнего инфицирования НР), приближаясь по составу к показа-телям НР(-) детей. Как результат, у этих пациентов и воспалительные изменения слизистой оболочки желудка были менее выраженными. То есть микробиологический состав слизистой оболочки желудка как комплексная экологическая система регулирует процесс воспаления, регенерации эпителия и создает условия для развития и прогрессирования патологии либо, напротив, предотвращает ее.
Если стратегия традиционной эрадикационной терапии с применением двух антибиотиков нацелена на устранение НР, но при этом сопровождается дальнейшим нарушением микроэкологии желудка в целом, то концепция пробиотической терапии, особенно монотерапии, направлена на длительную и постепенную коррекцию микробиоты желудка. Главным итогом такого подхода становится не столько устранение НР как такового, хотя и эта задача достижима при условии длительного назначения эффективного пробиотика, сколько прерывание прогрессирования патологического каскада и восстановление слизистой оболочки желудка. Эта стратегия, по нашему мнению, особенно приемлема в детском возрасте, поскольку на ранних стадиях хронического гастрита она дает возможность полного гистологического восстановления слизистой оболочки и обеспечивает благоприятный длительный прогноз, что особенно важно для профилактики более тяжелой патологии: язвенной болезни и рака желудка.
Заключение
Дальнейшие исследования могут быть направлены на поиск более эффективных штаммов и микробных метаболитов, оценку более длительного и регулярного приема пробиотических продуктов, что в конечном итоге может принципиально поменять концепцию антихеликобактерной терапии и снизить риск развития более тяжелых форм НР-ассоциированной патологии.
Литература
1. Bik E.M., Eckburg P.B., Gill S.R. et al. Molecular analysis of the bacterial microbiota in the human stomach // Proc Natl Acad Sci USA. 2006. Vol. 103. P. 732–737.
2. Корниенко Е.А., Паролова Н.И. Микробиота желудка и возможности пробиотиков в эрадикации H. pylori // Фарматека. 2017. № 13(346). С. 22–29 [Korniyenko Ye.A., Parolova N.I. Mikrobiota zheludka i vozmozhnosti probiotikov v eradikatsii H. pylori // Farmateka. 2017. № 13(346). S. 22–29 (in Russian)].
3. Osaki T., Matsuki T., Asahara T. et al. Comparative analysis of gastric bacterial microbiota in Mongolian gerbils after long-term infection with Helicobacter pylori // Microb Pathog. 2012. Vol. 53. P. 12–18.
4. Maldonado-Contreras A., Goldfarb K.C., Godoy-Vitorino F. et al. Structure of the human gastric bacterial community in relation to Helicobacter pylori status // ISME J. 2011. Vol. 5. P. 574–579.
5. Khosravi Y., Dieye Y., Poh B.H. et al. Culturable bacterial microbiota of the stomach of Helicobacter pylori positive and negative gastric disease patients // Scientific World Journal. 2014. Vol. 2014. P. 610421. DOI: 10.1155/2014/610421.
6. Sharma B.K., Santana I.A., Wood E.C. et al. Intragastric bacterial activity and nitrosation before, during, and after treatment with omeprazole // Br Med J (Clin Res Ed). 1984. Vol. 289. P. 717–719.
7. Jakszyn P., Bingham S., Pera G. et al. Endogenous versus exogenous exposure to N-nitroso compounds and gastric can-cer risk in the European Prospective Investigation into Cancer and Nutrition (EPIC-EURGAST) study // Carcinogenesis. 2006. Vol. 27. P. 1497–1501.
8. Schreiber F., Wunderlin P., Udert K.M., Wells G.F. Nitric oxide and nitrous oxide turnover in natural and engineered micro-bial communities: biological pathways, chemical reactions, and novel technologies // Front Microbiol. 2012. Vol. 3. P. 372. DOI: 10.3389/fmicb.2012.00372.
9. Junier P., Molina V., Dorador C. et al. Phylogenetic and functional marker genes to study ammonia-oxidizing microorganisms (AOM) in the environment // Appl Microbiol Biotechnol. 2010. Vol. 85. P. 425–440.
10. Martin M., Solnick J.V. The gastric microbial community, Helicobacter pylori colonization and disease // Gut Microbe. 2014. Vol. 5. P. 345–350.
11. Rolig A.S., Cech C., Ahler E. et al. The degree of Helicobacter pylori-triggered inflammation is manipu-lated by preinfection host microbiota // Infect Immun. 2013. Vol. 81. P. 1382–1389.
12. Lofgren J.L., Whary M.T., Ge Z. et al. Lack of commensal flora in Helicobacter pylori-infected INS-GAS mice reduces gastritis and delays intraepithelial neoplasia // Gastroenterology. 2011. Vol. 140. P. 210–220.
13. Lee C.W., Rickman B., Rogers A.B. et al. Combination of sulindac and antimicrobial eradication of Helicobacter pylori prevents progression of gastric cancer in hypergastrinemic INS-GAS mice // Cancer Res. 2009. Vol. 69. P. 8166–8174.
14. Yu G., Gail M.H., Shi J. et al. Association between upper digestive tract microbiota and cancer-predisposing states in the esophagus and stom-ach // Cancer Epidemiol Biomarkers Prev. 2014. Vol. 23(5). P. 735–741.
15. Dicksved J., Lindberg M., Rosenquist M. et al. Molecular characterization of the stomach microbiota in patients with gastric cancer and in controls // J Med Microbiol. 2009. Vol. 58(Pt 4). P. 509–516.
16. Aviles-Jimenez F., Vazquez-Jimenez F., Medrano-Guzman R. et al. Stomach microbiota composition varies between patients with non-atrophic gastritis and patients with intestinal type of gastric cancer // Sci Rep. 2014. Vol. 4. P. 4202.
17. Yang I., Woltemate S., Piazuelo M.B. et al. Different gastric microbiota compositions in two human populations with high and low gastric cancer risk in Colombia // Sci. Rep. 2016. Vol. 6. P.18594.
2. Корниенко Е.А., Паролова Н.И. Микробиота желудка и возможности пробиотиков в эрадикации H. pylori // Фарматека. 2017. № 13(346). С. 22–29 [Korniyenko Ye.A., Parolova N.I. Mikrobiota zheludka i vozmozhnosti probiotikov v eradikatsii H. pylori // Farmateka. 2017. № 13(346). S. 22–29 (in Russian)].
3. Osaki T., Matsuki T., Asahara T. et al. Comparative analysis of gastric bacterial microbiota in Mongolian gerbils after long-term infection with Helicobacter pylori // Microb Pathog. 2012. Vol. 53. P. 12–18.
4. Maldonado-Contreras A., Goldfarb K.C., Godoy-Vitorino F. et al. Structure of the human gastric bacterial community in relation to Helicobacter pylori status // ISME J. 2011. Vol. 5. P. 574–579.
5. Khosravi Y., Dieye Y., Poh B.H. et al. Culturable bacterial microbiota of the stomach of Helicobacter pylori positive and negative gastric disease patients // Scientific World Journal. 2014. Vol. 2014. P. 610421. DOI: 10.1155/2014/610421.
6. Sharma B.K., Santana I.A., Wood E.C. et al. Intragastric bacterial activity and nitrosation before, during, and after treatment with omeprazole // Br Med J (Clin Res Ed). 1984. Vol. 289. P. 717–719.
7. Jakszyn P., Bingham S., Pera G. et al. Endogenous versus exogenous exposure to N-nitroso compounds and gastric can-cer risk in the European Prospective Investigation into Cancer and Nutrition (EPIC-EURGAST) study // Carcinogenesis. 2006. Vol. 27. P. 1497–1501.
8. Schreiber F., Wunderlin P., Udert K.M., Wells G.F. Nitric oxide and nitrous oxide turnover in natural and engineered micro-bial communities: biological pathways, chemical reactions, and novel technologies // Front Microbiol. 2012. Vol. 3. P. 372. DOI: 10.3389/fmicb.2012.00372.
9. Junier P., Molina V., Dorador C. et al. Phylogenetic and functional marker genes to study ammonia-oxidizing microorganisms (AOM) in the environment // Appl Microbiol Biotechnol. 2010. Vol. 85. P. 425–440.
10. Martin M., Solnick J.V. The gastric microbial community, Helicobacter pylori colonization and disease // Gut Microbe. 2014. Vol. 5. P. 345–350.
11. Rolig A.S., Cech C., Ahler E. et al. The degree of Helicobacter pylori-triggered inflammation is manipu-lated by preinfection host microbiota // Infect Immun. 2013. Vol. 81. P. 1382–1389.
12. Lofgren J.L., Whary M.T., Ge Z. et al. Lack of commensal flora in Helicobacter pylori-infected INS-GAS mice reduces gastritis and delays intraepithelial neoplasia // Gastroenterology. 2011. Vol. 140. P. 210–220.
13. Lee C.W., Rickman B., Rogers A.B. et al. Combination of sulindac and antimicrobial eradication of Helicobacter pylori prevents progression of gastric cancer in hypergastrinemic INS-GAS mice // Cancer Res. 2009. Vol. 69. P. 8166–8174.
14. Yu G., Gail M.H., Shi J. et al. Association between upper digestive tract microbiota and cancer-predisposing states in the esophagus and stom-ach // Cancer Epidemiol Biomarkers Prev. 2014. Vol. 23(5). P. 735–741.
15. Dicksved J., Lindberg M., Rosenquist M. et al. Molecular characterization of the stomach microbiota in patients with gastric cancer and in controls // J Med Microbiol. 2009. Vol. 58(Pt 4). P. 509–516.
16. Aviles-Jimenez F., Vazquez-Jimenez F., Medrano-Guzman R. et al. Stomach microbiota composition varies between patients with non-atrophic gastritis and patients with intestinal type of gastric cancer // Sci Rep. 2014. Vol. 4. P. 4202.
17. Yang I., Woltemate S., Piazuelo M.B. et al. Different gastric microbiota compositions in two human populations with high and low gastric cancer risk in Colombia // Sci. Rep. 2016. Vol. 6. P.18594.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
