Лекарственные повреждения печени
Рубрика:
Гастроэнтерология
Лекарственные повреждения печени (ЛПП) являются одним из наиболее сложных острых или хронических заболеваний данного органа, с которыми встречаются врачи в своей практике. Многие исследователи к ЛПП относят повреждения печени, вызванные прямым или опосредованным воздействием лекарственных препаратов или их метаболитов на печень. ЛПП составляют более 10% всех побочных реакций организма, связанных с применением лекарств. Особого внимания заслуживают случаи ЛПП, ассоциированные с приемом различных биологически активных добавок (БАД) и препаратов народной медицины. Важно помнить о потенциальной гепатотоксичности этих средств. Даже в развитых странах разработка БАД не контролируется так же строго, как процесс поступления на рынок фармацевтических препаратов. В частности, для их регистрации не нужны доклинические токсикологические испытания и клинические испытания безопасности и эффективности. В качестве гепатопротекторной терапии 1-й линии при ЛПП препаратом выбора можно считать адеметионина 1,4-бутандисульфонат (Гептор). В статье рассматриваются эпидемиология, классификация, алгоритмы диагностики и лечения ЛПП, система дифференциальной диагностики, этапы диагностики, разбираются современные подходы к фармакотерапии ЛПП, приводятся оптимальные варианты медикаментозного лечения.
Ключевые слова: лекарственные повреждения печени, гепатотоксическое действие, острая печеночная недостаточность, гепатоциты, некроз, стеатоз, холестаз, лекарственная идиосинкразия, желтуха, гепатопротекторы, адеметионин, Гептор.
Ключевые слова: лекарственные повреждения печени, гепатотоксическое действие, острая печеночная недостаточность, гепатоциты, некроз, стеатоз, холестаз, лекарственная идиосинкразия, желтуха, гепатопротекторы, адеметионин, Гептор.
T.E. Polunina
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Drug-induced liver injury (DILI) is one of the most complex acute or chronic liver diseases that doctors have to deal with while working. According to many researchers, liver injury caused by the direct or indirect effects of drugs or their metabolites on the liver can be referred to DILI. DILI is more than 10% of all adverse reactions of the body associated with use of drugs. It is necessary to pay special attention to those DILI cases which imply the intake of various dietary supplement products (DSP) and traditional medicine. It is necessary to keep in mind the potential hepatotoxicity of these drugs, since even in developed countries the development of dietary supplements is not controlled as strictly as the process of entering the pharmaceuticals market. In particular, preclinical and clinical toxicology safety trials, clinical safety and efficacy trials are not necessary for their registration. Ademetionine 1,4-butanedisulfonate (Heptor) can be considered as the first-line hepatoprotective drugs for DILI. The article considers epidemiology, classification, algorithm for diagnosis and treatment of drug-induced liver injury. The system of differential diagnostics, the stages of diagnostics of drug-induced liver injury, the modern approaches to pharmacotherapy of drug-induced liver injury, the best options for drug treatment are given.
Key words: liver injury, hepatotoxic effect, acute hepatic failure, hepatocytes, necrosis, steatosis, cholestasis, drug idiosyncrasy, jaundice, hepatoprotectors, ademetionine, Heptor.
For citation: Polunina T.E. Drug-induced liver injury // RMJ. Medical Review. 2018. № 7(I). P. 7–12.
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Drug-induced liver injury (DILI) is one of the most complex acute or chronic liver diseases that doctors have to deal with while working. According to many researchers, liver injury caused by the direct or indirect effects of drugs or their metabolites on the liver can be referred to DILI. DILI is more than 10% of all adverse reactions of the body associated with use of drugs. It is necessary to pay special attention to those DILI cases which imply the intake of various dietary supplement products (DSP) and traditional medicine. It is necessary to keep in mind the potential hepatotoxicity of these drugs, since even in developed countries the development of dietary supplements is not controlled as strictly as the process of entering the pharmaceuticals market. In particular, preclinical and clinical toxicology safety trials, clinical safety and efficacy trials are not necessary for their registration. Ademetionine 1,4-butanedisulfonate (Heptor) can be considered as the first-line hepatoprotective drugs for DILI. The article considers epidemiology, classification, algorithm for diagnosis and treatment of drug-induced liver injury. The system of differential diagnostics, the stages of diagnostics of drug-induced liver injury, the modern approaches to pharmacotherapy of drug-induced liver injury, the best options for drug treatment are given.
Key words: liver injury, hepatotoxic effect, acute hepatic failure, hepatocytes, necrosis, steatosis, cholestasis, drug idiosyncrasy, jaundice, hepatoprotectors, ademetionine, Heptor.
For citation: Polunina T.E. Drug-induced liver injury // RMJ. Medical Review. 2018. № 7(I). P. 7–12.
В статье рассматриваются эпидемиология, классификация, алгоритмы диагностики и лечения лекарственных повреждений печени, разбираются современные подходы к фармакотерапии, приводятся оптимальные варианты медикаментозного лечения.

Введение
Лекарственные повреждения печени (ЛПП) являются одним из наиболее сложных острых или хронических заболеваний, с которыми встречаются врачи в своей практике. Многие исследователи относят к ЛПП повреждения, вызванные прямым или опосредованным воздействием лекарственных препаратов (ЛП) или их метаболитов на печень [1–4]. ЛПП составляют более 10% всех побочных реакций организма, связанных с применением лекарств. Известно, что большое количество ЛП, лекарственных трав и биологически активных добавок (БАД) вызывают повреждение печени, а на побочные действия лекарств приходится до 20–40% всех случаев острой печеночной недостаточности (ОПН) [5]. Приблизительно 75% идиосинкразических реакций на ЛП приводят к трансплантации печени или смерти. ЛПП являются наиболее распространенной причиной изъятия одобренного препарата из обращения. Врачи должны проявлять бдительность в выявлении повреждений печени, связанных с лекарствами, поскольку раннее выявление такого повреждения снизит тяжесть последствий. Клинические проявления ЛПП варьируют от асимптоматического повышения ферментов печени до фульминантной печеночной недостаточности.Особого внимания заслуживают случаи ЛПП, ассоциированные с приемом различных БАД и средств народной медицины [6, 7]. Их способность вызывать структурно-функциональные нарушения печени (гепатотоксичность) обычно недооценивается как пациентами, так и врачами. Между тем частота употребления таких препаратов населением достаточно высока. Только в США более половины жителей страны принимают БАД для поддержания здоровья, моделирования фигуры или лечения симптомов различных заболеваний [7]. Известна гепатотоксичность растений, использующихся в китайской и аюрведической медицине: чистотела, цимицифуги, дубровника, блоховника и многих других. Важное значение имеет взаимодействие между различными фитокомпонентами [8]. Клинические проявления и тяжесть ЛПП, вызванных БАД и фитотерапией, весьма разнообразны, от легкого гепатита до ОПН. Истинная распространенность и заболеваемость ЛПП, ассоциированных с приемом БАД, неизвестны [9].
Важно помнить о потенциальной гепатотоксичности БАД, т. к. даже в развитых странах их разработка не контролируется так же строго, как процесс поступления на рынок фармацевтических препаратов. В частности, для регистрации БАД не нужны доклинические и клинические токсикологические испытания безопасности препарата, клинические испытания безопасности и эффективности [9].
Эпидемиология
В США ежегодно наблюдаются примерно 2000 случаев ОПН, из них лекарственно обусловленных более 50% (39% из-за ацетаминофена, 13% — идиосинкразические реакции из-за других лекарств). ЛПП составляют 2–5% случаев госпитализации пациентов с желтухой и примерно 10% от всех случаев острого гепатита [10–12].В большей части стран Западной Европы и в США повреждения печени, вызванные лекарствами, являются наиболее распространенной причиной ОПН. В развивающихся странах в качестве причин ОПН преобладают вирусные инфекции (гепатит А, В и Е), ЛПП там встречается гораздо реже.
На рис. 1 представлены результаты ретроспективного исследования влияния различных групп ЛП и их отдельных представителей (исключая ацетаминофен) на поражение печени [13]. Были отобраны 899 пациентов с ЛПП различной степени тяжести. Для определения показателя тяжести заболевания использовались лабораторные и клинические исследования.
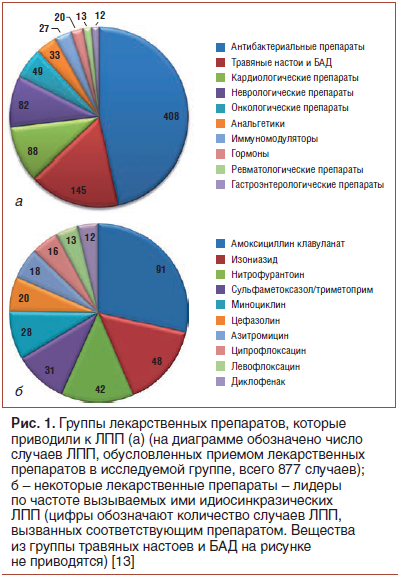
В российских источниках опубликован ряд исследований ЛПП, вызванных противотуберкулезными препаратами [14–16], нестероидными противовоспалительными средствами [14, 17]. В России острые медикаментозные поражения печени выявляются у 2,7% госпитализированных больных. Чаще всего ЛПП связаны с противотуберкулезными, антибактериальными, гормональными, цитостатическими, гипотензивными и антиаритмическими препаратами, анальгетиками, [16, 17]. Во фтизиатрии частота медикаментозных поражений печени составляет от 15 до 20% [15].
Доказано, что при одновременном приеме 5 ЛП вероятность развития побочных эффектов составляет около 4%, 5–10 ЛП — 10%, 10–16 ЛП — 28%, а 16–20 ЛП — 54% [14].
Клинические проявления и диагностика ЛПП
Клинические проявления ЛПП
Диапазон клинических проявлений ЛПП разнообразен: от небольшого повышения уровня аминотрансфераз, не сопровождающегося клинической симптоматикой, до молниеносных гепатитов и развития циррозов. Изменения показателей ферментов могут свидетельствовать о гепатоцеллюлярном повреждении печени при повышении уровня аминотрансфераз (аланинаминотрансферазы — АЛТ и аспартатаминотрансферазы — АСТ) в качестве преобладающего симптома или о холестатическом повреждении при повышении уровня щелочной фосфатазы (ЩФ) с гипербилирубинемией или без нее.
ЛПП могут напоминать почти все существующие заболевания печени: острый гепатит, стеатогепатит, острую печеночную недостаточность, сосудистые реакции, холестатическое поражение и др.
Лекарственные гепатиты, сопровождающиеся желтухой, могут протекать по цитолитическому, холестатическому или смешанному варианту. В ряде случаев развивается псевдохирургическая симптоматика (боли в животе, лихорадка, желтуха, увеличенный желчный пузырь). К ЛП, способным вызвать острую псевдохирургическую симптоматику, относятся цитостатики, антидепрессанты, антиаритмические препараты. Фактором, способствующим переходу гепатита в хроническое состояние, является длительный прием ЛП.
Классификация повреждений печени представлена в табл. 1.
![Таблица 1. Классификация ЛПП по консенсусу CIOMS (с коррекцией) [18, 19] Таблица 1. Классификация ЛПП по консенсусу CIOMS (с коррекцией) [18, 19]](/upload/medialibrary/fa8/7-2.png)
Международной рабочей группой экспертов было предложено деление ЛПП по степени тяжести (табл. 2).
![Таблица 2. Степени тяжести ЛПП [19, 20] Таблица 2. Степени тяжести ЛПП [19, 20]](/upload/medialibrary/1fa/7-3.png)
Диагностика
Диагностика ЛПП — это диагноз исключения, который опирается на данные анамнеза, клинической картины и течения заболевания, а также на результаты исследований, преимущественно лабораторных. Диагностика ЛПП включает следующие позиции:интервал между началом приема ЛП и развитием поражения печени;
клинические признаки;
длительность и течение периода восстановления;
конкретные факторы риска;
исключение других причин поражения печени;
учет предшествующих данных о гепатотоксичности ЛП.
Дополнительные (но не всегда доступные, а иногда и неуместные) позиции при постановке диагноза:
реакция на повторное назначение ЛП;
биопсия печени [21].
Анамнез должен включать дозу, путь введения, продолжительность приема ЛП, предыдущее введение и использование любых сопутствующих ЛП, включая лекарственные травы и БАД. Период латентности идиосинкразических реакций на ЛП сильно варьирует, следовательно, информация о каждом ЛП, принимаемом пациентом в течение последних 3-х месяцев, имеет важное значение. Первые признаки повреждения печени обычно появляются в течение 5–90 дней после начала приема ЛП. Исключение других причин поражения печени является существенным.
Важными диагностическими симптомами являются снижение уровня трансаминаз в сыворотке крови на 50% в течение 8 дней после прекращения приема ЛП и ранее документированные реакции на ЛП.
При дифференциальной диагностике гепатоцеллюлярного или смешанного ЛПП необходимо исключить следующие заболевания:
острые инфекции вирусами гепатитов А, В, и С;
аутоиммунный гепатит;
острую цитомегаловирусную инфекцию, вирусы Эпштейна — Барр и простого герпеса (при исключении классических вирусных гепатитов либо при таких признаках, как атипичный лимфоцитоз и лимфаденопатия);
болезнь Вильсона;
гемохроматоз;
синдром Бадда — Киари.
У лиц с подозрением на холестатическое ЛПП требуется исключить патологию желчевыводящих путей:
желчнокаменную болезнь с билиарной обструкцией;
первичный билиарный цирроз (холангит);
склерозирующие холангиты;
онкологические и другие инфильтративные процессы [6].
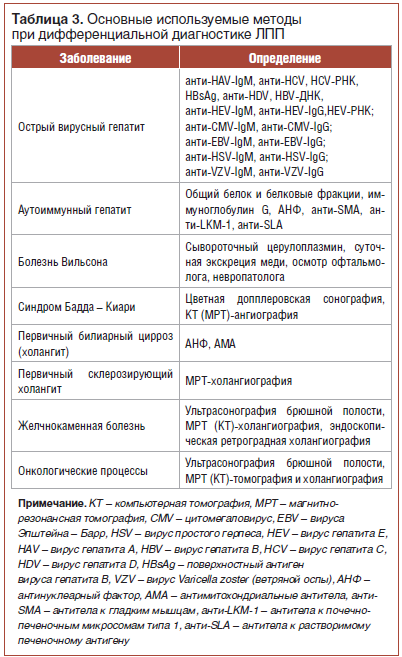
Основной спектр обследований, которые могут быть использованы при подозрении на различные гепатобилиарные заболевания, указан в табл. 3 [9].
Биопсия печени
Биопсия печени не является обязательным исследованием для постановки диагноза ЛПП, однако существуют ситуации, когда она необходима [6]:продолжающееся нарастание лабораторных печеночных показателей и признаки ухудшения функции печени, несмотря на отмену подозреваемого ЛП;
отсутствие снижения активности АЛТ на 50% и более через 30–60 дней (при гепатоцеллюлярном повреждении) либо ЩФ на 50% и более от пикового уровня через 180 дней (при холестатическом повреждении), несмотря на отмену подозреваемого ЛП;
в случаях, когда планируется дальнейшее использование или повторное назначение причинного ЛП;
сохранение изменений лабораторных показателей состояния печени более 180 дней, для оценки наличия хронического заболевания печени или хронического ЛПП.
Лечение ЛПП
Специфического лечения ЛПП не существует. В общих случаях проводится симптоматическое лечение. Первым шагом в лечении является немедленное исключение приема подозреваемого ЛП, растительного препарата или БАД. Специфическая терапия против индуцированного лекарством поражения печени ограничивается использованием N-ацетил-L-цистеина на ранних стадиях токсического поражения печени, вызванного ацетаминофеном [22, 23]. L-карнитин применяется в случаях повреждения печени при приеме вальпроата. При развитии гепатотоксической реакции на лефлуномид, в связи с его длительным периодом полувыведения и наличием энтерогепатической циркуляции, показано назначение холестирамина в течение 2-х недель [9]. Глюкокортикостероиды для лечения ЛПП имеют слабые доказательства эффективности.Однако для подавляющего большинства ЛПП, ассоциированных с приемом различных ЛП, не существует специфических антидотов, и в их терапии часто используются средства группы так называемых гепатопротекторов. Выбор гепатопротектора для лечения ЛПП, в т. ч. хронической формы, диктуется типом повреждения печени. Проводилось очень мало рандомизированных клинических исследований по эффективности применения гепатотропных препаратов (гепатопротекторов) при ЛПП. Это обусловлено редкостью и непредсказуемостью реакций на большинство ЛП.
Наибольший опыт в оценке эффективности гепатопротекторов при повреждениях печени, индуцированных ЛП, накоплен в онкологической практике. При этом целями назначения гепатопротекторов является не только лечение уже возникшего ЛПП, но и его профилактика, а также возможность обеспечить проведение полноценного курса химиотерапии [24–27].
В рекомендациях онкологов акцент делается на препараты S-аденозил-L-метионина (адеметионин) как имеющие наибольшую эффективность и доказательную базу [28].
Благоприятный эффект и безопасность применения адеметионина в терапии ЛПП обусловлены его фармакологическими свойствами. Прежде всего, это естественный метаболит организма, представленный во всех органах и средах. Адеметионин играет ключевую роль в ряде важных биохимических процессов. Реакция трансметилирования обеспечивает биосинтез фосфолипидов, транссульфатирование — синтез глутатиона и таурина, конъюгацию желчных кислот, детоксикацию желчных кислот и ксенобиотиков; аминопропилирование — синтез полиаминов (путресцин, спермидин, спермин), играющих важную роль в формировании структуры рибосом и процессах регенерации. ЛПП различных этиологий сопровождается нарушением функции гепатоцитов и холангиоцитов и развитием дефицита адеметионина в организме. Кроме того, указанный препарат обладает антифибротической активностью, антинейротоксическим и антидепрессивным действием [29].
В российском многоцентровом проспективном наблюдательном исследовании 105 пациентов с псориазом, получавших иммуносупрессивную терапию (метотрексат, циклоспорин, глюкокортикостероиды), показана эффективность адеметионина при ЛПП, протекавшем с холестазом. В качестве инициации гепатопротективной терапии пациенты получали исследуемый препарат парентерально в дозе 400–800 мг/сут в течение 2-х недель, а на поддерживающем этапе — 800–1600 мг/сут перорально 4 нед., период наблюдения после терапии составил 30 дней. Данная схема позволила достоверно снизить значения лабораторных показателей (уровень общего билирубина, активность ЩФ, гаммаглутамат трансферазы (ГГТ), АСТ, АЛТ), а также симптомы внутрипеченочного холестаза (кожный зуд, желтуха, слабость) [30].
Эффективность адеметионина при холестатических ЛПП была подтверждена и другими авторами [28]. При этом рассматривались и иные схемы назначения данного гепатопротектора. Достоверные позитивные результаты были получены при последовательном назначении парентерально 400 мг/сут в течение 10 дней, далее перорально 800 мг/сут в течение 15 дней [31].
В исследовании, проведенном у детей, введение адеметионина в дозе 20–30 мг/кг/сут в течение 28 дней внутривенно при ЛПП (холестатический и смешанный тип) приводило к достоверному, по сравнению с плацебо, уменьшению зуда, исчезновению или уменьшению желтухи, снижению активности АСТ и ГГТП [32].
В клинической практике предлагаются следующие схемы назначения адеметионина 1,4-бутандисульфоната: при выявлении ЛПП препарат вводится внутривенно в высокой дозе — 1600 мг/сут в течение 2–3-х недель с последующим переходом на пероральный прием в стандартной дозе 800 мг/сут или (при необходимости) в высокой дозе 1600 мг/сут. С целью поддержания ремиссии при хронической форме ЛПП рекомендуется курсовой прием препарата (доза 400, 800, 1600 мг/сут), продолжительность курса не менее 30 дней [24].
Препараты адеметионина зарегистрированы на территории России с показанием к лечению заболеваний печени, в т. ч. ЛПП. Результаты исследований демонстрируют быстрый эффект препарата по снижению биохимических маркеров внутрипеченочного холестаза [33]. Кроме того, существует ряд рандомизированных исследований, демонстрирующих эффекты адеметионина и при цитолитическом синдроме [34].
В России одним из препаратов, содержащим адеметионина 1,4-бутандисульфонат, является препарат Гептор. Будучи средством симптоматического лечения пациентов с ЛПП, Гептор способен уменьшить проявления холестаза и депрессии, улучшить качество жизни у этих пациентов, но его воздействие на более глобальные показатели (общую смертность, смертность вследствие гепатобилиарной патологии, прогрессирование фиброза) остается малоизученным [9].
Назначение препаратов урсодезоксихолевой кислоты (УДХК) в дозе 13–15 мг/кг возможно пациентам с холестатическим типом ЛПП, имеющим клинические и биохимические признаки холестаза [35]. Но данные, подтверждающие эффективность УДХК при лечении ЛПП, в настоящее время достаточно ограниченны. По результатам проспективного исследования по оценке ЛПП у 899 пациентов не была доказана эффективность УДХК ни при остром, ни при хроническом ЛПП [13].
Стоит отметить, что в систематическом обзоре данных по профилактике и лечению ЛПП не выявлены доказательства эффективности таких гепатопротекторов, как экстракт расторопши, глицирризиновая кислота и УДХК [36].
Вопросы эффективности эссенциальных фосфолипидов при ЛПП не могли остаться без внимания специалистов, занимающихся доказательной медициной. Однако в большом количестве обзоров по использованию эссенциальных фосфолипидов или фосфатидилхолина при заболеваниях печени исследований, посвященных применению этих ЛП при ЛПП, очень мало. Большинство работ, проведенных с применением этого класса ЛП, включали небольшое количество пациентов, были ограничены по времени, не учитывали частоту рецидивов и причины отсутствия клинического эффекта, а также сопутствующие заболевания [37].
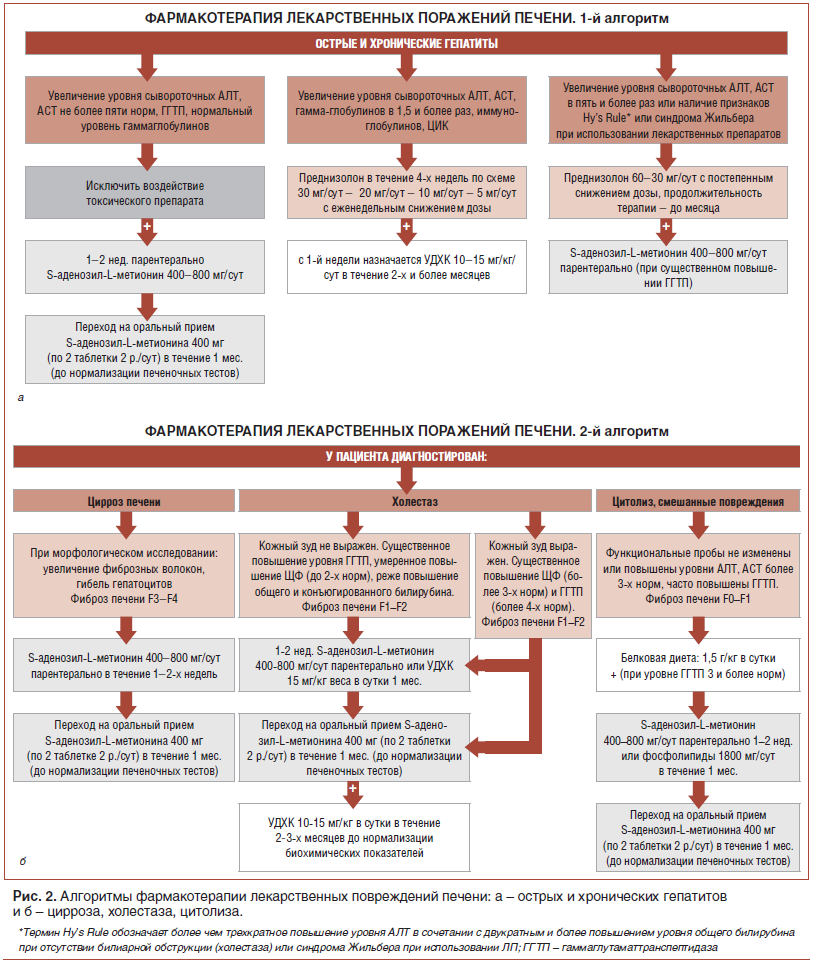
Основные алгоритмы терапии ЛПП, которые, согласно данным [1, 38], являются достаточно эффективными, представлены на рис. 2.
Заключение
Таким образом, лекарственные повреждения печени могут вызываться как фармакологическими средствами, так и БАД, а также средствами народной медицины. ЛПП могут протекать как бессимптомно, так и с выраженной и разнообразной клинической симптоматикой. Диагностика лекарственных повреждений печени является диагнозом исключения и обычно осуществляется на стадии, проявляющейся желтухой и гепатомегалией. Для подавляющего большинства ЛПП, ассоцированных с приемом различных препаратов, не существует специфических антидотов, и в их терапии используются средства группы так называемых гепатопротекторов. Выбор гепатопротектора для лечения ЛПП, в т. ч. хронической формы, диктуется типом повреждения печени. В качестве гепатопротективной терапии 1-й линии при ЛПП препаратом выбора можно считать адеметионина 1,4-бутандисульфонат (Гептор).
Литература
1. КовтунА.В., ЯковенкоА.В., ИвановА.Н. и др. Лекарственно-индуцированные поражения печени. Диагностика и лечение // Гастроэнтерология, Лечащий врач. 2011. №2. С.35–41 [Kovtun A.V., JakovenkoA.V., IvanovA.N. i dr. Lekarstvenno-inducirovannye porazhenija pecheni. Diagnostika i lechenie // Gastrojenterologija, Lechashhij vrach. 2011. №2. S.35–41 (in Russian)].
2. Заболевания печени и желчных путей / под ред. Ш.Шерлока, Дж.Дули. М.: ГЭОТАР-Медиа, 1999. 859 c. [Zabolevanija pecheni i zhelchnyh putej / pod red. Sh. Sherloka, Dzh. Duli. M.: GJEOTAR Media,1999. 859 s. (in Russian)].
3. KaplowitzN., De Leve LaurieD.Drug-induced liver disease // Inform. Healthcare. 2007. P.808.
4. LeeW.M.Drug-induced hepatotoxicity // N.Engl. J.Med. 2003.Vol. 349. P.474–485.
5. AnsariJ.A.Therapeutic Approaches in Management of Drug-induced Hepato-toxicity // Journal of Biological Sciences. 2010. Vol. 10. P.386–395.
6. ChalasaniN.P., HayashiP.H., BonkovskyH.L. et al. ACG Clinical Guideline: the diagnosis and management of idiosyncratic drug-induced liver injury // Am. J.Gastroenterol. 2014. Vol. 109. №7. Р.950–966.
7. NavarroV.J., BarnhartH., BonkovskyH.L. et al. Liver injury from herbals and dietary supplements in the U.S.Drug-Induced Liver Injury Network // Hepatology. 2014. Vol. 60 (4). P.1399–1408.
8. BunchorntavakulC.K., ReddyR.Review article: herbal and dietary supplement hepatotoxicity // Aliment. Pharmacol. Ther. 2013. Vol. 37. №1. P.3–17.
9. Лекарственные поражения печени. Клинические рекомендации для врачей / под ред. К.Л.Райхельсона, Л.К.Пальговой, Э.А.Кондрашиной и др. СПб.: Санкт-Петербургское общество гастроэнтерологов, гепатологов и диетологов. 2017. 116 с. [Lekarstvennye porazhenija pecheni. Klinicheskie rekomendacii dlja vrachej / pod red. K.L.Rajhel’sona, L.K.Pal’govoj, Je. A.Kondrashinoj i dr. SPb.: Sankt-Peterburgskoe obshhestvo gastrojenterologov, gepatologov i dietologov. 2017. 116 s. (in Russian)].
10. IchaiP., SamuelD.Epidemiology of liver failure // Clin. Res. Hepatol. Gastroenterol. 2011. Vol. 35 (10). P.610–617.
11. LeiseM.D., PoteruchaJ.J., TalwalkarJ.A.Drug-induced liver injury // Mayo Clin. Proc. 2014. Vol. 89. №1. P.95–106.
12. BernalW., WendonJ.Acute Liver Failure // N.Engl. J.Med. 2013. Vol. 369. P.2525–2534.
13. ChalasaniN., BonkovskyH.L., FontanaR. et al. Features and Outcomes of 899 Patients With Drug-Induced Liver Injury: The DILIN Prospective Study // Gastroenterology. 2015. Vol. 148. P.1340–1352.
14. Медикаментозные осложнения / под ред. Е.С.Белозерова, Е.И.Змушко. СПб.: Питер. 2001. 448 с. [Medikamentoznye oslozhnenija / pod red. E.S.Belozerova, E.I.Zmushko, SPb.: Piter. 2001. 448 s. (in Russian)].
15. СухановД.С., РоманцовМ.Г.Эффекты гепатопротектора при поражении печени у больных туберкулезом органов дыхания // Успехи современного естествознания. 2008. 10. С.40–50 [Suhanov D.S., RomancovM.G.Jeffekty gepatoprotektora pri porazhenii pecheni u bol’nyh tuberkulezom organov dyhanija // Uspehi sovremennogo estestvoznanija. 2008. 10. S.40–50 (in Russian)].
16. ИвановаД.А., БорисовС.Е.Оценка риска и мониторинг гепатотоксических реакций у больных туберкулезом // Туберкулез и болезни легких. 2017. Т.95. №9. С.40–48 [Ivanova D.A., BorisovS.E.Ocenka riska i monitoring gepatotoksicheskih reakcij u bol’nyh tuberkulezom // Tuberkuljoz i bolezni ljogkih. 2017. T.95 №9. S.40–48 (in Russian)].
17. ПолунинаТ.Е., МаевИ.В.Лекарственный гепатит // Consilium medicum. Приложение к журналу Consilium medicum. Гастроэнтерология. 2008. №1. С.3–10 [Polunina T.E., MaevI.V.Lekarstvennyj gepatit. // Consilium medicum. Prilozhenie k zhurnalu Consilium medicum. Gastrojenterologija. 2008. №1. S.3–10 (in Russian)].
18. Reporting adverse drug reactions definitions of terms and criteria for their use / Geneva: CIOMS. 1999. 146 p.
19. AithalG.P., WatkinsP.B., AndradeR.J. et al. Case definition and phenotype standardization in drug-induced liver injury. Review // Clin.Pharmacol. Ther. 2011. Vol.89. №6. P.806–815.
20. Drug-induced liver injury / by ed. J.R odes, J.– P.Benhamou, A.T.Blei et al. Textbook of hepatology: from basic science to clinical practice. 3rd ed. Blackwell Publishing. 2007. P. 1211–1277.
21. FontanaR.J., SeeffL.B., AndradeR.J. et al. Standardization of nomenclature and causality assessment in drug-induced liver injury: summary of a Clinical Research Workshop // Hepatol. 2010. Vol. 52. №2. P.730–742.
22. LeeW.M., HynanL.S., RossaroL. et al. Intravenous N-acetylcysteine improves transplant-free survival in early stage non-acetaminophen acute liver failure // Gastroenterology. 2009. Vol. 137. P.856–864.
23. ChalasaniN., FontanaR.J., BonkovskyH.L. et al. Causes, clinical features, and outcomes from a prospective study of drug induced liver injury in the United States // Gastroenterology. 2008. Vol. 135. P. 1924–1934.
24. Клинические рекомендации по коррекции гепатотоксичности индуцированной противоопухолевой химиотерапии / под ред. В.Б.Ларионовой, Е.Г.Громовой, А.В.Снеговой. М., 2016 [Klinicheskie rekomendacii po korrekcii gepatotoksichnosti inducirovannoj pro-tivoopuholevoj himioterapii / pod red. V.B.Larionovoj, E.G.Gromovoj, A.V.Snegovoj. M., 2016 (in Russian)]. [Электронный ресурс]. URL: http://www.rosoncoweb.ru/standarts/RUSSCO/2016/37.pdf (дата обращения: 14.09.2018).
25. Практические рекомендации по лекарственному лечению злокачественных опухолей (RUSSCO) / под ред. В.М.Моисеенко. М.: Общество онкологов-химиотерапевтов. 2016. 384 с. [Prakticheskie rekomendacii po lekarstvennomu lecheniju zlokachestvennyh opuholej (RUSSCO) / pod red. V.M.Moiseenko. M.: Obshhestvo onkologov-himioterapevtov. 2016. 384 s. (in Russian)].
26. СнеговойА.В., ГромоваЕ.Г., ЛарионоваВ.Б.Практические рекомендации по коррекции гепатотоксичности, индуцированной противоопухолевой химиотерапией // Злокачественные опухоли. 2015. №4, спецвыпуск. C.358–368. [Snegovoj A.V., GromovaE.G., LarionovaV.B.Prakticheskie rekomendacii po korrekcii gepatotoksichnosti, inducirovannoj protivoopuholevoj himioterapiej // Zlokachestvennye opuholi. 2015. №4, specvypusk. S.358–368 (in Russian)].
27. SkrypnykI., MaslovaG. S-ademetionine effectively prevents drug-induced liver injury in overweight patients with acute leukemia // J.Hepatology. 2018. Vol. 68. P.587.
28. AnsteeQ.M., DayC.P. S-adenosylmethionine (SAMe) therapy in liver disease: A review of current evidence and clinical utility // J.Hepatol. 2012. Vol. 57 (5). P.1097–1109.
29. Клиническая фармакология гепатопротекторов / под ред. С.В.Оковитого, С.Н.Шуленина. СПб., 2006. C.23–24 [Klinicheskaja farmakologija gepatoprotektorov / pod red. C.V.Okovitogo, C.N.Shulenina. SPb., 2006. S.23–24 (in Russian)].
30. PerlamutrovY., BakulevA., KorsunskayaI. et al. Ademetionine in treatment of drug induced liver injury: an observational study in Russian patients, receiving immunosuppressive therapy for psoriasis // Int. J.Pharmac. Sc. Res. 2014. Vol. 5. №12. P.5163–5169.
31. УгрюмоваЕ.В.Адеметионин в цитостатической терапии псориаза // В помощь практическому врачу. 2010. №2. C. 52–56 [Ugrjumova E.V.Ademetionin v citostaticheskoj terapii psoriaza // V pomoshh’ prakticheskomu vrachu. 2010. №2. S.52–56 (in Russian)].
32. ZhuS.S., DongY., GanY. et al. Efficacy and safety of ademetionine for treatment of drug-induced liver disease in children // Zhonghua Shi Yan He Lin Chuang Bing Du Xue Za Zhi. 2010.Vol. 24. №2. P.136–138.
33. ManzilloG., PiccininoF., SurrentiC. et al. Multicentre doubleblind placebo-controlled study of intravenous and oral S-adenosyl-L-methionine (SAMe) in cholestatic patients with liver disease // Drug Invest. 1992. Vol. 4 (suppl. 4). P.90–100.
34. SantiniD., VincenziD., MassacesiC. et al. S-adenosylmethionine (AdoMet) supplementation for treatment of chemotherapy-induced liver injury // Anticancer Res. 2003. Vol. 23. №6D. P.5173–5179.
35. MohankumarN., RanjanP., KumariA.Drug-induced liver injury: diagnosing (and treating) it early // J.Fam. Pract. 2015. Vol. 64. №10. P.634–644.
36. StineJ.G., LewisJ.H.Current and future directions in the treatment and prevention of drug-induced liver injury: a systematic review // Expert Rev. Gastroenterol. Hepatol. 2016. Vol. 10. №4. P.517–536.
37. Гепатопротекторы. Анализ международных исследований по препаратам группы лекарств для печени / под ред. А.В.Матвеева Симферополь: ИТ АРИАЛ. 2013. 384 с. [Gepatoprotektory. Analiz mezhdunarodnyh issledovanij po preparatam gruppy lekarstv dlja pecheni / pod red. MatveevaA.V.Simferopol’: IT ARIAL. 2013. 384 s. (in Russian)].
38. Лекарственные поражения печени / под ред. Т.Е.Полуниной. Терапевтический справочник. Т.2. М.: Бионика Медиа. 2015. С.155–168 [Lekarstvennye porazhenija pecheni / pod red. T.E.Poluninoj Terapevticheskij spravochnik. T.2. M.: Bionika Media. 2015. S.155–168 (in Russian)].
2. Заболевания печени и желчных путей / под ред. Ш.Шерлока, Дж.Дули. М.: ГЭОТАР-Медиа, 1999. 859 c. [Zabolevanija pecheni i zhelchnyh putej / pod red. Sh. Sherloka, Dzh. Duli. M.: GJEOTAR Media,1999. 859 s. (in Russian)].
3. KaplowitzN., De Leve LaurieD.Drug-induced liver disease // Inform. Healthcare. 2007. P.808.
4. LeeW.M.Drug-induced hepatotoxicity // N.Engl. J.Med. 2003.Vol. 349. P.474–485.
5. AnsariJ.A.Therapeutic Approaches in Management of Drug-induced Hepato-toxicity // Journal of Biological Sciences. 2010. Vol. 10. P.386–395.
6. ChalasaniN.P., HayashiP.H., BonkovskyH.L. et al. ACG Clinical Guideline: the diagnosis and management of idiosyncratic drug-induced liver injury // Am. J.Gastroenterol. 2014. Vol. 109. №7. Р.950–966.
7. NavarroV.J., BarnhartH., BonkovskyH.L. et al. Liver injury from herbals and dietary supplements in the U.S.Drug-Induced Liver Injury Network // Hepatology. 2014. Vol. 60 (4). P.1399–1408.
8. BunchorntavakulC.K., ReddyR.Review article: herbal and dietary supplement hepatotoxicity // Aliment. Pharmacol. Ther. 2013. Vol. 37. №1. P.3–17.
9. Лекарственные поражения печени. Клинические рекомендации для врачей / под ред. К.Л.Райхельсона, Л.К.Пальговой, Э.А.Кондрашиной и др. СПб.: Санкт-Петербургское общество гастроэнтерологов, гепатологов и диетологов. 2017. 116 с. [Lekarstvennye porazhenija pecheni. Klinicheskie rekomendacii dlja vrachej / pod red. K.L.Rajhel’sona, L.K.Pal’govoj, Je. A.Kondrashinoj i dr. SPb.: Sankt-Peterburgskoe obshhestvo gastrojenterologov, gepatologov i dietologov. 2017. 116 s. (in Russian)].
10. IchaiP., SamuelD.Epidemiology of liver failure // Clin. Res. Hepatol. Gastroenterol. 2011. Vol. 35 (10). P.610–617.
11. LeiseM.D., PoteruchaJ.J., TalwalkarJ.A.Drug-induced liver injury // Mayo Clin. Proc. 2014. Vol. 89. №1. P.95–106.
12. BernalW., WendonJ.Acute Liver Failure // N.Engl. J.Med. 2013. Vol. 369. P.2525–2534.
13. ChalasaniN., BonkovskyH.L., FontanaR. et al. Features and Outcomes of 899 Patients With Drug-Induced Liver Injury: The DILIN Prospective Study // Gastroenterology. 2015. Vol. 148. P.1340–1352.
14. Медикаментозные осложнения / под ред. Е.С.Белозерова, Е.И.Змушко. СПб.: Питер. 2001. 448 с. [Medikamentoznye oslozhnenija / pod red. E.S.Belozerova, E.I.Zmushko, SPb.: Piter. 2001. 448 s. (in Russian)].
15. СухановД.С., РоманцовМ.Г.Эффекты гепатопротектора при поражении печени у больных туберкулезом органов дыхания // Успехи современного естествознания. 2008. 10. С.40–50 [Suhanov D.S., RomancovM.G.Jeffekty gepatoprotektora pri porazhenii pecheni u bol’nyh tuberkulezom organov dyhanija // Uspehi sovremennogo estestvoznanija. 2008. 10. S.40–50 (in Russian)].
16. ИвановаД.А., БорисовС.Е.Оценка риска и мониторинг гепатотоксических реакций у больных туберкулезом // Туберкулез и болезни легких. 2017. Т.95. №9. С.40–48 [Ivanova D.A., BorisovS.E.Ocenka riska i monitoring gepatotoksicheskih reakcij u bol’nyh tuberkulezom // Tuberkuljoz i bolezni ljogkih. 2017. T.95 №9. S.40–48 (in Russian)].
17. ПолунинаТ.Е., МаевИ.В.Лекарственный гепатит // Consilium medicum. Приложение к журналу Consilium medicum. Гастроэнтерология. 2008. №1. С.3–10 [Polunina T.E., MaevI.V.Lekarstvennyj gepatit. // Consilium medicum. Prilozhenie k zhurnalu Consilium medicum. Gastrojenterologija. 2008. №1. S.3–10 (in Russian)].
18. Reporting adverse drug reactions definitions of terms and criteria for their use / Geneva: CIOMS. 1999. 146 p.
19. AithalG.P., WatkinsP.B., AndradeR.J. et al. Case definition and phenotype standardization in drug-induced liver injury. Review // Clin.Pharmacol. Ther. 2011. Vol.89. №6. P.806–815.
20. Drug-induced liver injury / by ed. J.R odes, J.– P.Benhamou, A.T.Blei et al. Textbook of hepatology: from basic science to clinical practice. 3rd ed. Blackwell Publishing. 2007. P. 1211–1277.
21. FontanaR.J., SeeffL.B., AndradeR.J. et al. Standardization of nomenclature and causality assessment in drug-induced liver injury: summary of a Clinical Research Workshop // Hepatol. 2010. Vol. 52. №2. P.730–742.
22. LeeW.M., HynanL.S., RossaroL. et al. Intravenous N-acetylcysteine improves transplant-free survival in early stage non-acetaminophen acute liver failure // Gastroenterology. 2009. Vol. 137. P.856–864.
23. ChalasaniN., FontanaR.J., BonkovskyH.L. et al. Causes, clinical features, and outcomes from a prospective study of drug induced liver injury in the United States // Gastroenterology. 2008. Vol. 135. P. 1924–1934.
24. Клинические рекомендации по коррекции гепатотоксичности индуцированной противоопухолевой химиотерапии / под ред. В.Б.Ларионовой, Е.Г.Громовой, А.В.Снеговой. М., 2016 [Klinicheskie rekomendacii po korrekcii gepatotoksichnosti inducirovannoj pro-tivoopuholevoj himioterapii / pod red. V.B.Larionovoj, E.G.Gromovoj, A.V.Snegovoj. M., 2016 (in Russian)]. [Электронный ресурс]. URL: http://www.rosoncoweb.ru/standarts/RUSSCO/2016/37.pdf (дата обращения: 14.09.2018).
25. Практические рекомендации по лекарственному лечению злокачественных опухолей (RUSSCO) / под ред. В.М.Моисеенко. М.: Общество онкологов-химиотерапевтов. 2016. 384 с. [Prakticheskie rekomendacii po lekarstvennomu lecheniju zlokachestvennyh opuholej (RUSSCO) / pod red. V.M.Moiseenko. M.: Obshhestvo onkologov-himioterapevtov. 2016. 384 s. (in Russian)].
26. СнеговойА.В., ГромоваЕ.Г., ЛарионоваВ.Б.Практические рекомендации по коррекции гепатотоксичности, индуцированной противоопухолевой химиотерапией // Злокачественные опухоли. 2015. №4, спецвыпуск. C.358–368. [Snegovoj A.V., GromovaE.G., LarionovaV.B.Prakticheskie rekomendacii po korrekcii gepatotoksichnosti, inducirovannoj protivoopuholevoj himioterapiej // Zlokachestvennye opuholi. 2015. №4, specvypusk. S.358–368 (in Russian)].
27. SkrypnykI., MaslovaG. S-ademetionine effectively prevents drug-induced liver injury in overweight patients with acute leukemia // J.Hepatology. 2018. Vol. 68. P.587.
28. AnsteeQ.M., DayC.P. S-adenosylmethionine (SAMe) therapy in liver disease: A review of current evidence and clinical utility // J.Hepatol. 2012. Vol. 57 (5). P.1097–1109.
29. Клиническая фармакология гепатопротекторов / под ред. С.В.Оковитого, С.Н.Шуленина. СПб., 2006. C.23–24 [Klinicheskaja farmakologija gepatoprotektorov / pod red. C.V.Okovitogo, C.N.Shulenina. SPb., 2006. S.23–24 (in Russian)].
30. PerlamutrovY., BakulevA., KorsunskayaI. et al. Ademetionine in treatment of drug induced liver injury: an observational study in Russian patients, receiving immunosuppressive therapy for psoriasis // Int. J.Pharmac. Sc. Res. 2014. Vol. 5. №12. P.5163–5169.
31. УгрюмоваЕ.В.Адеметионин в цитостатической терапии псориаза // В помощь практическому врачу. 2010. №2. C. 52–56 [Ugrjumova E.V.Ademetionin v citostaticheskoj terapii psoriaza // V pomoshh’ prakticheskomu vrachu. 2010. №2. S.52–56 (in Russian)].
32. ZhuS.S., DongY., GanY. et al. Efficacy and safety of ademetionine for treatment of drug-induced liver disease in children // Zhonghua Shi Yan He Lin Chuang Bing Du Xue Za Zhi. 2010.Vol. 24. №2. P.136–138.
33. ManzilloG., PiccininoF., SurrentiC. et al. Multicentre doubleblind placebo-controlled study of intravenous and oral S-adenosyl-L-methionine (SAMe) in cholestatic patients with liver disease // Drug Invest. 1992. Vol. 4 (suppl. 4). P.90–100.
34. SantiniD., VincenziD., MassacesiC. et al. S-adenosylmethionine (AdoMet) supplementation for treatment of chemotherapy-induced liver injury // Anticancer Res. 2003. Vol. 23. №6D. P.5173–5179.
35. MohankumarN., RanjanP., KumariA.Drug-induced liver injury: diagnosing (and treating) it early // J.Fam. Pract. 2015. Vol. 64. №10. P.634–644.
36. StineJ.G., LewisJ.H.Current and future directions in the treatment and prevention of drug-induced liver injury: a systematic review // Expert Rev. Gastroenterol. Hepatol. 2016. Vol. 10. №4. P.517–536.
37. Гепатопротекторы. Анализ международных исследований по препаратам группы лекарств для печени / под ред. А.В.Матвеева Симферополь: ИТ АРИАЛ. 2013. 384 с. [Gepatoprotektory. Analiz mezhdunarodnyh issledovanij po preparatam gruppy lekarstv dlja pecheni / pod red. MatveevaA.V.Simferopol’: IT ARIAL. 2013. 384 s. (in Russian)].
38. Лекарственные поражения печени / под ред. Т.Е.Полуниной. Терапевтический справочник. Т.2. М.: Бионика Медиа. 2015. С.155–168 [Lekarstvennye porazhenija pecheni / pod red. T.E.Poluninoj Terapevticheskij spravochnik. T.2. M.: Bionika Media. 2015. S.155–168 (in Russian)].

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
