Клиническое исследование применения Урсосан форте у пациентов с неалкогольной жировой болезнью печени и желчнокаменной болезнью (исследование КУРС)
DOI: 10.32364/2587-6821-2022-6-5-213-220
Цель исследования: оценить влияние урсодезоксихолевой кислоты (УДХК) на воспаление и стеатоз печени, дислипидемию, углеводный обмен, литолиз холестериновых камней у пациентов с сочетанием неалкогольной жировой болезни печени (НАЖБП) и желчнокаменной болезни (ЖКБ).
Материал и методы: проведено проспективное моноцентровое исследование, в которое включали пациентов с сочетанием НАЖБП и ЖКБ в возрасте от 19 до 65 лет. Диагноз устанавливали на основании клинико-лабораторных, ультразвуковых, рентгенологических данных. Оценивали характер и встречаемость коморбидной патологии. Степень фиброза и стеатоза печени определяли по данным МСКТ брюшной полости и сывороточным тестам фиброза (FIB 4, APRI) и стеатоза (FLI) печени, а также эластографии печени. Все пациенты получали препарат УДХК в дозе 15 мг/кг в течение 6 мес.
Результаты исследования: в исследование вошло 85 человек, из них 59 (70%) женщин, средний возраст составил 49,3±9,0 года. Камни малой плотности (до 75 HU) выявлены у 45 (52%) человек, которые составили 1-ю группу, большой плотности (75–120 HU) — у 40 (48%) человек, включенных во 2-ю группу. Коморбидность имели 42 (49%) человека. Во 2-й группе достоверно чаще встречалась коморбидная патология, была выше степень стеатоза и фиброза печени. На фоне лечения УДХК положительная динамика у пациентов 1-й группы выражалась в достоверном снижении показателей плотности и размера камня и нормализации плотности печени, показателей цитолиза и холестаза, улучшении показателей углеводного обмена, регрессе стеатоза печени по данным МСКТ и эластографии. У пациентов 2-й группы наблюдались снижение показателей плотности желчи и уменьшение размеров камня по МСКТ, положительная динамика липидограммы и индекса HOMA-IR, плотности и стеатоза печени по данным МСКТ и эластографии.
Заключение: применение УДХК у пациентов, коморбидных по НАЖБП и ЖКБ, в качестве патогенетической терапии положительно влияет на воспаление и стеатоз печени, дислипидемию, углеводный обмен, обеспечивает литолиз холестериновых камней, преимущественно плотностью менее 75 HU.
Ключевые слова: коморбидность, неалкогольная жировая болезнь печени, желчнокаменная болезнь, холестериновые камни, литолиз, стеатоз печени.
Для цитирования: Пирогова И.Ю., Уфимцева И.В. Клиническое исследование применения Урсосан форте у пациентов с неалкогольной жировой болезнью печени и желчнокаменной болезнью (исследование КУРС). РМЖ. Медицинское обозрение. 2022;6(5):213-220. DOI: 10.32364/2587-6821-2022-6-5-213-220.
I.Yu. Pirogova1,2, I.V. Ufimtseva2
1South Ural State Medical University, Chelyabinsk, Russian Federation
2Medical Center "Lotos" LLC, Chelyabinsk, Russian Federation
Aim: to evaluate the effect of ursodeoxycholic acid (UDCA) on hepatic fibrosis and steatosis, dyslipidemia, carbohydrate metabolism, and litholysis of cholesterol gallstones in patients with a combination of non-alcoholic fatty liver disease (NAFLD) and gallstone disease (GD).
Patients and Methods: a prospective monocenter study was conducted, which included patients with NAFLD and GD at the age of 19 to 65 years. The diagnosis was established on the basis of clinical, laboratory, ultrasound and radiological data. The nature and incidence of comorbid pathology were assessed. The degree of hepatic fibrosis and steatosis was determined according to the abdominal MSCT and serum tests of liver fibrosis (FIB 4, APRI) and hepatic steatosis (FLI), as well as liver elastography. All patients received UDCA at a dose of 15 mg/kg for 6 months.
Results: 85 patients were included in the study, 59 (70%) of them were female, the mean age was 49.3±9 years. Gallstones of low density (up to 75 HU) were detected in 45 (52%) patients who made up the group 1, of high density (75–120 HU) — in 40 (48%) patients included in the group 2. 42 (49%) patients had comorbidity. In group 2, comorbid pathology was significantly more common and the degree of hepatic steatosis and fibrosis was higher. During treatment with UDCA, the positive trend in group 1 was expressed in a significant decrease in the gallstone density and size, normalization of liver density, cytolysis and cholestasis indicators, improvement of carbohydrate metabolism, and regression of hepatic steatosis according to MSCT and elastography. In group 2, there was a decrease in bile density and gallstone size according to MSCT, as well as a positive trend of lipidogram, HOMA-IR index, hepatic density and steatosis according to MSCT and elastography.
Conclusion: the use of UDCA in patients with NAFLD and GD as pathogenetic therapy has a positive effect on hepatic fibrosis and steatosis, dyslipidemia, carbohydrate metabolism, and provides litholysis of cholesterol stones, mainly with a density of less than 75 HU.
Keywords: comorbidity, non-alcoholic fatty liver disease, cholelithiasis, cholesterol stones, litholysis, hepatic steatosis.
For citation: Pirogova I.Yu., Ufimtseva I.V. Clinical study of the Ursosan Forte in patients with non-alcoholic fatty liver disease and cholelithiasis (KURS study). Russian Medical Inquiry. 2022;6(5):213–220 (in Russ.). DOI: 10.32364/2587-6821-2022-6-5-213-220.
Введение
Широкое распространение ожирения в популяции привело к формированию гастроэнтерологических кластеров метаболического синдрома (МС), называемых «метаболической триадой». К ним относят заболевания пищевода (эндоскопически негативная гастроэзофагеальная рефлюксная болезнь с внепищеводными проявлениями, недостаточность кардии, грыжи пищеводного отверстия диафрагмы), заболевания печени и билиарного тракта (неалкогольная жировая болезнь печени (НАЖБП), холестероз желчного пузыря, желчнокаменная болезнь (ЖКБ)), заболевания толстой кишки (дивертикулез, гипомоторная дискинезия, полипы толстой кишки) [1–10].
Неалкогольная жировая болезнь печени в настоящее время вышла на 1-е место по частоте встречаемости среди заболеваний печени, составляя 37% по данным исследования DIREG-2 [11]. Эта патология имеет мультифакторный генез — инсулинорезистентность, липотоксичность с развитием воспаления, дисбаланс цитокинов и адипокинов уже системного характера с активацией иннантного иммунитета и микробиоты, а также воздействие экологических и генетических факторов. Стеатоз печени приводит к снижению количества рецепторов к ЛПНП на поверхности гепатоцита с последующим снижением синтеза ЛПВП и повышением индекса атерогенности. Поэтому атеросклероз и его сердечно-сосудистые осложнения у пациентов с НАЖБП развиваются даже при нормальном уровне холестерина, повышая риск сердечно-сосудистых заболеваний на 64% уже на I стадии стеатоза печени. Метаанализ 40 исследований [12] показал, что НАЖБП повышает смертность от сердечно-сосудистых заболеваний на 57%, печеночную смертность увеличивает в 5–10 раз в зависимости от степени фиброза, риск развития сахарного диабета (СД) 2 типа и хронической болезни почек возрастает в 2 раза. Причиной увеличения риска развития СД 2 типа является аккумуляция жира в печени, нарушающая регуляцию чувствительности к инсулину, с формированием инсулинорезистентности. Известно, что риск СД связан с тяжестью стеатоза и фиброза печени, начиная со II стадии. Кроме того, сочетание НАЖБП и СД 2 типа повышает риск гепатоцеллюлярной карциномы даже без развития цирроза печени [3].
Наиболее часто встречающейся коморбидной патологией у лиц с НАЖБП является ЖКБ [10]. Данные ряда авторов показывают, что высокий уровень триглицеридов приводит не только к развитию НАЖБП, но и к снижению моторики желчного пузыря, что является фактором риска формирования ЖКБ [2–10, 13, 14]. Кроме того, факторами риска образования желчных камней являются НАЖБП, женский пол и инсулинорезистентность [13–15]. В основе механизма камнеобразования при НАЖБП лежит нарушение липидного обмена, угнетение окисления жирных кислот и усиление липогенеза [6]. Кроме того, дополнительную роль играет воспаление, запускающее развитие стеатогепатита и фиброза печени, поддерживающее литогенез в желчном пузыре [9, 10, 13, 14]. Таким образом, образование холестериновых камней в желчном пузыре является следствием влияния многих местных и общих факторов, а ЖКБ — проявлением системных нарушений метаболического и воспалительного генеза.
Метаболический синдром, выступающий основным патогенетическим фактором развития НАЖБП и ЖКБ, является фактором риска осложненного течения ЖКБ [6, 9, 10, 13, 14]. МС вследствие системного воспаления и снижения иннантного иммунитета также часто определяет возникновение таких тяжелых осложнений ЖКБ, как острый холецистит, острый холангит и билиарнозависимый панкреатит. Холецистэктомия, несомненно, показана при возникновении хирургических осложнений ЖКБ, однако она не избавляет больного от обменных нарушений, лежащих в основе холецистолитиаза [15].
В связи с этим решение проблемы эффективного лечения ЖКБ связано с необходимостью раннего выявления дополнительных факторов риска холелитиаза, оптимизации ранней диагностической и прогностической модели существующей полиорганной патологии с целью уменьшения прогрессирования заболевания и снижения риска его осложнений.
Для лечения заболеваний желчного пузыря и печени в течение многих лет используются препараты урсодезоксихолевой кислоты (УДХК). Эффекты УДХК достаточно многочисленны и разноплановы. УДХК оказывает желчегонное, холелитолитическое, гиполипидемическое, гипохолестеринемическое и иммуномодулирующее действие. Обладая высокими полярными свойствами, УДХК встраивается в мембрану гепатоцита, холангиоцита и эпителиоцита ЖКТ, стабилизирует ее структуру и защищает клетку от повреждающего действия солей токсичных желчных кислот, для транспорта жиров из гепатоцита используя механизмы экзо- и эндоцитоза. Регресс стеатоза печени сопряжен со снижением активности воспалительного процесса в печени, нормализацией ее синтетической и метаболической функций [16, 17]. Способствуя снижению литогенных свойств желчи, УДХК растворяет холестериновые камни в желчном пузыре и билиарный сладж. В клинических исследованиях была продемонстрирована возможность растворения холестериновых камней и уменьшения их на 1 мм в месяц в 30–60% случаев [18, 19]. Полное растворение мелких (<5 мм) камней через 6 мес. отмечалось в 90% случаев. В исследовании, где УДХК назначалась в дозе 600 мг/сут в течение 1 мес. пациентам с холестериновыми камнями диаметром <15 мм, полное растворение было достигнуто в 43,2% случаев, частичное — в 16,2% [20]. Таким образом, применение УДХК при лечении НАЖБП в сочетании с ЖКБ патогенетически обосновано. Малоизученным является вопрос о влиянии УДХК на плотность камня и желчи в сопоставлении с активностью воспалительного процесса в печени, дислипидемией, инсулинорезистентностью, стадией стеатоза и фиброза печени.
Цель исследования: оценить влияние УДХК на воспаление и стеатоз печени, дислипидемию, инсулинорезистентность и эффективность литолиза холестериновых камней у пациентов с сочетанием НАЖБП и ЖКБ.
Материал и методы
Проведено проспективное когортное моноцентровое исследование, одобренное этическим комитетом ФГБОУ ВО ЮУГМУ Минздрава России. Все пациенты подписывали добровольное информированное согласие на участие в исследовании.
Критерии включения в исследование: возраст 18–65 лет; коморбидность по НАЖБП и ЖКБ; плотность камней желчного пузыря не более 120 единиц Хаунсфилда (HU), холестериновые камни желчного пузыря.
Критерии невключения: беременность; сопутствующие заболевания сердечно-сосудистой, дыхательной, мочевыделительной, пищеварительной систем в стадии декомпенсации, онкопатология.
В работе учитывались анамнестические данные (наследственность, длительность заболевания, коморбидная патология), антропометрические данные (рост, масса тела, окружность талии). Всем пациентам были выполнены общеклинические (общие анализы крови и мочи), биохимические (АСТ, АЛТ, общий и прямой билирубин, амилаза, γ-глутамилтранспептидаза (ГГТП), липидограмма, глюкоза, индекс НОМА-IR) исследования крови. Для косвенной оценки состояния печени проведен расчет индексов фиброза печени APRI, FIB 4, индекса стеатоза печени FLI [21]. Индекс фиброза печени APRI рассчитывали по формуле: 100
APRI = АСТ × [(верхний предел АСТ) × тромбоциты (109/л)].
Индекс APRI, превышающий 1,0, имеет чувствительность 76% и специфичность 72% для прогнозирования цирроза печени, превышающий 0,7, — 77% и 72% соответственно для прогнозирования значительного (F2–F3 по Metavir) фиброза печени [21]. Для расчета индекса фиброза FIB 4 использовали формулу: возраст × AСT
FIB 4 = количество тромбоцитов × √AЛT .
Для НАЖБП оценка по шкале FIB 4 <1,30 соответствует F0–F1 по Metavir, оценка >2,67 соответствует F3–F4 по Metavir [23–21]. Индекс FLI является суррогатным маркером НАЖБП и включает показатели ИМТ, окружность талии, уровень триглицеридов и ГГТП сыворотки крови и рассчитывается по логарифмической формуле. Значение FLI <30 указывает на отсутствие стеатоза, при значениях 30–60 стеатоз возможен и требуется дальнейшее обследование, значение >60 с вероятностью 78% указывает на наличие НАЖБП [21].
УЗИ брюшной полости проводили на аппарате Voluson E8 BT 15 (США) (для верификации стеатоза и камней желчного пузыря), МСКТ брюшной полости — на аппарате Philips MX8000 IDT-16CT (для определения плотности камня в HU, размера камня, плотности печени и поджелудочной железы, выявления атеросклероза сосудов, а также сопутствующих заболеваний ЖКТ), всем пациентам рассчитан индекс коморбидности СIRS-G. Шестидесяти пациентам выполнено фибросканирование печени с определением стадии фиброза и стеатоза печени на аппарате FibroScan 502 TOUCH с функцией CAP.
Все пациенты принимали препарат УДХК Урсосан форте 500 мг в расчете на массу тела 15 мг/кг/сут на протяжении 6 мес.
Для статистического анализа использовали пакет прикладных программ Microsoft Excel, Statistica 6.1. Проверку нормальности распределения проводили с использованием критерия Шапиро — Уилка. Так как распределение показателей в выборках не удовлетворяло требованиям параметрического анализа, показатели представлены в виде медианы и 25-го и 75-го процентилей (Me [25%; 75%]), для статистической обработки количественных данных использован непараметрический метод (критерий Манна — Уитни). При p<0,05 различия считали статистически значимыми. Для оценки связи между показателями использовали коэффициент корреляции Спирмена r.
Результаты исследования
В исследование включено 85 человек, из них 66 (70%) женщин, в возрасте от 18 до 65 лет (средний возраст 49,3±9,0 года), обратившихся в ООО МЦ «Лотос» г. Челябинска в период 2018–2020 гг. с сочетанием ЖКБ и НАЖБП. По результатам МСКТ печени и желчного пузыря камни малой плотности (до 75 HU) и малых (3–8 мм) размеров выявлены у 45 (65%) человек, которые составили 1-ю группу, камни большей плотности (75–120 HU) размерами 8–12 мм выявлены у 40 (35%) человек, включенных во 2-ю группу. Коморбидная патология была представлена ожирением, сердечно-сосудистыми заболеваниями (гипертоническая болезнь, ИБС, атеросклероз), заболеваниями эндокринной системы (аутоиммунный тиреоидит, гипотиреоз, гипертиреоз, СД 2 типа), патологией органов пищеварения (хронический гастрит, язвенная болезнь, хронический неязвенный колит, хронический панкреатит), патологией почек и мочевыделительной системы (мочекаменная болезнь, хронический пиелонефрит, хронический цистит) (табл. 1).
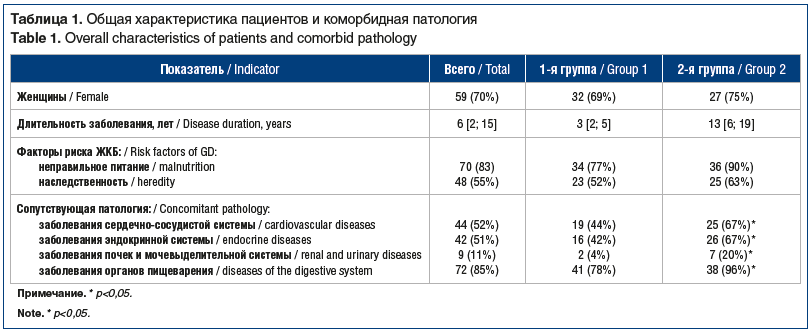
Как видно из приведенных данных, во 2-й группе пациентов на фоне большей длительности заболевания, метаболических нарушений и семейного анамнеза достоверно чаще встречалась коморбидная патология — ожирение, сердечно-сосудистые, эндокринные заболевания. Индекс коморбидности CIRS-G для пациентов 1-й группы в среднем составил 1,5 [0,9; 2,2], для пациентов 2-й группы — 2,5 [1,9; 3,1]. К факторам кардиометаболического риска, согласно клиническим рекомендациям [15], относят: мужской пол, возраст >55 лет у мужчин и >65 лет у женщин, курение, дислипидемию (общий холестерин >4,9 ммоль/л, и/или ЛПНП >3 ммоль/л, и/или ЛПВП <1,0 ммоль/л у мужчин и <1,2 ммоль/л у женщин, и/или триглицериды >1,7 ммоль/л), нарушение гликемии натощак (глюкоза плазмы 5,6–6,9 ммоль/л), СД 2 типа, избыточную массу тела (ИМТ 25–29,9 кг/м2) или ожирение (ИМТ >30 кг/м2), окружность талии >102 см у мужчин и >88 см у женщин, семейный анамнез развития сердечно-сосудистого заболевания в молодом возрасте (<55 лет у мужчин и <65 лет для женщин), малоподвижный образ жизни. Данные по оценке кардиометаболических рисков, стеатоза и фиброза печени неинвазивными методами представлены в таблице 2.
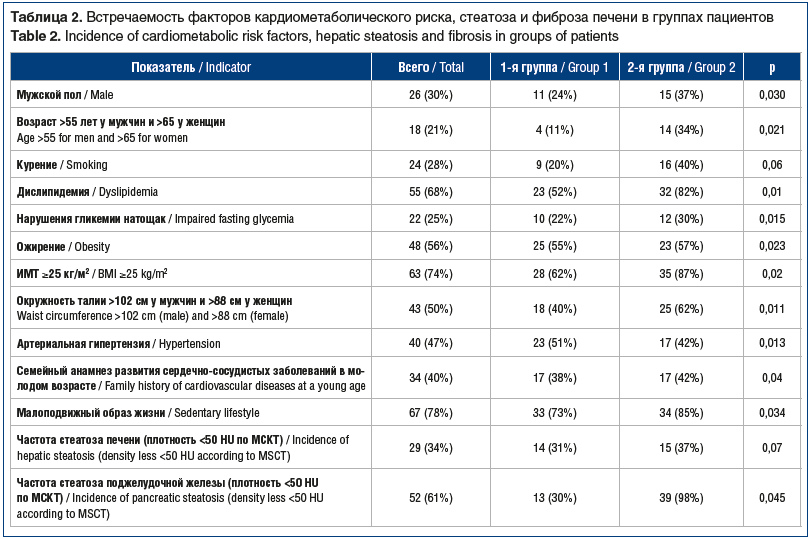
Таким образом, во 2-й группе пациентов достоверно (р<0,05) чаще встречались факторы кардиометаболического риска, коморбидная патология, был больше стаж заболевания и выше степень стеатоза и фиброза печени.
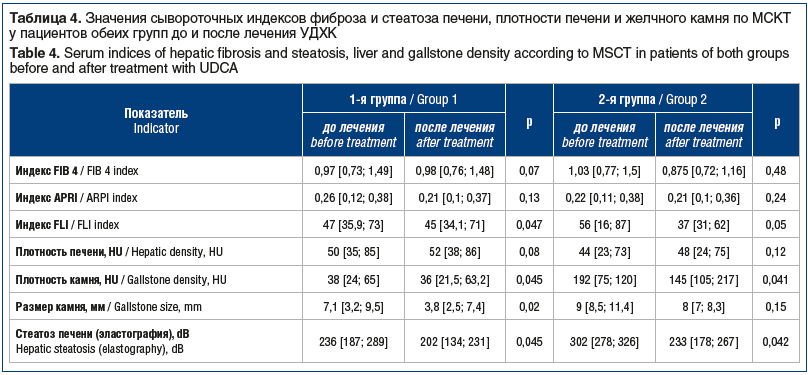
На фоне терапии УДХК положительная динамика у пациентов 1-й группы выражалась в достоверном (р<0,05) снижении показателей плотности и размера камня и нормализации плотности печени (повышение плотности печени >50 HU говорит о регрессе стеатоза), положительной динамике индексов фиброза и стеатоза, снижении показателей цитолиза (АСТ, АЛТ), холестаза (билирубин, ГГТП), улучшении показателей углеводного обмена (глюкоза, индекс НОМА-IR) (табл. 3, 4).
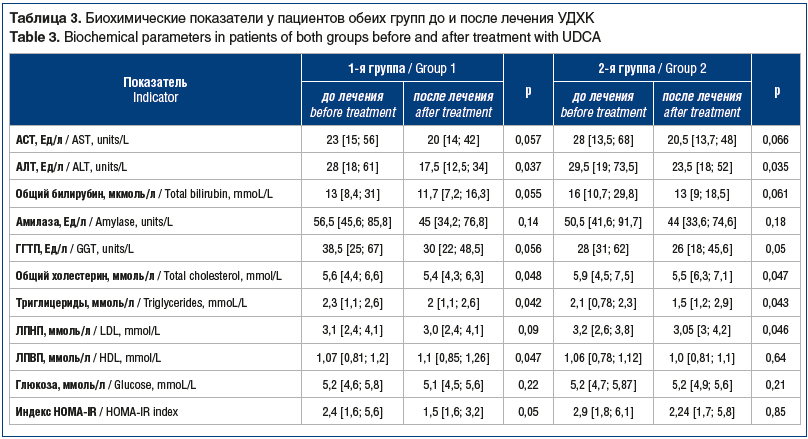
Во 2-й группе наиболее значимая динамика коснулась биохимических показателей, отражающих активность воспалительного процесса в печени, — АЛТ и АСТ, холестаза, уровня триглицеридов и инсулинорезистентности, отличавшихся от нормы.
Неинвазивные сывороточные методы оценки фиброза, стеатоза печени демонстрировали положительную динамику стеатоза печени после курса терапии УДХК, подтвержденную данными эластографии. Положительная динамика метаболических показателей в обеих группах коррелировала с эффективным литолизом желчных камней и регрессом стеатоза печени по данным неинвазивной диагностики.
Согласно приведенным данным в обеих группах значения индексов фиброза были в пределах нормы до и после лечения, индекс стеатоза FLI достоверно снижался на фоне лечения в обеих группах, увеличивалась плотность печени по МСКТ (свидетельство регресса стеатоза), уменьшалась плотность камня. Это говорит об эффективном литолизе у пациентов 1-й группы и о положительной динамике метаболических процессов у пациентов 2-й группы за 6 мес. терапии Урсосаном форте.
Положительная динамика метаболических показателей в обеих группах коррелировала с эффективным литолизом желчных камней и регрессом стеатоза печени по данным неинвазивной диагностики. Корреляционный анализ показал, что стеатоз печени по данным эластографии прямо коррелировал с индексом коморбидности, возрастом пациента, ИМТ, стадией фиброза и значением индекса FLI, размером камня (коэффициент корреляции Спирмена r≥0,3). Размер камня прямо коррелировал с индексом коморбидности, индексом HOMA-IR, уровнем билирубина, ИМТ (r≥0,3). Это свидетельствует о необходимости ранней диагностики и лечения пациентов с сочетанием НАЖБП и ЖКБ.
Полного литолиза удалось достигнуть у 23 (44,2%) человек из 1-й группы. Пациентам с положительной динамикой (уменьшение размера и плотности камня) рекомендовано продолжение терапии до 12 мес., пациентам с отсутствием динамики рекомендована плановая холецистэктомия. Во 2-й группе полного литолиза удалось достигнуть у 5 (17%) пациентов. Однако на фоне лечения наблюдалось снижение показателей плотности желчи (р<0,05), что является профилактикой дальнейшего камнеобразования. Улучшение показателей липидного обмена, регресс стеатоза печени по данным сывороточных тестов, эластографии предупреждает прогрессирование НАЖБП в неалкогольный стеатогепатит, снижает риски метаболических нарушений.
Пациентам из 2-й группы в случае наличия клинических проявлений или осложненного течения ЖКБ (острый холецистит, холангит, острый панкреатит) была рекомендована холецистэктомия, а также курсовое лечение УДХК (Урсосан форте) для снижения литогенности желчи, коррекции нарушенных метаболических процессов.
Обсуждение
Применение препаратов УДХК в качестве патогенетической терапии у пациентов при сочетании НАЖБП и ЖКБ целесообразно по многим причинам. УДХК является гидрофильной желчной кислотой. При ЖКБ эффекты УДХК направлены на снижение насыщения желчи холестерином за счет подавления его кишечной абсорбции и реабсорбции, угнетения синтеза холестерина в гепатоцитах и уменьшения его секреции в желчь. УДХК снижает всасывание гидрофобных эндогенных желчных кислот из тонкого кишечника, растворяет их соли и оказывает желчегонное действие. УДХК является препаратом плейотропного действия, что выражается в наличии системных эффектов в отношении гепатобилиарной системы и метаболизма в целом [16, 17]. В настоящее время известно, что препараты УДХК положительно влияют на липидный обмен. Прием УДХК сопровождается увеличением уровня ЛПВП и снижением уровня ЛПНП. Подчеркивается, что прием УДХК при НАЖБП позволяет не только снизить уровень АЛТ, АСТ, ГГТП, но и уменьшить степень стеатоза и фиброза печени [15]. УДХК рассматривается в настоящее время как регулятор апоптоза, воспаления, фиброза, липидного и углеводного обмена, иммунных реакций, снижения канцерогенеза. Международное многоцентровое исследование УСПЕХ [16] показало, что монотерапия УДХК у пациентов с НАЖБП достоверно снижает гепатологические (биохимические показатели цитолиза и холестаза, снижение степени стеатоза и фиброза) и сердечно-сосудистые (снижение уровня ЛПНП, триглицеридов, повышение уровня ЛПВП, снижение толщины комплекса «интима-медиа») риски коморбидных пациентов с НАЖБП.
В нашем исследовании мы постарались изучить несколько практических вопросов лечения пациентов с сочетанием НАЖБП и ЖКБ препаратом УДХК. В изученной когорте большинство (75% наблюдений) составили пациенты с ИМТ ≥25 кг/м2. Увеличение плотности камней и частоты стеатоза печени во 2-й группе сопровождалось большей коморбидностью пациентов в плане метаболических заболеваний, что может указывать на отягощающее влияние коморбидности на течение ЖКБ и НАЖБП. Известно, что стеатоз печени и поджелудочной железы является фактором риска сердечно-сосудистой патологии, СД. Соответственно, ожирение, СД, дислипидемия сопровождаются стеатозом печени и поджелудочной железы. Развитие фиброза печени при НАЖБП увеличивает риски развития СД, сердечно-сосудистых катастроф и уменьшает продолжительность жизни [3–10, 13, 14].
Результаты проведенного исследования показывают, что применение литолитической терапии возможно в группе пациентов с размерами камня желчного пузыря до 10 мм и плотностью камня до 75 HU. Такие параметры имеют холестериновые единичные камни, занимающие не более 1/3 просвета желчного пузыря. Наши данные совпадают с данными проведенных ранее исследований, где также была продемонстрирована возможность растворения холестериновых камней и уменьшения их на 1 мм в месяц в 30–60% случаев [18]. В другом исследовании продемонстрировано полное растворение мелких камней (<5 мм) с помощью УДХК после 6 мес. (примерно 90% случаев). После полного растворения прием УДХК рекомендовалось продолжать еще 3 мес. [20]. Отсутствие динамики или минимальное изменение диаметра камня желчного пузыря в течение 6–12 мес. на фоне лечения УДХК является плохим прогностическим признаком с точки зрения эффективности для дальнейшего литолиза. Вероятность растворения камня большого размера (>20 мм в диаметре) или нескольких камней очень низкая (менее 40–50% после 1 года лечения) [20, 22].
Терапия препаратом УДХК позволяет не только провести литолиз, но и уменьшить литогенность желчи за счет влияния на метаболические процессы (улучшить показатели липидограммы, индекса HOMA-IR), снизить риски трансформации НАЖБП в неалкогольный стеатогепатит (уменьшение цитолиза и холестаза), а также степень стеатоза печени и поджелудочной железы, снижая риск развития СД.
Заключение
Результаты исследования показали, что при ЖКБ в сочетании с НАЖБП чаще встречается такая коморбидная патология, как ожирение, заболевания сердечно-сосудистой системы, эндокринная патология, заболевания ЖКТ, которая отрицательно влияет на результативность литолиза при ЖКБ и ухудшает прогноз у данных пациентов. Увеличение плотности камней желчного пузыря ассоциировано с нарастанием стадии стеатоза и фиброза печени, формированием стеатогепатита и, как следствие, возможным увеличением кардиоваскулярных рисков. Медикаментозный литолиз у данных пациентов возможен на начальной стадии заболевания при наличии камней малых плотности и размеров. Уменьшение литогенности желчи даже без эффективного литолиза является профилактикой дальнейшего роста камней и осложнений ЖКБ. Полученные данные показывают положительную динамику в лечении стеатоза печени как предиктора нарушения липидного обмена и формирования ЖКБ и позволяют рассматривать УДХК в качестве патогенетической терапии пациентов с сочетанием ЖКБ и НАЖБП.
Сведения об авторах:
Пирогова Ирина Юрьевна — д.м.н., профессор кафедры факультетской терапии ФГБОУ ВО ЮУГМУ Минздрава России; 454092, Россия, г. Челябинск, ул. Воровского, д. 64; руководитель центра гастроэнтерологии МЦ «Лотос»; 454007, Россия, г. Челябинск, пр-т Ленина, д. 17; ORCID iD 0000-0003-1278-3746.
Уфимцева Ирина Владимировна — врач-гастроэнтеролог ООО МЦ «Лотос»; 454007, Россия, г. Челябинск, пр-т Ленина, д. 17.
Контактная информация: Пирогова Ирина Юрьевна, e-mail: irina_pirogova@inbox.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 05.04.2022.
Поступила после рецензирования 28.04.2022.
Принята в печать 27.05.2022.
About the authors:
Irina Yu. Pirogova — Dr. Sc. (Med.), Professor of the Department of Faculty Therapy of the South Ural State Medical University; 64, Voroskogo str., Chelyabinsk, 454092, Russian Federation; Head of the Center of Gastroenterology, Medical Center "Lotos" LLC; 17, Lenin Ave., Chelyabinsk, 454007, Russian Federation; ORCID iD 0000-0003-1278-3746.
Irina V. Ufimtseva — gastroenterologist, Medical Center "Lotos" LLC; 17, Lenin Ave., Chelyabinsk, 454007, Russian Federation.
Contact information: Irina Yu. Pirogova, e-mail: irina_pirogova@inbox.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 05.04.2022.
Revised 28.04.2022.
Accepted 27.05.2022.
2. Chowdhury M.Z.I., Anik A.M., Farhana Z. et al. Prevalence of metabolic syndrome in Bangladesh: a systematic review and meta-analysis of the studies. BMC Public Health. 2018;18(1):308. DOI: 10.1186/s12889-018-5209-z.
3. Маевская М.В., Котовская Ю.В., Ивашкин В.Т. и др. Консенсус для врачей по ведению взрослых пациентов с неалкогольной жировой болезнью печени и ее основными коморбидными состояниями. Терапевтический архив. 2022;94(2). DOI: 10.26442/00403660.2022.02.201363.
4. Осадчук М.А., Киреева Н.В., Васильева И.Н., Миронова Е.Д. Влияние степени выраженности метаболических нарушений на диаметр конкрементов в желчном пузыре: клинико-инструментальные и лабораторные данные. Терапия. 2019;5(3):55–59. DOI: 10.18565/therapy.2019.3.55-59.
5. Chen L.-Y., Qiao Q.-H., Zhang S.-C. et al. Metabolic syndrome and gallstone disease. World J Gastroenterol. 2012;18(31):4215–4220. DOI: 10.3748/wjg.v18.i31.4215.
6. Ata N., Kucukazman M., Yavuz B. et al. The metabolic syndrome is associated with complicated gallstone disease. Can J Gastroenterol. 2011;25(5):274–276. DOI: 10.1155/2011/356761.
7. Marques P., Collado A., Martinez-Hervás S. et al. Systemic Inflammation in Metabolic Syndrome: Increased Platelet and Leukocyte Activation, and Key Role of CX3CL1/CX3CR1 and CCL2/CCR2 Axes in Arterial Platelet-Proinflammatory Monocyte Adhesion. J Clin Med. 2019;8(5):798. DOI: 10.3390/jcm8050708.
8. Lin I.-C., Yang Y.-W., Wu M.-F. et al. The association of metabolic syndrome and its factors with gallstone disease. BMC Fam Pract. 2014;15:138. DOI: 10.1186/1471-2296-15-138.
9. Fairfield C.J., Wigmore S.J., Harrison E.M. Gallstone Disease and the Risk of Cardiovascular Disease. Sci Rep. 2019;9(1):5830. DOI: 10.1038/s41598-019-42327-2.
10. Успенский Ю., Фоминых Ю., Соусова Я. и др. Гастроэнтерологические проявления метаболического синдрома. Врач. 2018;29(12):3–8. DOI: 10.29296/25877305-2018-12-01.
11. Ткачев А.В., Тарасова Г.Н., Грошилин В.С. и др. Распространенность неалкогольной жировой болезни печени у пациентов амбулаторно-поликлинической практики в Ростове-на-Дону: региональные результаты исследования DIREG-2. Терапевтический архив. 2016;88(8):59–66. DOI: 10.17116/terarkh201688859-66.
12. Musso G., Gambino R., Cassader M., Pagano G. Meta-analysis: Natural history of non-alcoholic fatty liver disease (NAFLD) and diagnostic accuracy of non-invasive tests for liver disease severity. Ann Med. 2011;43(8):617–649. DOI: 10.3109/07853890.2010.518623.
13. Ивашкин В.Т., Маев И.В., Баранская Е.К. и др. Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению желчнокаменной болезни. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2016;26(3):64–80. DOI: 10.22416/1382-4376-2016-26-3-64-80.
14. Smelt A.H.M. Triglycerides and gallstone formation. Clin Chim Acta. 2010;411(21–22): 1625–1631. doi: 10.1016/j.cca.2010.08.003.
15. Буеверов А.О. Клинико-патогенетические параллели НАЖБП и ЖКБ. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2019;29(1):17–23. DOI: 10.22416/1382-4376-2019-29-1-17-23.
16. Ивашкин В.Т., Маевская М.В., Павлов Ч.С. и др. Клинические рекомендации по диагностике и лечению неалкогольной жировой болезни печени Российского общества по изучению печени и Российской гастроэнтерологической ассоциации. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2016;26(2):24–41. DOI: 10.22416/1382-4376-2016-26-2-24-42.
17. Маевская М.В., Надинская М.Ю., Луньков В.Д. и др. Влияние урсодезоксихолевой кислоты на воспаление, стеатоз и фиброз печени и факторы атерогенеза у больных неалкогольной жировой болезнью печени: результаты исследования УСПЕХ. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2019;29(6):22–29. DOI: 10.22416/1382-4376-2019-29-6-22-29.
18. Скворцова Т.Э., Ситкин С.И., Радченко В.Г., Селиверстов П.В. Желчнокаменная болезнь. Современные подходы к диагностике, лечению и профилактике: пособие для врачей. М.: Фортепринт; 2013.
19. Tomida S., Abei M., Yamaguchi T. et al. Long-term ursodeoxycholicacid therapy is associated with reduced risk of biliary pain and acute cholecystitis in patients with gallbladder stones: a cohort analysis. Hepatology. 1999;30(1):6–13. DOI: 10.1002/hep.510300108.
20. Tint G.S., Salen G., Colalillo A. et al. Ursodeoxycholic acid: a safe and effective agent for dissolving cholesterol gallstones. Ann Intern Med. 1982;97(3):351–356. DOI: 10.7326/0003-4819-97-3-351.
21. Драпкина О.М., Шепель Р.Н., Яковенко Э.П., Зятенкова Е.В. Неинвазивные методы выявления прогрессирующего фиброза у пациентов с неалкогольной жировой болезнью печени. Профилактическая медицина. 2019;22(2):82‑88. DOI: 10.17116/profmed20192202182.
22. Lee J.M., Hyun J.J., Choi I.Y. et al. Comparison on Response and Dissolution Rates Between Ursodeoxycholic Acid Alone or in Combination With Chenodeoxycholic Acid for Gallstone Dissolution According to Stone Density on CT Scan: Strobe Compliant Observation Study. Medicine (Baltimore). 2015;94(50):e2037. DOI: 10.1097/MD.0000000000002037.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
