Безопасность проведения трансоральной гастроскопии у пациентов с сопутствующими сердечно-сосудистыми заболеваниями в условиях анестезиологической защиты (обзор литературы)
Рубрика:
Гастроэнтерология
Эзофагогастродуоденоскопия (ЭФГДС) — классическая трансоральная гастроскопия — сопровождается повышением уровня норадреналина, кортизола, глюкозы, С-реактивного белка в крови и частоты сердечных сокращений (ЧСС). Ишемия миокарда, индуцированная психическим стрессом, у пациентов с заболеванием коронарных артерий ассоциируется с двукратным увеличением риска развития сердечно-сосудистых осложнений и общей смертности. Подобный стресс у пациента на фоне атеросклеротического поражения коронарных сосудов способен спровоцировать развитие острого инфаркта миокарда. Пациенты преклонного возраста с сопутствующими сердечно-сосудистыми и сердечно-легочными заболеваниями подвергаются высокому риску развития нежелательных явлений, вплоть до летального исхода. Данной категории пациентов для безопасного проведения эндоскопического вмешательства требуется анестезиологическая защита. Возникает необходимость в поиске метода, направленного на подавление повышенной активности симпатической нервной системы и снижение уровня ЧСС. В статье рассматриваются такие методы профилактики осложнений ЭФГДС, как бета-адреноблокаторы, альтернативная трансназальная гастроскопия и внутривенные анестетики. Из всего разнообразия представленных седативных препаратов и анальгетиков пропофол считается наиболее безопасным для применения в эндоскопии. Также очень эффективна его комбинация с мидазоламом. Согласно современным руководствам, седация должна быть предложена каждому пациенту перед эндоскопическим исследованием.
Ключевые слова: эзофагогастродуоденоскопия, трансназальная гастроскопия, трансоральная гастроскопия, нежелательные явления, седация, пропофол, мидазолам.
Ключевые слова: эзофагогастродуоденоскопия, трансназальная гастроскопия, трансоральная гастроскопия, нежелательные явления, седация, пропофол, мидазолам.
R.E. Leshchenko1, N.S. Davydova2
1 LLC Medical Association «New hospital», Ekaterinburg
2 Ural State Medical University, Ekaterinburg
Esophagogastroduodenoscopy (EFGDS) — a classical transoral gastroscopy — is accompanied by an increase in the level of norepinephrine, cortisol, glucose, C-reactive protein in the blood and heart rate. Myocardial ischemia induced by mental stress in patients with coronary artery disease is associated with a twofold increase in the risk of developing cardiovascular complications and total mortality. Such stress in the patient with atherosclerotic lesions of the coronary vessels, can provoke the development of acute myocardial infarction. Elderly patients with concomitant cardiovascular and cardiopulmonary diseases are at high risk of developing adverse events, up to a lethal outcome. For this category of patients anesthesia protection is required to provide safety of endoscopic intervention. There is a need to find a method aimed at suppressing the increased activity of the sympathetic nervous system and lowering the level of heart rate. The article considers such methods of preventing these complications, as beta-adrenoblockers, alternative transnasal gastroscopy and intravenous anesthetics. Among all presented sedatives and analgesics, Propofol is considered the safest drug for endoscopy. Its combination with midazolam is also very effective. According to modern guidelines, sedation should be offered to each patient before endoscopic examination.
Key words: esophagogastroduodenoscopy, transnasal gastroscopy, transoral gastroscopy, adverse events, sedation, propofol, midazolam.
For citation: Leshchenko R.E., Davydova N.S. Safety of transoral gastroscopy in patients with concomitant cardiovascular diseases under sedation (review) // RMJ. Medical Review. 2018. № 7(I). P. 40–45.
Обзор литературы посвящен безопасности проведения трансоральной гастроскопии у пациентов с сопутствующими сердечно-сосудистыми заболеваниями в условиях анестезиологической защиты
Введение
Эзофагогастродуоденоскопия (ЭФГДС) является «золотым стандартом» исследования верхних отделов желудочно-кишечного тракта (ЖКТ) [1]. ЭФГДС позволяет визуально оценить состояние слизистой верхних отделов ЖКТ и получить биопсийный материал для гистологического исследования [1].Инвазивные методы исследования ЖКТ могут сопровождаться развитием нежелательных явлений (НЯ), литературные данные о причинах и частоте их развития разноречивы [2].
Авторы из Великобритании выявили неожиданно высокую частоту развития НЯ и высокий уровень смертности при проведении лечебной и диагностической ЭФГДС. Были зарегистрированы сердечно-легочные осложнения и НЯ, связанные с седацией [3, 4].
По другим опубликованным иностранным данным из нескольких исследовательских центров, частота развития НЯ составила 1 случай на 200–10 000 эндоскопических процедур; смертность — 0–1 случай на 2000 исследований [5–7].
Частота развития сердечно-легочных осложнений, согласно данным большого ретроспективного анализа, составила 1 случай на 170 эндоскопических процедур, смертность от сердечно-сосудистых НЯ — 1 случай на 10 000 исследований. Эти данные получены в результате анализа 140 000 эндоскопических исследований [8].
В настоящее время большинство ЭФГДС в США и Европе выполняются в условиях седации [9].
Были опубликованы результаты ретроспективного анализа, где клиницисты проанализировали 73 029 эндоскопических исследований верхних отделов ЖКТ. Частота остановки сердечной деятельности и смертности составила 6,07 и 4,28 случая на 10 000 пациентов соответственно [10].
В 1970–1990-е гг., согласно имеющимся литературным данным, частота развития сердечно-сосудистых НЯ регистрировалась в значительно большем количестве, чем в настоящее время. Тахикардия, брадикардия и признаки ишемии миокарда отмечены в диапазоне в 31–41% случаев [11–13].
Неоднородность опубликованных результатов объясняется различием методов сбора данных [14]. Некоторые авторы указывают только незначительные НЯ, такие как транзиторная гипоксемия, малые объемы кровопотери и т. д. [15], другие — акцентируют внимание на серьезных нежелательных явлениях (СНЯ), которые приводят к преждевременной остановке исследований и госпитализации [15].
Сердечно-сосудистые и сердечно-легочные осложнения, связанные с проведением ЭФГДС
Мониторирование сердечного ритма во время проведения ЭФГДС позволило исследователям-клиницистам зарегистрировать у пациентов развитие тахикардии с ЧСС более 120 уд./мин, желудочковые и наджелудочковые экстрасистолы, а также косонисходящую депрессию сегмента S-T. Важно отметить, что большая часть вышеописанных изменений на электрокардиограмме (ЭКГ) была зафиксирована у пациентов с сопутствующей сердечно-легочной патологией [16–18].К.Yazawa et al. оценили риски развития НЯ при проведении ЭФГДС у 53 пациентов с сопутствующими сердечно-сосудистыми заболеваниями сердца. Увеличение работы миокарда сопровождалось депрессией сегмента S-T у пациентов с мультифокальным поражением коронарных артерий [19].
Согласно рекомендациям, сопутствующая сердечно-легочная патология, преклонный возраст и 3-й класс по ASA (Американская ассоциация анестезиологов) являются факторами риска развития сердечно-легочных осложнений при проведении ЭФГДС [14].
Патогенез сердечно-сосудистых НЯ
Патогенез сердечно-сосудистых НЯ при проведении ЭФГДС остается неясным [20]. Ранее считалось, что возникновение гипоксии в результате проведения седации является основной причиной развития сердечно-сосудистых осложнений. Дополнительная ингаляция кислородом не оказывала существенного влияния на ЭКГ-изменения во время проведения процедуры эндоскопического исследования. Было высказано предположение, что активация симпатической нервной системы (СНС) и тахикардия выступают в роли основных патогенетических факторов, влияющих на изменение гемодинамических показателей [13, 21–23].
М.Ristikankare et al. также показали, что тахикардия играет ведущую роль в патогенезе формирования сердечно-сосудистых осложнений во время выполнения эндоскопических исследований [24].
Человеческий организм, подверженный влиянию травмы, инициирует системный гормональный ответ для поддержания гомеостаза. ЭФГДС расценивается как травма. Механическая стимуляция верхних отделов ЖКТ эндоскопическим аппаратом сопровождается болью в горле, кашлем и гипоксией [25]. Возникновение временного эндокринного ответа, рассматривается как классическая стресс-реакция организма, сопоставимая с проведением хирургического вмешательства [26]. Повышение уровня эндокринных гормонов играет важную роль в развитии тахикардии [27].
Классический эндокринный ответ во время проведения ЭФГДС был описан в нескольких клинических проспективных исследованиях. Важно отметить, что повышение уровня норадреналина, кортизола, глюкозы крови, С-реактивного белка сопровождалось увеличением ЧСС [25, 26].
Заслуживает внимания исследование, в котором М.Ristikankare et al. оценили вегетативную регуляцию сердечной деятельности у 213 пациентов во время и после проведения гастроскопии. Исследователи-клиницисты отметили статистически достоверно значимое повышение ЧСС
в группе пациентов без седации, в сравнении с исходными данными (p<0,001). Через 30 мин после процедуры исследования уровень ЧСС не вернулся к исходным значениям (рис. 1). В контрольной группе активность СНС была подтверждена данными вариабельности сердечного ритма, с помощью которых оценивают его вегетативную регуляцию.
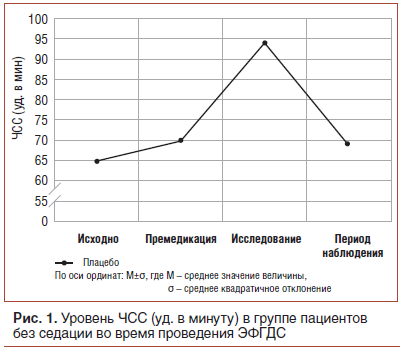
Авторы констатировали, что гастроскопия без седации сопровождается активацией СНС. Повышенный уровень активности ЦНС может играть важную роль в этиологии формирования сердечно-сосудистых осложнений, связанных с эндоскопическим вмешательством. Также показано, что развитие серьезных сердечно-сосудистых осложнений у молодых и здоровых пациентов маловероятно [20].
W.Adachi et al. у семи здоровых добровольцев оценили уровень сердечного стресса во время проведения ЭФГДС без седации. На основании полученных результатов был сделан следующий вывод: сердечный стресс во время проведения эндоскопического исследования сопоставим с физической нагрузкой средней интенсивности. Высокий уровень индекса напряжения миокарда (ИНМ), равный 66%, подтверждает данный вывод. Пациенты, испытывающие подобный сердечный стресс, имели повышенный уровень ЧСС и адреналина в крови, что было статистически достоверно значимо (p<0,05%) [28]. ИНМ — это неинвазивный метод оценки потребления кислорода миокардом и функции желудочков сердца в конкретный период времени [28–30].
ИНМ рассчитывается по формуле:
САД (среднее артериальное давление) × ЧСС / 1000 [31].
Составляющие ИНМ (ЧСС и САД) играют важную роль в доставке кислорода к миокарду и регуляции ишемической болезни сердца в условиях стресса [29]. Повышение уровня САД без изменения ЧСС способствует увеличению доставки кислорода к миокарду. В результате одновременного повышения уровня САД и ЧСС доставка кислорода к миокарду снижается [32]. СогласноW.B.White et al., ИНМ≤12 с ЧСС в пределах 60–120 уд./мин и САД 100–140 мм рт. ст. считается нормальным значением, без какого-либо риска развития сердечно-сосудистых осложнений [33].
Острый инфаркт миокарда (ОИМ) может развиться как во время, так и после ЭФГДС [4, 34]. В литературе описаны единичные случаи возникновения ОИМ, развитие которых связано с проведением эндоскопических вмешательств [35]. Это объясняется тем, что эмоциональный стресс вызывает вазоконстрикцию коронарных артерий и увеличение ЧСС [36]. На этом фоне возрастает потребность миокарда в кислороде. Кроме того, стресс может спровоцировать электрическую нестабильность и нарушение реполяризации миокарда, которые являются предикторами развития аритмии сердца и внезапной смерти [37].
В подтверждение вышеизложенного, согласно данным крупного метаанализа, ишемия миокарда, индуцированная психическим стрессом у пациентов с заболеванием коронарных артерий, ассоциируется с двукратным увеличением риска развития сердечно-сосудистых осложнений и общей смертности (относительный риск 2,24, 95% доверительный интервал 1,59–3,15) [38].
Таким образом, можно сделать следующий вывод: миокард испытывает стресс, находясь под влиянием повышенной активности СНС во время проведения ЭФГДС. Подобный стресс на фоне атеросклеротического поражения коронарных сосудов способен спровоцировать развитие острого инфаркта миокарда. Возникает необходимость в поиске метода, направленного на подавление повышенной активности СНС и снижение уровня ЧСС.
Методы профилактики и лечения сердечно-сосудистых НЯ
Тахикардия — важный патогенетический фактор развития ишемии миокарда, которая может возникнуть во время ЭФГДС [39].Представленные методы профилактики и лечения сердечно-сосудистых НЯ в основном направлены на снижение уровня ЧСС во время проведения гастроскопии:
Бета-адреноблокаторы. Согласно полученным данным в двойном слепом рандомизированном контролируемом исследовании, метопролол предотвращал развитие ишемии миокарда во время проведения эндоскопической холангиопанкреатографии. Средняя длительность эндоскопической холангиопанкреатографии составила от 31 до 37 мин. Вероятно, предотвращение ишемии связано со снижением ЧСС во время процедуры исследования. Это подтверждает ключевую роль тахикардии в развитии ишемии [40].
Трансназальная гастроскопия (ТГС) может применяться в качестве альтернативы классической ЭФГДС (трансоральной гастроскопии). Как предполагалось ранее, трансназальная гастроскопия с использованием гастроскопа меньшего диаметра (4,0–6,0 мм) может предотвратить развитие НЯ и способствовать увеличению удовлетворенности пациента от проводимой процедуры [41–43]. Действительно, применение трансназального гастроскопа ассоциируется с хорошей переносимостью ЭФГДС и меньшим уровнем тревоги у пациента [43]. Более половины пациентов (54,4%) изъявили желание пройти трансназальную гастроскопию повторно в случае необходимости [42].
Интерес представляет рандомизированное проспективное клиническое исследование, где исследователи оценили уровень повышения ЧСС на фоне проведения трансоральной и трансназальной гастроскопии. В зависимости от метода проведения гастроскопии пациенты были разделены на 2 группы: в 1-й группе (n=50) выполнялась трансоральная ЭФГДС (диаметр гастроскопа 9,0 мм), во 2-й группе (n=48) выполнялась ТГС (диаметр гастроскопа 6,0 мм). Частота успешного выполнения ТГС составила 77% по причине стеноза носовых ходов полости носа у части пациентов. Исследователи получили следующие результаты: исходно в обеих группах исследуемых уровень ЧСС не различался (р=0,6). Количество пациентов с развитием тахикардии (ЧСС≥100 уд./мин) также было больше в группе ЭФГДС (n=31; 65%), чем в группе ТГС (n=23; 52%), но отличия были статистически достоверно незначимые. Максимальный средний уровень ЧСС в 1-й и 2-й группах составил 107 и 101 уд./мин (M±σ) (р=0,05) соответственно. В результате ТГС не исключает развития тахикардии во время проведения процедуры исследования и не предотвращает увеличения работы миокарда [41].
Внутривенные анестетики. Как известно, общая анестезия способна оказывать влияние на активность СНС [44]. Данный факт побудил исследователей-клиницистов рассмотреть седацию в качестве защиты от стресса [45].
Американское общество гастроинтестинальной эндоскопии (ASGE) и Японское анестезиологическое общество (JSA) рекомендуют применять бензодиазепины, наркотические анальгетики и седативные препараты для седации в эндоскопии [46, 47]. В представленных рекомендациях фигурирует нейролептик — галоперидол. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) рекомендует применять галоперидол в качестве дополнительного седативного средства, когда препараты первой линии не способны обеспечить необходимый уровень седации во время эндоскопического исследования [46].
Симпатическая нервная система (СНС) играет важную роль в регуляции сердечно-сосудистой системы. Для оценки влияния анестетиков на СНС используется микронейрография — метод непосредственной и быстрой оценки симпатической нервной активности. Во время исследования микроэлектрод вводят в малоберцовый или большеберцовый нерв и оценивают показатели нейрограммы. Методом микронейрографии регистрируют мышечную (МСНА) и кожную симпатическую нервную активность (КСНА). Концентрация норадреналина в плазме венозной крови, забранная из области предплечья, коррелирует с МСНА малоберцового нерва [44].
Барбитураты, бензодиазепины и пропофол снижают активность СНС в покое и подавляют барорефлекс на изменения артериального давления (АД) (табл. 1) [48].
Кетамин — единственный инъекционный анестетик, который повышает АД и ЧСС у пациентов во время анестезии [54]. R (-) кетамин у здоровых пациентов повышает АД и уровень норадреналина в плазме крови [55]. Повышение уровня норадреналина в плазме крови связано со способностью кетамина ингибировать обратный захват катехоламинов в нейронах, а также с усилением симпатического влияния на системы органов.

В отличие от R (-) кетамина, барбитуратов и пропофола, S (+) кетамин увеличивает мышечную симпатическую нервную активность, несмотря на повышенное АД [44].
Фентанил индуцирует повышение норадреналина на 70% и адреналина на 180% в плазме крови у здоровых пациентов на спонтанном дыхании [56]. По другим данным, фентанил, применяемый в качестве премедикации у здоровых пациентов, не изменял уровня мышечной симпатической нервной активности [50]. В первом исследовании повышение активности СНС может быть результатом развившейся опиоид-индуцированной депрессии дыхания [44]. В исследовании на собаках, когда исключалась вероятность развития гиповентиляции, высокие дозы фентанила уменьшали уровень ЧСС, АД, норадреналина и адреналина в плазме крови [57]. Во-вторых, как классически показано на примере тримеперидина, опиоиды могут высвобождать гистамин из тучных клеток, что приводит к снижению АД за счет вазодилатации [58]. В свою очередь, снижение АД может привести к рефлекторной активации СНС [59, 60]. В итоге снижения активности СНС можно ожидать только в случае использования наркотических анальгетиков в высоких дозах и длительного периода применения. Барбитураты, как известно, оказывают депрессивное действие на центральную нервную систему [44]. Тахикардия, возникающая после введения индукционной дозы препарата, связана с подавлением активности парасимпатической нервной системы [56]. Барбитураты в одинаковой степени подавляют МСНА и КСНА [44].
Диазепам при использовании у здоровых добровольцев снижал уровень катехоламинов в плазме крови и подавлял активность барорефлекса [61]. В исследовании М.Bechir et al. применяли алпразолам с целью проведения анксиолитической терапии у пациентов с паническими расстройствами. В результате повышение уровня МСНА и ЧСС было зарегистрировано у пациентов в контрольной группе и в группе пациентов с паническими расстройствами [62]. Диазепам способствует снижению АД, что связано с центральным механизмом действия препарата [63]. В целом бензодиазепины могут снижать базовый уровень КСНА и рефлекторное увеличение активности СНС в ответ на повышение АД. Следует подчеркнуть, что комбинированное использование бензодиазепинов и опиоидов приводит к существенному снижению активности СНС [44].
Пропофол снижает среднее АД со 100 до 73 мм рт. ст., что сопровождается уменьшением МСНА на 66±7% в течение 3 мин [60, 64]. Применение пропофола с целью обеспечения среднего и глубокого уровней седации значимо снижает симпатическую нервную активность на 65% и 92% соответственно [44].
В своем исследовании T.J.Ebert et al. задались целью выявить механизмы, вызывающие гипотонию на фоне применения седативных доз пропофола. В протоколе принимали участие здоровые добровольцы в возрасте от 21 до 37 лет. Исследователи сделали следующие выводы: использование пропофола в дозе, которая не компрометирует легочную функцию, оказывает существенное ингибирующее влияние на симпатическую нервную активность и рефлекторный ответ СНС на развитие гипотонии. Подобное влияние препарата на СНС приводит к вазодилатации и значимому снижению среднего АД [65].
Нет сомнений в том, что медикаментозная седация способна снижать активность СНС и уровень катехоламинов в плазме крови. Следовательно, применение медикаментозной седации с целью профилактики и лечения сердечно-сосудистых НЯ во время проведения ЭФГДС может быть патогенетически обоснованным.
В литературе представлено небольшое количество рандомизированных, проспективных и контролируемых исследований, где оценивался риск развития сердечно-легочных осложнений во время проведения ЭФГДС в условиях седации (табл. 2). В данных проспективных исследованиях оценка риска развития сердечно-сосудистых НЯ у пациентов с сопутствующими сердечно-сосудистыми заболеваниями целенаправленно не проводилась. В исследованиях пропофол фигурирует в качестве основного седативного препарата, применяемого при ЭФГДС. Частота развития сердечно-легочных НЯ зарегистрирована в меньшем количестве на фоне использования пропофола. Данный факт можно объяснить особенностями фармакокинетики и коротким периодом полувыведения препарата, что идеально подходит для применения в эндоскопии [76, 77].
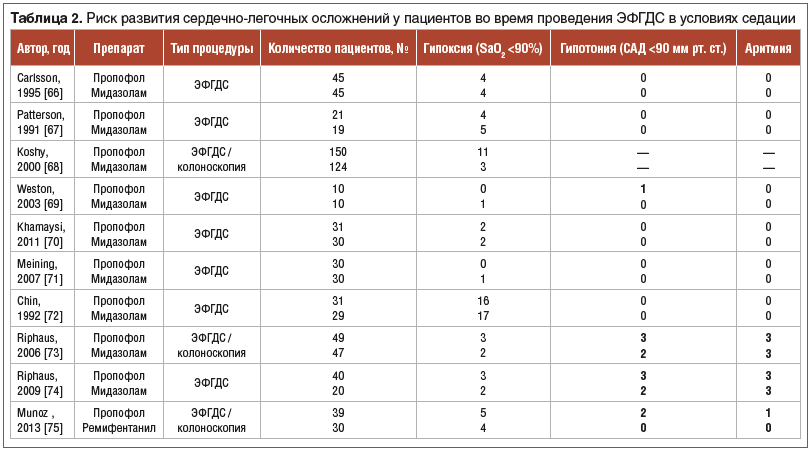
Традиционное использование комбинации бензодиазепина и наркотического анальгетика для проведения седации сокращается. Основные причины — это длительный период восстановления и низкий уровень удовлетворенности пациентов проведением процедуры исследования. Метаанализ, выполненный W.Vaibhav et al., также показал, что использование пропофола в качестве седативного препарата ассоциируется с меньшей частотой развития гипоксии, гипотонии и аритмий. Всем пациентам выполнялись гастроинтестинальные эндоскопические исследования. Цель метаанализа состояла в том, чтобы сравнить частоту развития сердечно-легочных НЯ в условиях применения пропофола и традиционных методов обезболивания [78].
Мидазолам — бензодиазепин, часто используемый для седации в эндоскопии. В литературе представлено несколько нерандомизированных исследований, где показана способность мидазолама влиять на уровень эндокринных гормонов в крови и развившуюся тахикардию во время проведения эндоскопического вмешательства. Результаты показали, что мидазолам не подавляет тахикардию и эндокринный ответ на эндоскопическое вмешательство [20, 25, 45].
В одном ретроспективном анализе наглядно продемонстрировано влияние комбинации мидазолам/пропофол на частоту развития НЯ у пациентов со средним возрастом 75 лет. Все пациенты имели сопутствующие заболевания, в т. ч. сердечно-сосудистые (заболевания коронарных сосудов, болезни клапанов сердца и хроническая сердечная недостаточность) (табл. 3). Важно отметить, что 75,8% пациентов имели 3-й класс по ASA и 13,5% — 4-й класс. Часть пациентов страдали пневмонией и хронической обструктивной болезнью легких [79]. Из всех гастроинтестинальных исследований ЭФГДС была выполнена в 270 (46,7%) случаях. В итоге ни у одного пациента на фоне седации комбинацией мидазолам/пропофол не было зарегистрировано развития тахикардии. Данный факт подтверждает способность пропофола снижать активность СНС даже при среднем уровне седации [44]. Несмотря на высокий риск по ASA, смертность, связанная с процедурой исследования, составила 0% [79].

Заключение
Проведение ЭФГДС сопряжено с развитием психоэмоционального стресса. Как показали исследования, уровень стресса сопоставим с физической нагрузкой средней интенсивности. На фоне катехоламинового всплеска в плазме крови с последующим увеличением ЧСС более 120 уд./мин возрастает потребность миокарда в кислороде. Молодые и здоровые пациенты за счет компенсаторных механизмов способны легко справляться с любыми психоэмоциональными нагрузками без риска для здоровья. Очевидно, что пациенты преклонного возраста с сопутствующими сердечно-сосудистыми и сердечно-легочными заболеваниями подвергаются высокому риску развития нежелательных явлений вплоть до летального исхода. Данной категории пациентов для безопасного проведения эндоскопического вмешательства требуется анестезиологическая защита. Вместе с тем анестезиологическое пособие не должно нести в себе дополнительных рисков развития НЯ. Пропофол из всего разнообразия представленных седативных препаратов и анальгетиков считается наиболее безопасным для применения в эндоскопии, он способен на короткий промежуток времени защитить организм пациента от внешнего раздражающего фактора.В истории нет рандомизированных проспективных сравнительных исследований, где исследователи смогли показать безопасность и необходимость проведения ЭФГДС у пациентов с сопутствующими сердечно-сосудистыми заболеваниями в условиях анестезиологической защиты. Отсутствие сравнительных исследований прежде всего связано с тем, что в развитых странах пациенты отказываются от проведения эндоскопического исследования без седации. Согласно современным руководствам, седация должна быть предложена каждому пациенту перед эндоскопическим исследованием [80]. Седация при проведении эндоскопической процедуры помогает устранить беспокойство и дискомфорт у пациентов [46].
Таким образом, на сегодняшний день седация носит рекомендательный характер при проведении эндоскопических процедур у любой категории пациентов. Однако, на наш взгляд, безопасность пациентов должна быть приоритетом.
Литература
1. BegS., RagunathK., WymanA. et al. Quality standards in upper gastrointestinal endoscopy: a position statement of the British Society of Gastroenterology (BSG) and Association of Upper Gastrointestinal Surgeons of Great Britain and Ireland (AUGIS) // Gut. 2017. Vol. 66. P. 11.
2. GreenJ. BSG Guidelines in Gastroenterology // Gut. 2006. Vol. 55 (4). P. 442.
3. QuineM.A., BellG.D., McCloy R.F. et al. Prospective audit of upper gastrointestinal endoscopy in two regions of England: safety, staffing and sedation, methods // Gut. 1995. Vol. 36. P. 462–467.
4. BowlesC., LeicesterR., RomayaC. et al. A prospective study of colonoscopy practice in the United Kingdom today are we adequately prepared for national colorectal cancer screening tomorrow? // Gut. 2004. Vol. 53. P. 277–283.
5. SiegA., HachmoellerE.Prospective evaluation of complications in outpatient GI endoscopy: a survey among German gastroenterologists // Gastrointestinal endoscopy. 2001. Vol. 53. P. 620–627.
6. WolfsenH.C., HemmingerL.L., AchemS.R. et al. Complications of endoscopy of the upper gastrointestinal tract: a single-center experience // Mayo Clinic Proc. 2004. Vol. 79. P. 1264–1267.
7. HeussL., FroehlichF., BeglingerC.Changing patterns of sedation and monitoring practice during endoscopy: results of a nationwide survey in Switzerland // Endoscopy. 2005. Vol. 37. P. 161–166.
8. SharmaV.K., NguyenC.C., CrowellM.D. et al. A national study of cardiopulmonary unplanned events after GI endoscopy // Gastrointestinal endoscopy. 2007. Vol. 66. P. 27–34.
9. CohenL.B., WecslerJ.S., GaetanoJ.N. et al. Endoscopic sedation in the United States: results from a nationwide survey // Am J Gastroenterol. 2006. Vol. 101. P. 967–974.
10. GoudraB., NuzatA., SinghP. et al. Cardiac arrests in patients undergoing gastrointestinal endoscopy: A retrospective analysis of 73,029 procedures // Saudi J Gastroenterol. 2015. Vol. 21 (6). P. 400–411.
11. LevyN., AbinaderE.Continuous electrocardiographic monitoring with Holter electrocardiocorder throughout all stages of gastroscopy // Am J Dig Dis. 1977. Vol. 22. P. 1091–1096.
12. PyöräläK., SalmiH., JussilaJ., HeikkiläJ.Electrocardiographic changes during gastroscopy // Endoscopy. 1973. Vol. 5. P. 183–186.
13. RosenbergJ., StausholmK., AndersenI. et al. No effect of oxygen therapy on myocardial ischemia during gastroscopy // Scand J Gastroenterol. 1996. Vol. 31. P. 200–205.
14. American Society for Gastrointestinal Endoscopy. Guidelines. Adverse events of upper GI endoscopy // 2012. Vol. 76 (4). P. 707–718. DOI: 10.1016/j.gie.2012.03.252.
15. CottonP.B., EisenG.M., AabakkenL. et al. A lexicon for endoscopic adverse events: report of an ASGE workshop // GI endoscopy. 2010. Vol. 71. P. 446–454.
16. GiesenH., K.Cardiac side-effects of esophago-gastro-duodenoscopy in relation to premedication // Dtsch Med Wochenschr. 1978. Vol. 103 (39). P. 1517–1520.
17. Wierzbicka-Paczos E.Arrhythmia during endoscopy of the upper gastrointestinal tract // Przegl Lek. 1989. Vol. 46 (5). P. 451–454.
18. GuptaS.C., GopalswamyN., SarkarA. et al. Cardiac arrhythmias and electrocardiographic changes during upper and lower gastrointestinal endoscopy // Mil Med. 1990. Vol. 155 (1). P. 9–11.
19. YazawaK., AdachiW., KoideN. et al. Changes in cardiopulmonary parameters during upper gastrointestinal endoscopy in patients with heart disease: towards safer endoscopy // Endoscopy. 2000. Vol. 32 (4). P. 287–293.
20. RistikankareM., JulkunenR., HeikkinenM. et al. Cardiac autonomic regulation during gastroscopy // Dig Liver Dis. 2009. Vol. 41 (9). P. 52–64.
21. JurellK.R., O’Connor K.W., SlackJ. et al. Effect of supplemental oxygen on cardiopulmonary changes during gastrointestinal endoscopy // Gastrointestinal endoscopy. 1994. Vol. 40. P. 665–670.
22. RosenbergJ., JorgensenL.N., RasmussenV. et al. Hypoxemia and myocardial ischemia during and after endoscopic cholangiopancreatography: call for further studies // Scand. J.Gastroent. 1992. Vol. 27. P. 717–720.
23. RosenbergJ., OvergaardH., AndersenM. et al. Double blind randomized controlled trial of effect of metoprolol on myocardial ischemia during endoscopic cholangiopancreatography // Br. Med. 1996. Vol. 313. P. 25–61.
24. RistikankareM., JulkunenR., HeikkinenM. et al. Sedation, topical pharyngeal anesthesia and cardiorespiratory safety during gastroscopy // J Clin Gastroenterol. 2006. Vol. 40. P. 899–905.
25. YetkinG., ObaS., UludagM. et al. Effects of sedation during upper gastrointestinal endoscopy on endocrine response and cardiorespiratory function // Braz J Med Biol Res. 2007. Vol. 40 (12). P. 1647–1652.
26. TonnesenH., PuggaardL., BraagaardJ. et al. Stress response to endoscopy // Scand J Gastroenterol. 1999. Vol. 34. P. 629–631.
27. LynnR.B.Mechanisms of esophageal pain // Am J Med. 1992 Vol. 92. P. 11S–19S.
28. AdachiW., YazawaK., OwaM. et al. Quantification of cardiac stress during EGD without sedation // Gastrointest Endosc. 2002 Vol. 55 (1). P. 58–64.
29. PremaS., SembulingamK., SaraswathiI., SrideviG.Rate Pressure Product as a Determinant of Physical Fitness in Normal Young Adults // Am J Hypertens. 2015. Vol. 14 (4). P. 2279–0861.
30. UchiyamaK., IshikawaT., SakamotoN. et al. Analysis of cardiopulmonary stress during endoscopy: is unsedated transnasal esophagogastroduodenoscopy appropriate for elderly patients? // Can J Gastroenterol Hepatol. 2014. Vol. 28 (1). P. 31–34.
31. De MeersmanR.E., ZionA.S., GiardinaE.G et al. Estrogen replacement, vascular distensibility and blood pressures in postmenopausal women // Am J Physiol. 1998. Vol. 274. P. H1539–H1544.
32. SangeetaN., LilyW., HemL.Effect of exercise on rate pressure product in premenopausal and postmenopausal women with coronary artery disease // Indian J Physiol Pharmacol. 2007. Vol 51 (3). P. 279–283.
33. WhiteW.B.Heart rate and rate pressure product as determinants of cardiovascular risk in patients with hypertension // Am. J.Hypertens. 1999. Vol. 12. P. 5.
34. BellG.D.Premedication, Preparation, and Surveillance in “State of the Art in Gastroenterologic Endoscopy — A review of last year’s most significant publications“ // Endoscopy. 2004. Vol. 36. P. 23–31.
35. ChangM.C., LeeA.Y., ChenT.J., ChangW.F.Acute myocardial infarction after upper gastrointestinal gastroscopy // Zhonghua Yi Xue Za Zhi (Taipei). 2001. Vol. 64 (10). P. 581–585.
36. KrantzD.S., BurgM.M.Current perspective on mental stress-induced myocardial ischemia // Psychosom Med. 2014. Vol. 76. P. 168–170.
37. LampertR., ShustermanV., BurgM. et al. Anger induced T-wave alternans predicts future ventricular arrhythmias in patients with implantable cardioverter-defibrillators // J Am Coll Cardiol. 2009. Vol. 53. P. 774–778.
38. WeiJ., RooksC., RamadanR. et al. Meta-analysis of mental stress-induced myocardial ischemia and subsequent cardiac events in patients with coronary artery disease // Am J Cardiol. 2014. Vol. 114 (2). P.187–192.
39. HolmC., RosenbergJ.Pulse oximetry and supplemental oxygen during gastrointestinal endoscopy: a critical review // Endoscopy. 1996. Vol. 28. P.703–711.
40. RosenbergJ., OvergaardH., AndersenM. et al. Double blind randomized controlled trial of effect of metoprolol on myocardial ischemia during endoscopic cholangiopancreatography // BMJ. 1996. Vol. 313. P.258–261.
41. NeuenschwanderA.U., ChristensenM., SchulzeS. et al. Less tachycardia during transnasal versus conventional gastroscopy // Dan MedJ. 2012. Vol. 59 (6). P.A4432.
42. UchiyamaK., IshikawaT., SakamotoN. et al. Analysis of cardiopulmonary stress during endoscopy: is unsedated transnasal esophagogastroduodenoscopy appropriate for elderly patients? // Can J Gastroenterol Hepatol. 2014. Vol. 28 (1). P.31–34.
43. ThotaP.N., ZuccaroG.J., VargoJ.J. et al. A randomized prospective trial comparing unsedated esophagoscopy via transnasal and transoral routes using a 4-mm video endoscope with conventional endoscopy with sedation // Endoscopy. 2005. Vol. 37 (6). P.559–565.
44. NeukirchenM., KienbaumP.Sympathetic nervous system: evaluation and importance for clinical general anesthesia // Anesthesiology. 2008. Vol. 109 (6). P.1113–1131.
45. YazawaK., AdachiW., OwaM. et al. Can sedation reduce the cardiac stress during gastrointestinal endoscopy? A study with non-invasive automated cardiac flow measurement by color Doppler echocardiography // Scand J Gastroenterol. 2002. Vol. 37 (5). P.602–607.
46. The Standards of Practice Committee of the American Society for Gastrointestinal Endoscopy (ASGE). Sedation and anesthesia in GI endoscopy. Guidelines // Gastrointestinal Endoscopy. 2007. Vol. 133. P.501–675.
47. KatsutoshiO., KenH., AtsushiI., MitsuruK.Guidelines for sedation in gastroenterological endoscopy // Dig Endosc. 2015. Vol. 27. P.435–449.
48. AkataT.General anesthetics and vascular smooth muscle: Direct actions of general anesthetics on cellular mechanisms regulating vascular tone // Anesthesiology. 2007 Vol. 106. P.365–391.
49. KienbaumP., HeuterT., PavlakovicG. et al. S (+) -ketamine increases muscle sympathetic activity and maintains the neural response to hypotensive challenges in humans // Anaesthesiology. 2001. Vol. 94. Р.252–258.
50. SellgrenJ., PontenJ., WallinB.G.Characteristics of muscle nerve sympathetic activity during general anaesthesia in humans // Acta. Anaesthesiol. Scand. 1992. Vol. 36. Р.336–345.
51. EbertT.J., KanitzD.D., KampineJ.P.Inhibition of sympathetic neural outflow during thiopental anesthesia in humans // Anesth. Analg. 1990. Vol. 71. Р.319–326.
52. SellgrenJ., PontenJ., WallinB.G.Percutaneous recording of muscle nerve sympathetic activity during propofol, nitrous oxide, and isoflurane anesthesia in humans // Anaesthesiology. 1990. Vol. 73. Р.20–27.
53. EbertT.J., MuziM., BerensR. at al. Sympathetic responses to induction of anesthesia in humans with propofol or etomidate // Anaesthesiology. 1992. Vol. 76. Р.725–733.
54. TweedW.A., MinuckM., MyminD.Circulatory responses to ketamine anesthesia // Anesthesiology. 1972 Vol. 37. P.613–619.
55. KienbaumP., HeuterT., PavlakovicG. et al. Racemic ketamine decreases muscle sympathetic activity but maintains the neural response to hypotensive challenges in humans // Anesthesiology. 2000. Vol. 92. P.94–101.
56. HoeheM., DukaT.Opiates increase plasma catecholamines in humans // Psychoneuroendocrinology. 1993. Vol. 18. P.141–148.
57. TaneyamaC., GotoH., KohnoN. et al. Effects of fentanyl, diazepam, and the combination of both on arterial baroreflex and sympathetic nerve activity in intact and barodenervated dogs // Anesth. Analg. 1993. Vol. 77. P.44–48.
58. FlackeJ.W., FlackeW.E., BloorB.C. et al. Histamine release by four narcotics: A double-blind study in humans // Anesth. Analg. 1987. Vol. 66. P.723–730.
59. SundlofG., WallinB.G.Human muscle nerve sympathetic activity at rest: Relationship to blood pressure and age // J Physiol. 1978. Vol. 274. P.621–637.
60. SellgrenJ., BiberB., HenrikssonB.A. et al. The effects of propofol, methohexitone and isoflurane on the baroreceptor reflex in the cat // Acta. Anaesthesiol. Scand. 1992. Vol. 36. P.784–790.
61. MartyJ., GauzitR., LefevreP. et al. Effects of diazepam and midazolam on baroreflex control of heart rate and on sympathetic activity in humans // Anesth. Analg. 1986. Vol. 65. P.113–119.
62. Bechir M, Schwegler K, ChenevardR. et al. Anxiolytic therapy with alprazolam increases muscle sympathetic activity in patients with panic disorders // Auton Neurosci. 2007. Vol. 134. P.69–73.
63. KitajimaT., KanbayashiT., SaitoY. et al. Diazepam reduces both arterial blood pressure and muscle sympathetic nerve activity in human // Neurosci Lett. 2004. Vol. 355. P.77–80.
64. SellgrenJ., EjnellH., ElamM. et al. Sympathetic muscle nerve activity, peripheral blood flows, and baroreceptor reflexes in humans during propofol anesthesia and surgery // Anesthesiology. 1994. Vol. 80. P.534–544.
65. EbertT.J.Sympathetic and hemodynamic effects of moderate and deep sedation with propofol in humans // Anesthesiology. 2005. Vol. 103. P.20–24.
66. CarlssonU., GrattidgeP.Sedation for upper gastrointestinal endoscopy: a comparative study of propofol and midazolam // Endoscopy. 1995. Vol. 27. P.240–243.
67. PattersonK.W, CaseyP.B., MurrayJ.P. et al. Propofol sedation for outpatient upper gastrointestinal endoscopy: comparison with midazolam // Br J Anaesth. 1991. Vol. 67. P.108–111.
68. KoshyG., NairS., NorkusE.P. et al. Propofol versus midazolam and meperidine for conscious sedation in GI endoscopy // Am J Gastroenterol. 2000. Vol. 95. P.1476–1479.
69. WestonB.R., ChadalawadaV., ChalasaniN. et al. Nurse-administered propofol versus midazolam and meperidine for upper endoscopy in cirrhotic patients // Am J Gastroenterol. 2003. Vol 98. P.2440–2447.
70. KhamaysiI., WilliamN., OlgaA. et al. Sub-clinical hepatic encephalopathy in cirrhotic patients is not aggravated by sedation with propofol compared to midazolam: a randomized controlled study // J.Hepatol. 2011. Vol. 54. P.7–77.
71. MeiningA., SemmlerV., KassemA.M. et al. The effect of sedation on the quality of upper gastrointestinal endoscopy: an investigator-blinded, randomized study comparing propofol with midazolam // Endoscopy. 2007. Vol. 39. P.345–349.
72. ChinN.M., TaiH.Y., ChinM.K.Intravenous sedation for upper gastrointestinal endoscopy: midazolam versus propofol // Singapore Med. J. 1992. Vol. 33. P.478–480.
73. RiphausA., GstettenbauerT., FrenzM.B. et al. Quality of psychomotor recovery after propofol sedation for routine endoscopy: a randomized and controlled study // Endoscopy. 2006. Vol. 38. P.677–683.
74. RiphausA., LechowiczI., FrenzM.B. et al. Propofol sedation for upper gastrointestinal endoscopy in patients with liver cirrhosis as an alternative to midazolam to avoid acute deterioration of minimal encephalopathy: a randomized, controlled study // Scand. J.Gastroenterol. 2009. Vol. 44. P.1244–1251.
75. MuñozL., ArévaloJ.J., ReyesL.E. et al. Remifentanil vs. propofol controlled infusion for sedation of patients undergoing gastrointestinal endoscopic procedures: a clinical randomized controlled clinical trial // ColombianJ.Anesthesiology. 2013.Vol. 41. P.114–119.
76. VargoJ.J., ZuccaroG.Jr., DumotJ.A. et al. Gastroenterologist administered propofol versus meperidine and midazolam for advanced upper endoscopy: a prospective, randomized trial // Gastroenterology. 2002. Vol. 123. P.8–16.
77. VargoJ.J.Propofol: a gastroenterologist’s perspective // Gastrointest. Endosc. Clin. Am. 2004. Vol. 14. P.313–323.
78. VaibhavW., DannyI., SushilG. et al. Similar Risk of Cardiopulmonary Adverse Events Between Propofol and Traditional Anesthesia for Gastrointestinal Endoscopy: A Systematic Review and Meta-analysis // Clin Gastroenterol Hepatol. 2017. Vol. 15 (2). P.194–206.
79. KerkerA., HardtC., SchliefH.E., DumoulinF.L.Combined sedation with midazolam/propofol for gastrointestinal endoscopy in elderly patients // BMC Gastroenterol. 2010. Vol. 10. P.11.
80. RiphausA. S3 Guideline: sedation for gastrointestinal endoscopy 2008 // Endoscopy. 2009. Vol. 41. P.787–815.
2. GreenJ. BSG Guidelines in Gastroenterology // Gut. 2006. Vol. 55 (4). P. 442.
3. QuineM.A., BellG.D., McCloy R.F. et al. Prospective audit of upper gastrointestinal endoscopy in two regions of England: safety, staffing and sedation, methods // Gut. 1995. Vol. 36. P. 462–467.
4. BowlesC., LeicesterR., RomayaC. et al. A prospective study of colonoscopy practice in the United Kingdom today are we adequately prepared for national colorectal cancer screening tomorrow? // Gut. 2004. Vol. 53. P. 277–283.
5. SiegA., HachmoellerE.Prospective evaluation of complications in outpatient GI endoscopy: a survey among German gastroenterologists // Gastrointestinal endoscopy. 2001. Vol. 53. P. 620–627.
6. WolfsenH.C., HemmingerL.L., AchemS.R. et al. Complications of endoscopy of the upper gastrointestinal tract: a single-center experience // Mayo Clinic Proc. 2004. Vol. 79. P. 1264–1267.
7. HeussL., FroehlichF., BeglingerC.Changing patterns of sedation and monitoring practice during endoscopy: results of a nationwide survey in Switzerland // Endoscopy. 2005. Vol. 37. P. 161–166.
8. SharmaV.K., NguyenC.C., CrowellM.D. et al. A national study of cardiopulmonary unplanned events after GI endoscopy // Gastrointestinal endoscopy. 2007. Vol. 66. P. 27–34.
9. CohenL.B., WecslerJ.S., GaetanoJ.N. et al. Endoscopic sedation in the United States: results from a nationwide survey // Am J Gastroenterol. 2006. Vol. 101. P. 967–974.
10. GoudraB., NuzatA., SinghP. et al. Cardiac arrests in patients undergoing gastrointestinal endoscopy: A retrospective analysis of 73,029 procedures // Saudi J Gastroenterol. 2015. Vol. 21 (6). P. 400–411.
11. LevyN., AbinaderE.Continuous electrocardiographic monitoring with Holter electrocardiocorder throughout all stages of gastroscopy // Am J Dig Dis. 1977. Vol. 22. P. 1091–1096.
12. PyöräläK., SalmiH., JussilaJ., HeikkiläJ.Electrocardiographic changes during gastroscopy // Endoscopy. 1973. Vol. 5. P. 183–186.
13. RosenbergJ., StausholmK., AndersenI. et al. No effect of oxygen therapy on myocardial ischemia during gastroscopy // Scand J Gastroenterol. 1996. Vol. 31. P. 200–205.
14. American Society for Gastrointestinal Endoscopy. Guidelines. Adverse events of upper GI endoscopy // 2012. Vol. 76 (4). P. 707–718. DOI: 10.1016/j.gie.2012.03.252.
15. CottonP.B., EisenG.M., AabakkenL. et al. A lexicon for endoscopic adverse events: report of an ASGE workshop // GI endoscopy. 2010. Vol. 71. P. 446–454.
16. GiesenH., K.Cardiac side-effects of esophago-gastro-duodenoscopy in relation to premedication // Dtsch Med Wochenschr. 1978. Vol. 103 (39). P. 1517–1520.
17. Wierzbicka-Paczos E.Arrhythmia during endoscopy of the upper gastrointestinal tract // Przegl Lek. 1989. Vol. 46 (5). P. 451–454.
18. GuptaS.C., GopalswamyN., SarkarA. et al. Cardiac arrhythmias and electrocardiographic changes during upper and lower gastrointestinal endoscopy // Mil Med. 1990. Vol. 155 (1). P. 9–11.
19. YazawaK., AdachiW., KoideN. et al. Changes in cardiopulmonary parameters during upper gastrointestinal endoscopy in patients with heart disease: towards safer endoscopy // Endoscopy. 2000. Vol. 32 (4). P. 287–293.
20. RistikankareM., JulkunenR., HeikkinenM. et al. Cardiac autonomic regulation during gastroscopy // Dig Liver Dis. 2009. Vol. 41 (9). P. 52–64.
21. JurellK.R., O’Connor K.W., SlackJ. et al. Effect of supplemental oxygen on cardiopulmonary changes during gastrointestinal endoscopy // Gastrointestinal endoscopy. 1994. Vol. 40. P. 665–670.
22. RosenbergJ., JorgensenL.N., RasmussenV. et al. Hypoxemia and myocardial ischemia during and after endoscopic cholangiopancreatography: call for further studies // Scand. J.Gastroent. 1992. Vol. 27. P. 717–720.
23. RosenbergJ., OvergaardH., AndersenM. et al. Double blind randomized controlled trial of effect of metoprolol on myocardial ischemia during endoscopic cholangiopancreatography // Br. Med. 1996. Vol. 313. P. 25–61.
24. RistikankareM., JulkunenR., HeikkinenM. et al. Sedation, topical pharyngeal anesthesia and cardiorespiratory safety during gastroscopy // J Clin Gastroenterol. 2006. Vol. 40. P. 899–905.
25. YetkinG., ObaS., UludagM. et al. Effects of sedation during upper gastrointestinal endoscopy on endocrine response and cardiorespiratory function // Braz J Med Biol Res. 2007. Vol. 40 (12). P. 1647–1652.
26. TonnesenH., PuggaardL., BraagaardJ. et al. Stress response to endoscopy // Scand J Gastroenterol. 1999. Vol. 34. P. 629–631.
27. LynnR.B.Mechanisms of esophageal pain // Am J Med. 1992 Vol. 92. P. 11S–19S.
28. AdachiW., YazawaK., OwaM. et al. Quantification of cardiac stress during EGD without sedation // Gastrointest Endosc. 2002 Vol. 55 (1). P. 58–64.
29. PremaS., SembulingamK., SaraswathiI., SrideviG.Rate Pressure Product as a Determinant of Physical Fitness in Normal Young Adults // Am J Hypertens. 2015. Vol. 14 (4). P. 2279–0861.
30. UchiyamaK., IshikawaT., SakamotoN. et al. Analysis of cardiopulmonary stress during endoscopy: is unsedated transnasal esophagogastroduodenoscopy appropriate for elderly patients? // Can J Gastroenterol Hepatol. 2014. Vol. 28 (1). P. 31–34.
31. De MeersmanR.E., ZionA.S., GiardinaE.G et al. Estrogen replacement, vascular distensibility and blood pressures in postmenopausal women // Am J Physiol. 1998. Vol. 274. P. H1539–H1544.
32. SangeetaN., LilyW., HemL.Effect of exercise on rate pressure product in premenopausal and postmenopausal women with coronary artery disease // Indian J Physiol Pharmacol. 2007. Vol 51 (3). P. 279–283.
33. WhiteW.B.Heart rate and rate pressure product as determinants of cardiovascular risk in patients with hypertension // Am. J.Hypertens. 1999. Vol. 12. P. 5.
34. BellG.D.Premedication, Preparation, and Surveillance in “State of the Art in Gastroenterologic Endoscopy — A review of last year’s most significant publications“ // Endoscopy. 2004. Vol. 36. P. 23–31.
35. ChangM.C., LeeA.Y., ChenT.J., ChangW.F.Acute myocardial infarction after upper gastrointestinal gastroscopy // Zhonghua Yi Xue Za Zhi (Taipei). 2001. Vol. 64 (10). P. 581–585.
36. KrantzD.S., BurgM.M.Current perspective on mental stress-induced myocardial ischemia // Psychosom Med. 2014. Vol. 76. P. 168–170.
37. LampertR., ShustermanV., BurgM. et al. Anger induced T-wave alternans predicts future ventricular arrhythmias in patients with implantable cardioverter-defibrillators // J Am Coll Cardiol. 2009. Vol. 53. P. 774–778.
38. WeiJ., RooksC., RamadanR. et al. Meta-analysis of mental stress-induced myocardial ischemia and subsequent cardiac events in patients with coronary artery disease // Am J Cardiol. 2014. Vol. 114 (2). P.187–192.
39. HolmC., RosenbergJ.Pulse oximetry and supplemental oxygen during gastrointestinal endoscopy: a critical review // Endoscopy. 1996. Vol. 28. P.703–711.
40. RosenbergJ., OvergaardH., AndersenM. et al. Double blind randomized controlled trial of effect of metoprolol on myocardial ischemia during endoscopic cholangiopancreatography // BMJ. 1996. Vol. 313. P.258–261.
41. NeuenschwanderA.U., ChristensenM., SchulzeS. et al. Less tachycardia during transnasal versus conventional gastroscopy // Dan MedJ. 2012. Vol. 59 (6). P.A4432.
42. UchiyamaK., IshikawaT., SakamotoN. et al. Analysis of cardiopulmonary stress during endoscopy: is unsedated transnasal esophagogastroduodenoscopy appropriate for elderly patients? // Can J Gastroenterol Hepatol. 2014. Vol. 28 (1). P.31–34.
43. ThotaP.N., ZuccaroG.J., VargoJ.J. et al. A randomized prospective trial comparing unsedated esophagoscopy via transnasal and transoral routes using a 4-mm video endoscope with conventional endoscopy with sedation // Endoscopy. 2005. Vol. 37 (6). P.559–565.
44. NeukirchenM., KienbaumP.Sympathetic nervous system: evaluation and importance for clinical general anesthesia // Anesthesiology. 2008. Vol. 109 (6). P.1113–1131.
45. YazawaK., AdachiW., OwaM. et al. Can sedation reduce the cardiac stress during gastrointestinal endoscopy? A study with non-invasive automated cardiac flow measurement by color Doppler echocardiography // Scand J Gastroenterol. 2002. Vol. 37 (5). P.602–607.
46. The Standards of Practice Committee of the American Society for Gastrointestinal Endoscopy (ASGE). Sedation and anesthesia in GI endoscopy. Guidelines // Gastrointestinal Endoscopy. 2007. Vol. 133. P.501–675.
47. KatsutoshiO., KenH., AtsushiI., MitsuruK.Guidelines for sedation in gastroenterological endoscopy // Dig Endosc. 2015. Vol. 27. P.435–449.
48. AkataT.General anesthetics and vascular smooth muscle: Direct actions of general anesthetics on cellular mechanisms regulating vascular tone // Anesthesiology. 2007 Vol. 106. P.365–391.
49. KienbaumP., HeuterT., PavlakovicG. et al. S (+) -ketamine increases muscle sympathetic activity and maintains the neural response to hypotensive challenges in humans // Anaesthesiology. 2001. Vol. 94. Р.252–258.
50. SellgrenJ., PontenJ., WallinB.G.Characteristics of muscle nerve sympathetic activity during general anaesthesia in humans // Acta. Anaesthesiol. Scand. 1992. Vol. 36. Р.336–345.
51. EbertT.J., KanitzD.D., KampineJ.P.Inhibition of sympathetic neural outflow during thiopental anesthesia in humans // Anesth. Analg. 1990. Vol. 71. Р.319–326.
52. SellgrenJ., PontenJ., WallinB.G.Percutaneous recording of muscle nerve sympathetic activity during propofol, nitrous oxide, and isoflurane anesthesia in humans // Anaesthesiology. 1990. Vol. 73. Р.20–27.
53. EbertT.J., MuziM., BerensR. at al. Sympathetic responses to induction of anesthesia in humans with propofol or etomidate // Anaesthesiology. 1992. Vol. 76. Р.725–733.
54. TweedW.A., MinuckM., MyminD.Circulatory responses to ketamine anesthesia // Anesthesiology. 1972 Vol. 37. P.613–619.
55. KienbaumP., HeuterT., PavlakovicG. et al. Racemic ketamine decreases muscle sympathetic activity but maintains the neural response to hypotensive challenges in humans // Anesthesiology. 2000. Vol. 92. P.94–101.
56. HoeheM., DukaT.Opiates increase plasma catecholamines in humans // Psychoneuroendocrinology. 1993. Vol. 18. P.141–148.
57. TaneyamaC., GotoH., KohnoN. et al. Effects of fentanyl, diazepam, and the combination of both on arterial baroreflex and sympathetic nerve activity in intact and barodenervated dogs // Anesth. Analg. 1993. Vol. 77. P.44–48.
58. FlackeJ.W., FlackeW.E., BloorB.C. et al. Histamine release by four narcotics: A double-blind study in humans // Anesth. Analg. 1987. Vol. 66. P.723–730.
59. SundlofG., WallinB.G.Human muscle nerve sympathetic activity at rest: Relationship to blood pressure and age // J Physiol. 1978. Vol. 274. P.621–637.
60. SellgrenJ., BiberB., HenrikssonB.A. et al. The effects of propofol, methohexitone and isoflurane on the baroreceptor reflex in the cat // Acta. Anaesthesiol. Scand. 1992. Vol. 36. P.784–790.
61. MartyJ., GauzitR., LefevreP. et al. Effects of diazepam and midazolam on baroreflex control of heart rate and on sympathetic activity in humans // Anesth. Analg. 1986. Vol. 65. P.113–119.
62. Bechir M, Schwegler K, ChenevardR. et al. Anxiolytic therapy with alprazolam increases muscle sympathetic activity in patients with panic disorders // Auton Neurosci. 2007. Vol. 134. P.69–73.
63. KitajimaT., KanbayashiT., SaitoY. et al. Diazepam reduces both arterial blood pressure and muscle sympathetic nerve activity in human // Neurosci Lett. 2004. Vol. 355. P.77–80.
64. SellgrenJ., EjnellH., ElamM. et al. Sympathetic muscle nerve activity, peripheral blood flows, and baroreceptor reflexes in humans during propofol anesthesia and surgery // Anesthesiology. 1994. Vol. 80. P.534–544.
65. EbertT.J.Sympathetic and hemodynamic effects of moderate and deep sedation with propofol in humans // Anesthesiology. 2005. Vol. 103. P.20–24.
66. CarlssonU., GrattidgeP.Sedation for upper gastrointestinal endoscopy: a comparative study of propofol and midazolam // Endoscopy. 1995. Vol. 27. P.240–243.
67. PattersonK.W, CaseyP.B., MurrayJ.P. et al. Propofol sedation for outpatient upper gastrointestinal endoscopy: comparison with midazolam // Br J Anaesth. 1991. Vol. 67. P.108–111.
68. KoshyG., NairS., NorkusE.P. et al. Propofol versus midazolam and meperidine for conscious sedation in GI endoscopy // Am J Gastroenterol. 2000. Vol. 95. P.1476–1479.
69. WestonB.R., ChadalawadaV., ChalasaniN. et al. Nurse-administered propofol versus midazolam and meperidine for upper endoscopy in cirrhotic patients // Am J Gastroenterol. 2003. Vol 98. P.2440–2447.
70. KhamaysiI., WilliamN., OlgaA. et al. Sub-clinical hepatic encephalopathy in cirrhotic patients is not aggravated by sedation with propofol compared to midazolam: a randomized controlled study // J.Hepatol. 2011. Vol. 54. P.7–77.
71. MeiningA., SemmlerV., KassemA.M. et al. The effect of sedation on the quality of upper gastrointestinal endoscopy: an investigator-blinded, randomized study comparing propofol with midazolam // Endoscopy. 2007. Vol. 39. P.345–349.
72. ChinN.M., TaiH.Y., ChinM.K.Intravenous sedation for upper gastrointestinal endoscopy: midazolam versus propofol // Singapore Med. J. 1992. Vol. 33. P.478–480.
73. RiphausA., GstettenbauerT., FrenzM.B. et al. Quality of psychomotor recovery after propofol sedation for routine endoscopy: a randomized and controlled study // Endoscopy. 2006. Vol. 38. P.677–683.
74. RiphausA., LechowiczI., FrenzM.B. et al. Propofol sedation for upper gastrointestinal endoscopy in patients with liver cirrhosis as an alternative to midazolam to avoid acute deterioration of minimal encephalopathy: a randomized, controlled study // Scand. J.Gastroenterol. 2009. Vol. 44. P.1244–1251.
75. MuñozL., ArévaloJ.J., ReyesL.E. et al. Remifentanil vs. propofol controlled infusion for sedation of patients undergoing gastrointestinal endoscopic procedures: a clinical randomized controlled clinical trial // ColombianJ.Anesthesiology. 2013.Vol. 41. P.114–119.
76. VargoJ.J., ZuccaroG.Jr., DumotJ.A. et al. Gastroenterologist administered propofol versus meperidine and midazolam for advanced upper endoscopy: a prospective, randomized trial // Gastroenterology. 2002. Vol. 123. P.8–16.
77. VargoJ.J.Propofol: a gastroenterologist’s perspective // Gastrointest. Endosc. Clin. Am. 2004. Vol. 14. P.313–323.
78. VaibhavW., DannyI., SushilG. et al. Similar Risk of Cardiopulmonary Adverse Events Between Propofol and Traditional Anesthesia for Gastrointestinal Endoscopy: A Systematic Review and Meta-analysis // Clin Gastroenterol Hepatol. 2017. Vol. 15 (2). P.194–206.
79. KerkerA., HardtC., SchliefH.E., DumoulinF.L.Combined sedation with midazolam/propofol for gastrointestinal endoscopy in elderly patients // BMC Gastroenterol. 2010. Vol. 10. P.11.
80. RiphausA. S3 Guideline: sedation for gastrointestinal endoscopy 2008 // Endoscopy. 2009. Vol. 41. P.787–815.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья

