Патогенетически значимые факторы риска прогрессирования впервые выявленного инфильтративного туберкулеза легких
Цель исследования: оценить роль некоторых патогенетических факторов (эндогенной интоксикации, липоперекисного окисления, иммунного дисбаланса) в прогрессировании туберкулеза и возможность их коррекции.
Материал и методы: проведено проспективное когортное исследование с участием 60 пациентов в возрасте от 25 до 60 лет с впервые выявленным инфильтративным туберкулезом легких. Все пациенты были разделены на 2 группы по 30 человек. В группе сравнения (18 (60%) женщин; средний возраст 47,2±3,6 года) пациенты получали стандартное противотуберкулезное лечение, в основной группе (16 (53,3%) женщин; средний возраст 44,7±3,25 года) — дополнительно получали иммунорегуляторный пептид (аргинил-a-аспартил-лизил-валил-тирозил-аргинин) Имунофан® — 2 курса по 10–15 инъекций 50 мг внутримышечно. Оценивали динамику клинических проявлений, данных рентгенологического исследования, показателей общего анализа крови, интоксикации, липоперекисного окисления и антиоксидантной системы, а также функциональной активности иммунитета. Исследования проводили через 1 и 3 мес. после начала лечения.
Результаты исследования: развитие инфильтративной формы туберкулеза легких сопровождается существенными нарушениями в системе гомеостаза: формированием эндогенной интоксикации, выраженной активацией перекисного окисления липидов и фосфолипазного компонента, ингибированием антиоксидантной активности, а также иммунным дисбалансом — значимыми факторами прогрессирования патологии. У пациентов с ограниченным легочным процессом интенсивность вышеуказанных предикторов была минимальной относительно больных с распространенными формами, где регистрировались выраженны е и стойкие расстройства. Применение стандартного противотуберкулезного лечения характеризовалось недостаточной эффективностью: менее выраженной положительной динамикой как проанализированных лабораторных показателей, так и рентгенологических.
Выводы: включение иммунорегуляторного пептида в схему терапии пациентов с впервые выявленным инфильтративным туберкулезом на ранних стадиях позволяет целенаправленно и сравнительно быстро воздействовать на патогенетически значимые изменения в системе гомеостаза, что не только улучшает течение инфекции, но и формирует условия для эрадикации возбудителя.
Ключевые слова: туберкулез, эндотоксикоз, перекисное окисление липидов, фосфолипаза, антиоксидантная система, иммунитет.
Для цитирования: Басиева О.З., Джагаева З.К., Кобесов Н.В., Малиев Б.М. Патогенетически значимые факторы риска прогрессирования впервые выявленного инфильтративного туберкулеза легких. РМЖ. Медицинское обозрение. 2022;30(2):11-15.
Pathogenically important risk factors for the progression of newly diagnosed infiltrative pulmonary tuberculosis
O.Z. Basieva, Z.K. Dzhagaeva, N.V. Kobesov, B.M. Maliev
North Ossetia State Medical Academy, Vladikavkaz
Aim: to evaluate the role of certain pathogenic factors (i.e., endogenous intoxication, lipid peroxidation, and immune imbalance) in the progression of tuberculosis and the potential tools to manage them.
Patients and Methods: this prospective cohort study included 60 patients aged 25–60 years with newly diagnosed infiltrative pulmonary tuberculosis (TB). All participants were divided into two groups (30 patients each). Comparison group patients (18 women [60%], mean age 47.2±3.6 years) received standard anti-TB treatment. Study group patients (16 women [53.3%], mean age 44.7±3.25 years) additionally received Imunofan® (arginil-α-aspartil-lysil-valil-tyrosil-arginine), an immunoregulatory peptide (two series of 10–15 injections, 50 mg IM). Changes in clinical presentations, radiological findings, CBC parameters, indicators of intoxication, lipid peroxidation, antioxidant system, and immune functions were evaluated. Examinations were performed one and three months after starting treatment.
Results: infiltrative pulmonary TB is associated with significant alterations in homeostasis, e.g., endogenous intoxication, activation of lipid peroxidation and phospholipase, inhibition of antioxidant activity, and immune imbalance. These are important factors of TB progression. In patients with limited lung damage, the intensity of these predictors was minimal compared to patients with advanced disease associated with more severe and persistent impairments. The efficacy of standard anti-TB treatment was inadequate (less significant improvement in lab tests and lung tissue infiltration) .
Conclusions: immunoregulatory peptide as a part of complex treatment of newly diag-nosed infiltrative pulmonary TB at early stages provides a focused and relatively fast effect on pathogenically important alterations of homeostasis. Imunofan® improves infection course and helps eliminate the pathogen.
Keywords: tuberculosis, endotoxicosis, lipid peroxidation, phospholipase, antioxidant system, immunity.
For citation: Basieva O.Z., Dzhagaeva Z.K., Kobesov N.V., Maliev B.M. Pathogenically important risk factors for the progression of newly diagnosed infiltrative pulmonary tuberculosis. RMJ. 2022;2:11–15.
Введение
Одной из актуальных задач фтизиатрии является изучение патогенетического механизма развития туберкулеза с целью повышения эффективности диагностики и лечения пациентов с данным заболеванием [1, 2].
Как показал анализ литературы, актуальность данной патологии определяется рядом факторов: высокой распространенностью (по данным ВОЗ за 2019 г., ежегодно в мире болеют около 10 млн взрослых и 1,2 млн детей, а в России — 41,1 на 100 тыс. взрослого населения), сложностью диагностики, высоким процентом прогрессирования (87,0%), терапевтической устойчивостью [3, 4] — все это в целом определяет туберкулез как серьезное социальное, экономическое и медицинское бремя.
Развитие туберкулеза на фоне иммунной дисфункции сопровождается существенными нарушениями в цитокиновом спектре, количественным дисб алансом клеток лимфоцитарного ряда, развитием специфического воспалительного ответа с казеозным поражением легочной ткани, что создает условия для массивного бактериовыделения и формирует ремоделирующие деструктивные процессы в легких [5, 6].
Эндогенная интоксикация представляется фактором риска прогрессирования разных патологий и одним из основных критериев оценки тяжести их патологического процесса [7]. Указанный синдром характеризуется увеличением секреции токсических продуктов метаболизма, их нак оплением в тканях органов, снижением детоксикационной активности организма, повреждением главных систем, формированием полиорганной недостаточности [8].
Многими исследователями отмечено, что на динамику туберкулезного процесса оказывают влияние активация свободнорадикального окисления, а также баланс его взаимодействия с антиоксидантной системой. Интенсификация перекисного окисления липидов способствует изменению функ ционального иммунного ответа, в том числе его гуморального компонента [9].
На фоне развития туберкулезной инфекции наблюдаются иммунные нарушения в виде уменьшения продукции флогогенных цитокинов (интерлейкина (ИЛ) 2, интерферона γ и др.), увеличения продукции и привлечения противовоспалительных (ИЛ-4, ИЛ-10 и др.) [10].
Отмеченные особенности развития туберкулеза обусловливают утяжеление патогенетических реакций, усиление распада легочной ткани, повышение фибробластной активности, замедление процессов рассасывания и способствуют развитию фиброзных изменений в легких [11–13].
Цель исследования: оценить роль некоторых патогенетических факторов (эндогенной интоксикации, липоперекисного окисления, иммунного дисбаланса) в прогрессировании туберкулеза и возможность их коррекции.
Материал и методы
На базе ГБУЗ РКЦФП МЗ РСО-Алания (клиника кафедры фтизиопульмонологии ФГБОУ ВО СОГМА Минздрава России) проведено проспективное когортное исследование у 60 пациентов с впервые выявленным инфильтративным туберкулезом легких.
Критерии включения: больные обоего пола в возрасте от 25 до 60 лет с впервые выявленным туберкулезом легких, находящиеся на круглосуточном стационарном пребывании с одинаковыми условиями больничной среды; наличие информированного персонального согласия; обоснование к ebинического диагноза «туберкулез легких, инфильтративная форма с наличием бактериовыделения» согласно приказам Минздрава России от 21.03.2003 № 109 и от 29.12.2014 № 951; сохранение чувствительности к противотуберкулезной терапии.
Критерии исключения: наличие других форм туберкулеза или локализаций; наличие сопутствующей патологии или состояний, непосредственно влияющих на результаты исследования (СПИД любой стадии, опухолевая патология, беременность и др.).
Критерии прерывания клинического исследования: выраженные побочные реакции на препарат, отказ пациента от участия в исследовании, нарушение режима лечения.
Пациенты были разделены на 2 группы по 30 человек: группа сравнения (18 (60,0%) женщин; средний возраст 47,2±3,64 года) получала стандартную противотуберкулезную терапию в соответствии с утвержденным регламентом, основная группа (16 (53,3%) женщин; средний возраст 44,7±3,25 года) в дополнение к традиционному лечению получала иммунорегуляторный пептид (ИП, аргинил-a-аспартил-лизил-валил-тирозил-аргинин) Имунофан®. Препарат назначали в фазе интенсивной терапии (1-й месяц от начала лечения) в дозе 50 мкг внутримышечно через день, курс 10–15 инъекций и в фазе продолжения лечения (3-й месяц лечения) по аналогичной схеме.
Верификацию клинического диагноза проводили с использованием бактериологического, молекулярно-генетических и лучевых методов диагностики.
Обследование пациентов включало сбор анамнеза, физикальный осмотр, лучевую (цифровая флюорография, обзорная и боковая рентгенография, компьютерная томография) и эндоскопическую (фибробронхоскопия с трансбронхоскопической биопсией) диагностику, УЗИ внутренних органов, кожные иммунологические тесты (проба Манту c 2 ТЕ, Диаскин-тест). Лабораторные методы включали помимо стандартных (общеклинические, биохимические, бактериологические исследования, ПЦР в режиме реального времени) методов оценку эндогенной интоксикации (молекулы средней массы 254 нм (МСМ), индекс токсичности (ИТ) по М.В. Гриневу, 1989), перекисного окисления липидов (диеновые конъюгаты (ДК), тиобарбитуровая кислота (ТБК), фосфолипаза А2), антиоксидантной защиты (супероксиддисмутаза (СОД), каталаза); иммунофенотипирование методом иммунофлюоресценции с моноклональными антителами (ООО «Сорбент», Москва) — популяции и субпопуляции лимфоцитов CD3, CD4, CD8, CD20, CD25, иммуноглобулиновый спектр — общие IgM, IgG, IgA, IgE, показатели неспецифической резистентности: поглотительная активность нейтрофилов (фагоцитарное число, фагоцитарный индекс), НСТ-тест; определение иммунной активности (ИЛ-2, ИЛ-4, фактор некроза опухоли α (ФНО-α).
Обследования проводили через 1–2 мес. после поступления пациентов в клинику (фаза интенсивного лечения туберкулеза) и через 3–4 мес. от начала терапии (фаза продолжения лечения).
Статистическую обработку полученных в ходе исследования данных проводили с использованием компьютерных программ IBM SPSS statistics 25 и Microsoft Office Excel 2013 и критериев Манна — Уитни, Фишера, χ2 Пирсона.
Результаты исследования
При изучении анамнеза оказалось, что у пациентов имелись некоторые интеркуррентные заболевания: инфекционные (гепатиты) — в 9 (15,0%) случаях, желудочно-кишечного тракта (гастрит, язвенная болезнь и др.) — в 11 (18,3%), эндокринные (сахарный диабет и др.) — в 7 (11,7,0%), ЛОР-органов — в 4 (6,6%), сердечно-сосудистые (артериальная гипертония и др.) — в 13 (21,6%) случаях.
На начальном этапе диагностического поиска при проведении фибробронхоскопии регистрировались следующие изменения: рубцовые деформации бронхов — у 12 (40,0 %) пациентов группы сравнения и 10 (33,3%) — основной, бронхоскопические признаки активного туберкулеза (катаральный эндобронхит, инфильтративные изменения, грануляции, изъязвления) у 8 (26,6%) и 11 (36,5%) соответственно, гнойный эндобронхит у 13 (43,3%) и 10 (33,3%) соответственно (рис. 1).
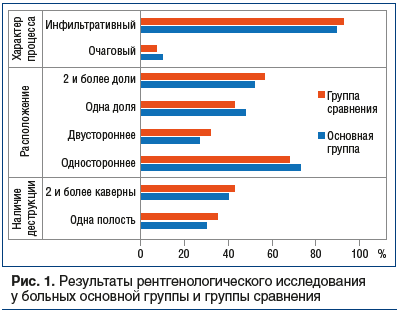
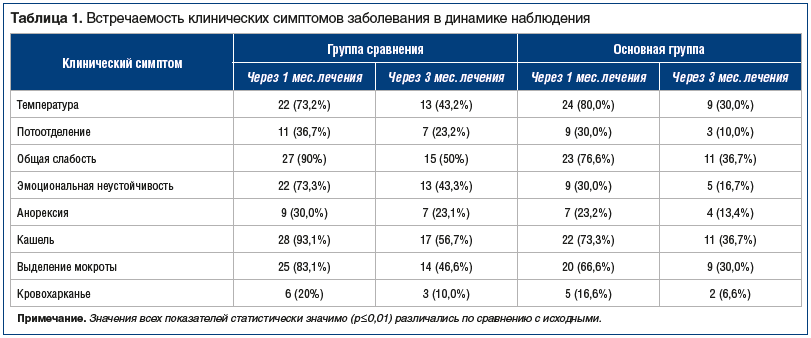
На фоне проводимого лечения в обеих группах отмечалась положительная динамика клинической картины (табл. 1).
Общий анализ крови показал, что на фоне стандартной терапии туберкулез сохраняет свою активность. Лейкоцитоз обнаружен у 20 (66,7%, р≤0,01) больных спустя 1 мес. и у 11 (36,7%, р≤0,01) — спустя 3 мес., палочкоядерный сдвиг — у 17 (56,6%, р≤0,01) и 9 (30,0%, р≤0,01), лимфопения — у 15 (50,0%, р≤0,01) и 8 (26,7%, р≤0,01), повышение СОЭ — у 19 (63,3%, р≤0,01) и 11 (36,7%, р≤0,01), С-реактивного белка — у 22 (73,3%, р≤0,01) и 13 (43,1%, р≤0,01) больных соответственно.
Добавление ИП в схему терапии модифицировало воспалительный процесс. При этом относительно исходных параметров наблюдалось увеличение числа лейкоцитов, уменьшение количества палочкоядерных лейкоцитов, снижение концентрации лимфоцитов, повышение СОЭ, уровня С-реактивного белка на первом этапе наблюдения у 18 (60,0%), 14 (23,3%), 13 (43,3%), 15 (50,0%), 20 (66,6%) (для всех р≤0,01 по сравнению с исходным) и у 7 (23,3%), 6 (20,0%), 5 (16,6%), 8 (26,7%) и 9 (30,0%) (р≤0,01) через 1 и 3 мес. лечения соответственно.
Изучение данных бактериологического исследования и люминесцентной микроскопии мокроты показало, что бактериовыделение через 2 мес. регистрировали у 23 (76,6%, р≤0,01) больных группы сравнения и 19 (63,3%) — основной группы, спустя 3 мес. — у 11 (36,6%, р≤0,01) и 8 (26,6%, р≤0,01) соответственно.
Результаты рентгенологических исследований на фоне применения стандартной терапии демонстрировали уменьшение инфильтративных изменений легочной ткани через 1 мес. на 36,5% (р≤0,01), через 3 мес. на 41,2% (р≤0,01) относительно исходных. У больных основной группы данный показатель составил 45,8% и 59,8% (р≤0,01) соответственно.
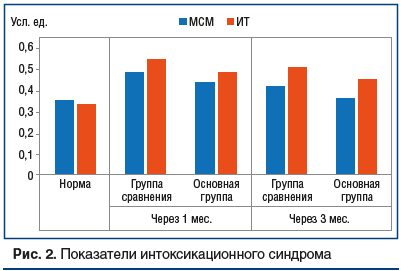
На фоне проведения лечения отмечалось развитие интоксикационного синдрома (рис. 2). В группе сравнения показатели интоксикации (МСМ и ИТ) превышали норму на первом этапе исследования на 53,1% и 62,1% (р≤0,01), на втором этапе — на 31,6% и 49,2% (р≤0,01). В основной группе показатели МСМ и ИТ превосходили референсные уровни спустя 1 мес. на 37,5% и 43,2% (р≤0,01) соответственно. Степень выраженности эндотоксикоза на фоне использования ИП в фазе интенсивной терапии существенно снижалась, но все же концентрация МСМ и ИТ оставалась относительно повышенной — на 15,0% и 30,1% (р≤0,01) (см. рис. 2).
Результаты исследования показали, что развитие эндогенной интоксикации туберкулезного генеза сопровождается активацией перекисного окисления липидов и фосфолипазного звена, ингибированием антиоксидантной системы и иммунным дисбалансом.В групе сравнения через 1 мес. после старта стандартного лечения установлено, что содержание ДК, ТБК и фосфолипазы А2 было повышено относительно исходного значения на 79,3, 86,2 и 64,4% (р≤0,01), а СОД и каталазы — снижено на 32,0% и 27,6% (р≤0,01). После 3-го месяца лечения содержание этих метаболитов в плазме крови снижалось незначительно, уровень ДК был выше нормы на 39,0% (р≤0,01), ТБК — на 49,2% (р≤0,01), фосфолипазы А2 — на 31,6% (р≤0,01), тогда как активность СОД и каталазы оставалась ниже нормы на 28,5% и 20,5% (р≤0,01) соответственно (рис. 3).
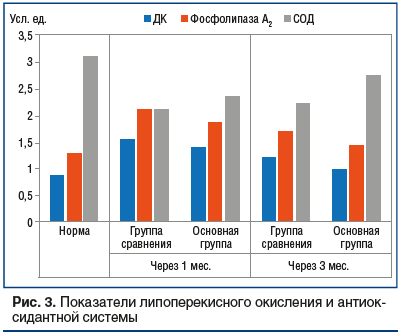
В основной группе метаболиты перекисного окисления липидов (ДК и ТБК) и уровень фосфолипазы А2 превосходили референсные значения через 1 мес. лечения на 61,0, 72,8 и 45,2% (р≤0,01). По прошествии 3 мес. данные показатели почти соответствовали норме. В то же время дефицит антиоксидантной защиты (каталаза и СОД) был зарегистрирован лишь спустя 1 мес. и равнялся 24,1% и 19,8% (р≤0,01) соответственно. К конечной точке наблюдения (через 3 мес.) активность антиоксидантной системы демонстрировала нормальные значения (см. рис. 3).
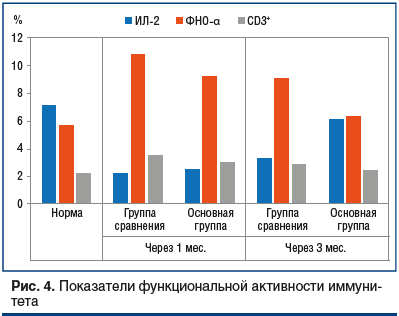
При анализе функциональной активности иммунитета в группе сравнения (на фоне стандартной терапии) отмечено увеличение содержания ИЛ-4, ФНО-α, CD4+ и CD3+ Т-лимфоцитов через 1 и 3 мес. исследования на 65,7, 90,7, 43,9, 56,7 и на 32,4, 54,2, 39,8 и 58,9% (р≤0,01) соответственно (рис. 4). Однако значение ИЛ-2 было ниже нормы спустя 1 мес. на 70,2% (р≤0,01) и спустя 3 мес. на 54,2% (р≤0,01).
Иммунологические эффекты ИП проявлялись в виде восстановления изначально сниженных показателей Т-клеточного звена, стимуляции процессов фагоцитоза, урегулирования иммуноглобулинового спектра. У 43,5% больных этой группы отрицательные значения Диаскин-теста приобретали положительно-нормергические значения, тогда как в группе сравнения (у 39,2%) достаточно длительно, в течение всей фазы интенсивной терапии и на этапе продолжения стандартного лечения, сохранялись негативные зн e0чения этого кожного иммунологического теста.
Терапевтический эффект комплексной схемы (с ИП) в условиях специфической воспалительной реакции оказал положительное влияние на статус иммунной активности. Плазменные концентрации ИЛ-4, ФНО-α, CD3+- и CD4+-лимфоцитов превышали нормальные значения только через 1 мес. лечения на 49,8, 61,9, 28,7 и 36,1% (р≤0,01) соответственно. Через 3 мес. исследования указанные параметры приближались к нормальным показателям. Провоспалительная реакция у больных основной группы была снижена лишь через 1 мес. лечения (уровень ИЛ-2 был ниже нормы на 65,2%, р≤0,01), а через 3 мес. он восстановился (см. рис. 4).
Сравнительным анализом установлено, что расстройства системы гомеостаза (интоксикация, активность липоперекисного окисления, ингибирование антиоксидантной защиты, дисбаланс иммунитета) были более выражены в группе сравнения, где проводилась стандартная терапия, чем в основной группе, как на первом этапе наблюдения, так и на втором. При этом интенсивность эндогенной интоксикации (МСМ, ИТ) была ниже в основной группе наблюдения на 10,1, 11,1 и 13,2, 12,3% (р≤0,01); активация липоперекисного окисления (ДК, фосфолипаза А2) была ниже на 11,1, 10,9 и 19,5, 15,3% (р≤0,01); угнетение антиоксидантной активности (СОД, каталаза) было ниже на 12,3, 14,5 и 23,4, 31,6% (р≤0,01); дисбаланс иммунной реакции по показателям высокого уровня ИЛ-4, ФНО-α, CD3+ был выражен на 21,3, 15,6, 13,5, и 24,3, 29,7, 15,4% (р≤0,01) меньше, снижение уровня ИЛ-2 было на 17,8% и 51,2% (р≤0,01) менее выраженным.
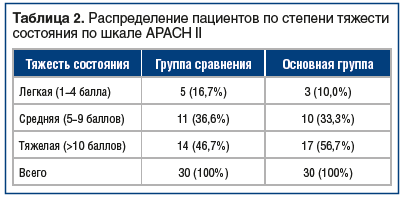
Определение количественной оценки степени тяжести состояния обследуемых пациентов при поступлении в клинику с помощью шкалы АРАСН II является ценным инструментом диагностики и прогнозирования рисков прогрессирования заболевания [14]. 6 2 нашем исследовании в группе сравнения средний балл по шкале АРАСН II составил 11,2±0,24, а в основной — 13,1±0,35 (табл. 2).
Использование шкалы АРАСН II позволило установить, что у пациентов с легкой степенью тяжести параметры системы гомеостаза были умеренно нарушены лишь на первом этапе исследования, тогда как у пациентов со средней и тяжелой степенью данные параметры были существенно повышены как на начальном сроке наблюдения, так и на заключительном.
При изучении параметров системы гомеостаза установлено, что степень влияния факторов прогрессирования туберкулеза (эндотоксикоза, интенсификации перекисного окисления липидов и фосфолипазной активности, угнетения антиоксидантного механизма, равновесия иммунитета) была более выражена у пациентов с тяжелой (14 (46,7%) пациентов группы сравнения и 17 (56,7%) — основной группы) и среднетяжелой (11 (36,6%) и 10 (33,3%) пациентов соответственно) степенью заболевания через 1 и 3 мес. относительно пациентов с легкой формой (МСМ выше на 15,8% и 13,8%, 19,4% и 15,2% (р≤0,01), ДК выше на 15,8% и 13,1%, 18,5% и 16,4% (р≤0,01), СОД ниже на 14,7% и 12,6%, 17,8% и 14,1% (р≤0,01), ФНО-α выше на 17,4% и 14,6%, 21,4% и 18,6% (р≤0,01), ИЛ-2 ниже на 23,6 и 19,7, 45,8 и 37,1% (р≤0,01).
Выводы
У больных с впервые выявленным инфильтративным туберкулезом легких специфический воспалительный процесс сопровождается существенными нарушениями в системе гомеостаза: формированием эндогенной интоксикации, выраженной активацией перекисного окисления липидов и фосфолипазного компонента, ингибированием антиоксидантной активности, а также иммунным дисбалансом — значимыми патогенетическими факторами прогрессирования заб олевания.
У пациентов с легкой степенью тяжести состояния по шкале APACH II интенсивность вышеуказанных предикторов была минимальной относительно больных со средней и тяжелой формами, где регистрировались выраженные и стойкие расстройства.
Применение стандартного противотуберкулезного лечения характеризовалось недостаточной эффективностью в виде сохранения синдрома эндогенной интоксикации и иммунной дисфункции.
Включение ИП в схему терапии пациентов с впервые выявленным инфильтративным туберкулезом лЦ 5гких на ранних стадиях способствует целенаправленному и сравнительно быстрому воздействию на параметры гомеостаза с формированием механизма саногенеза, а также сокращению сроков эрадикации возбудителя туберкулеза.
2. Головко А., Ищенко О. Динамика заболеваемости туберкулезом за период 2015–2019 гг. Norwegian journal of development of the international science. 2021;53–2:38–40. [Golovko A., Ishchenko O. Dynamics of tuberculosis incidence during the period 2015–2019. Norwegian journal of development of the international science. 2021;53–2:38–40 (in Russ.)].
3. Бурмистрова И.А., Самойлова А.Г., Тюлькова Т.Е. и др. Лекарственная устойчивость m. Tuberculosis (исторические аспекты, современный уровень знаний). Туберкулез и болезни легких. 2020;98(1):54–61. [Burmistrova I.A., Samoylova A.G., Tyulkova T.E. et al. Drug resistance of m. tuberculosis (historical aspects, current level of knowledge). Tuberculosis and lung diseases. 2020;98(1):54–61 (in Russ.)]. DOI: 10.21292/2075-1230-2020-98-1-54-61.
4. Гулябин К.Р. Современный подход к лекарственной терапии туберкулеза. Справочник врача общей практики. 2021;1:34–40. [Gulyabin K.R. Modern approach to drug therapy of tuberculosis. Spravochnik vracha obshchey praktiki. 2021;1:34–40 (in Russ.)]. DOI: 10.33920/med-10-2101-05.
5. Губкина М.Ф., Хохлова Ю.Ю., Петракова И.Ю., Юхименко Н.В. Эффективность ориентированной на пациента химиотерапии ограниченных туберкулезных процессов у детей из эпидемических очагов туберкулеза с множественной/широкой лекарственной устойчивостью. Туберкулез и болезни легких. 2019;97(2):20–25. [Gubkina M.F., Khokhlova Yu.Yu., Petrakova I.Yu., Yukhimenko N.V. Efficacy of patient-oriented chemotherapy of local tuberculous lesions in the children exposed to multiple/extensive drug resistant tuberculosis. Tuberculosis and lung diseases. 2019;97(2):20–25 (in Russ.)]. DOI: 10.21292/2075-1230-2019-97-2-20-25.
6. Каспрук Л.И. Актуальные вопросы иммунопрофилактики туберкулеза. Справочник врача общей практики. 2021;1:41–45. DOI: 10.33920/med-10-2101-06. [Kaspruk L.I. Topical issues of immunoprophylaxis of tuberculosis. Spravochnik vracha obshchey praktiki. 2021;1:41-45 (in Russ.)]. DOI: 10.33920/med-10-2101-06.
7. Захаров А.В. Клинические особенности и эффективность лечения изониазид-устойчивого туберкулеза легких с дополнительной устойчивостью возбудителя к другим препаратам. Вестник Центрального научно-исследовательского института туберкулеза. 2020;1:38–45. [Zakharov A.V. Clinical features and treatment efficacy in isoniazid-resistant pulmonary TB patients with additional MTB resistance to other drugs. CTRI Bulletin. 2020;1:38–45 (in Russ.)]. DOI: 10.7868/S2587667820010045.
8. Филинюк О.В., Аллилуев А.С., Амичба Д.Э. и др. ВИЧ-инфекция и туберкулез с множественной лекарственной устойчивостью: частота сочетания, эффективность лечения. Туберкулез и болезни легких. 2021;99(2):45–51. [Filinyuk O.V., Alliluev A.S., Amichba D.E. et al. HIV infection and multiple drug resistant tuberculosis: the frequency of co-infection and treatment efficacy. Tuberculosis and lung diseases. 2021;99(2):45–51 (in Russ.)]. DOI: 10.21292/2075-1230-2021-99-2-45-51.
9. Иванова Д.А., Борисов С.Е., Родина О.В. и др. Безопасность режимов лечения больных туберкулезом с множественной лекарственной устойчивостью возбудителя согласно новым рекомендациям ВОЗ 2019 г. Туберкулез и болезни легких. 2020;98(1):5–15. [Ivanova D.A., Borisov S.E., Rodina O.V. et al. Safety of treatment regimens in multiple drug resistant tuberculosis patients compiled as per the new who recommendations as of 2019. Tuberculosis and lung diseases. 2020;98(1):5–15 (in Russ.)]. DOI: 10.21292/2075-1230-2020-98-1-5-15.
10. Малиев Б.М., Басиева О.З., Хетагурова С.Б., Туаллагова Э.Т. Сравнительное изучение эффективности препаратов имунофан и тубосан у больных с впервые выявленным туберкулезом легких. Туберкулез и болезни легких. 2019;97(6):63–64. [Maliev B.M., Basieva O.Z., Khetagurova S.B., Tuallagova E.T. Comparative assessment of imunofan and tubosan efficacy in new pulmonary tuberculosis cases. Tuberculosis and lung diseases. 2019;97(6):63–64 (in Russ.)]. DOI: 10.21292/2075-1230-2019-97-6-63-64.
11. Сабадаш Е.В., Скорняков С.Н., Медвинский И.Д. и др. Аминокислотный гомеостаз в реализации адаптивных реакций у животных с различной устойчивостью к туберкулезной инфекции (экспериментальное исследование). РМЖ. 2020;4:29–33. [Sabadash E.V., Skornyakov S.N., Medvinskii I.D. et al. Amino acid homeostasis during the implementation of adaptive responses in animals with various resistance to tuberculosis infection (experimental study). RMJ. 2020;4:29–33 (in Russ.)].
12. Скак К., Батрова З.Р., Кочеткова Т.С., Шарыпина Е.П. Влияние применения метода xpertmtb/rif на эффективность лечения туберкулеза с множественной лекарственной устойчивостью возбудителя. В кн.: сборник статей III Международной научно-практической конференции "Applied science of today: problems and new approaches". Петрозаводск: Международный центр научного партнерства «Новая Наука»; 2020: 173–179. [Skak K., Batrova Z.R., Kochetkova T.S., Sharypina Ye.P. Influence of the xpertmtb/rif method on the effectiveness of the treatment of multidrug-resistant tuberculosis. In the collection of articles of the III International Scientific and Practical Conference "Applied science of today: problems and new approaches". Petrozavodsk: Mezhdunarodnyy tsentr nauchnogo partnerstva "Novaya Nauka"; 2020: 173–179 (in Russ.)].
13. Хренов А.А., Федосеева В.М., Гришин М.М. Системный цитокиновый потенциал у больных с хронической обструктивной болезнью легких, завершивших лечение туберкулеза легких. Туберкулез и болезни легких. 2020;98(1):22–26. [Khrenov A.A., Fedoseeva V.M., Grishin M.M. Systemic cytokine potential in patients with chronic obstructive pulmonary disease who completed treatment for pulmonary tuberculosis. Tuberculosis and lung diseases. 2020;98(1):22–26 (in Russ.)]. DOI: 10.21292/2075-1230-2020-98-1-22-26.
14. Zimmerman J.E., Kramer A.A., McNair D.S., Malila F.M. Acute Physiology and Chronic Health Evaluation (APACHE) IV: hospital mortality assessment for today’s critically ill patients. Crit Care Med. 2006;34(5):1297–1310. DOI: 10.1097/01.CCM.0000215112.84523.F0.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
