Подбор дозы базального инсулина для достижения оптимального гликемического контроля: роль врача и пациента
Достижение целевых уровней гликированного гемоглобина (HbA1c) снижает риск поздних осложнений сахарного диабета (СД), но многим пациентам с СД 2 типа не удается достичь адекватного гликемического контроля. Это может быть следствием клинической инерции, обусловленной у пациента страхом гипогликемии или набора массы тела, обременяющими режимами терапии, низкой приверженностью инъекционной терапии, нехваткой времени у врача для обучения пациентов, сложностями с пониманием пациентом необходимости подбора дозы препарата, переживаниями по поводу потраченного времени на достижение целевых показателей. Новая форма инсулина гларгин 300 ЕД/мл обеспечивает более плавный профиль активности препарата, удлиняет его действие и позволяет более стойко поддерживать концентрации глюкозы в крови. Результаты исследования TAKE CONTROL свидетельствуют о том, что самостоятельная титрация инсулина гларгин 300 ЕД/мл превосходила титрацию, управляемую врачом, с точки зрения снижения HbA1c.
Ключевые слова: базальный инсулин, титрация, гларгин 300 ЕД/мл, сахарный диабет.
Для цитирования: Демидова Т.Ю. Подбор дозы базального инсулина для достижения оптимального гликемического контроля: роль врача и пациента. РМЖ. Медицинское обозрение. 2019;3(10(II)):75-81.
T.Yu. Demidova
Pirogov Russian National Research Medical University, Moscow
Achieving target levels of glycated haemoglobin (HbA1c) reduces the risk of diabetes mellitus late complications, however, many patients with type 2 diabetes mellitus do not achieve adequate glycemic control in general practice. Inadequate glycemic control can be a consequence of clinical inertia due to several barriers on the part of both the physician and the patient. For example, due to the fear of hypoglycemia or weight gain, burdensome therapy regimens, low adherence to injection therapy, lack of time of physician to train patients, difficulty for the patient in understanding the importance and necessity of dosage selection, and worries about the time spent on achieving targets. The new form of insulin glargine 300 U/ml provides an even smoother activity profile of the drug, prolongates its action and allows more stable maintenance of blood glucose concentrations. The TAKE CONTROL study results indicate that self-titration of insulin glargine 300 U/ml was superior to titration managed by the physician in terms of reducing HbA1c.
Keywords: basal insulin, titration, glargine 300 U/ml, diabetes mellitus.
For citation: Demidova T.Yu. Basal insulin dosage selection for optimal glycemic control: physician’s and patient’s role. RMJ. Medical Review. 2019;10(II):75–81.
В статье обсуждается роль врача и пациента в подборе дозы базального инсулина для достижения оптимального гликемического контроля
Факторы, влияющие на достижение целевых уровней гликированного гемоглобина у пациентов с СД 2 типа
Достижение целевых уровней гликированного гемоглобина (НbА1с) снижает риск поздних осложнений сахарного диабета (СД) [1], но многим пациентам с СД 2 типа (СД 2) не удается достичь адекватного гликемического контроля [2–4]. Это может быть следствием клинической инерции, обусловленной у пациента страхом гипогликемии или набора массы тела, обременяющими режимами терапии, низкой приверженностью инъекционной терапии, нехваткой времени у врача для обучения пациентов и сложностью понимания пациентом необходимости подбора дозы препарата, переживаниями по поводу потраченного времени на достижение целевых показателей, недостаточной коммуникацией между врачом и пациентами, тревожностью [5–10]. Поскольку СД является прогрессирующим заболеванием, со временем гликемический контроль ослабевает и требуется интенсификация терапии [11].
Предоставление возможности пациентам с СД 2 принимать более активное участие в их собственном лечении может помочь им достичь нужного уровня гликемии и снизить риск смертности от всех причин [12, 13], сократить стоимость лечения осложнений и количества госпитализаций [14], способствовать снижению растущего бремени СД в системах здравоохранения всех стран мира. Данная концепция пациенто-ориентированного здравоохранения и самостоятельного управления заболеванием является ключевой концепцией действующего консенсуса, представленного Американской ассоциацией диабета (ADA) и Европейской ассоциацией по изучению сахарного диабета (EASD).
Самостоятельная титрация инсулина гларгин 100 ЕД/мл может быть более эффективной, чем подбор дозы, осуществляемый врачом [14, 15], и при этом не отмечается проблем с безопасностью [16, 17]. Однако, вероятно, самостоятельная титрация может быть связана с более высоким риском симптоматической гипогликемии, чем управляемая врачом [15, 16]. Данное ограничение инсулина гларгин 100 ЕД/мл может быть преодолено при помощи самостоятельной титрации инсулина гларгин 300 ЕД/мл — базального инсулина второго поколения с более пролонгированным и стабильным фармакокинетическим и фармакодинамическим профилем, чем у инсулина гларгин 100 ЕД/мл [18, 19].
Формы препаратов инсулина и контроль гликемии
Новая форма разработана для обеспечения более плавного профиля действия препарата, его удлинения и обеспечения более стойкого поддержания концентрации глюкозы в крови. Несмотря на то что вышеуказанные препараты содержат одно и то же активное вещество — инсулин гларгин, его концентрация в единице объема в 3 раза больше в инсулине гларгин 300 ЕД/мл [20], поэтому для одного и того же количества единиц инсулина гларгин вводимый объем инсулина гларгин 300 ЕД/мл составляет 1/3 часть. Очевидно, что объем депонированного преципитата зависит от концентрации инъекционного раствора, однако количество единиц введенного инсулина остается постоянным. Таким образом, гларгин 300 ЕД/мл образует преципитат меньшего объема, чем гларгин 100 ЕД/мл. Ввиду того, что скорость высвобождения молекул инсулина гларгин из депо пропорциональна площади поверхности депо препарата, меньший объем преципитата инсулина гларгин 300 ЕД/мл обеспечивает более медленное поступление в системный кровоток инсулина по сравнению с таковым при введении инсулина гларгин 100 ЕД/мл, который имеет больший объем преципитата. В результате этого применение гларгина 300 ЕД/мл сопровождается более постепенным высвобождением инсулина и, соответственно, более равномерным и длительным периодом активности [18, 21–23] (рис. 1, 2).
![Рис. 1. Схема высвобождения инсулина гларгин 300 ЕД/мл и инсулина гларгин 100 ЕД/мл [18, 21–23]. Рис. 1. Схема высвобождения инсулина гларгин 300 ЕД/мл и инсулина гларгин 100 ЕД/мл [18, 21–23].](/upload/medialibrary/a66/60-8.png)
![Рис. 2. Сравнение фармакокинетики (концентрация инсулина в крови) и фармакодинамики (сахароснижающий эффект) инсулинов гларгин 100 ЕД/мл (Гла-100) и гларгин 300 ЕД/мл (Гла-300) в ходе клэмп-теста [18] Рис. 2. Сравнение фармакокинетики (концентрация инсулина в крови) и фармакодинамики (сахароснижающий эффект) инсулинов гларгин 100 ЕД/мл (Гла-100) и гларгин 300 ЕД/мл (Гла-300) в ходе клэмп-теста [18]](/upload/medialibrary/393/60-9.png)
Результаты исследования равновесной концентрации препарата продемонстрировали больший период полувыведения (19 ч против 13,5 ч), время действия и даже более равномерное воздействие инсулина гларгин 300 ЕД/мл по сравнению с инсулином гларгин 100 ЕД/мл. Другое исследование показало низкую внутригрупповую вариабельность инсулина гларгин 300 ЕД/мл (коэффициент вариабельности составил 17,4%). Колебания от пика до нижней точки (0,6) были ниже, чем для инсулина гларгин 100 ЕД/мл (1,6) [18]. Таким образом, в исследованиях была продемонстрирована более низкая вариабельность гликемии при применении инсулина гларгин 300 ЕД/мл, что еще более приближает лечение к физиологической норме, снижает риск гипогликемий, прогностически положительно влияет на развитие микрососудистых осложнений и облегчает управление СД [24–26].
Исследования III фазы с применением подхода «лечение до цели» продемонстрировали низкий риск гипогликемии на фоне применения инсулина гларгин 300 ЕД/мл по сравнению с инсулином гларгин 100 ЕД/мл у пациентов с СД 2, особенно в фазе титрации [27]. В исследованиях принимали участие 2737 пациентов с СД 2 и 792 пациента с СД 1. Во всех исследованиях инсулин гларгин 300 ЕД/мл был сопоставим по своему гипогликемическому эффекту с инсулином гларгин 100 ЕД/мл [28–35].
Благодаря описанному механизму, обеспечивающему более стабильный профиль фармакокинетики и фармакодинамики — низкий уровень вариабельности гликемии [18, 24–26, 36, 37], пациенты, получавшие в ходе исследований III фазы инсулин гларгин 300 ЕД/мл, имели значительно меньший риск гипогликемии, чем пациенты, получавшие инсулин гларгин 100 ЕД/мл [28–35]. В частности, это касалось меньшего риска ночной гипогликемии в исследовании EDITION 1, проводившемся среди пациентов с СД 2 на базис-болюсном режиме терапии [30, 33], меньшего риска гипогликемии в течение всего дня и ночью в исследовании EDITION 2, проводившемся среди пациентов с СД 2, получавших ранее иной базальный инсулин [31, 34].
В исследованиях EDITION 2 и EDITION 3 (исследование среди больных СД 2, не получавших инсулин ранее) пациенты, получавшие инсулин гларгин 300 ЕД/мл, имели более низкий уровень вариабельности глюкозы и низкий риск симптоматической и тяжелой гипогликемии, что было подтверждено Индексом низкой глюкозы крови (LBGI) — показателем, который подтверждает низкий вероятный риск гипогликемии [31, 32, 34].
Исследование EDITION 4, проводившееся среди больных СД 1, ранее получавших иной базальный инсулин, показало, что пациенты, получавшие инсулин гларгин 300 ЕД/мл, достигали сравнимого с инсулином гларгин 100 ЕД/мл гликемического контроля с более низким риском гипогликемии и набора массы тела при переводе с других режимов инсулинотерапии, независимо от времени введения [20].
Сравнение инсулина гларгин 300 ЕД/мл проводилось не только с базальными инсулинами 1-го поколения, но и с базальным инсулином 2-го поколения сверхдлительного действия — инсулином деглудек 100 ЕД/мл. В прямом сравнительном рандомизированном контролируемом 24-недельном исследовании (BRIGHT) участвовали пациенты с неконтролируемым СД 2, ранее не получавшие инсулин. Участники были рандомизированы в соотношении 1:1 в группы инсулина гларгин 300 ЕД/мл (n = 466) или деглудек 100 ЕД/мл (n = 463); оба препарата вводили в вечернее время; дозу подбирали до достижения уровня глюкозы плазмы натощак 4,4–5,5 ммоль/л при самостоятельном измерении пациентом. Первичной конечной точкой являлось изменение уровня НbА1с через 24 нед. по сравнению с исходными величинами. Через 24 нед. в обеих группах было отмечено сопоставимое улучшение показателей HbА1с по сравнению с исходными значениями — с 8,7% в группе инсулина гларгин 300 ЕД/мл и 8,6% в группе инсулина деглудек 100 ЕД/мл до 7,0%, наименьшие квадраты средних различий — 0,05% (95% доверительный интервал (ДИ) от -0,15 до 0,05), что свидетельствовало о сопоставимой эффективности инсулина гларгин 300 ЕД/мл и инсулина деглудек 100 ЕД/мл (р<0,0001). Доля пациентов с эпизодами гипогликемии, зафиксированными в ходе исследования, и частота эпизодов гипогликемии через 24 нед. были также сопоставимы в обеих группах, однако в течение периода активного титрования дозы (от начала до 12-й нед.) доля пациентов с подтвержденной гипогликемией и частота эпизодов подтвержденной гипогликемии (≤3,9 и <3,0 ммоль/л) в любое время суток (24 ч) в группе инсулина гларгин 300 ЕД/мл были ниже [38].
Меньший риск гипогликемии также был отмечен в исследованиях реальной клинической практики при переводе пациентов на применение инсулина гларгин 300 ЕД/мл с других базальных инсулинов [39].
Согласно инструкции по медицинскому применению инсулина гларгин 300 ЕД/мл единицы инсулина гларгин 300 ЕД/мл относятся только к данному препарату и не эквивалентны другим единицам, выражающим силу действия других аналогов инсулина. Гларгин 100 ЕД/мл и гларгин 300 ЕД/мл не эквивалентны по своим фармакокинетическим, фармакодинамическим характеристикам и клиническим эффектам.
Правила перехода с одной формы препаратов инсулина на другую
В связи с изложенным выше переход с инсулина гларгин 100 ЕД/мл на инсулин гларгин 300 ЕД/мл и наоборот требует наблюдения врача, проведения тщательного метаболического контроля и индивидуальной коррекции дозы препарата. Начальная доза инсулин гларгин 300 ЕД/мл составляет 0,2 ЕД/кг массы тела 1 р./сут с последующей индивидуальной коррекцией дозы [37].
Переход с инсулина гларгин 100 ЕД/мл на инсулин гларгин 300 ЕД/мл может быть проведен из расчета единица на единицу (1:1), но для достижения целевого диапазона концентраций глюкозы в плазме крови может потребоваться более высокая доза препарата инсулин 300 ЕД/мл [37].
При переходе с инсулина гларгин 300 ЕД/мл на инсулин гларгин 100 ЕД/мл для снижения риска развития гипогликемии доза должна быть уменьшена (приблизительно на 20%) с последующей ее коррекцией при необходимости [37].
Рекомендуется проведение тщательного метаболического мониторинга во время и в течение нескольких первых недель после перехода с одного из этих препаратов на другой. При переходе со схем лечения инсулинами промежуточной и длительной продолжительности действия на схему лечения инсулином гларгин 300 ЕД/мл может потребоваться изменение дозы базального инсулина и коррекция одновременно проводимой гипогликемической терапии (изменение доз и времени введения инсулинов короткого действия или быстродействующих аналогов инсулина либо доз неинсулиновых гипогликемических препаратов) [37].
Переход с однократного в течение суток введения базальных инсулинов на однократное в течение суток введение инсулина гларгин 300 ЕД/мл может проводиться из расчета единица на единицу (1:1) ранее вводимой дозы базального инсулина [37].
При переходе с двукратного в течение суток введения базальных инсулинов на однократное введение инсулина гларгин 300 ЕД/мл рекомендованная начальная доза инсулина гларгин 300 ЕД/мл составляет 80% от общей суточной дозы базального инсулина, лечение которым прекращается [37].
С улучшением метаболического контроля и возникающим в результате этого увеличением чувствительности к инсулину может потребоваться дополнительная коррекция режима дозирования. Она может также потребоваться, например, при изменении массы тела или стиля жизни пациента, времени введения дозы инсулина или при возникновении других состояний, которые повышают предрасположенность к развитию гипо- и гипергликемии [37].
Принципы титрования дозы инсулина
Период активного подбора дозы (титрования) сразу после инициации инсулинотерапии обычно связан с наибольшим увеличением доз инсулина, наибольшим снижением уровня глюкозы в плазме и HbA1c [40]. К сожалению, часто в клинической практике неоптимальное титрование дозы базального инсулина приводит к отсутствию адекватного гликемического контроля у пациентов [8, 41, 42].
Исследование TAKE CONTROL имело целью изучение эффективности и безопасности инсулина гларгин 300 ЕД/мл при самостоятельном титровании по сравнению с титрованием, управляемым врачом, чтобы оценить возможность простого самостоятельного процесса подбора дозы пациентом [43].
TAKE CONTROL было спланировано как мультицентровое 24-недельное открытое исследование с двумя параллельными группами пациентов, как ранее не применяв-
ших, так и применявших инсулин. Пациенты были рандомизированы в соотношении 1:1 на самостоятельную титрацию инсулина или подбор дозы, управляемый врачом, с применением инсулина гларгин 300 ЕД/мл. Цель гликемии плазмы натощак составляла 4,4–7,2 ммоль/л. Первичной конечной точкой было подтверждение адекватной динамики HbA1c от исходного к 24-й нед. Вторичные конечные точки включали достижение целевого показателя глюкозы в плазме натощак по данным самоконтроля без гипогликемии, встречаемость гипогликемии и нежелательные явления. К 24-й нед. средний показатель снижения HbA1c, рассчитанный по методу наименьших квадратов, составил 0,97% и 0,84% в группе самостоятельной титрации и в группе титрации, управляемой врачом (алгоритм титрации отображен на рисунке 3), соответственно, со средней разницей, рассчитанной по методу наименьших квадратов -0,13% (95% ДИ от -0,2619 до -0,0004), что демонстрирует не меньшую (р<0,0001) и превосходящую (р=0,0247) эффективность самостоятельной титрации по сравнению с титрацией, которой управляет врач (рис. 4) [43].
![Рис. 3. Алгоритм титрования в исследовании TAKE CONTROL для обеих групп [43] Рис. 3. Алгоритм титрования в исследовании TAKE CONTROL для обеих групп [43]](/upload/medialibrary/fae/60-10.png)
![Рис. 4. Динамика от исходного значения к 24-й нед. среднего значения HbA1c, рассчитанного по методу наименьших квадратов (ITT-популяция) [43]. Рис. 4. Динамика от исходного значения к 24-й нед. среднего значения HbA1c, рассчитанного по методу наименьших квадратов (ITT-популяция) [43].](/upload/medialibrary/29b/60-11.png)
Также значимо больше пациентов в группе самостоятельной титрации достигли целевого значения глюкозы в плазме натощак по данным самоконтроля без гипогликемии (67% по сравнению с 58%; р=0,0187) (рис. 5) [43].
![Рис. 5. Динамика от исходного значения к 24-й нед. средне- го значения глюкозы в плазме натощак, рассчитанного по методу наименьших квадратов (ITT-популяция) [43] Рис. 5. Динамика от исходного значения к 24-й нед. средне- го значения глюкозы в плазме натощак, рассчитанного по методу наименьших квадратов (ITT-популяция) [43]](/upload/medialibrary/b0d/60-12.png)
В целом встречаемость гипогликемии была сопоставимой между группами. Не было сообщено о проблемах с безопасностью. В обеих группах, по отзывам пациентов, произошло сходное улучшение, в частности по дистрессу, связанному с бременем СД, и по уверенности в самостоятельном управлении заболеванием. В группе самостоятельной титрации дозы было несколько больше пациентов, достигших клинически значимого снижения эмоционального бремени и меньшее количество пациентов с высоким эмоциональным бременем. В результате данного исследования был сделан вывод о том, что самостоятельная титрация инсулина гларгин 300 ЕД/мл превосходила титрацию, управляемую врачом, с точки зрения снижения HbA1c [43].
Результаты исследования TAKE CONTROL в общем поддерживаются результатами ранее проведенных исследований ATLAS [16] и ATLANTUS [15, 44]. Оба исследования были рандомизированными 24-недельными мультицентровыми открытыми исследованиями, которые продемонстрировали значимое улучшение гликемического контроля при самостоятельной титрации инсулина гларгин 100 ЕД/мл по сравнению с титрацией, управляемой врачом, у пациентов с неадекватным контролем СД 2 [15, 16, 44].
Установленные в рамках исследовательских программ особенности применения инсулина гларгин 300 ЕД/мл у пациентов с неадекватным гликемическим контролем СД 2 хочется проиллюстрировать рядом клинических примеров. Крайне важно, что данные РКИ во многом повторяются в условиях рутинной клинической практики и позволяют достигать целевой компенсации СД и улучшения качества жизни больных.
Клинические примеры
Клинический пример № 1. Пациент С., 54 года, страдающий СД 2 в течение 3 лет, обратился в клинику с жалобами на ночную потливость, чувство слабости по утрам, высокие уровни глюкозы в крови, значительные перепады показателей гликемии при самоконтроле, онемение стоп.
У пациента диагностированы: диабетическая пролиферативная ретинопатия, ожирение (ИМТ — 38,6 кг/м2). Три года назад при постановке диагноза СД 2 пациенту была проведена экзартикуляция 1-го пальца левой стопы по поводу гангрены. С дебюта заболевания пациенту была назначена базисно-болюсная инсулинотерапия, которую он получал до настоящего времени: инсулин короткого действия по 8–12 ЕД перед основными приемами пищи, инсулинизофан по 18 ЕД утром и 14 ЕД на ночь, а также метформин 2000 мг/сут. Пациент плохо соблюдает рекомендации по питанию, с трудом осуществляет подсчет углеводов по системе хлебных единиц. Болюсный (прандиальный) инсулин, как правило, вводит в фиксированной дозе, вне зависимости от показателей гликемии и питания. Уровень НbА1с — 6,9%.
Для оценки особенностей суточного гликемического профиля и коррекции сахароснижающей терапии пациенту было проведено непрерывное мониторирование гликемии в течение 4 дней. На графике представлены продолжительный период ночной гипогликемии, выраженная вариабельность гликемии с высокими постпрандиальными подъемами уровня глюкозы в крови в дневное время (рис. 6).
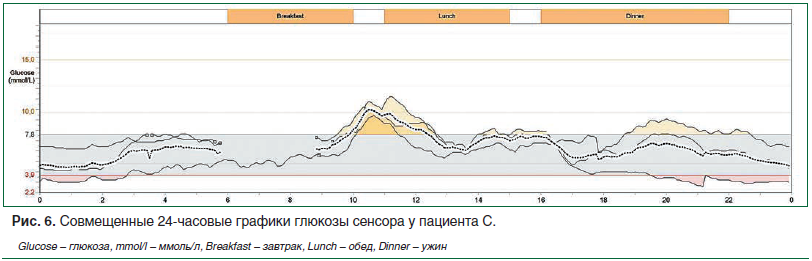
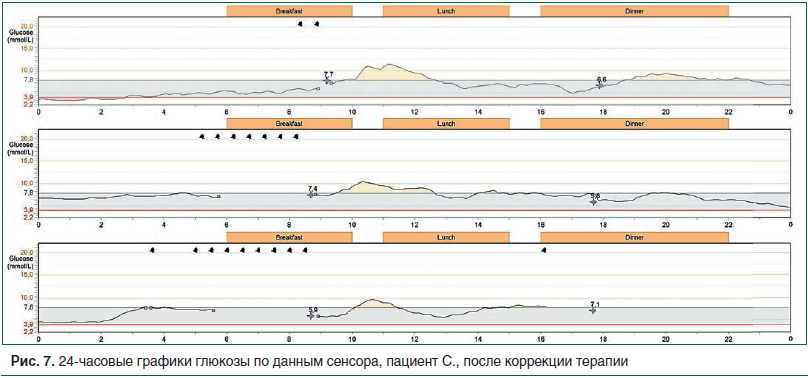
Пациенту скорректирована сахароснижающая терапия: вместо инсулина-изофана, на фоне которого зарегистрированы гипогликемии, назначен инсулин гларгин 300 ЕД/мл в эквивалентной дозе 26 ЕД/сут. Пациенту с непродолжительным анамнезом СД и выраженным ожирением инсулин короткого действия был отменен, назначен дапаглифлозин 10 мг, метформин сохранен в прежней дозе. Далее доза инсулина гларгин титровалась до достижения целевых показателей гликемии натощак и составила 32 ЕД/сут.
На представленном графике мониторирования после коррекции терапии отмечается существенная положительная динамика в виде стабилизации показателей гликемии в ночное время в пределах физиологической нормы, постпрандиальная гликемия в рамках целевых значений, отсутствие эпизодов гипогликемии (рис. 7).
Клинический пример № 2. Пациентка К., 63 года, страдающая СД 2 в течение 8 лет, обратилась в клинику с жалобами на ночную потливость, высокие уровни глюкозы в крови, значительные перепады показателей гликемии при самоконтроле. У пациентки диагностировано атеросклеротическое поражение коронарных артерий, проводилось стентирование огибающей ветви левой коронарной артерии 4 года назад.
За период болезни получала различные комбинации сахароснижающих препаратов, в течение последних 5 лет — инсулин-изофан 10 ЕД утром и 6 ЕД на ночь, метформин с пролонгированным высвобождением 1000 мг/сут, гликлазид с пролонгированным высвобождением 120 мг утром. Пациентка не соблюдает диетические рекомендации, хлебные единицы не учитывает, имеет ожирение 2 степени, ИМТ — 37,3 кг/м2. Уровень НbА1с — 7,0%.
Для оценки особенностей суточного гликемического профиля и коррекции инсулинотерапии пациентке было проведено непрерывное мониторирование гликемии в течение 4 дней. На представленном графике установлены: выраженная продолжительная гипогликемия в ночное время, вариабельность гликемии с высокими постпрандиальными подъемами уровня глюкозы в крови в дневное время (рис. 8).
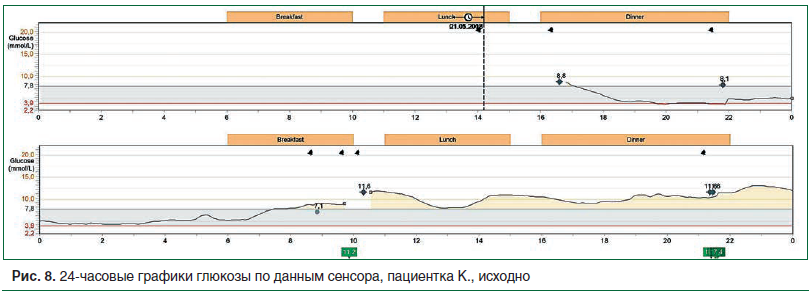
Была проведена коррекция назначенной терапии: инсулин-изофан был заменен на инсулин гларгин 300 ЕД/мл в дозе 12 ЕД перед сном. Гликлазид отменен, назначен дапаглифлозин 10 мг/сут, метформин сохранен в прежней дозе. Проводилось обучение в школе для пациентов с диабетом, даны рекомендации по питанию и физической активности. Доза инсулина гларгин 300 ЕД/мл титровалась до достижения целевых показателей гликемии натощак и составила 16 ЕД/сут.
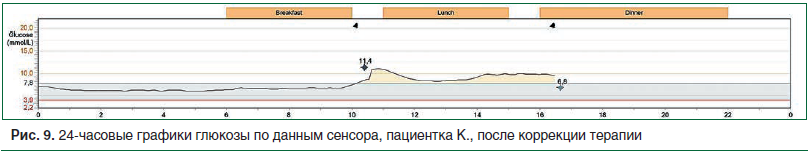
На графике гликемического профиля после коррекции терапии отражена нормализация ночной гликемии в пределах целевых значений. Постпрандиальные значения глюкозы в крови также соответствуют целевым. Гипогликемий не зарегистрировано (рис. 9).
Заключение
Поддержание целевых показателей гликемического контроля, безусловно, является одной из приоритетных задач терапии СД. Разработка базальных аналогов инсулина длительного действия, в частности аналога инсулина гларгин 300 ЕД/мл, предоставляет дополнительные возможности пациенту и лечащему врачу для интенсификации и оптимизации сахароснижающей терапии и безопасного достижения целевых показателей гликемии. Это стало возможным за счет равномерного и пролонгированного действия препарата с меньшим риском развития эпизодов гипогликемии. Однако для достижения поставленных целей требуется грамотный и тщательный подбор дозы препарата инсулина. Показано, что самостоятельный подбор дозы пациентами в амбулаторных условиях обеспечивает даже большую эффективность сахароснижающей терапии и способствует вовлечению пациентов с СД в активное управление заболеванием.
2. Polinski J.M., Kim S.C., Jiang D. et al. Geographic patterns in patient demographics and insulin use in 18 countries, a global perspective from the multinational observational study assessing insulin use: understanding the challenges associated with progression of therapy (MOSAIc). BMC Endocr Disord. 2015;15:46.
3. Khunti K., Caputo S., Damci T. et al. The safety and efficacy of adding once-daily insulin detemir to oral hypoglycaemic agents in patients with type 2 diabetes in a clinical practice setting in 10 countries. Diabetes Obes Metab. 2012;14:1129–1136.
4. Mauricio D., Meneghini L., Seufert J. et al. Glycaemic control and hypoglycaemia burden in patients with type 2 diabetes initiating basal insulin in Europe and the USA. Diabetes Obes Metab. 2017;19:1155–1164.
5. Polonsky W.H., Fisher L., Guzman S. et al. Psychological insulin resistance in patients with type 2 diabetes: the scope of the problem. Diabetes Care. 2005;28:2543–2545.
6. Polinski J.M., Smith B.F., Curtis B.H. et al. Barriers to insulin progression among patients with type 2 diabetes: a systematic review. Diabetes Educ. 2013;39:53–65.
7. Peyrot M., Barnett A.H., Meneghini L.F., Schumm-Draeger P.M. Insulin adherence behaviours and barriers in the multinational global attitudes of patients and physicians in insulin therapy study. Diabet Med. 2012;29:682–689.
8. Russell-Jones D., Pouwer F., Khunti K. Identification of barriers to insulin therapy and approaches to overcoming them. Diabetes Obes Metab. 2018;20(3):488–496.
9. Berard L., Bonnemaire M., Mical M., Edelman S. Insights into optimal basal insulin titration in type 2 diabetes: results of a quantitative survey. Diabetes Obes Metab. 2018;20(2):301–308.
10. Wei W., Pan C., Xie L., Baser O. Real-world insulin treatment persistence among patients with type 2 diabetes. Endocr Pract. 2014;20:52–61.
11. Standards of medical care in diabetes–2015: summary of revisions. Diabetes Care. 2015;38: S33–S40.
12. White R.D. Patient empowerment and optimal glycemic control. Curr Med Res Opin. 2012;28:979–989.
13. He X., Li J., Wang B. et al. Diabetes self-management education reduces risk of all-cause mortality in type 2 diabetes patients: a systematic review and meta-analysis. Endocrine. 2017;55:712–731.
14. Powers M.A., Bardsley J., Cypress M. et al. Diabetes self-management education and support in type 2 diabetes: a joint position statement of the American Diabetes Association, the American Association of Diabetes Educators, and the academy of nutrition and dietetics. Clin Diabetes. 2016;34:70–80.
15. Davies M., Storms F., Shutler S. et al. for the AT.LANTUS Study Group. Improvement of glycemic control in subjects with poorly controlled type 2 diabetes: comparison of two treatment algorithms using insulin glargine. Diabetes Care. 2005;28:1282–1288.
16. Garg S.K., Admane K., Freemantle N. et al. Patient-led versus physician-ledtitration of insulin glargine in patients with uncontrolled type 2 diabetes: a randomized multinational ATLAS study. Endocr Pract. 2015;21:143–157.
17. Harris S.B., Yale J.F., Berard L. et al. Does a patient-managed insulin intensification strategy with insulin glargine and insulin glulisine provide similar glycemic control as a physician-managed strategy? Results of the START (Self-Titration With Apidra to Reach Target) study: a randomized noninferiority trial. Diabetes Care. 2014;37:604–610.
18. Becker R.H., Dahmen R., Bergmann K. et al. New insulin glargine 300 units mL-1 provides a more even activity profile and prolonged glycemic control at steady state compared with insulin glargine 100 units mL-1. Diabetes Care. 2015;38:637–643.
19. Heise T., Hovelmann U., Nosek L. et al. Comparison of the pharmacokinetic and pharmacodynamic profiles of insulin degludec and insulin glargine. Expert Opin Drug Metab Toxicol. 2015;11:1193–1201.
20. Home P.D., Bergenstal R.M., Bolli G.B. et al. New insulin glargine 300 units/mL versus glargine 100 units/mL in people with type 1 diabetes: a randomized, phase 3a, open-label clinical trial (EDITION 4). Diabetes Care. 2015; 38: 2217–2225.
21. Pettus J., Santos Cavaiola T., Tamborlane W.V., Edelman S. The past, present, and future of basal insulins. Diabetes Metab Res Rev. 2016;32:478–496.
22. Sutton G., Minguet J., Ferrero C., Bramlage P. U300, a novel long-acting insulin formulation. Expert Opin Biol Ther. 2014;14:1849–1860.
23. Steinstraesser A., Schmidt R., Bergmann K. et al. Investigational new insulin glargine 300 U/ml has the same metabolism as insulin glargine 100 U/ml. Diabetes Obes Metab. 2014;16:873–876.
24. Becker R.H., Nowotny I., Teichert L. et al. Low within- and between-day variability in exposure to new insulin glargine 300 U/ml. Diabetes Obes Metab. 2015;17:261–267.
25. Jinnouchi H., Koyama M., Amano A. et al. Continuous glucose monitoring during basal–bolus therapy using insulin glargine 300 U/mL and glargine 100U/mL in Japanese people with type 1 diabetes mellitus: a crossover pilot study. Diabetes Ther. 2015;6:143–152.
26. Steinstraesser A., Schmidt R., Bergmann K. et al. Investigational new insulin glargine 300 U/mL has the same metabolism as insulin glargine 100 U/mL. Diabetes Obes Metab. 2014;16:873–876.
27. Ritzel R., Roussel R., Bolli G.B. et al. Patient-level meta-analysis of the EDITION 1, 2 and 3 studies: glycaemic control and hypoglycaemia with new insulin glargine 300 U/ml versus glargine 100 U/ml in people with type 2 diabetes. Diabetes Obes Metab. 2015;17:859–867.
28. Matsuhisa M., Koyama M., Cheng X. et al. New insulin glargine 300 U/mL versus glargine 100 U/mL in Japanese adults with type 1 diabetes using basal and mealtime insulin: glucose control and hypoglycaemia in a randomized controlled trial (EDITION JP 1). Diabetes Obes Metab. 2016;18:375–383.
29. Matsuhisa M., Koyama M., Cheng X. et al. Sustained glycaemic control and less nocturnal hypoglycemia with insulin glargine 300U/mL compared with glargine 100U/mL in Japanese adults with type 1 diabetes (EDITION JP 1 randomised 12-month trial including 6-month extension). Diabetes Res Clin Pract. 2016;122:133–140.
30. Riddle M.C., Bolli G.B., Ziemen M. et al. New insulin glargine 300 units/mL versus glargine 100 units/mL in people with type 2 diabetes using basal and mealtime insulin: glucose control and hypoglycemia in a 6-month randomized controlled trial (EDITION 1). Diabetes Care. 2014;37:2755–2762.
31. Yki-Jarvinen H., Bergenstal R., Ziemen M. et al. New insulin glargine 300 units/mL versus glargine 100 units/mL in people with type 2 diabetes using oral agents and basal insulin: glucose control and hypoglycemia in a 6-month randomized controlled trial (EDITION 2). Diabetes Care. 2014;37:3235–3243.
32. Bolli G.B., Riddle M.C., Bergenstal R.M. et al. New insulin glargine 300 U/mL compared with glargine 100 U/mL in insulin-naive people with type 2 diabetes on oral glucose-lowering drugs: a randomized controlled trial (EDITION 3). Diabetes Obes Metab. 2015;17:386–394.
33. Riddle M.C., Yki-Jarvinen H., Bolli G.B. et al. One-year sustained glycaemic control and less hypoglycemia with new insulin glargine 300 U/mL compared with 100 U/mL in people with type 2 diabetes using basal plus meal-time insulin: the EDITION 1 12-month randomized trial, including 6-month extension. Diabetes Obes Metab. 2015;17:835–842.
34. Yki-Jarvinen H., Bergenstal R.M., Bolli G.B. et al. Glycaemic control and hypoglycaemia with new insulin glargine 300 U/mL versus insulin glargine 100 U/mL in people with type 2 diabetes using basal insulin and oral antihyperglycemic drugs: the EDITION 2 randomized 12-month trial including 6-month extension. Diabetes Obes Metab. 2015;17:1142–1149.
35. Terauchi Y., Koyama M., Cheng X. et al. New insulin glargine 300 U/mL versus glargine 100 U/mL in Japanese people with type 2 diabetes using basal insulin and oral antihyperglycemic drugs: glucose control and hypoglycemia in a randomized controlled trial (EDITION JP 2). Diabetes Obes Metab. 2016;18:366–374.
36. Shiramoto M., Eto T., Irie S. et al. Single-dose new insulin glargine 300 U/mL provides prolonged, stable glycaemic control in Japanese and European people with type 1 diabetes. Diabetes Obes Metab. 2015;17:254–260.
37. Инструкция по применению лекарственного препарата для медицинского применения Туджео СолоСтар®. ЛП-003653–300516, изм. № 3 от 2018 г.
38. Rosenstock J., Cheng A., Ritzel R. et al. More Similarities Than Differences Testing Insulin Glargine 300 Units/mL Versus Insulin Degludec 100 Units/mL in Insulin-Naive Type 2 Diabetes: The Randomized Head-to-Head BRIGHT Trial. Diabetes Care. 2018 Oct;41 (10):2147–2154.
39. Zhou F.L., Ye F., Berhanu P. et al. Real-world evidence on clinical and economic outcomes of switching to insulin glargine 300 Units/mL vs other basal insulins in patients with type 2 diabetes on basal insulin. Diabetes Obes Metab. 2018;20(5):1293–1297.
40. Owens D.R., Traylor L., Dain M.P., Landgraf W. Efficacy and safety of basal insulin glargine 12 and 24 weeks after initiation in persons with type 2 diabetes: a pooled analysis of data from treatment arms of 15 treat-to-target randomised controlled trials. Diabetes Res Clin Pract. 2014;106:264–274.
41. Aschner P., Gagliardino J.J., Ilkova H.M. et al. Poor Glycemic Control in People with T1D and T2D — Results from the International Diabetes Management Practices Study (IDMPS). Diabetes. 2018;67(1):1656-P.
42. Dalal M., Kazemi M., Ye F., Xie L. Hypoglycemia After Initiation of Basal Insulin in Patients with Type 2 Diabetes in the United States: Implications for Treatment Discontinuation and Healthcare Costs and Utilization. Adv Ther. 2017;34:2083–2092.
43. Russell-Jones D. et al. Take Control: A randomized trial evaluating the efficacy and safety of self- versus physician-managed titration of insulin glargine 300 U/mL in patients with uncontrolled type 2 diabetes. Diabetes Obes Metab. 2019;21:1615–1624.
44. Davies M., Storms F., Shutler S. et al. for the AT.LANTUS Study Group. Improvement of glycemic control in subjects with poorly controlled type 2 diabetes: comparison of two treatment algorithms using insulin glargine. Diabetes Care. 2005;28:1282–1288.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.