Пищевое поведение пациентов с сахарным диабетом 2 типа и полиморфизм гена рецептора меланокортина
DOI: 10.32364/2587-6821-2020-4-6-318-323
Цель исследования: провести анализ ассоциаций полиморфного локуса rs17782313 гена рецептора меланокортина 4-го типа MC4R у больных сахарным диабетом 2 типа (СД2) в этнической группе татар (Республика Башкортостан), определить типы нарушений пищевого поведения у пациентов с СД2 и их взаимосвязь с аллельными вариантами гена MC4R (rs17782313).
Материал и методы: генотипирование по полиморфному маркеру rs17782313 гена MC4R проведено с использованием полимеразной цепной реакции синтеза ДНК в двух группах: у 190 здоровых лиц (39 мужчин и 151 женщина, средний возраст
55,3±9,8 года) и у 200 пациентов с СД2 (57 мужчин и 143 женщины, средний возраст 59,2±9,5 года). Пищевое поведение оценивалось с использованием опросника DEBQ (The Dutch Eating Behaviour Questionnaire — Голландский опросник пищевого поведения) у 134 лиц контрольной группы и 83 пациентов с СД2. Все испытуемые были этническими татарами, жителями Республики Башкортостан. Статистическая обработка данных проведена с использованием компьютерных программ Statistica 6.0 и SNPStats (https://www.snpstats.net/start.htm). Показатель отношения шансов (ОШ) рассчитан на онлайн-сервисе (https://www.medcalc.org/calc/odds_ratio.php).
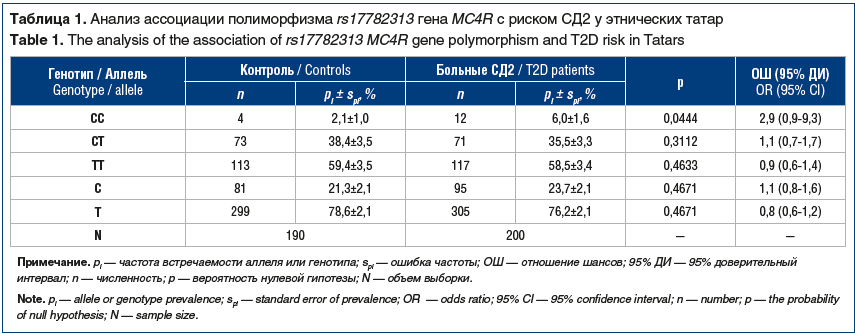
Результаты исследования: в группе пациентов с СД2 выявлена более высокая частота встречаемости генотипа CC полиморфного локуса гена MC4R (rs17782313) по сравнению с контрольной группой (6,0% против 2,1% соответственно; р=0,0444). У пациентов с СД2 по сравнению с лицами без диабета были выше показатели DEBQ по шкале «Эмоциогенное пищевое поведение» (р=0,00001), но ниже по шкалам «Ограничительное пищевое поведение» (р=0,0001) и «Экстернальное пищевое поведение» (р=0,0047). Аллельные варианты гена MC4R (rs17782313) не показали ассоциацию с типом пищевого поведения у пациентов с СД2 и у лиц контрольной группы.
Заключение: генотип CC полиморфного локуса гена MC4R (rs17782313) является маркером повышенного риска развития СД2 в этнической группе татар (ОШ=2,9; p=0,0444). Механизм, посредством которого аллельные варианты гена MC4R (rs17782313) влияют на развитие СД2, требует дальнейшего изучения.
Ключевые слова: сахарный диабет 2 типа, пищевое поведение, голландский опросник, DEBQ, ген рецептора меланокортина 4-го типа, эмоциогенное пищевое поведение, экстернальное пищевое поведение, ограничительное пищевое поведение, генетическая предрасположенность, татарская этническая группа.
Для цитирования: Авзалетдинова Д.Ш., Моругова Т.В., Шарипова Л.Ф., Кочетова О.В. Пищевое поведение пациентов с сахарным диабетом 2 типа и полиморфизм гена рецептора меланокортина. РМЖ. Медицинское обозрение. 2020;4(6):318-323. DOI: 10.32364/2587-6821-2020-4-6-318-323.
D.Sh. Avzaletdinova1, T.V. Morugova1, L.F. Sharipova1, O.V. Kochetova2
1Bashkir State Medical University, Ufa, Russian Federation
2Institute of Biochemistry and Genetics of Ufa Scientific Center of the Russian Academy of Sciences, Ufa, Russian Federation
Aim: to analyze the associations of rs17782313 polymorphism of melanocortin type 4 receptor (MC4R) gene in patients with type 2 diabetes (T2D) in Tatar ethnic group (Republic of Bashkortostan) and to determine the types of eating disorders in T2D patients and their association with MC4R allelic variants (rs17782313).
Patients and Methods: MC4R rs17782313 gene polymorphism was genotyped by polymerase chain reaction (PCR) in 190 healthy individuals (39 men and 151 women, mean age 55.3±9.8 years) and 200 patients with T2D (57 men and 143 women, mean age 59.2±9.5 years). Eating behavior was assessed using the Dutch Eating Behaviour Questionnaire (DEBQ) in 134 controls and 83 patients with T2D. All individuals belonged to the Tatar ethnic group and lived in the Republic of Bashkortostan. Statistical analysis was performed using Statistica 6.0 and SNPStats software (https://www.snpstats.net/start.htm). Odds ratio (OR) was calculated using online platform (https://www.medcalc.org/calc/odds_ratio.php).
Results: higher prevalence of C/C genotype of MC4R rs17782313 gene polymorphism was revealed in T2D patients compared to the controls (6.0% vs. 2.1%, respectively, p=0.0444). T2D patients were characterized by higher “Emotional eating” scores (р<0.00001) but lower “Restrictive eating” scores (р=0.0001) and “External eating” scores (р<0.0047) compared to healthy individuals. MC4R allelic variants (rs17782313) did not demonstrate any associations with eating behavior types in either T2D patients or controls.
Conclusion: C/C genotype of rs17782313 MC4R gene polymorphism is a marker of higher risk of T2D in Tatar ethnic group (OR=2.9, p=0,0444). The mechanisms by which MC4R allelic variants (rs17782313) affect T2D pathogenesis require further studies.
Keywords: type 2 diabetes, eating behavior, Dutch Eating Behavior Questionnaire, DEBQ, melanocortin receptor type 4 gene, emotional eating, external eating, restrictive eating, genetic susceptibility, Tatar ethnic group.
For citation: Avzaletdinova D.Sh., Morugova T.V., Sharipova L.F., Kochetova O.V. Eating behavior in patients with type 2 diabetes and melanocortin receptor gene polymorphism. Russian Medical Inquiry. 2020;4(6):318–323. DOI: 10.32364/2587-6821-2020-4-6-318-323.
Введение
Управление сахарным диабетом 2 типа (СД2) — один из приоритетных вопросов медицины, что связано с ранней инвалидизацией таких пациентов и чрезвычайно высокой прогрессией заболеваемости во всем мире. СД2 — классическое многофакторное заболевание, когда манифестация наступает как апофеоз взаимодействия множества триггеров, как средовых, так и генетически обусловленных. В качестве одного из модифицируемых факторов риска СД2 выделяют лишний вес, что послужило мотивом для введения в медицинскую терминологию понятия «diabesity» (англ. «diabetes» — диабет, «obesity» — ожирение) [1].
В свою очередь, в этиопатогенез ожирения вовлечено множество факторов, включая особенности пищевого поведения и генетическую предрасположенность [2, 3].
Молекулярно-генетические механизмы СД2 и ожирения пересекаются: по данным полногеномных исследований, шесть генетических локусов, ассоциированных с ожирением, предрасполагают также и к развитию СД2, и среди них — ген рецептора к меланокортину 4-го типа (MC4R) [4–9]. При этом механизм, посредством которого осуществляется влияние гена MC4R на предрасположенность к ожирению и СД2, не ясен.
Ген MC4R экспрессируется в ядрах гипоталамуса, вовлечен в сигнальный путь «лептин — меланокортин», регулирует аппетит, потребление пищи и поддержание энергетического гомеостаза путем интеграции сигналов его агониста α-меланоцитстимулирующего гормона и его антагониста — agouti-связанного пептида, что продемонстрировано на мышах [10]. Результатом стимуляции рецепторов меланокортина мозга являются снижение потребления пищи и потеря веса.
На основании вышеизложенного нами была выдвинута гипотеза, что ассоциация полиморфного локуса rs17782313 гена MC4R с СД2 реализуется через его влияние на пищевое поведение у пациентов с СД2.
Цели исследования: провести анализ ассоциаций полиморфного локуса rs17782313 гена рецептора меланокортина 4-го типа MC4R у больных СД2 в этнической группе татар (Республика Башкортостан), определить типы нарушений пищевого поведения у пациентов с СД2 и их взаимосвязь с аллельными вариантами гена MC4R (rs17782313).
Материал и методы
Исследование было проведено в два этапа. На первом этапе в исследовании участвовали 390 человек. Из них группу контроля составили 190 человек без клинических и лабораторных признаков СД (151 женщина и 39 мужчин), средний возраст составил 55,3±9,8 года. Во вторую группу вошли 200 пациентов с СД2 (143 женщины и 57 мужчин), средний возраст составил 59,2±9,5 года. Все испытуемые были этническими татарами и проживали в Республике Башкортостан.
На данном этапе было проведено молекулярно-генетическое исследование. ДНК выделяли из венозной крови методом фенольно-хлороформной экстракции. Амплификацию локуса гена MC4R (rs17782313) проводили с помощью метода полимеразной цепной реакции синтеза ДНК на амплификаторах «Терцик» (ДНК-технология, Россия) и Gene Amp 2700 (Applied Biosystems, США). Последовательности специфических олигонуклеотидных праймеров, размеры амплифицируемых фрагментов представлены в доступной литературе. Для определения нуклео-
тидных замен проводили гидролиз амплифицированных фрагментов ДНК рестриктазой BcnI при температуре 37 °С. Фрагменты ДНК после амплификации и рестрикции разделяли при помощи электрофореза в 7% полиакриламидном геле.
После окончания электрофореза гель окрашивали раствором бромистого этидия и визуализировали в проходящем ультрафиолетовом свете. Фиксацию результатов электрофореза проводили с использованием гель-документирующей системы Quantum (Viber Lourmat, Франция).
Второй этап исследования заключался в оценке пищевого поведения. В него вошли 217 человек, рандомно отобранных из участников первого этапа. Из них группу контроля составили 134 человека без клинических и лабораторных признаков СД (105 женщин и 29 мужчин), средний возраст составил 55,0±10,2 года. В группу пациентов с СД2 вошли 83 человека (62 женщины и 21 мужчина), средний возраст составил 59,0±9,9 года.
У всех участников второго этапа определяли рост и вес, рассчитывали индекс массы тела (ИМТ) как соотношение массы тела (кг) к росту (м2), определяли степень ожирения по классификации Всемирной организации здравоохранения.
Для анкетирования были использованы следующие опросники пищевого поведения.
Голландский опросник пищевого поведения DEBQ (The Dutch Eating Behaviour Questionnaire) — позволяет диагностировать типы пищевого поведения: ограничительный, эмоциогенный, экстернальный [11]. Лица с ограничительным пищевым поведением ограничивают себя в приеме пищи, что приводит к «диетической депрессии». Для эмоциогенного пищевого поведения характерно появление аппетита как реакция на негативные эмоциональные переживания. Экстернальное пищевое поведение характеризуется возникновением желания поесть под воздействием внешнего вида и запаха еды, а также при виде людей, принимающих пищу. У лиц без ожирения пищевое поведение в среднем оценивается в следующих значениях: ограничительное — 2,4 балла, эмоциогенное — 1,8 балла, экстернальное — 2,7 балла. При превышении этих показателей диагностируются нарушения пищевого поведения.
Тест отношения к приему пищи EAT-26 (Eating Attitudes Test) — позволяет проводить скрининг нервной анорексии и нервной булимии (расстройство пищевого поведения соответствует сумме баллов более 20).
Опросник для исследования уровня импульсивности В.А. Лосенкова — позволяет определить показатель импульсивности (ПИ). Если ПИ находится в диапазоне 66–80, то импульсивность выражена сильно, ПИ в диапазоне 35–65 свидетельствует об умеренной импульсивности, а если ПИ равен 34 и меньше, то импульсивность низкая. Высокий ПИ встречается у людей с недостаточным уровнем самоконтроля.
Статистическая обработка данных осуществлялась с использованием компьютерных программ Statistica 6.0 и SNPStats (https://www.snpstats.net/start.htm). Вычислялись средние арифметические величины (m), стандартные отклонения (σ), 95% доверительные интервалы. Показатель отношения шансов рассчитывали на онлайн-сервисе https://www.medcalc.org/calc/odds_ratio.php.
Протокол исследования одобрен комитетом по этике ФГБОУ ВО БГМУ Минздрава России. Все лица, участвовавшие в исследовании, подписывали информированное согласие, утвержденное комитетом по этике ФГБОУ ВО БГМУ Минздрава России.
Результаты исследования
На первом этапе исследования, при изучении полиморфного локуса rs17782313 гена MC4R в этнической группе татар выявлены статистически значимые различия в распределении частоты генотипа СС (р=0,0444) между группой пациентов с СД2 и контрольной группой. Генотип СС чаще встречался в выборке больных, что позволяет отнести его к маркеру повышенного риска СД2 в этнической группе татар (табл. 1).
Второй этап. У исследуемых пациентов с СД2 ИМТ в среднем составил 29,7±5,2 кг/м2 (от 22,6 до 38,0 кг/м2), из них у 8 (9,6%) наблюдалась избыточная масса тела, у 17 (20,5%) — ожирение 1-й степени, у 34 (41,0%) — ожирение 2-й степени, у 21 (25,3%) — ожирение 3-й степени и у 3 (3,6%) — ожирение 4-й степени. Ни один из пациентов не имел нормальной массы тела.
У лиц контрольной группы ИМТ в среднем составил 28,7±4,9 кг/м2 (от 20,0 до 47,5 кг/м2), из них у 60 (44,8%) наблюдалась избыточная масса тела, у 31 (23,2%) — ожирение 1-й степени, у 11 (8,2%) — ожирение 2-й степени, у 3 (2,2%) — ожирение 3-й степени, у 1 (0,7%) — ожирение 4-й степени, нормальная масса тела была у 28 (20,9%) человек.
В контрольной группе ограничительное пищевое поведение диагностировано у 96 человек (71%), эмоциогенное — у 114 (85%), экстернальное — у 106 человек (79%). В группе пациентов с СД2 ограничительное поведение выявлено у 60 (72%), эмоциогенное — у 78 (93%), экстернальное — у 73 (87%) человек. Несмотря на то, что среди пациентов с СД2 выше доля лиц с эмоциогенным и экстернальным поведением, данные отличия не достигали статистической значимости (р=0,0508 и р=0,1022 соответственно).
При сравнительном анализе показателей пищевого поведения отмечено, что средние значения показателей пищевого поведения отличались у пациентов двух групп по шкалам «Ограничительное пищевое поведение» (р=0,0001), «Эмоциогенное пищевое поведение» (р=0,00001) и «Экстернальное пищевое поведение» (р=0,0047) (табл. 2).
По опроснику уровня импульсивности В.А. Лосенкова также имелись достоверные различия (р=0,0001) между группой контроля и пациентами с СД2. Вместе с тем, несмотря на то, что ПИ выше в группе контроля (61,0 против 47,0), испытуемые обеих групп имели средний уровень импульсивности (см. табл. 2).
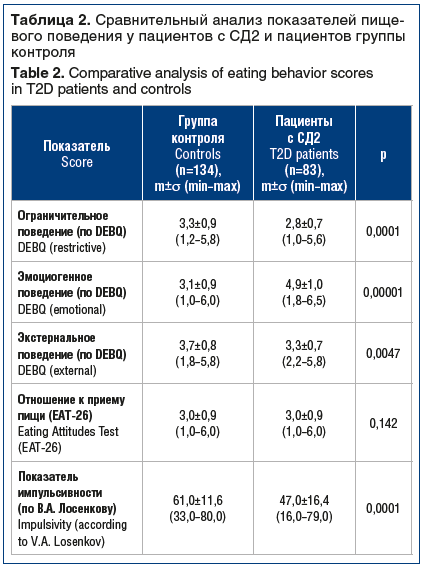
Показатели опросника EAT-26 не отличались в группе контроля и у пациентов с СД2 и свидетельствовали об отсутствии таких расстройств пищевого поведении, как анорексия и булимия (см. табл. 2).
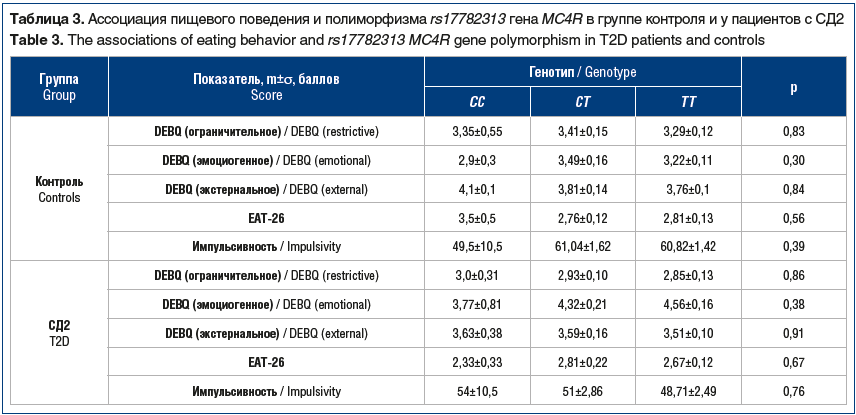
В таблице 3 приведены данные анализа ассоциаций полиморфного локуса rs17782313 гена MC4R с типами пищевого поведения в группе контроля и у пациентов с СД2. Достоверных отличий не выявлено.
Обсуждение
Данные крупных метаанализов полногеномных исследований, выполненных в европейских и азиатских популяциях, подтверждают роль аллельных вариантов гена MC4R (rs17782313) в развитии СД2 [6–8]. В Российской Федерации показана ассоциация другого полиморфного локуса гена MC4R (rs571312) с СД2 у русских жителей г. Тюмени [9]. Исследований по анализу ассоциаций участка rs17782313 гена MC4R с СД2 в других популяциях РФ в доступной литературе нет.
С другой стороны, варианты гена MC4R rs17782313 являются одними из наиболее значимых в этиологии ожирения. Так, взаимосвязь минорного аллеля С полиморфного локуса rs17782313 гена MC4R с повышенным ИМТ неоднократно продемонстрирована в исследованиях [12–15].
Несмотря на то, что взаимосвязь гена MC4R с массой тела и СД2 неоднократно подтверждена многочисленными исследованиями, точный механизм данного влияния не установлен. Существует точка зрения, согласно которой ген MC4R взаимодействует с серотониновыми и дофаминовыми рецепторами, что объясняет возможное участие его в регуляции настроения [16]. Использование антидепрессанта фенфлурамина (агониста серотониновых 2С-рецепторов) у мышей с выключенным геном MC4R показало снижение эффекта антидепрессанта [17]. На молекулярном уровне было подтверждено, что при стресс-индуцированной адаптации запускается синаптическая передача сигналов с участием гена MC4R в зоны мозга, связанные с вознаграждением и повышенной выработкой дофамина [18]. Исследования на животных показали, что дефицит рецепторов к меланокортину 4-го типа может приводить как к повышенному потреблению пищи в целом, так и к предпочтению жирной пищи [19–20].
Полиморфизм rs17782313 связан с депрессивным настроением и обусловленным им увеличением приема пищи [21]. В двух исследованиях чилийских детей, страдающих ожирением и имеющих генотип СС полиморфизма rs17782313, было показано увеличение пищевого удовольствия при употреблении сладкой пищи [22–23]. Исследования как на животных моделях, так и на людях выявили ассоциацию полиморфизма rs17782313 гена MC4R с употреблением алкоголя [24].
Рядом авторов получены данные о роли локуса rs17782313 гена MC4R в формировании нарушений пищевого поведения по типу переедания, а также в развитии депрессии. Horstmann A. et al. (2013) обнаружили, что у гомозиготных носителей аллеля C увеличен объем серого вещества в структурах головного мозга, регулирующих пищевое поведение, а также выше показатели эмоционального переедания, причем данная взаимосвязь прослеживалась только у женщин [25].
Yilmaz Z. et al. (2015) впервые сообщили о том, что ассоциация полиморфного локуса rs17782313 гена MC4R (аллель С) с повышенным ИМТ реализуется через его взаимосвязь с эмоциогенным пищевым поведением [21].
Необходимо отметить, что в доступной литературе нет работ, посвященных анализу пищевого поведения в зависимости от полиморфных вариантов rs17782313 гена MC4R у больных СД2, все исследования выполнены либо на здоровых добровольцах, либо же критерием исключения служило только наличие психических заболеваний.
Мы предположили, что локус rs17782313 гена MC4R ассоциирован с нарушениями пищевого поведения в группе пациентов с СД2. В нашем исследовании не было обнаружено взаимосвязи вариабельного участка rs17782313 гена MC4R с нарушениями пищевого поведения у лиц без диабета и у пациентов с СД2. Возможно, необходимо провести оценку пищевого поведения с использованием других методик либо увеличить число испытуемых лиц.
Заключение
В представленном исследовании показано, что маркером повышенного риска СД2 в этнической группе татар является генотип СС по полиморфному локусу rs17782313 гена рецептора меланокортина 4-го типа, что согласуется с данными работ, проведенных на популяциях европейцев и азиатов.
Выявлено, что для пациентов с СД2 характерны более высокие показатели по шкалам пищевого поведения по типу переедания, когда желание поесть стимулирует не реальное чувство голода, а внешний вид еды, ее запах, текстура, либо вид людей, принимающих пищу, либо оно является ответом на негативное эмоциональное состояние.
Несмотря на имеющиеся литературные данные о взаимосвязи полиморфного локуса rs17782313 гена MC4R с пищевым поведением, посредством чего реализуется риск развития ожирения, мы не выявили ассоциаций участка гена MC4R (rs17782313) с пищевым поведением у пациентов с СД2 и лиц контрольной группы.
Таким образом, можно заключить, что продукт гена MC4R вовлечен сразу в несколько звеньев патогенеза СД2, что реализуется в ассоциации его полиморфизмов с СД2.
Источник финансирования
Работа получила частичную финансовую поддержку Российского фонда фундаментальных исследований (№ 20-013-00261) и Министерства науки и высшего образования Российской Федерации НИР № АААА-А16-116020350031-4.
Funding
The study is partially supported by the Russian Foundation for Basic Research (research project No. 20-013-00261) and the Ministry of Science and Higher Education of Russian Federation (research project No. АААА-А16-116020350031-4).
Сведения об авторах:
Авзалетдинова Диана Шамилевна — к.м.н., доцент кафедры эндокринологии, ФГБОУ ВО БГМУ Минздрава России, 450008, Россия, г. Уфа, ул. Ленина, д. 3; ORCID iD 0000-0002-1590-6433.
Моругова Татьяна Вячеславовна — д.м.н., профессор, заведующая кафедрой эндокринологии, ФГБОУ ВО БГМУ Минздрава России, 450008, Россия, г. Уфа, ул. Ленина, д. 3; ORCID iD 0000-0001-7405-486X.
Шарипова Ляйсан Фаритовна — аспирант кафедры эндокринологии, ФГБОУ ВО БГМУ Минздрава России, 450008, Россия, г. Уфа, ул. Ленина, д. 3; ORCID iD 0000-0003-4866-0983.
Кочетова Ольга Владимировна — к.б.н., научный сотрудник, ИБГ УФИЦ РАН, 450054, Россия, г. Уфа, пр-т Октября, д. 71, лит. 1Е; ORCID iD 0000-0003-2071-0969.
Контактная информация: Авзалетдинова Диана Шамилевна, e-mail: hyppocrat@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 02.08.2020, поступила после рецензирования 16.08.2020, принята в печать 03.09.2020.
About the authors:
Diana Sh. Avzaletdinova — Cand. of Sci. (Med.), Associate Professor of the Department of Endocrinology, Bashkir State Medical University, 3, Lenin str., Ufa, 450000, Russian Federation; ORCID iD 0000-0002-1590-6433.
Tat’yana V. Morugova — Doct. of Sci. (Med.), Professor, Head of the Department of Endocrinology, Bashkir State Medical University, 3, Lenin str., Ufa, 450000, Russian Federation; ORCID iD 0000-0001-7405-486X.
Lya’san F. Sharipova — postgraduate student of the Department of Endocrinology, Bashkir State Medical University, 3, Lenin str., Ufa, 450000, Russian Federation; ORCID iD 0000-0003-4866-0983.
Olga V. Kochetova — Cand. of Sci. (Biol.), researcher, Institute of Biochemistry and Genetics of Ufa Scientific Center of the Russian Academy of Sciences, 71, Oktyabrya av., Ufa, 450054, Russian Federation; ORCID iD 0000-0003-2071-0969.
Contact information: Diana Sh. Avzaletdinova, e-mail: hyppocrat@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 02.08.2020, revised 16.08.2020, accepted 03.09.2020.
2. Michaud A., Vainik U., Garcia-Garcia I., Dagher A. Overlapping neural endophenotypes in addiction and obesity. Front Endocrinol (Lausanne). 2017;8:127. DOI: 10.3389/fendo.2017.00127.
3. Locke A.E., Kahali B., Berndt S.I. et al. Genetic studies of body mass index yield new insights for obesity biology. Nature. 2015;518:197–206. DOI: 10.1038/nature14177.
4. Li H., Kilpeläinen T.O., Liu C. et al. Association of genetic variation in FTO with risk of obesity and type 2 diabetes with data from 96,551 East and South Asians. Diabetologia. 2012;55:981–995. DOI: 10.1007/s00125-011-2370-7.
5. Thorleifsson G., Walters G.B., Gudbjartsson D.F. et al. Genome-wide association yields new sequence variants at seven loci that associate with measures of obesity. Nat Genet. 2009;41:18–24. DOI: 10.1038/ng.274.
6. Voight B.F., Scott L.J., Steinthorsdottir V. et al. Twelve type 2 diabetes susceptibility loci identified through large-scale association analysis. Nat Genet. 2010;42:579–589. DOI: 10.1038/ng.609.
7. Cho Y.S., Chen C.H., Hu C. et al. Meta-analysis of genome-wide association studies identifies eight new loci for type 2 diabetes in East Asians. Nat Genet. 2011;44:67–72. DOI: 10.1038/ng.1019.
8. Xi B., Takeuchi F., Chandak G.R. et al. Common polymorphism near the MC4R gene is associated with type 2 diabetes: data from a meta-analysis of 123,373 individuals. Diabetologia. 2012;55:2660–2666. DOI: 10.1007/s00125-012-2655-5.
9. Вахромеева К.А., Суплотова Л.А., Носиков В.В. Полиморфные генетические маркеры сахарного диабета 2-го типа в русской популяции. Проблемы эндокринологии. 2016;5:10–11. [Vahromeeva K.A., Suplotova L.A., Nosikov V.V. Polymorphic genetic markers of type 2 diabetes mellitus in the Russian population. Problemy endocrinologii. 2016;5:10–11 (in Russ.)]. DOI: 10.14341/probl201662510-11.
10. Ellacott K.L., Cone R.D. The role of the central melanocortin system in the regulation of food intake and energy homeostasis: lessons from mouse models. Philos Trans R Soc Lond B Biol Sci. 2006;361:1265–1274. DOI: 10.1098/rstb.2006.1861.
11. Van Strien T. Causes of emotional eating and matched treatment of obesity. Current diabetes reports. 2018;18(6):35. DOI: 10.1007/s11892-018-1000-x.
12. Kochetova O.V., Korytina G.F., Akhmadishina L.Z. et al. Association of polymorphic variants of FTO and MC4R genes with obesity in a Tatar population. Genetika. 2015;51:248–255.
13. Hong J., Shi J., Qi L. et al. Genetic susceptibility, birth weight and obesity risk in young Chinese. Int J Obes. 2013;37:673–677. DOI: 10.1038/ijo.2012.87.
14. Hong K.W., Oh B. Recapitulation of genome-wide association studies on body mass index in the Korean population. Int J Obes. 2012;36:1127–1130. DOI: 10.1038/ijo.2011.202.
15. Sull J.W., Lee M., Jee S.H. Replication of genetic effects of MC4R polymorphisms on body mass index in a Korean population. Endocrine. 2013;44(3):675–679. DOI: 10.1007/s12020-013-9909-y.
16. Xu Y., Jones J.E., Lauzon D.A. et al. A serotonin and melanocortin circuit mediates D-fenfluramine anorexia. J Neurosci. 2010;30:14630–14634. DOI: 10.1523/JNEUROSCI.5412-09.2010.
17. Rowland N.E., Fakhar K.J., Robertson K.L., Haskell-Luevano C. Effect of serotonergic anorectics on food intake and induction of Fos in brain of mice with disruption of melanocortin 3 and/or 4 receptors. Pharmacol Biochem Behav. 2010;97:107–111. DOI: 10.1016/j.pbb.2010.03.008.
18. Lim B.K., Huang K.W., Grueter B.A. et al. Anhedonia requires MC4R-mediated synaptic adaptations in nucleus accumbens. Nature. 2012;487:183–189. DOI: 10.1038/nature11160.
19. Srisai D., Gillum M.P., Panaro B.L. et al. Characterization of the hyperphagic response to dietary fat in the MC4R knockout mouse. Endocrinology. 2011;152:890–902. DOI: 10.1210/en.2010-0716.
20. Atalayer D., Robertson K.L., Haskell-Luevano C. et al. Food demand and meal size in mice with single or combined disruption of melanocortin type 3 and 4 receptors. Am J Physiol Regul Integr Comp Physiol. 2010;298: R1667–R1674. DOI: 10.1152/ajpregu.00562.2009.
21. Yilmaz Z., Davis C., Loxton N.J. et al. Association between MC4R rs17782313 polymorphism and overeating behaviours. Int J Obes (Lond). 2015;39(1):114–120. DOI: 10.1038/ijo.2014.79.
22. Valladares M., Dominguez-Vasquez P., Obregon A.M. et al. Melanocortin-4 receptor gene variants in Chilean families: association with childhood obesity and eating behavior. Nutr Neurosci. 2010;13:71–78. DOI: 10.1179/147683010X12611460763643.
23. Ho-Urriola J., Guzman-Guzman I.P., Smalley S.V. et al. Melanocortin-4 receptor polymorphism rs17782313: Association with obesity and eating in the absence of hunger in Chilean children. Nutrition. 2014;30:145–149. DOI: 10.1016/j.nut.2013.05.030.
24. Navarro M., Lerma-Cabrera J.M., Carvajal F. et al. Assessment of voluntary ethanol consumption and the effects of a melanocortin (MC) receptor agonist on ethanol intake in mutant C57BL/6J mice lacking the MC-4 receptor. Alcohol Clin Exp Res. 2011;35:1058–1066. DOI: 10.1111/j.1530-0277.2011.01438.x.
25. Horstmann A., Kovacs P., Kabisch S. et al. Common genetic variation near MC4R has a sex-specific impact on human brain structure and eating behavior. PLoS One. 2013;8: e74362. DOI: 10.1371/journal.pone.0074362.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.

