Оценка эффективности применения отечественных биосимиляров инсулина для лечения сахарного диабета 1 типа у подростков
DOI: 10.32364/2618-8430-2022-5-2-164-168
Цель исследования: изучить возможное влияние смены терапии оригинальными препаратами инсулина лизпро и гларгин на терапию с использованием отечественных биосимиляров на показатели гликемического контроля у подростков с сахарным диабетом 1 типа (СД1).
Материал и методы: проведено 24-недельное обсервационное клиническое исследование. Обследовано 24 подростка с СД1 в возрасте от 12 до 15 лет (средний возраст 13,4±1,1 года) — 13 мальчиков (54,2%, средний возраст 13,1±1,1 года) и 11 девочек (45,8%, средний возраст 13,0±0,9 года). Длительность заболевания составляла 4,0±1,1 года у мальчиков и 4,3±1,8 года у девочек. Инсулинотерапия проводилась оригинальными препаратами инсулина лизпро и гларгин в режиме многократных ежедневных инъекций. Перевод на инсулинотерапию отечественными биосимилярами осуществлялся в соотношении 1:1, корректировали дозу пациенты самостоятельно. Контроль показателей гликемии осуществлялся системой флэш-мониторирования гликемии. Оценивалось время в целевом диапазоне (TIR), время выше целевого диапазона (TAR), время ниже целевого диапазона (TBR) и уровень гликированного гемоглобина (HbA1c) на фоне терапии оригинальными препаратами инсулина и через 3 и 6 мес. после перевода на терапию отечественными биосимилярами.
Результаты исследования: через 3 и 6 мес. после перевода подростков с СД1 на терапию отечественными биосимилярами инсулина были получены данные, указывающие на отсутствие клинически значимого ухудшения показателей гликемического контроля: уровень HbA1c через 3 мес. — 7,6±1,1%, через 6 мес. — 7,5±0,9% (p>0,05); TIR через 3 мес. — 65,1±10,6%, через 6 мес. — 66,5±10,7% (р>0,05); TAR через 3 мес. — 26,8±10,9%, через 6 мес. — 25,5±11,1% (p>0,05); TBR через 3 мес. — 8,1±4,3%, через 6 мес. — 7,9±4,5% (p>0,05). Статистически достоверных различий в исследуемых показателях между мальчиками и девочками через 3 и 6 мес. после смены инсулинотерапии не отмечалось. Суточная доза инсулина за период наблюдения достоверно не изменилась: через 3 мес. она составила 1,4±0,3 ед/кг, через 6 мес. — 1,3±0,3 ед/кг.
Заключение: применение отечественных биосимиляров инсулина лизпро и гларгин для лечения подростков с СД1 не сопровождается увеличением суточной дозы инсулина и ухудшением таких показателей гликемического контроля, как уровень HbA1c, TIR, TAR, TBR.
Ключевые слова: сахарный диабет 1 типа, инсулин, биосимиляры, лизпро, гларгин, гликированный гемоглобин, гликемический контроль, время в целевом диапазоне.
Для цитирования: Платонов В.В., Дубинина Т.А., Патракеева Е.М., Резвых А.М., Казаченко Н.В. Оценка эффективности применения отечественных биосимиляров инсулина для лечения сахарного диабета 1 типа у подростков. РМЖ. Медицинское обозрение. 2022;5(2):164-168. DOI: 10.32364/2618-8430-2022-5-2-164-168.
V.V. Platonov1,2, T.A. Dubinina1, E.M. Patrakeeva3, A.M. Rezvykh2, N.V. Kazachenko1
1K.A. Raukhfus Children’s City Multidisciplinary Clinical Center of High Medical Technologies,
St. Peterburg, Russian Federation
2St. Petersburg State Pediatric Medical University, St. Petersburg, Russian Federation
3Dr. Fomin’s Clinics in St. Petersburg, St. Petersburg, Russian Federation
Aim: to assess the potential effect of switching from original insulins (lispro and glargine) to Russian biosimilars on glycemic control in adolescents with type 1 diabetes (T1D).
Patients and Methods: this 24-week observational clinical trial enrolled 24 adolescents with T1D aged 12–15 (mean age 13.4±1.1 years), 13 boys (54.2%, mean age 13.1±1.1 years) and 11 girls (45.8%, mean age 13.0±0.9 years). Disease duration was 4.0±1.1 years in boys and 4.3±1.8 years in girls. Insulin therapy included original multiple daily injections (MDI) of insulins lispro and glargine. Patients were switched to biosimilars at a ratio of 1:1, doses were adjusted by the patients themselves. Blood sugar levels were measured by flash glucose monitoring (FGM). Time in the target range (TIR), time above the target range (TAR), time below the target range (TBR), and glycated hemoglobin (HbA1c) in the original insulin therapy and 3 and 6 months after switching to Russian biosimilars were evaluated.
Results: three and six months after switching of T1D adolescents to Russian biosimilars, no clinically significant worsening of glycemic control parameters was reported, i.e., HbA1c (3 months) 7.6±1.1%, HbA1c (6 months) 7.5±0.9% (p>0.05), TIR (3 months) 65.1±10.6%, TIR (6 months) 66.5±10.7% (р>0.05), TAR (3 months) 26.8±10.9%, TAR (6 months) 25.5±11.1% (p>0.05), TBR (3 months) 8.1±4.3%, TBR (6 months) 7.9±4.5% (p>0,05). No significant differences in the parameters studied between boys and girls 3 and 6 months after therapy switching were reported. No significant changes in the total daily Insulin dose (TDI) were reported, i.e., TDI (3 months) 1.4±0.3 U/kg, TDI (6 months) 1.3±0.3 U/kg.
Conclusion: Russian biosimilars of insulins lispro and glargine for T1D in adolescents are not associated with either an increase in TDI or worsening of glycemic control parameters, e.g., HbA1c, TIR, TAR, and TBR.
Keywords: type 1 diabetes, insulin, biosimilars, lispro, glargine, glycated hemoglobin, glycemic control, time in the range.
For citation: Platonov V.V., Dubinina T.A., Patrakeeva E.M. et al. Efficacy of Russian insulin biosimilars for type 1 diabetes in adolescents. Russian Journal of Woman and Child Health. 2022;5(2):164–168 (in Russ.). DOI: 10.32364/2618-8430-2022-5-2-164-168.
Введение
Сахарный диабет 1 типа (СД1) — это тяжелое хроническое аутоиммунное заболевание, требующее постоянной инсулинотерапии для поддержания показателей гликемического контроля в диапазонах, снижающих риски развития и прогрессирования специфических осложнений [1]. Прогресс в области медицинских технологий в значительной мере изменил прогноз течения многих тяжелых заболеваний. Так, в свое время открытие инсулина Ф. Бантингом и Ч. Бестом полностью перевернуло существовавшие представления и подходы к лечению сахарного диабета. Однако полный химический синтез человеческого инсулина был осуществлен только в 1974 г., а первые генно-инженерные человеческие инсулины получили одобрение на клиническое использование в 1982 г. [2]. Современные инсулины относятся к классу лекарственных средств, производимых с помощью биотехнологий.
Истечение срока патентной защиты оригинального биопрепарата открывает возможность для создания его версии, или биосимиляра (англ.: biological drug — биологический препарат и similar — похожий). Стремительное появление биосимиляров инсулина вызывает значительный научный и клинический интерес отчасти потому, что в отличие от типичного низкомолекулярного продукта инсулин имеет четко определенные первичную, вторичную и третичную структуры, которые оказывают решающее влияние на его биологическое действие [3]. Вариации в процессе производства могут оказывать заметное влияние как на безопасность, так и на эффективность инсулина [4, 5], и различия в его составе могут привести к изменениям фармакокинетики и фармакодинамики [6].
Биосимиляр инсулина является биоэквивалентным, если доказана сопоставимость с референтным инсулином на всех этапах доклинических и клинических исследований. Клинические исследования биосимиляров у детей не проводятся ни в Российской Федерации, ни в странах с высоким уровнем регулирования. Такой подход к исследованиям биосимиляров инсулина закреплен в международных руководствах Европейского медицинского агентства (EMEA, Европейский союз) [7] и Комиссии по контролю за качеством пищевых и лекарственных средств (FDA, США) [8]. Российское законодательство полностью синхронизировано с европейскими стандартами в отношении подходов к оценке биоэквивалентности биоподобных препаратов [9].
Под биоэквивалентностью лекарственного препарата понимается достижение сопоставимых показателей скорости всасывания, степени поступления к месту действия и скорости выведения одного или нескольких обладающих фармакологической активностью действующих веществ при использовании лекарственного препарата для медицинского применения, имеющих одно международное непатентованное (или химическое, или группировочное) наименование, в эквивалентных дозировках и при одинаковом способе введения [3]. Однако нужно учитывать и тот факт, что клинические эффекты, индуцированные одной и той же дозой одного и того же инсулина, имеют различия не только у разных людей (межиндивидуальная вариабельность действия), но и у одного человека (интраиндивидуальная вариабельность действия). Эти различия могут быть связаны со скоростью абсорбции, метаболизма (фармакокинетический аспект вариабельности) и действия инсулина (фармакодинамический аспект).
Высокая вариабельность кинетики и действия инсулина может затруднять подбор доз и повышать риски развития гипогликемий [10]. Поэтому при сравнении биосимиляра с оригинальным инсулином EMA требует приводить результаты эугликемического гиперинсулинемического клэмпа [7].
В течение последних лет в некоторых регионах Российской Федерации происходит замена оригинальных препаратов инсулина на биосимиляры, что сопровождается возрастающим числом родительских страхов и тревог, касающихся эффективности и безопасности такой смены инсулинотерапии.
Успешное внедрение биосимиляров зачастую зависит от согласия пациента. Исследования [11–13] показывают, что некоторые пациенты негативно относятся к биоаналогам и не желают отказываться от оригинальных препаратов. Негативное восприятие основано на убеждении, что биоаналоги не соответствуют стандартам качества, безопасности и эффективности [11, 13]. Пациенты также сообщают об опасениях по поводу перехода на биосимиляр без предварительного обсуждения с лечащим врачом [12] и считают, что более низкая стоимость связана с более низким качеством [11]. Негативное восприятие способно вызывать реакцию ноцебо и усиливать преднамеренное несоблюдение режима лечения, что в итоге приводит к напрасной трате ресурсов здравоохранения [14]. В другом, уже маркетинговом исследовании [15] среди пациентов с сахарным диабетом 1 и 2 типа примерно 66% респондентов сообщили, что они согласны перейти на гипотетический менее дорогой биоаналог инсулина, рекомендованный их лечащим врачом, если он будет таким же безопасным и эффективным, как и оригинальный препарат.
Исследований, описывающих применение биосимиляров инсулина у детей, в настоящее время критически мало не только в отечественных, но и в зарубежных источниках, поэтому описание реального клинического опыта является остроактуальным.
Цель исследования: изучить возможное влияние смены терапии оригинальными препаратами инсулина на терапию с использованием отечественных биосимиляров аналога инсулина гларгин (баиГ) и лизпро (баиЛ) на показатели гликемического контроля у подростков с СД1.
Материал и методы
Проведено 24-недельное обсервационное клиническое исследование на базе Городского детского эндокринологического центра Санкт-Петербурга. В исследование были включены подростки с СД1, получающие инсулинотерапию в режиме многократных ежедневных инъекций (МЕИ), со стажем заболевания более 1 года, использующие для контроля гликемии систему флэш-мониторирования гликемии (ФМГ). Критерии исключения: нарушения функции печени, почек, надпочечниковая недостаточность, целиакия, нарушение функции щитовидной железы, наличие анемии, эпизода диабетического кетоацидоза или тяжелой гипогликемии в течение последнего года. Обследовано 24 подростка с СД1 в возрасте от 12 до 15 лет (средний возраст 13,4±1,1 года) — 13 мальчиков (54,2%, средний возраст 13,1±1,1 года) и 11 девочек (45,8%, средний возраст 13,0±0,9 года). Длительность заболевания составляла 4,0±1,1 года у мальчиков и 4,3±1,8 года у девочек. Инсулинотерапия проводилась оригинальными препаратами инсулина баиЛ и баиГ в режиме МЕИ. Перевод на инсулинотерапию биосимилярами осуществлялся в соотношении 1:1, корректировали дозу пациенты самостоятельно. Контроль показателей гликемии осуществлялся системой ФМГ. Оценивалось время в целевом диапазоне (TIR) 3,9–10,0 ммоль/л, время выше целевого диапазона (TAR) >10,0 ммоль/л, время ниже целевого диапазона (TBR) <3,9 ммоль/л и уровень гликированного гемоглобина (HbA1c) на фоне терапии оригинальными препаратами инсулина и через 3 и 6 мес. после перевода на терапию отечественными биосимилярами инсулина баиЛ (РинЛиз®) и баиГ (РинГлар®).
Уровень HbA1c оценивался иммунохимическим методом. Параметры TIR, TAR и TBR рассчитывались автоматически и оценивались согласно Международному консенсусу по использованию систем непрерывного мониторирования гликемии и времени в целевом диапазоне по отчетам стандартного амбулаторного профиля глюкозы [16].
Дополнительного структурированного обучения в специализированных школах диабета не проводилось.
Статистический анализ проводился с использованием программы StatTech v. 2.6.5. Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро — Уилка (при числе исследуемых менее 50) или критерия Колмогорова — Смирнова (при числе исследуемых более 50). Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD). Категориальные данные описывались с указанием абсолютных значений и процентных долей. Сравнение двух групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий выполнялось с помощью t-критерия Стьюдента.
Результаты исследования
По результатам отчетов системы ФМГ подростки c СД1 имели следующие исходные показатели гликемического контроля: TIR 64,7±11,1%, TAR 26,3±12,2%, TBR 8,9±4,8%, HbA1c 7,7±1,1%. Гендерных различий в исследуемых показателях не отмечалось: уровень HbA1c у мальчиков — 7,78±1,39%, у девочек — 7,70±0,76% (p>0,05); TIR у мальчиков — 65,8±13,1%, у девочек — 63,5±8,6% (р>0,05); TAR у мальчиков — 24,8±13,8%, у девочек — 28,0±10,3% (p>0,05); TBR у мальчиков — 9,3±5,4%, у девочек — 8,4±4,2% (p>0,05). Суточная доза инсулина (СДИ) составила у мальчиков 1,2±0,4 ед/кг, у девочек 1,4±0,3 ед/кг (р>0,05).
Через 3 и 6 мес. после перевода на терапию с использованием отечественных биосимиляров баиЛ и баиГ у детей не отмечалось статистически значимых различий в исследуемых показателях гликемического контроля (табл. 1). СДИ значимо не изменилась. Гендерных различий в исследуемых показателях также не отмечено.
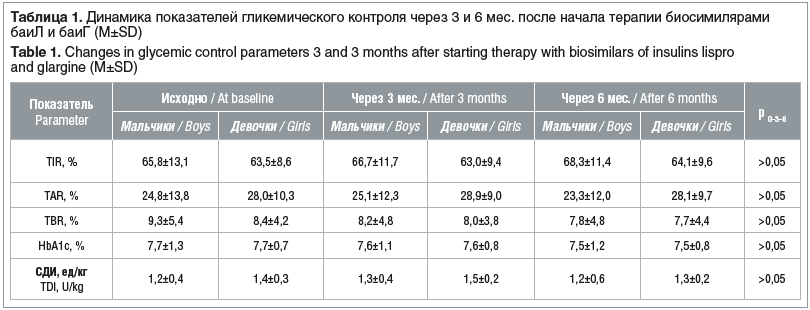
За период наблюдения количество пациентов, достигающих оптимальных показателей гликемического контроля (уровень HbA1c <7,0%, TIR>70%), оставалось без достоверных изменений (табл. 2).
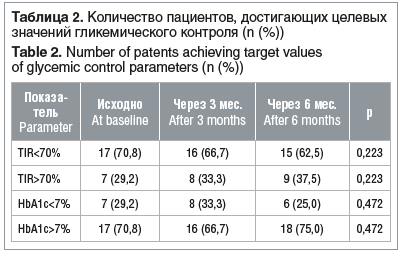
Полученные данные указывают на отсутствие клинически значимого ухудшения показателей гликемического контроля после перевода подростков с СД1 на терапию отечественными биосимилярами баиЛ и баиГ.
Обсуждение
Существует четкое различие между биоподобностью и взаимозаменяемостью — подтверждение биоподобности не означает полной взаимозаменяемости. Биоподобный продукт может иметь такую же эффективность, переносимость и безопасность, что и оригинальный препарат, но для перехода терапии с одного препарата на другой может потребоваться участие врача. Клиницисты, назначающие инсулин, обычно избегают перевода пациентов с одной формы инсулина на другую без веской причины, так как смена инсулинов, как правило, сопровождается необходимостью коррекции дозы базального и прандиального инсулинов, что в ряде случаев приводит к увеличению частоты эпизодов гипогликемии [17].
У некоторых пациентов с СД1 часто развивается психологическая зависимость от конкретного типа инсулина, обусловленная страхом возможной нестабильности уровня глюкозы при смене препарата инсулина [18]. Часть из них убеждена, что смена режима терапии может привести к заметному ухудшению контроля уровня глюкозы, что сопровождается ухудшением качества жизни и увеличением потребности в медицинской помощи в долгосрочной перспективе [19].
Таким образом, пациенты обычно не желают переходить на другую форму инсулина без веской причины. Обозначение взаимозаменяемости (гарантия того, что действие инсулина идентично, а не просто похоже на действие исходного инсулина) делает взгляд на такие изменения более позитивным.
Результатом нашего исследования стали сопоставимые с исходным уровни HbA1c через 3 и 6 мес. после начала терапии биосимилярами. Схожие результаты получены в исследовании T.C. Blevins et al. [20], в котором была продемонстрирована одинаковая эффективность на фоне применения оригинального гларгина и при переводе пациентов на биоаналог (биосимиляр) LY IGlar (24 нед. наблюдения) по показателям HbA1c.
Проведенные исследования [21–23] подтвердили, что не отмечалось статистически значимых различий в частоте гипогликемий между группой пациентов, получавших биоаналог (биосимиляр) гларгина MYL-1501D, и контрольной группой, находящейся на терапии оригинальным гларгином. C. Kapitza et al. [21] продемонстрировали, что участники, несколько раз переключавшиеся между эталонным гларгином и его биоаналогом (биосимиляром) MYL-1501D, достигали аналогичного контроля уровня глюкозы с аналогичным профилем безопасности.
В исследовании SORELLA 1 [22] показана не меньшая эффективность биосимиляра лизпро SAR342434 (SA-Lis) в снижении уровня HbA1c по сравнению с оригинальным препаратом. Кроме того, было проведено исследование [23] по безопасности и совместимости SAR342434 (SA-Lis) у взрослых, получающих инсулинотерапию методом постоянной подкожной инфузии. По его результатам в 2017 г. Комитет EMA по медицинским продуктам для человека вынес положительное заключение и разрешил продажу SA-Lis в Европе.
Все эти исследования продемонстрировали одинаковую эффективность и безопасность терапии при переходе с оригинального инсулина на биоаналог (биосимиляр).
Поскольку показатели HbA1c не отражают краткосрочных колебаний гликемии, данные непрерывного мониторирования гликемии и ФМГ в дополнение к показателям HbA1c могут предоставить более полную картину гликемии и ее вариабельности при попытках понять гликемические паттерны и в итоге оптимизировать контроль. Поэтому одной из целей нашего исследования была оценка влияния терапии биосимилярами баиЛ и баиГ на показатели TIR, TAR и TBR, величина которых коррелирует с уровнем HbA1c [24]. Полученные результаты продемонстрировали достижение не худших показателей TIR, TAR и TBR при использовании биосимиляров баиЛ и баиГ по сравнению с терапией оригинальными препаратами.
Заключение
Несмотря на бурный прогресс в области диабетологических технологий, достижение оптимальных показателей гликемического контроля остается серьезным вызовом не только для пациентов с СД1 и их семей, но и для специалистов здравоохранения [25]. Известно, что наиболее уязвимым с точки зрения компенсации нарушений углеводного обмена является подростковый возраст — возраст когнитивного, психосоциального и физического созревания, с началом которого гликемический контроль часто значимо ухудшается, несмотря на сопутствующее увеличение доз инсулина [26]. Поэтому любые изменения инсулинотерапии, будь то смена метода введения (режим МЕИ или постоянная подкожная инфузия) или замена препарата, должны быть максимально деликатными и щадящими.
Полученные нами данные указывают на отсутствие клинически значимого ухудшения показателей гликемического контроля после перевода подростков с СД1 на терапию отечественными биосимилярами баиЛ и баиГ, что предполагает возможность их безопасного и эффективного применения у данной категории пациентов.
Сведения об авторах:
Платонов Вадим Валерьевич — к.м.н., врач — детский эндокринолог Городского детского эндокринологического центра СПб ГБУЗ ДГМКЦ ВМТ им. К.А. Раухфуса; 191036, Россия, г. Санкт-Петербург, Лиговский пр-т, д. 8; ассистент кафедры детских болезней им. И.М. Воронцова ФПВ и ДПО ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0003-0923-6223.
Дубинина Татьяна Александровна — главный внештатный детский эндокринолог г. Санкт-Петербурга, заведующая Городским детским эндокринологическим центром СПб ГБУЗ ДГМКЦ ВМТ им. К.А. Раухфуса; 191036, Россия, г. Санкт-Петербург, Лиговский пр-т, д. 8.
Патракеева Евгения Михайловна — главный врач ООО КДФ-СПб (Клиника Доктора Фомина Санкт-Петербург); 191014, Россия, г. Санкт-Петербург, пер. Басков, д. 2, стр. 1; ORCID iD 0000-0003-0903-6395.
Резвых Анастасия Михайловна — врач-педиатр, клинический ординатор ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2.
Казаченко Наталья Васильевна — к.м.н., врач — детский эндокринолог Городского детского эндокринологического центра СПб ГБУЗ ДГМКЦ ВМТ им. К.А. Раухфуса; 191036, Россия, г. Санкт-Петербург, Лиговский пр-т, д. 8; ORCID iD 0000-0002-1079-6378.
Контактная информация: Платонов Вадим Валерьевич, e-mail: v_platonov@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 06.02.2022.
Поступила после рецензирования 02.03.2022.
Принята в печать 29.03.2022.
About the authors:
Vadim V. Platonov — C. Sc. (Med.), pediatric endocrinologist, City Children Endocrinological Center of the K.A. Raukhfus Children’s City Multidisciplinary Clinical Center of High Medical Technologies; 8, Ligovskiy av., St. Peterburg, 191036, Russian Federation; assistant of the I.M. Vorontsov Department of Children’s Diseases of the Faculty of Post-Institute and Additional Professional Education, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Peterburg, 194100, Russian Federation; ORCID iD 0000-0003-0923-6223.
Tatyana A. Dubinina — Chief Visiting Pediatric Endocrinologist of St. Petersburg, Head of the City Children Endocrinological Center of the K.A. Raukhfus Children’s City Multidisciplinary Clinical Center of High Medical Technologies; 8, Ligovskiy av., St. Peterburg, 191036, Russian Federation.
Evgeniya M. Patrakeeva — Head Doctor, Dr. Fomin’s Clinics in St. Petersburg; 2 build. 1, Baskov lane, St. Petersburg, 191014, Russian Federation; ORCID iD 0000-0003-0903-6395.
Anastasiya M. Rezvykh — pediatrician, clinical resident, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194100, Russian Federation.
Natalya V. Kazachenko — C. Sc. (Med.), pediatric endocrinologist, City Children Endocrinological Center of the K.A. Raukhfus Children’s City Multidisciplinary Clinical Center of High Medical Technologies; 8, Ligovskiy av., St. Peterburg, 191036, Russian Federation; ORCID iD 0000-0002-1079-6378.
Contact information: Vadim V. Platonov, e-mail: v_platonov@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 06.02.2022.
Revised 02.03.2022.
Accepted 29.03.2022.
2. Hilgenfeld R., Seipke G., Berchtold H., Owens D.R. The evolution of insulin glargine and its continuing contribution to diabetes care. Drugs. 2014;74(8):911–927. DOI: 10.1007/s40265-014-0226-4.
3. Gough S. Biosimilar insulins: opportunities and challenges. Practical Diabetes. 2013;30(4):146–147a. DOI: 10.1002/pdi.1763.
4. DeVries J.H., Gough S.C., Kiljanski J., Heinemann L. Biosimilar insulins: a European perspective. Diabetes Obes Metab. 2015;17(5):445–451. DOI: 10.1111/dom.12410.
5. June J., Pollom R.K., Hadjiyianni I. et al. Biosimilar insulins: What do you need to know? Intern Diabetes Nursing. 2017;14:1:32–35. DOI: 10.1080/20573316.2017.1340246.
6. Blandizzi C.M., Lapadula G. Comparing Originator Biologics and Biosimilars: A Review of the Relevant Issues. Clinical therapeutics. 2017;39(5):1026–1039. DOI: 10.1016/j.clinthera.2017.03.014.
7. Guideline on non-clinical and clinical development of similar biological medicinal products containing recombinant human insulin and insulin analogues 26 February 2015 EMEA/CHMP/BMWP/32775/2005_Rev. 1 Committee for Medicinal products for Human Use. (Electronic resource.) URL: https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-non-clinical-clinical-development-similar-biological-medicinal-products-containing_en-0.pdf (access date: 15.01.2022).
8. Carter A.W. FDA-approved biosimilar insulin: good enough for critical care, adulterated, or counterfeit? How can we tell? J Diabetes Sci Technol. 2014;8(5):1052–1054. DOI: 10.1177/1932296814539275.
9. Дедов И.И., Шестакова М.В., Петеркова В.А. и др. Проект рекомендаций Российской ассоциации эндокринологов по применению биосимиляров инсулина. Сахарный диабет. 2021;24(1):76–79. [Dedov I.I., Shestakova M.V., Peterkova V.A. et al. Russian association of endocrinologist draft recommendation on insulin biosimilars using. Diabetes mellitus. 2021;24(1):76–79 (in Russ.)].
10. Kovatchev B. Glycemic Variability: Risk Factors, Assessment, and Control. J Diabetes Sci Technol. 2019;13(4):627–635. DOI: 10.1177/1932296819826111.
11. Wilkins A.R., Venkat M.V., Brown A.S. et al. Patient perspectives on biosimilar insulin. J Diabetes Sci Technol. 2014;8:23–25. DOI: 10.1177/19322 96813515132.
12. Attara G., Bressler B., Bailey R. et al. Canadian patient and caregiver perspectives on subsequent entry biologics/biosimilars for infammatory bowel disease. Gastroenterol. 2016;150:443–444. DOI: 10.1016/ s0016-5085(16)31540-2.
13. Ighani A., Wang J.Y., Manolson M.F. An evaluation of psoriasis patient perceptions and understanding of biosimilars: A Canadian survey comparing biologic and nonbiologic users. J Cutan Med Surg. 2018;22:365–367. DOI: 10.1177/1203475417746337.
14. Rezk M.F., Pieper B. Treatment outcomes with biosimilars: Be aware of the nocebo efect. Rheumatol Ther. 2017;4:209–218. DOI: 10.1007/s40744-017-0085-z.
15. Heinemann L. Biosimilar insulins. Expert Opin Biol Ther. 2012;12(8):1009–1016. DOI: 10.1517/14712598.2012.688024.
16. Battelino T., Danne T., Bergenstal R.M. et al. Clinical Targets for Continuous Glucose Monitoring Data Interpretation: Recommendations From the International Consensus on Time in Range. Diabetes Care. 2019;42(8):1593–1603. DOI: 10.2337/dci19-0028.
17. Rodriguez-Stanley J., Zilioli S., Idalski Carcone A. et al. Naturalistically observed interpersonal problems and diabetes management in older adolescents and young adults with type 1 diabetes. Psychol Health. 2021;4:1–16. DOI: 10.1080/08870446.2021.1960345.
18. Ohno Y., Seki T., Kojima Y. et al. Investigation of factors that cause insulin precipitation and/or amyloid formation in insulin formulations. J Pharm Health Care Sci. 2019;5:22. DOI: 10.1186/s40780-019-0151-5.
19. Blevins T.C., Dahl D., Rosenstock J. et al. Efficacy and safety of LY2963016 insulin glargine compared with insulin glargine (Lantus®) in patients with type 1 diabetes in a randomized controlled trial: the ELEMENT 1 study. Diabetes Obes Metab. 2015;17(8):726–733. DOI: 10.1111/dom.12496.
20. Blevins T.C., Barve A., Raiter Y. et al. Efficacy and safety of MYL-1501D versus insulin glargine in people with type 1 diabetes mellitus: Results of the INSTRIDE 3 phase 3 switch study. Diabetes Obes Metab. 2020;22(3):365–372. DOI: 10.1111/dom.13904.
21. Kapitza C., Nowotny I., Lehmann A. et al. Similar pharmacokinetics and pharmacodynamics of rapid-acting insulin lispro products SAR342434 and US- and EU-approved Humalog in subjects with type 1 diabetes. Diabetes Obes Metab. 2017;19(5):622–627. DOI: 10.1111/dom.12856.
22. Garg S.K., Wernicke-Panten K., Rojeski M. et al. Efficacy and Safety of Biosimilar SAR342434 Insulin Lispro in Adults with Type 1 Diabetes Also Using Insulin Glargine-SORELLA 1 Study. Diabetes Technol Ther. 2017;19(9):516–526. DOI: 10.1089/dia.2017.0117.
23. Phelan H., King B., Anderson D. et al. Young children with type 1 diabetes can achieve glycemic targets without hypoglycemia: Results of a novel intensive diabetes management program. Pediatr Diabetes. 2018;19(4):769–775. DOI: 10.1111/pedi.12644.
24. Beck R.W., Bergenstal R.M., Riddlesworth T.D. et al. Validation of Time in Range as an Outcome Measure for Diabetes Clinical Trials. Diabetes Care. 2019;42(3):400–405. DOI: 10.2337/dc18-1444.
25. Kuritzky L., Reid T.S., Wysham C.H. Practical Guidance on Effective Basal Insulin Titration for Primary Care Providers. Clin Diabetes. 2019;37(4):368–376. DOI: 10.2337/cd18-0091.
26. Vanelli M., Chiarelli F., Chiari G., Tumini S. Relationship between metabolic control and quality of life in adolescents with type 1 diabetes. Report from two Italian centres for the management of diabetes in childhood. Acta Biomed. 2003;74(Suppl 1):13–17. PMID: 12817795.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
