Новый мощный подход в лечении больных сахарным диабетом 2 типа
DOI: 10.32364/2587-6821-2021-5-9-592-597
Заболеваемость сахарным диабетом 2 типа (СД2) очень высока и продолжает угрожающе расти, являясь ведущей причиной смертности населения. Медицинская и социальная значимость СД2 определяется прежде всего его тяжелыми сосудистыми и неврологическими осложнениями, которые приводят к ранней инвалидизации и высокой смертности, сокращению продолжительности жизни и ухудшению ее качества. СД2 характеризуется прогрессирующим нарушением функции β-клеток поджелудочной железы на фоне развития инсулинорезистентности. В статье рассмотрены механизмы действия сахароснижающих препаратов из группы агонистов рецептора, активируемого пролифератором пероксисом (PPARγ), — пиоглитазона и группы ингибиторов дипептидилпептидазы-4 — алоглиптина. Пиоглитазон повышает чувствительность к инсулину через увеличение экспрессии многочисленных генов, кодирующих протеины или белки, которые модулируют метаболизм глюкозы и жиров. Алоглиптин повышает глюкозозависимую активность β-клеток с низким риском гипогликемии, подавляет повышенную секрецию глюкагона, обладает кардиоваскулярной безопасностью. Обоснована целесообразность использования фиксированной комбинации пиоглитазона и алоглиптина, что позволяет эффективно и безопасно управлять СД2, одномоментно влияя на 10 из 11 патофизиологических поломок, обусловивших развитие заболевания.
Ключевые слова: сахарный диабет 2 типа, инсулинорезистентность, β-клетки, ингибитор дипептидилпептидазы-4, тиахолидиндион, глиптин.
Для цитирования: Мкртумян А.М., Свиридова М.И. Новый мощный подход в лечении больных сахарным диабетом 2 типа. РМЖ. Медицинское обозрение. 2021;5(9):592-597. DOI: 10.32364/2587-6821-2021-5-9-592-597.
A.M. Mkrtumyan1, M.I. Sviridova2
1A.S. Loginov Moscow Clinical Research Center, Moscow, Russian Federation
2N.E. Bauman City Clinical Hospital No. 29, Moscow, Russian Federation
The prevalence of type 2 diabetes (T2D) is very high and grows dangerously, being the most common cause of death. Severe vascular and neurological complications, which result in early disability and high mortality, and reduction in life expectancy and the quality of life, account for the medical and social relevance of T2D. T2D is characterized by progressive dysfunction of pancreatic β-cells in the development of insulin resistance. This paper addresses the mechanisms of action of glucose-lowering medications, i.e., pioglitazone belonging to a group of peroxisome proliferator-activated receptor (PPARγ) agonists, and alogliptin belonging to a group of dipeptidyl peptidase 4 (DPP-4) inhibitors. Pioglitazone increases insulin sensitivity via enhancing the expression of numerous genes encoding proteins that modulate glucose and lipid metabolism. Alogliptin improves the glucose-dependent activity of β-cells and inhibits the increased secretion of glucagon. Alogliptin is characterized by low risks of hypoglycemia and cardiovascular safety. Pioglitazone-alogliptin fixed-dose combination is helpful to control T2D effectively and safely since this combination affects 10 out of 11 pathophysiological defects resulting in T2D.
Keywords: type 2 diabetes, insulin resistance, β-cells, dipeptidyl peptidase 4 inhibitor, thiazolidinediones, gliptin.
For citation: Mkrtumyan A.M., Sviridova M.I. New powerful treatment approach to type 2 diabetes. Russian Medical Inquiry. 2021;5(9):592–597 (in Russ.). DOI: 10.32364/2587-6821-2021-5-9-592-597.
Введение
Сахарный диабет 2 типа (СД2) — одно из самых распространенных заболеваний во всем мире. Несмотря на большое количество имеющихся сахароснижающих препаратов, число пациентов, достигших целевого уровня гликированного гемоглобина (HbA1c), невелико. По данным Российского регистра пациентов с СД2, уровень HbA1c <7% имеют 52,2% пациентов, а в некоторых регионах — 25,2% [1].
Прогрессирующий характер заболевания связан со сложным патогенезом диабета, при котором развитию осложнений способствует не только гипергликемия, но и другие метаболические нарушения. Кроме основных звеньев патогенеза — инсулинорезистентности (ИР) и недостаточности функции β-клеток определены и другие патофизиологические механизмы:
сниженный инкретиновый эффект — нарушение секреции глюкагоноподобного пептида (ГПП-1), резистентность β-клеток к стимулирующему действию ГПП-1;
увеличение в плазме крови свободных жирных кислот, накопление в β-клетках, гепатоцитах и миоцитах токсичных липидных метаболитов из-за резистентности адипоцитов к антилиполитическому действию инсулина;
повышенная секреция глюкагона α-клетками поджелудочной железы и повышенная чувствительность печеночных клеток к глюкагону;
усиление реабсорбции глюкозы почками;
повышение аппетита, увеличение веса, усугубление резистентности к инсулину в мышцах и печени [2].
Ключевым звеном патогенеза СД2 служит ИР, которая со временем приводит к нарастающему снижению функции β-клеток поджелудочной железы. На оба нарушения можно воздействовать посредством сенсибилизации гепатоцитов, миоцитов и адипоцитов к инсулину, а также корректируя недостаточность инкретинов — ГПП-1 и глюкозозависимого инсулинотропного полипептида (ГИП) [3]. Применяемые сахароснижающие препараты определенных классов не могут влиять сразу на все патофизиологические нарушения, имеющиеся при СД2, поэтому для оптимального гликемического контроля необходимо сочетание препаратов различных групп, в частности глитазонов с ингибитором дипептидилпептидазы-4 (иДПП-4). Кроме того, поскольку препараты различных групп снижают уровень глюкозы в плазме посредством различных механизмов, то подобная комбинированная терапия будет иметь суммарный эффект в снижении HbA1c по сравнению с каждым отдельно взятым препаратом [4].
Пиоглитазон
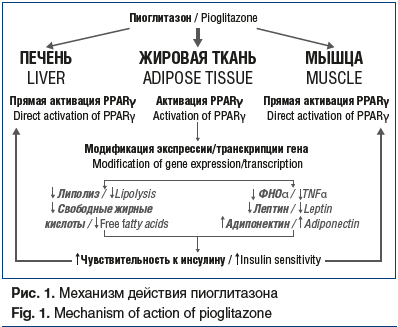
В настоящее время пиоглитазон — единственный представитель группы сахароснижающих препаратов — тиазолидиндионов (глитазонов). Эти препараты являются агонистами ядерных γ-рецепторов, активируемых пролифератором пероксисом (PPARγ), который экспрессируется преимущественно в жировой ткани и вызывает транскрипцию генов, принимающих участие в метаболизме глюкозы и липидов. В адипоцитах активация PPARγ снижает уровни воспалительных цитокинов и свободных жирных кислот и увеличивает концентрацию адипонектина, таким образом способствуя повышению чувствительности к инсулину и снижению уровня глюкозы (рис. 1) [5].
К преимуществам пиоглитазона можно отнести:
достаточно высокую сахароснижающую активность — эффективность пиоглитазона сравнима или превосходит эффективность иДПП-4 и производных сульфонилмочевины, действие препаратов из этой группы не связано с гипогликемией (рис. 2) [6, 7];
![Рис. 2. Улучшение функции β-клеток (секреция инсулина / индекс ИР) у пациентов с впервые выявленным СД2, не принимавших пероральные сахароснижающие препараты, и у лиц, длительно принимавших производные сульфонилмочевины (адаптировано из [7]). ПИО — пиогли Рис. 2. Улучшение функции β-клеток (секреция инсулина / индекс ИР) у пациентов с впервые выявленным СД2, не принимавших пероральные сахароснижающие препараты, и у лиц, длительно принимавших производные сульфонилмочевины (адаптировано из [7]). ПИО — пиогли](/upload/medialibrary/5f5/592-2.png)
положительное влияние на липидный спектр: пиоглитазон снижает уровень триглицеридов, увеличивает количество липопротеинов высокой плотности и увеличивает размер частиц липопротеинов низкой плотности при одновременном снижении их концентрации в связи с активацией PPARα [2];
снижение концентрации свободных жирных кислот в плазме крови, усиление образования оксида азота и, таким образом, улучшение эндотелиальной функции [8];
стимуляцию PPARα, повышение секреции адипонектина, что приводит к повышению чувствительности тканей к инсулину и ингибированию атерогенеза [9].
Подобные эффекты напрямую связаны со снижением ИР, которая, как показывают большие проспективные исследования, является сильным независимым предиктором сердечно-сосудистых заболеваний, инфаркта миокарда (ИМ) и инсульта [10, 11]. Исследование PROactive, в котором участвовало более 5000 пациентов с СД2, подтвердило, что пиоглитазон снижает основную вторичную конечную точку смертности от всех причин, нефатального ИМ и инсульта на 16% по сравнению с плацебо [11, 12].
Исследование PROactive является крупномасштабным проспективным, рандомизированным, двойным слепым исследованием вторичной профилактики, в котором изучали влияние пиоглитазона на макрососудистые осложнения у 5238 пациентов с СД2 и сердечно-сосудистыми заболеваниями в анамнезе. Около 50% пациентов, включенных в данное исследование, имели в анамнезе ИМ, а 25% пациентов — инсульт. У 25% пациентов было установлено заболевание периферических артерий. Согласно протоколу исследования пиоглитазон или плацебо назначали в дополнение к стандартному лечению диабета, которое включало сахароснижающие, антигипертензивные, липидснижающие и антитромботические препараты. Результаты исследования показали статистически значимое снижение риска комбинированной конечной точки MACE на 18% (смерть от сердечно-сосудистых причин, нефатальный ИМ и нефатальный инсульт) (ОР 0,82, 95% ДИ 0,70–0,97) [11, 13]. Следует особо отметить, что у пациентов с ИМ в анамнезе пиоглитазон достоверно снизил риск повторного ИМ на 28% и риск развития острого коронарного синдрома на 38% [14]. У пациентов же с инсультом в анамнезе пиоглитазон снизил риск развития повторного инсульта на 47% [15].
Препараты группы тиазолидиндионов продемонстрировали благоприятное действие на различные биомаркеры атеросклероза: в исследованиях показано снижение уровня провоспалительных цитокинов у пациентов с СД2 — С-реактивного белка, интерлейкина 6, CD40L, хемоаттрактантного белка моноцитов-1 и металлопротеиназы-9 [16], в результате чего отмечено улучшение функции эндотелия, уменьшение толщины интима-медиа сонной артерии [17].
Известно, что ИР связана с фибрилляцией предсердий, а СД2 является одним из самых сильных независимых факторов риска этого нарушения. По данным метаанализа, прием пиоглитазона был связан с более низким риском возобновления фибрилляции предсердий [18].
Значимым преимуществом пиоглитазона является защитное действие на β-клетки. Проведенные исследования показывают, что после начального снижения HbA1c более качественный гликемический контроль обеспечивается сохранением функции β-клеток у пациентов с СД2 [19]. В исследовании ACT NOW риск развития СД2 был снижен на 72% (p<0,0001). Наряду с этим наступило улучшение индекса секреции инсулина/ИР (диспозиции) — «золотого стандарта» оценки функции β-клеток. Именно этот показатель является самым сильным предиктором профилактики диабета [20].
Улучшение функции β-клеток под влиянием пиоглитазона происходит, с одной стороны, вследствие стимуляции ядерных рецепторов PPARγ на β-клетках, а с другой — из-за повышения чувствительности β-клеток к глюкозе и снижения липотоксичности [21].
Алоглиптин
Как уже было отмечено, у пациентов с СД2 снижен инкретиновый эффект, в связи с чем не происходит должного влияния инкретиновых гормонов на секрецию инсулина β-клетками и нарушается механизм необходимого подавления секреции глюкагона в ответ на прием пищи.
Препараты группы иДПП-4, к которым относится алоглиптин, предотвращают физиологическую инактивацию ГИП и ГПП-1, в результате чего удерживаются повышенные уровни этих гормонов в плазме крови после приема пищи (рис. 3).
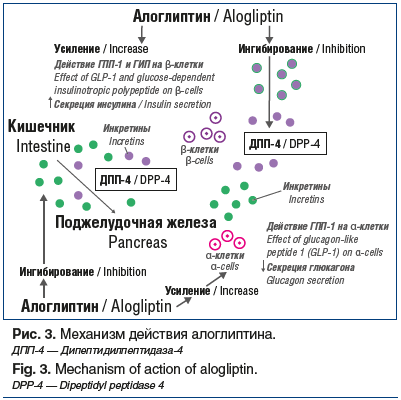
В результате такого действия иДПП-4 снижают уровень глюкозы в плазме крови после приема пищи и натощак. Особенностями действия иДПП-4 также являются снижение уровня HbA1c при низком риске гипогликемии и отсутствие набора веса [22]. Повышенные уровни инкретиновых гормонов определяют дополнительную чувствительность к глюкозе в α- и β-клетках поджелудочной железы, что при гипергликемии приводит к увеличению секреции инсулина и снижению секреции глюкагона, а при гипогликемии — к снижению секреции инсулина и увеличению секреции глюкагона [22, 23]. Кроме того, при лечении иДПП-4 определяются и дополнительные эффекты: уменьшение липолиза и снижение уровня богатых триацилглицерином атерогенных липопротеинов после приема пищи [24, 25].
Сахароснижающий эффект алоглиптина доказан в ходе большого числа исследований. При добавлении алоглиптина к терапии пациентов с недостаточно контролируемым диабетом на фоне приема препаратов сульфонилмочевины (уровень НbA1c 8,1%) уровень HbA1c снижался на 0,39–0,53% по сравнению с группой контроля [26]. В другом исследовании у пациентов с исходным уровнем HbA1c 7,9±0,8%, не получавших лечения, назначение алоглиптина показало хороший сахароснижающий эффект. У 50% пациентов наблюдалось снижение уровня HbA1c на 0,5%, у 29% — более чем на 1%. Кроме того, при приеме алоглиптина в дозе 25 мг отмечалось небольшое снижение уровня общего холестерина и триглицеридов [27, 28].
Алоглиптин — высокоселективный иДПП-4. Селективность алоглиптина по отношению к ДПП-4 более чем в 10 000 раз выше, чем к другим типам ДПП, что выше, чем у других представителей класса иДПП-4. Терапевтические дозы алоглиптина ингибируют ДПП-4 плазмы более чем на 80% с сохранением эффекта в течение 24 ч и повышают концентрацию ГПП-1 в 2–3 раза [29].
Исследование EXAMINE, в котором приняли участие 5380 пациентов с СД2 и острым ИМ или нестабильной стенокардией, не выявило кардиопротективного действия алоглиптина, но продемонстрировало его безопасность: после среднего периода наблюдения 18 мес. не наблюдалось значительных различий в частоте возникновения ИМ, инсульта, смертности от сердечно-сосудистых заболеваний и смертности от всех причин в группе пациентов, к терапии которых был добавлен алоглиптин, и в группе пациентов, получающих плацебо [30]. Вместе с тем исследованиe, проведенное в Японии, показало, что применение алоглиптина у пациентов с СД2 и гипертонической болезнью не только улучшало гликемический контроль (через 3, 6 и 12 мес. уровень HbA1c снизился с 7,0±0,97% до 6,4±0,61%, 6,3±0,58% и 6,3±0,75% соответственно, p<0,01), но и снижало систолическое артериальное давление с 137±18 мм рт. ст. до 127±13, 125±15 и 120±17 мм рт. ст. соответственно (p<0,01), диастолическое артериальное давление — c 79±13 мм рт. ст. до 74±8, 74±10 и 70±8 мм рт. ст. соответственно (p<0,01) [31].
По результатам субанализа исследования EXAMINE J.P. Ferreira et al. [32] отметили в подгруппе пациентов с СКФ≥60 мл/мин/1,73 м2, лечившихся алоглиптином, статистически значимое снижение риска развития комбинированной конечной точки MACE, включающей смерть по причине сердечно-сосудистых причин, нефатальный инсульт и нефатальный ИМ, на 19% (ОР 0,81, 95% ДИ 0,65–0,99, р=0,014) по сравнению с получавшими плацебо [32]. При этом риск сердечно-сосудистой смертности снизился на 39% (p=0,013), риск нефатального ИМ — на 14% (p=0,013).
В другом субанализе EXAMINE W.B. White et al. (2018) оценивали эффективность и безопасность добавления алоглиптина к двум пероральным сахароснижающим препаратам (метформину и производному сульфонилмочевины) в сравнении с плацебо. Было установлено, что добавление алоглиптина привело не только к дополнительному снижению HbA1c на 0,5%, но и к достоверному снижению сердечно-сосудистой смертности и смертности от всех причин на 51% (ОР 0,49, ДИ 95% 0,28–0,84, p=0,01) и 39% (ОР 0,61, 95% ДИ 0,38–0,96, p=0,033) соответственно [33].
Комбинация пиоглитазона и алоглиптина
Комбинированная терапия тиазолидиндионом и иДПП-4 в первую очередь показала хороший сахароснижающий эффект. Так, в 26-недельном исследовании среди наивных пациентов [27] на фиксированной комбинации пиоглитазона и алоглиптина (Инкресинк®) 63% пациентов достигли уровня HbA1c <7%, причем у пациентов с исходным уровнем HbA1c >8,5% на комбинированном препарате снижение HbA1c в среднем составило 2,1%. Комбинация препаратов обеспечивала более выраженное улучшение гликемического контроля, чем монотерапия пиоглитазоном и алоглиптином (рис. 4).
![Рис. 4. Динамика уровня HbA1с (A) и частота достижения целевого уровня HbA1с (B) на фоне различной пероральной сахароснижающей терапии (адаптировано из [27]). Исходный уровень HbA1с во всех случаях составил 8,8% Fig. 4. Changes in HbA1с levels (A) and the Рис. 4. Динамика уровня HbA1с (A) и частота достижения целевого уровня HbA1с (B) на фоне различной пероральной сахароснижающей терапии (адаптировано из [27]). Исходный уровень HbA1с во всех случаях составил 8,8% Fig. 4. Changes in HbA1с levels (A) and the](/upload/medialibrary/49b/592-4.png)
В другом 26-недельном исследовании пациентам, получающим метформин, с недостаточным гликемическим контролем был добавлен алоглиптин отдельно или в комбинации с пиоглитазоном. Изучалось изменение уровня HbA1с по сравнению с исходным, изменение уровня глюкозы в плазме натощак и оценивалась функция β-клеток. В результате на фоне комбинированной терапии было получено значительное снижение уровня HbA1c и гликемии натощак. Результаты исследования показали улучшение функции β-клеток (по оценке модели гомеостаза функции β-клеток) [28].
Также в ряде исследований было показано благотворное влияние комбинации алоглиптина и пиоглитазона на метаболизм липидов: на фоне приема комбинированного препарата отмечалось значительное снижение уровня постпрандиальных триглицеридов и липопротеинов, богатых триглицеридами, что в целом снижает общий кардиометаболический риск [24, 25].
Заключение
Таким образом, фиксированная комбинация пиоглитазона и алоглиптина (Инкресинк®) представляется клинически эффективной, так как воздействует сразу на несколько звеньев патогенеза сахарного диабета: снижает ИР, увеличивая поглощение глюкозы в мышечной ткани и снижая производство глюкозы в печени, а также снижая липолиз в адипоцитах, усиливает инкретиновый эффект, секрецию инсулина, снижает секрецию глюкагона. Используемые препараты по механизму действия взаимно дополняют друг друга. Пиоглитазон снижает прогрессирование атеросклероза, улучшая функцию эндотелия и снижая риск сердечно-сосудистых событий. Вместе с тем нельзя не учитывать его побочные эффекты: повышение веса на 1–2 кг и задержку жидкости у 2–4% пациентов. Алоглиптин показал безопасность в плане сердечно-сосудистых событий и хороший сахароснижающий эффект. Использование препаратов в комбинации позволяет применять более низкие дозы пиоглитазона, минимизируя побочные эффекты.
Фиксированная доза препарата, удобство приема делают препарат привлекательным для назначения пациентам с небольшой длительностью диабета или впервые выявленным диабетом, при непереносимости метформина или возможных побочных действиях при увеличении дозы метформина, а также пациентам, имеющим дополнительные факторы сердечно-сосудистого риска. Препарат может использоваться и при длительном течении диабета, когда длительный прием секретагенов, неудовлетворительный контроль гликемии истощает β-клетки и речь заходит о назначении инсулина — использование подобной комбинации может отодвинуть назначение инсулинотерапии.
Благодарность
Редакция благодарит компанию «Штада» за оказанную помощь в технической редактуре настоящей публикации.
Aknowledgement
The technical edition is supported by Stada.
Сведения об авторах:
Мкртумян Ашот Мусаелович — д.м.н., профессор, руководитель отдела эндокринных и метаболических нарушений ГБУЗ МКНЦ имени А.С. Логинова ДЗМ; 111123, Россия, г. Москва, ш. Энтузиастов, д. 86; ORCID iD 0000-0003-1316-5245.
Свиридова Мария Ивановна — к.м.н., заведующая центром эндокринных заболеваний беременных женщин ГБУЗ «ГКБ № 29 им. Н.Э. Баумана»; 111020, Россия, г. Москва, Госпитальная пл., д. 2; ORCID iD 0000-0001-8942-3111.
Контактная информация: Мкртумян Ашот Мусаелович, e-mail: vagrashot@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 26.08.2021.
Поступила после рецензирования 12.09.2021.
Принята в печать 30.09.2021.
About the authors:
Ashot M. Mkrtumyan — Dr. Sc. (Med.), Professor, Head of the Division of Endocrine and Metabolic Disorders, A.S. Loginov Moscow Clinical Research Center; 86, Entuziastov road, Moscow, 111123, Russian Federation; ORCID iD 0000-0003-1316-5245.
Mariya I. Sviridova — C. Sc. (Med.), Head of the Center of Endocrine Disorders of Pregnancy, N.E. Bauman City Clinical Hospital No. 29; 2, Gospital’naya sq., Moscow, 111020, Russian Federation; ORCID iD 0000-0001-8942-3111.
Contact information: Ashot M. Mkrtumyan, e-mail: vagrashot@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 26.08.2021.
Revised 12.09.2021.
Accepted 30.09.2021.
2. Triplitt C., Cersosimo E., DeFronzo R.A. Pioglitazone and alogliptin combination therapy in type 2 diabetes: a pathophysiologically sound treatment. Vasc Health Risk Manag. 2010;6:671–690. DOI: 10.2147/vhrm.s4852.
3. Scheen A.J. Pharmacokinetics and clinical evaluation of the alogliptin plus pioglitazone combination for type 2 diabetes. Expert Opin Drug Metab Toxicol. 2015;11(6):1005–1020. DOI: 10.1517/17425255.2015.1041499.
4. Hurren K.M., Dunham M.W. Are thiazolidinediones a preferred drug treatment for type 2 diabetes? Expert Opin Pharmacother. 2021;22(2):131–133. DOI: 10.1080/14656566.2020.1853100.
5. Console A., Formoso G. Do thiazolidinediones play a role in the treatment of type 2 diabetes mellitus? Diabetes Obesity Metab. 2013;15:967–977. DOI: 10.1111/dom.12101.
6. Di Pino A., DeFronzo R.A. Insulin resistanse and atherosclerosis implication for insulin-sensitising agents. Endocr Rev. 2019;40(6):1447–1467. DOI: 10.1210/er.2018-00141.
7. Eldor R., DeFronzo R.A., Abdul-Ghani M. In vivo actions of peroxisome proliferator-activated receptors: glycemic control, insulin sensitivity, and insulin secretion. Diabetes Care. 2013;36 Suppl 2(Suppl 2):S162–S74. DOI: 10.2337/dcS13-2003.
8. Alam F., Islam M.A., Mohamed M. et al. Efficacy and safety of pioglitazone monotherapy in type 2 diabetes mellitus: a systematic review and meta-analysis of randomized controlled trials. Sci Rep. 2019;9(1):5389. DOI: 10.1038/s41598-019-41854-2.
9. Pyörälä M., Miettinen X., Halonen P. et al. Insulin resistance syndrome makes it possible to predict the risk of coronary heart disease and stroke in healthy middle-aged men: the results of a 22-year follow-up of the Helsinki Police Study. Arterioscleris Thromb Vasc Biol. 2000;20:538–544. DOI: 10.1161/01.ATV.20.2.538.
10. Bonora E., Formentini G., Calcaterra F. et al. Insulin resistance according to HOME is an independent prognostic factor of cardiovascular diseases in patients with type 2 diabetes: prospective data from the Verona Study of Diabetic Complications. Diabetes Care. 2002;25:1135–1141. DOI: 10.2337/diacare.25.7.1135.
11. Dormandy J.A., Charbonnel D., Eckland D.J. et al. Secondary prevention of macrovascular events in patient with type 2 in the PROactive study (PROspective pioglitazone Clinical Trial in macrovascular Events): a randomized controlled trial. Lancet. 2005;366(9493):1279–1289. DOI: 10.1016/S0140-6736(05)67528-9.
12. Scherntaner J. Pleiotropic effects of thiazolidinediones on traditional and non — traditional risk factors for atherosclerosis. Int J Clin Pract. 2009;63:912–929. DOI: 10.1111/j.1742-1241.2009.02025.x.
13. Schernthaner G., Curry C.J., Scherntaner G.-H. Do we need pioglitazone for the treatment of type 2 diabetes? A risk-benefit critique in 2013. Diabetes Care. 2013;36(Suppl 2):S155–S161. DOI: 10.2337/dcS13-2031.
14. Di Pino A., Defronzo R.A. Insulin resistance and atherosclerosis: implications for insulin-sensitizing agents. Endocrinologist. 2019;40(6):1447–1467. DOI: 10.1210/er.2018-00141.
15. Zhang Z., Zhang X., Korantzopoulous P. et al. The use of thiazolidinedione and atrial fibrillation in diabetic patients: a meta-analysis. BMC Cardiovasc Disord. 2017;17:96–104. DOI: 10.1186/s12872-017-0531-4.
16. Daniele J., Abdul-gHani M., DeFronzo R.A. What are the options for pharmacotherapy for the treatment of prediabetes? Expert Opin Pharmacol. 2014;15:2003–2018. DOI: 10.1517/14656566.2014.944160.
17. DeFronzo R.A., Tripati D., Schwenke D.C. Pioglitazone for the prevention of diabetes with impaired glucose tolerance. New Engl J Med. 2011;364:1104–1115. DOI: 10.1056/NEJMoa1010949.
18. Zhou Y., Huang Y., Ji X. et al. Pioglitazone for the Primary and Secondary Prevention of Cardiovascular and Renal Outcomes in Patients with or at High Risk of Type 2 Diabetes Mellitus: A Meta-Analysis. J Clin Endocrinol Metab. 2020;105(5):dgz252. DOI: 10.1210/clinem/dgz252.
19. Ahrén B., Foley J.E. Improved glucose regulation in type 2 diabetic patients with DPP-4 inhibitors: focus on alpha and beta cell function and lipid metabolism. Diabetologia. 2016;59(5):907–917. DOI: 10.1007/s00125-016-3899-2.
20. Van Raalte D.H., van Genugten R.E., Eliasson B. et al. The effect of alogliptin and pioglitazone combination on various aspects of β-cell function in patients with recent-onset type 2 diabetes. Eur J Endocrinol. 2014;170:565–574. DOI: 10.1530/EJE-13-0639.
21. Pratley R.E., Kipnes M.S., Fleck P.R. et al. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor alogliptin in patients with type 2 diabetes inadequately controlled by glyburide monotherapy. Diabetes Obes Metab. 2009;11(2):167–176. DOI: 10.1111/j.1463-1326.2008.01016.x.
22. DeFronzo R.A., Fleck P.R., Wilson C.A. et al. Efficacy and safety of the dipeptidyl peptidase inhibitor alogliptin in patient with type 2 diabetes and inadequate glycemic control: a randomized, double-blind, placebo-controlled study. Diabetes Care. 2008;31(12):2315–2317. DOI: 10.2337/dc08-1035.
23. Петунина Н.А., Кузина И.А., Тельнова М.Э. и др. Патофизиологически обоснованная комбинированная терапия алоглиптином и пиоглитазоном при сахарном диабете 2 типа. Эффективная фармакотерапия. 2021;17(20):6–12. DOI: 10.33978/2307-3586-2021-17-20-6-12.[Petunina N.A., Kuzina I.A., Telnova M.E. et al. Pathophysiologically Based Combination Therapy with Alogliptin and Pioglitazone in Type 2 Diabetes Mellitus. Effective Pharmacotherapy. 2021;17(20):6–12 (in Russ.)]. DOI: 10.33978/2307-3586-2021-17-20-6-12.
24. Eliasson B., Möller-Goede D., Eeg-Olofsson K. et al. Lowering of postprandial lipids in individuals with type 2 diabetes treated with alogliptin and/or pioglitazone: a randomised double-blind placebo-controlled study. Diabetology. 2012;55:915–925. DOI: 10.1007/s00125-011-2447-3.
25. White W.B., Cannon C.P., Heller S.R. et al. EXAMINE Investigators. Alogliptin after acute coronary syndrome in patients with type 2 diabetes. N Engl J Med. 2013;369:1327–1335. DOI: 10.1056/NEJMoa1305889.
26. Shinji Kishimoto, Yoshihiko Kinoshita, Takeshi Matsumoto et al. Effects of the Dipeptidyl Peptidase 4 Inhibitor Alogliptin on Blood Pressure in Hypertensive Patients with Type 2 Diabetes Mellitus. Am J Hypertens. 2019;32(7):695–702. DOI: 10.1093/ajh/hpz065.
27. Rosenstock J., Inzucchi S.E. Initial combination therapy with alogliptin and pioglitazone in drug-naïve patients with type 2 diabetes. Diabetes Care. 2010;33(11):2406–2408. DOI: 10.2337/dc10-0159.
28. DeFronzo R.A., Burant C.F., Fleck P. et al. Efficacy and tolerability of the DPP-4 inhibitor alogliptin combined with pioglitazone, in metformin-treated patients with type 2 diabetes J Clin Endocrinol Metab. 2012;97(5):1615–1622. DOI: 10.1210/jc.2011-2243.
29. Van Raalte D.H., van Genugten R.E., Eliasson B. et al. The effect of alogliptin and pioglitazone combination therapy on various aspects of β-cell function in patients with recent-onset type 2 diabetes. Eur J Endocrinol. 2014;170(4):565–574. DOI: 10.1530/EJE-13-063.
30. Zannad F., Cannon C.P., Cushman W.C. et al. EXAMINE Investigators. Heart failure and mortality outcomes in patients with type 2 diabetes taking alogliptin versus placebo in EXAMINE: a multicentre, randomised, double-blind trial. Lancet. 2015;385(9982):2067–2076. DOI: 10.1016/S0140-6736(14)62225-X.
31. Tomlinson B., Chan P., Wai Kei Lam C. An overview of alogliptin + pioglitazone for the treatment of type 2 diabetes. Expert Opin Pharmacother. 2021;1–14. DOI: 10.1080/14656566.2021.1985465 (Online ahead of print).
32. Ferreira J.P., Mehta C., Sharma A. et al. Alogliptin after acute coronary syndrome in patients with type 2 diabetes: a renal function stratified analysis of the EXAMINE trial. BMC Med. 2020;18(1):165. DOI: 10.1186/s12916-020-01616-8.
33. White W.B., Heller S.R., Cannon C.P. et al. EXAMINE Investigators. Alogliptin in Patients with Type 2 Diabetes Receiving Metformin and Sulfonylurea Therapies in the EXAMINE Trial. Am J Med. 2018;131(7):813–819.e5. DOI: 10.1016/j.amjmed.2018.02.023.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.