Нерешенные вопросы диагностики гипофосфатазии: мнение экспертов
DOI: 10.32364/2587-6821-2021-5-9-605-614
Гипофосфатазия (ГФФ) — это редкое наследственное метаболическое заболевание, результат мутации с потерей функции (loss-of-function) в гене ALPL, кодирующем тканенеспецифическую щелочную фосфатазу (ЩФ). Клинические проявления ГФФ полиморфны и зависят от возраста начала заболевания и степени его тяжести. Распространенность более легких форм, включая ГФФ у взрослых, определить затруднительно из-за значительной гетерогенности клинических проявлений и низкой частоты диагностических исследований. Безусловным фактором выявляемости ГФФ выступает осведомленность врачей об этой редкой патологии. В статье представлен обзор результатов совета экспертов, посвященный вопросам диагностики ГФФ и возможным мерам по ее улучшению. В заседаниях совета приняли участие 10 экспертов из разных регионов России — от Дальнего Востока до Республики Кабардино-Балкарии. Каждый эксперт поделился опытом и сложившейся практикой по диагностике орфанных заболеваний в своем регионе, высказал мнение и предложения по оптимизации подходов к диагностике ГФФ. Результатом совета стала разработка алгоритма обследования и маршрутизации пациента от выявления первых симптомов до принятия решения о необходимости назначения ферментзаместительной терапии и последующего наблюдения на всех уровнях оказания медицинской помощи.
Ключевые слова: гипофосфатазия, щелочная фосфатаза, орфанные заболевания, ALPL, ферментзаместительная терапия, маршрутизация.
Для цитирования: Захарова Е.Ю., Варламова Т.В., Воронин С.В., Власенко Н.Ю., Кочегурова Е.М., Мамбетова А.М., Печатникова Н.Л., Соснина И.Б., Удалова О.В., Храмова Е.Б. Нерешенные вопросы диагностики гипофосфатазии: мнение экспертов. РМЖ. Медицинское обозрение. 2021;5(9):605-614. DOI: 10.32364/2587-6821-2021-5-9-605-614.
E.Yu. Zakharova1, T.V. Varlamova2, S.V. Voronin3, N.Yu. Vlasenko4, E.M. Kochegurova5,6, A.M. Mambetova7, N.L. Pechatnikova8, I.B. Sosnina9, O.V. Udalova10, E.B. Khramova11
1Research Center for Medical Genetics, Moscow, Russian Federation
2Petrozavodsk State Univerity, Petrozavodsk, Russian Federation
3Regional Clinical Center of Specialized Medical Care, Vladivostok, Russian Federation
4Omsk State Medical University, Omsk, Russian Federation
5 Tver State Medical University, Tver, Russian Federation
6E.M. Bakunina Regional Clinical Perinatal Center, Tver, Russian Federation
7Kh.M. Berbekov Kabardian-Balkar State University, Nalchik, Russian Federation
8Morozov Children’s City Clinical Hospital, Moscow Russian Federation
9Consultative Diagnostic Center for Children, St. Petersburg, Russian Federation
10Privolzhsk Research Medical University, Nizhniy Novgorod, Russian Federation
11Tyumen State Medical University, Tyumen, Russian Federation
Hypophosphatasia (HPP) is a rare hereditary metabolic disease resulting from the loss-of-function mutation in the ALPL gene encoding tissue-nonspecific alkaline phosphatase (ALP). Clinical presentations are polymorphic and manifest themselves differently depending on the age of disease onset and severity. The occurrence of mild disease, including adult HPP, is challenging to assess due to the high heterogeneity of clinical signs and a lower diagnosis rate. Doctors’ awareness of HPP is the fundamental factor affecting its detection rate. This paper reviews the conclusions of the Expert Council on HPP diagnosis and potentialities to improve diagnosis. Ten experts from various Russian regions participated in panel sessions. Each member shared the experience and established practice on the diagnosis of orphan diseases in his/her region and gave suggestions to optimize the diagnostic approach to HPP. The result was the development of a management algorithm and routing of patients from identifying symptoms to decision making on prescribing enzyme-replacement therapy and subsequent follow-up at every level of medical care.
Keywords: hypophosphatasia, alkaline phosphatase, orphan diseases, ALPL, enzyme-replacement therapy, routing.
For citation: Zakharova E.Yu., Varlamova T.V., Voronin S.V. et al. Unsolved diagnostic issues of hypophosphatasia: Expert Council. Russian Medical Inquiry. 2021;5(9):605–614 (in Russ.). DOI: 10.32364/2587-6821-2021-5-9-605-614.
Введение
Гипофосфатазия (ГФФ) — прогрессирующее наследственное метаболическое заболевание, вызванное мутацией в гене ALPL, приводящей к дефициту щелочной фосфатазы (ЩФ) [1, 2]. Распространенность тяжелых форм ГФФ — перинатальной и инфантильной — колеблется от 1:100 000 до 1:300 000 [3, 4], а в популяциях с выявленным эффектом «основателя» — до 1:2500 [5]. В основном болезнь проявляется нарушением минерализации костной ткани, приводящим к рахитическим деформациям скелета, нарушению роста и развития, поражению почек, дыхательной и нервной систем, ревматологическим проявлениям [2]. Редкость ГФФ в сочетании с относительной неспецифичностью симптомов — причина гиподиагностики этого заболевания. По данным проспективного наблюдательного исследования «Международный регистр ГФФ», задержка в постановке диагноза в среднем составляет более одного года, медиана возраста появления первых симптомов — 7,2 мес. [-2,3; 190,7], тогда как медиана возраста постановки диагноза — 20,4 мес. [-0,2; 191,9] [6]. Учитывая высокую летальность среди пациентов с ранними формами ГФФ и прогрессирующий характер ее течения, важным фактором считают своевременную диагностику заболевания.
В ноябре 2020 г. в формате онлайн состоялся совет экспертов «Нерешенные вопросы диагностики гипофосфатазии», основной задачей которого была разработка мер по улучшению выявляемости и маршрутизации пациентов с ГФФ в РФ. В обзоре представлены основные вопросы, обсуждавшиеся экспертами и консолидированные мнения участников по каждому из них.
Существующие подходы к диагностике ГФФ, их преимущества и недостатки
К общим проблемам диагностики ГФФ относится недостаточная информированность о заболевании как у специалистов первичного звена, так и у специалистов узкого профиля, которые сталкиваются с характерными проявлениями ГФФ: врачей ультразвуковой диагностики (осуществляющих пренатальную диагностику), детских стоматологов, эндокринологов, ортопедов, неврологов, нефрологов.
Крайне важной проблемой является отсутствие корректно установленных референсных значений активности ЩФ во многих биохимических лабораториях. Зачастую нижняя граница нормальной активности фермента указывается равной нулевому значению.
Существуют сложности, связанные со значительной удаленностью населенных пунктов от центров медико-генетических консультаций, что наряду с дефицитом кадров в этих центрах значительно влияет на скорость диагностического обследования: повторный прием у врача-генетика может состояться только через несколько месяцев после первичного. И наконец, на сегодняшний день отсутствует четкий согласованный алгоритм маршрутизации пациентов с ГФФ. В силу всех этих причин многие пациенты с ГФФ поздно приходят к врачу-генетику или не направляются к нему совсем, что фатально удлиняет время постановки диагноза и влияет на прогноз жизни пациентов, и в первую очередь детей.
Обсуждая объем диагностического обследования, эксперты отметили необходимость оценки клинической картины: рахитоподобные изменения скелета, деформации конечностей, грудной клетки и черепа, нарушения походки, низкорослость и характерные рентгенологические признаки ГФФ. Кроме того, в группу риска входят пациенты с клиническими изменениями со стороны нервной, дыхательной и мочевыделительной систем, а также стоматологической патологией.
В педиатрическом стационаре и на консультативном приеме в соответствии с клиническими признаками назначается анализ крови для определения уровня активности ЩФ. При выявлении низкой активности фермента проводится сбор анамнеза для исключения других причин снижения активности ЩФ, рентгенография длинных трубчатых костей (зоны роста), грудной клетки, черепа и генетическая диагностика (генетическая панель или отдельный ген — в зависимости от возможностей лабораторий).
При пренатальном консультировании беременных с характерными эхографическими признаками ГФФ у плода рекомендуется проводить пренатальную диагностику (биопсия ворсин хориона, плацентоцентез, амниоцентез или кордоцентез, с последующим молекулярно-генетическим исследованием), а также определять активность ЩФ у новорожденного и родителей. При низкой активности ЩФ также проводится молекулярно-генетическая диагностика.
Эксперты отметили возможности ретроспективного скрининга: выявление пациентов с низкой активностью ЩФ (при использовании электронной базы данных лаборатории), затем анализ медицинской документации на предмет клинических проявлений и при совокупности биохимических изменений и клиники — проведение генетического исследования на ГФФ. Данный метод имеет ряд преимуществ в виде высокой эффективности и минимальных материальных и ресурсных затрат. При этом тактика поиска ГФФ у пациентов с низкой активностью ЩФ без характерных клинических признаков нерациональна, так как существует множество других причин снижения активности фермента.
Нормативная документация федерального и регионального уровней
Среди используемой нормативной документации при диагностике редких заболеваний были выделены Международная классификация болезней, травм и состояний, влияющих на здоровье, 10-го пересмотра, «Клинические рекомендации» (протоколы лечения), приказ Минздрава России от 30 декабря 1993 г. № 316 «О дальнейшем развитии медико-генетической службы Министерства здравоохранения Российской Федерации», поручения Президента РФ о расширении скрининга наследственных болезней обмена (НБО) (поручение дано по итогам заседания Координационного совета по реализации Национальной стратегии действий в интересах детей, состоявшегося 15 ноября 2016 г.).
Кроме того, существуют приказы региональных минздравов о проведении селективного скрининга. Одним из таких примеров является приказ ДЗМ Москвы от 14 июня 2016 г. № 500 «Об организации проведения селективного скрининга». Данный скрининг проводится на базе Морозовской детской городской клинической больницы путем первичной консультации пациентов с НБО и исследования образцов крови на тандемной масс-спектрометрии за счет городского бюджета. Все учреждения первичного звена и стационары Москвы при наличии одного основного или двух и более дополнительных критериев/симптомов НБО имеют возможность направить пациента в Референс-центр ГБУЗ «Морозовская ДГКБ ДЗМ» для проведения исследования на выявление НБО.
Также важным вопросом остается создание и работа профильных отделений, занимающихся проблемами редких (орфанных) заболеваний на уровне субъектов. В Москве эту роль выполняет ГБУЗ «Морозовская ДГКБ ДЗМ» и созданный на ее базе Референс-центр врожденных, наследственных заболеваний, генетических отклонений, орфанных и других редких заболеваний (приказ Департамента здравоохранения г. Москвы от 2 июня 2015 г. № 461 «Об организации Референс-центра врожденных наследственных заболеваний, генетических отклонений, орфанных и других редких заболеваний»). К основным задачам и функциям центра относятся: консультативная, амбулаторная и стационарная специализированная медицинская помощь детям и подросткам с врожденными наследственными заболеваниями, генетическими отклонениями, орфанными и другими редкими заболеваниями; клинико-лабораторное, инструментальное и морфогенетическое обследование с целью установления (подтверждения) диагноза; проведение динамического наблюдения; обеспечение этапной реабилитации и социальной адаптации, а также обеспечение детей и подростков, жителей г. Москвы, лекарственными препаратами (составление экспертных заключений, профильных комплексных заявок для закупок с указанием потребностей, выписка рецептов в установленном порядке, введение лекарственных препаратов с внесением данных в медицинскую документацию).
Подобная практика может быть внедрена во всех регионах РФ. Московский Референс-центр врожденных наследственных заболеваний, генетических отклонений, орфанных и других редких заболеваний проводит обучающие программы и обмен опытом по организации и развитию подобных центров в регионах.
Отдельно были отмечены профессиональные стандарты врачей: генетика, педиатра, терапевта, неонатолога, невропатолога, пульмонолога, уролога и др., а также клинические рекомендации по оказанию медицинской помощи пациентам с ГФФ. Клинические рекомендации реально используются врачами в клинической практике, однако они построены не по принципу дифференциального диагностического поиска, а по нозологиям. Несмотря на наличие в рекомендациях диагностических критериев того или иного редкого заболевания, врачам на местах может быть трудно определиться с алгоритмом диагностического поиска. В таких случаях существенную помощь могли бы оказать вышеупомянутые профильные отделения, занимающиеся пациентами с орфанными заболеваниями.
Существующие алгоритмы по скринингу и выявлению пациентов с ГФФ
В ходе совета проведен анализ опубликованных в литературе алгоритмов по скринингу и выявлению пациентов с ГФФ.
При оценке алгоритма, предложенного В.П. Ивановым и соавт. [7], эксперты сошлись во мнении, что данный алгоритм удобен в использовании в клинической практике, при этом целесообразно проводить постановку диагноза с выявлением мутаций (данное исследование отмечено в алгоритме как дополнительное). Среди преимуществ выделены: указание клинических симптомов по системам органов, наличие рекомендаций по исключению других заболеваний, приводящих к снижению ЩФ. Данный алгоритм позволяет установить референсные значения уровня ЩФ для детей, провести проспективную диагностику ГФФ на основе активности ЩФ и клинических признаков ГФФ. Эксперты обратили внимание также на недостатки данного алгоритма. В частности, дискутабелен вопрос об определении уровней субстратов — методики являются малодоступными в повседневной практике, поэтому эти показатели рассматриваются как дополнительные и могут быть рассчитаны только при наличии технической возможности и на заключительном этапе подтверждения диагноза. Также рекомендуется указать роль врачей различных специальностей и поэтапную маршрутизацию пациента с подозрением на ГФФ.
В отношении алгоритма И.Б. Сосниной и соавт. [8] отмечено, что ретроспективная диагностика крайне важна, она позволяет с минимальными затратами выявлять пациентов высокой группы риска и диагностировать ГФФ. Однако не во всех регионах РФ существуют единые лабораторные базы данных с результатами исследования ЩФ, мало регионов, в которых установлены корректные референсные значения уровня ЩФ. В отношении блока проспективной диагностики возникли замечания, касающиеся того, что диагноз может быть выставлен без анализа ДНК, что на практике редко встречается и может вызывать вопросы. Идея ретроспективного алгоритма построена на выявлении пациентов с низким уровнем ЩФ, что представляется корректным, однако воплощение данной идеи возможно только при соблюдении ряда условий: указание лабораторией корректных значений нижней границы нормы ЩФ; наличие электронной базы данных лабораторных исследований (что крайне затруднительно организовать в некоторых районах страны); наличие специалистов, которые будут осуществлять поиск и анализ медицинской документации. В то же время данный алгоритм позволяет отталкиваться от клинических проявлений заболевания в дифференциальном диагнозе.
Алгоритм V. Saraff et al. [9] (рис. 1) был признан наиболее корректным, однако не всегда выполнимым в некоторых регионах страны, не имеющих полноценной общеклинической лабораторной базы. Алгоритм позволяет оценить не только клинические проявления, но и сочетания клиники с лабораторными и рентгенологическими признаками ГФФ. Недостаток данного алгоритма заключается в том, что в его основу положен уровень ЩФ, тогда как клинические проявления оцениваются позже. В таком случае может возникнуть ситуация, когда пациенту вообще не будет назначен такой анализ (например, при обращении ребенка с ранней потерей зубов к стоматологу).
![Рис. 1. Диагностический алгоритм обследования детей с низкой активностью ЩФ и/или симптомами гипофосфатазии [9] Fig. 1. Diagnostic algorithm for the investigation of children presenting with low ALP activity and/or symptoms of hypophosphatasia [9] Рис. 1. Диагностический алгоритм обследования детей с низкой активностью ЩФ и/или симптомами гипофосфатазии [9] Fig. 1. Diagnostic algorithm for the investigation of children presenting with low ALP activity and/or symptoms of hypophosphatasia [9]](/upload/medialibrary/6e5/605-1.png)
Было высказано мнение, что поражение нервной системы при ГФФ почти всегда сочетается с поражением скелета, дыхательной и других систем организма, поэтому проводить отбор пациентов для диагностики ГФФ только по неспецифическим неврологическим признакам нецелесообразно, необходимо всегда обращать внимание на уровень активности ЩФ.
Маршрутизация пациентов с подозрением на ГФФ
Общие вопросы маршрутизации
До настоящего времени отсутствовал единый подход в организации маршрутизации пациентов с ГФФ. В каждом конкретном регионе он реализуется по-своему. В Москве пациентов с подозрением на ГФФ направляют в один из центров на консультацию врача-генетика, который и назначает последующие диагностические мероприятия. В РДКБ г. Нальчика существует несколько вариантов маршрутизации пациента. При первом варианте при подозрении на ГФФ педиатром первичного звена или врачом общей практики пациент направляется в консультативную поликлинику Республиканской детской клинической больницы, где педиатром изучается генеалогический анамнез, определяется уровень ЩФ, исследуются показатели фосфорно-кальциевого обмена. Одновременно пациент консультируется генетиком, неврологом, а при наличии нефрокальциноза, признаков остеодистрофии — нефрологом. Проводится ультразвуковая диагностика, рентгенография трубчатых костей. Если биохимические изменения не позволяют интерпретировать диагноз однозначно, определяются показания к молекулярно-генетической диагностике. Во втором варианте, который определяется состоянием ребенка, например при подозрении на перинатальную форму ГФФ, пациент сразу направляется в специализированные отделения Республиканской детской клинической больницы.
В Тверской области детальная маршрутизация пациентов пока не разработана и осуществляется разными путями. При выявлении клинических симптомов (чаще всего это поражение костной ткани и неврологические симптомы, крайне редко — поражение дыхательной системы, почек и зубов) ребенок направляется на консультацию генетика, как правило, после посещения педиатра, ортопеда, невролога. Однако врачи данных специальностей часто не используют в дифференциальной диагностике нозологию ГФФ, указывая в качестве направляющего диагноза рахитоподобное заболевание. Врач-генетик изучает амбулаторную карту или назначает исследование уровня ЩФ (часть лабораторий медучреждений области выдает результаты без указания нижней границы нормы ЩФ). Сложность представляют пациенты из отдаленных районов, где нет возможности выполнения биохимических анализов и возникает необходимость повторных визитов в областной центр. При низком уровне ЩФ кровь пациента направляется в лабораторию МГНЦ им. акад. Н.П. Бочкова, далее проводится обследование на федеральном уровне.
В Нижнем Новгороде во время стационарной или амбулаторной консультации в ПИМУ при выявлении клинических признаков ГФФ пациента направляют на определение активности ЩФ. Налажен порядок забора крови для генетического исследования, курьерской доставки и получения результата. Возможно проведение полного диагностического алгоритма в частной клинике.
В Омской области чаще проводится госпитализация в кардио-эндокринологическое отделение областной детской клинической больницы (на базе учреждения располагаются 3 кафедры ОмГМУ) — единственное в области эндокринное отделение для детей. Областная детская клиническая больница является учреждением 3-го уровня, где специалисты имеют возможность проконсультировать пациента с помощью федеральных баз.
В Консультативно-диагностическом центре для детей (КДЦД) Санкт-Петербурга врач-педиатр или врач-специалист первичного звена направляет пациента с задержкой роста, развития и другими жалобами на углубленное обследование в СПб ГБУЗ КДЦД. В КДЦД в обязательном порядке осуществляется лабораторное определение уровня ЩФ и выполняется алгоритм поиска ГФФ.
В Детской республиканской больнице (ГБУЗ «ДРБ») Петрозаводска при выявлении пациента с подозрением на ГФФ информация сообщается главному внештатному детскому эндокринологу. Далее ребенок может быть дообследован на уровне Центра детской эндокринологии и гастроэнтерологии ГБУЗ «ДРБ» (стационар 3-го уровня, в обследование входит консультация генетика) или амбулаторно (если ребенок проживает в г. Петрозаводске). При подтверждении вероятности ГФФ решается вопрос о проведении молекулярно-генетического исследования, в Карелии решением данного вопроса занимается главный специалист детский эндокринолог.
Маршрутизация пациентов с ГФФ в Тюменской области продемонстрирована на примере двух пациентов с подтвержденным диагнозом. В первом случае пациента с перинатальной формой после рождения осматривал генетик в перинатальном центре, направлял кровь на молекулярно-генетическое исследование. В период ожидания результатов анализа ребенок обследовался в условиях отделения патологии новорожденных. Второй пациент с детской формой ГФФ наблюдался по месту жительства у невролога, на основании неспецифических симптомов и низкого уровня ЩФ в повторных образцах крови была заподозрена ГФФ, проведено генетическое исследование, которое подтвердило наличие мутации, и ребенок был направлен в федеральный центр для дообследования и принятия решения о дальнейшей тактике ведения.
Роль врача амбулаторного звена в диагностике ГФФ
Врач амбулаторного звена — ключевая фигура в диагностике ГФФ, роль его крайне значима, так как он одним из первых сталкивается с пациентом. Роль врача первичного звена заключается в перенаправлении пациентов с подозрением на ГФФ к генетику, ортопеду, эндокринологу, стоматологу, проведении анализа на активность ЩФ и выполнении рентгенографии. Необходимо обращать внимание на детей с ранним выпадением зубов и костными деформациями. Было отмечено, что анализ на активность ЩФ входит в стандарт дифференциальной диагностики рахитоподобных заболеваний, в других случаях (например, при задержке роста) уровень ЩФ не определяют, соответственно, необходимы формулировки симптомов/синдромов, при которых должен определяться данный биохимический маркер.
Эксперты отметили, что на практике врач первичного звена отвечает за заключение при проведении профилактических осмотров несовершеннолетних, он должен анализировать все данные осмотра узкими специалистами и результаты оценки физического развития. Однако пациенты с задержкой роста и костными деформациями направляются к генетику не педиатром, а узкими специалистами.
Эксперты также обозначили аспекты усовершенствования существующих подходов. В частности, было отмечено, что в приказах о профосмотрах детей необходимо обозначить, что нужно делать педиатру в случае выявления отклонений в состоянии здоровья (при каких изменениях направлять пациента к узким специалистам). Также необходимо включить в обязательное исследование при прохождении профосмотра определение уровня ЩФ хотя бы один раз за первые 2–3 года жизни, сделать определение маркеров минерально-костных нарушений доступным для врачей первичного звена. Необходимо информировать врачей первичного звена о ГФФ, учитывая орфанный характер заболевания, а также выделить ресурсы в лечебно-профилактическом учреждении (ЛПУ) и/или медицинском центре, где возможно направление биоматериала на генетическое исследование.
Совершенствование маршрутизации пациентов с ГФФ и помощи данным пациентам
Эксперты обсудили вопросы, требующие усовершенствования и/или оптимизации существующих подходов к маршрутизации пациентов с ГФФ. Было отмечено, что улучшения требуют все этапы, однако особое внимание следует уделить возможности экстренной госпитализации детей с тяжелыми формами ГФФ в специализированные клиники федерального уровня. При любых формах заболевания важно, чтобы пациенты направлялись к специалисту, осведомленному о ГФФ. Также необходимо разработать порядок обследования и маршрут пациента при случайном выявлении низкой активности ЩФ, а сам маршрут должен учитывать региональные особенности и возможности, необходимо предусмотреть возможность направления пациентов в федеральные центры для детального обследования. В данном маршруте нужно указать экспертные лечебные учреждения и необходимые консультации узких специалистов. Отдельно отмечена необходимость в преемственности между учреждениями каждого уровня, принимающими участие в обследовании пациента и постановке диагноза ГФФ.
Эксперты отметили, что непрофильные специалисты должны быть осведомлены о клинических и рентгенологических проявлениях ГФФ, для чего необходимо внедрение генетических панелей тестов. Важно установить корректные референсные значения уровня ЩФ для разных возрастных групп, обеспечить доступность определения уровня витамина D и паратгормона в первичном звене медицинской помощи.
В Нальчике имеется удачный пример маршрутизации пациента с другим редким заболеванием — атипичным гемолитико-уремическим синдромом. При подозрении на эту патологию в любом ЛПУ пациент незамедлительно переводится в лечебное учреждение республиканского уровня, где организуются консультации всех специалистов, проводятся дополнительные исследования, в том числе молекулярно-генетические. В случае тяжелого состояния пациента организуются экстренные телеконсультации со специалистами федеральных центров. При подтверждении диагноза назначается патогенетическая терапия. Вопрос о назначении такой терапии может быть решен в течение ближайших часов/суток.
Высказаны мнения, что информированность врачей играет решающую роль, без этого важного аспекта будет крайне сложно своевременно поставить диагноз. Эксперты отметили, что осведомленность врачей первичного звена, врачей-неонатологов, врачей лучевой диагностики на данный момент недостаточна.
Маршрут должен быть максимально простым и понятным как для врача, так и для пациента, желательно внедрение в РФ общепринятых алгоритмов диагностики и маршрутизации, а также создание новых клинических рекомендаций по ГФФ. Необходим приказ регионального минздрава о направлении пациента на консультацию к специалисту (генетику/эндокринологу) при наличии соответствующих клинических проявлений. Прозвучало предложение заключить договор с крупными лабораториями в регионах для выполнения анализа на активность ЩФ или другие маркеры ГФФ у любого пациента по направлению от любого врача. Также было предложено внедрить таблицу с подсчетом баллов по симптомам: при высокой вероятности ГФФ проводить обследование.
Диагностика ГФФ: роль врачей разных специальностей
Отвечая на вопрос о том, от каких специалистов в основном направляются пациенты с подозрением на ГФФ, эксперты отметили, что чаще всего речь идет об ортопедах, педиатрах, неврологах, стоматологах, нефрологах, эндокринологах и генетиках.
Эксперт из Нальчика отметила, что чаще других с подозрением на ГФФ направляются: дети из перинатального центра с выраженными дыхательными и неврологическими расстройствами; дети из ЛПУ по месту жительства с неврологическими, костными изменениями, поражением зубов, с ультразвуковыми проявлениями нефрокальциноза и/или другими признаками почечной остеодистрофии; дети с задержкой роста, плохой прибавкой массы тела.
В Твери пациенты поступают к эксперту в основном из Детской областной клинической больницы и городской больницы № 1, в Нижнем Новгороде — из ГИТО, в Тюмени — из перинатального центра, в Санкт-Петербурге — из городских поликлиник. При этом поводом к обращению в большинстве случаев являются задержка роста и развития, наличие рахитоподобных деформаций скелета.
Как правило, впервые диагноз ГФФ пациенту ставит неонатолог, педиатр, нефролог, невролог, ортопед, генетик. В Санкт-Петербурге диагноз ГФФ устанавливает врач консультативно-диагностического центра для детей по совокупности клинических, инструментальных и лабораторных данных, результатов генетического тестирования. Подтверждает диагноз консилиум федерального уровня.
Все эксперты сошлись во мнении, что решение вопроса о необходимости ферментзаместительной терапии должно приниматься в федеральных центрах, специализирующихся на лечении пациентов с ГФФ. В Санкт-Петербурге лечение назначает консилиум федерального уровня в клинике центра им. Алмазова или СПбГПМУ, динамическое наблюдение осуществляется совместно городским детским диагностическим центром и федеральной клиникой в установленные сроки.
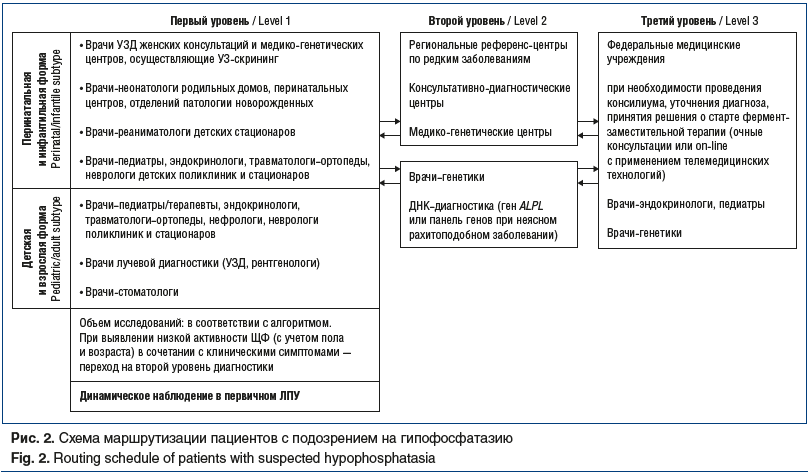
В рамках работы совета экспертов И.Б. Сосниной была предложена схема маршрутизации пациентов с подозрением на ГФФ как для перинатальной и инфантильной (рис. 2), так и для детской и взрослой форм.
Н.Л. Печатникова со ссылкой на российские и международные публикации предложила использовать таблицу для проведения дифференциальной диагностики ГФФ с наиболее часто встречающимися рахитоподобными заболеваниями (табл. 1). Кроме того, исключать следует и другие причины/состояния, при которых возможно снижение активности ЩФ. К ним относятся: применение лекарственных средств, таких как препараты для химиотерапии, глюкокортикоиды, клофибрат, бисфосфонаты; ряд медицинских состояний — гипотиреоз, множественная миелома, лейкоз, целиакия, дефицит магния и/или цинка, тяжелая анемия, болезнь Вильсона — Коновалова, синдром Кушинга, клейдокраниальная дисплазия, несовершенный остеогенез II типа, анорексия; другие причины — интоксикация витамином D, неправильный забор крови или аналитические ошибки, массивная трансфузия крови, длительное голодание, дефицит витамина С, коронарное шунтирование [10, 11].
![Таблица 1. Основные биохимические показатели гипофосфатазии и сходных заболеваний для проведения дифференциального диагноза [10] Table 1. Major biochemical parameters of hypophosphatasia and similar diseases for differential diagnosis [10] Таблица 1. Основные биохимические показатели гипофосфатазии и сходных заболеваний для проведения дифференциального диагноза [10] Table 1. Major biochemical parameters of hypophosphatasia and similar diseases for differential diagnosis [10]](/upload/medialibrary/f86/605-3.png)
Заключение
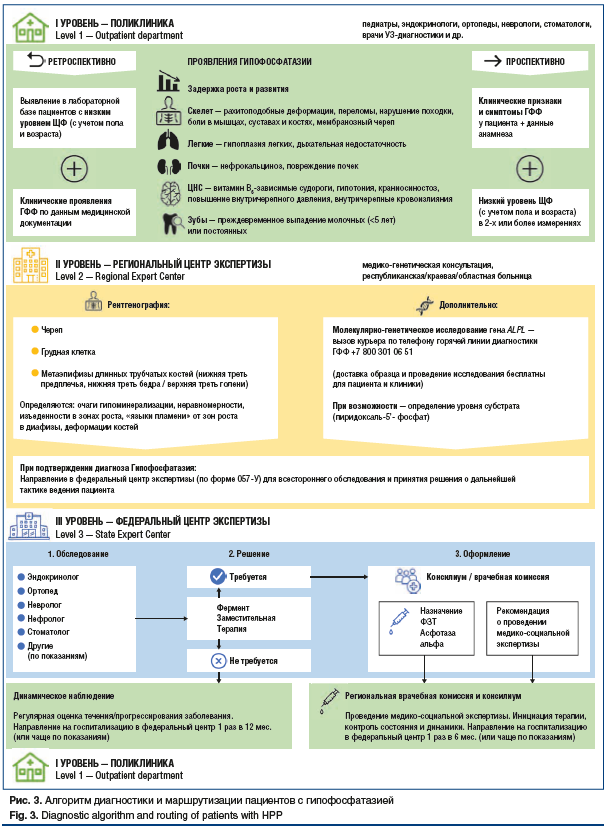
В ходе совместной работы эксперты объединили накопленный в диагностике пациентов с ГФФ опыт, поделились особенностями обследования, постановки диагноза и маршрутизации пациентов в своих регионах, обсудили проблемы и возможности их решения. Результатом этой работы стало формирование единого алгоритма диагностики и маршрутизации пациентов (рис. 3), в котором отражены все основные этапы и шаги — от первоначального обследования пациента с подозрением на ГФФ до определения тактики его ведения. Широкое внедрение алгоритма в повседневную практику может повысить настороженность врачей, улучшить диагностику редкого заболевания и сократить время от появления первых симптомов до постановки верного диагноза, что позволит избежать тяжелых осложнений и улучшит прогноз для пациентов с ГФФ.
Сведения об авторах:
Захарова Екатерина Юрьевна — д.м.н., заведующая лабораторией наследственных болезней обмена веществ и лабораторией селективного скрининга ФГБНУ «МГНЦ»; 115478, Россия, г. Москва, ул. Москворечье, д. 1; ORCID iD 0000-0002-5020-1180.
Варламова Татьяна Валентиновна — к.м.н., доцент кафедры педиатрии и детской хирургии, ФГБОУ ВО «Петрозаводский государственный университет»; 185910, Россия, г. Петрозаводск, пр-кт Ленина, д. 33; ORCID iD 0000-0001-5617-8893.
Воронин Сергей Владимирович — к.м.н., заведующий краевой медико-генетической консультацией ГАУЗ «ККЦ СВМП»; 690091, Россия, г. Владивосток, ул. Уборевича, д. 30/37; ORCID iD 0000-0002-9918-9565.
Власенко Наталья Юрьевна — к.м.н., доцент кафедры госпитальной педиатрии с курсом дополнительного профессионального образования ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0001-5669-1718.
Кочегурова Елена Михайловна — к.м.н., доцент кафедры поликлинической педиатрии и неонатологии ФГБОУ ВО Тверской ГМУ Минздрава России; 170100, Россия, г. Тверь, ул. Советская, д. 4; заведующая медико-генетической консультацией ГБУЗ ТО «ОКПЦ им. Е.М. Бакуниной»; 170036, Россия, г. Тверь, Петербургское ш., д. 115, к. 3; ORCID iD 0000-0002-8011-589X.
Мамбетова Анета Мухамедовна — д.м.н., профессор кафедры общей врачебной подготовки и медицинской реабилитации Кабардино-Балкарского государственного университета им. Х.М. Бербекова; 360004, Россия, г. Нальчик, ул. Чернышевского, д. 173; ORCID iD 0000-0003-0378-0754.
Печатникова Наталья Леонидовна — к.м.н., руководитель генетической службы ГБУЗ «Морозовская ДГКБ ДЗМ»; 119049, Россия, г. Москва, 4-й Добрынинский пер., д. 1/9; ORCID iD 0000-0002-2445-132X.
Соснина Ирина Брониславовна — заместитель главного врача по медицинской части СПБ ГБУЗ «КДЦД»; 192289, Россия, г. Санкт-Петербург, ул. Олеко Дундича, д. 36, к. 2; ORCID iD 0000-0002-0077-9435.
Удалова Ольга Васильевна — к.м.н., врач-генетик Центра медицинской генетики: ФГБОУ ВО «ПИМУ» Минздрава России; 603005, Россия, г. Нижний Новгород,
пл. Минина и Пожарского, д. 10/1; ORCID iD 0000-0002-8678-4349.
Храмова Елена Борисовна — д.м.н., заведующая кафедрой детских болезней педиатрического факультета ФГБОУ ВО Тюменский ГМУ Минздрава России; 625023, г. Тюмень, ул. Одесская, д. 54; ORCID iD 0000-0001-8968-3925.
Контактная информация: Соснина Ирина Брониславовна,
e-mail: sosnina_kdcd@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах.
Конфликт интересов отсутствует.
Статья поступила 17.08.2021.
Поступила после рецензирования 09.09.2021.
Принята в печать 04.10.2021.
About the authors:
Ekaterina Yu. Zakharova — Dr. Sc. (Med.)., Head of the Laboratory of Hereditary Metabolic Disorders and Selective Screening, Research Center for Medical Genetics; 1, Moskvorechye str., Moscow, 115522, Russian Federation; ORCID iD 0000-0002-5020-1180.
Tat’yana V. Varlamova — C. Sc. (Med.), associate professor of the Department of Pediatrics and Children’s Surgery, Petrozavodsk State Univerity; 33, Lenin av., Petrozavodsk, 185910, Russian Federation; ORCID iD 0000-0001-5617-8893.
Sergey V. Voronin — C. Sc. (Med.), Head of the Regional Medical Genetic Consultation, Regional Clinical Center of Specialized Medical Care; 30/37, Uborevich str., Vladivostok, 690091, Russian Federation; ORCID iD 0000-0002-9918-9565.
Natal’ya Yu. Vlasenko — C. Sc. (Med.), associate professor of the Department of Hospital Pediatrics with the Course of Additional Professional Education, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0001-5669-1718.
Elena M. Kochegurova — C. Sc. (Med.), associate professor of the Department of Polyclinic Pediatrics and Neonatology, Tver State Medical University; 4, Sovetskaya str., Tver, 170100, Russian Federation; Head of the Medical Genetic
Consultation, E.M. Bakunina Regional Clinical Perinatal
Center; 115 build. 3, Peterburgskoe road, Tver, 170036, Russian Federation; ORCID iD 0000-0002-8011-589X.
Aneta M. Mambetova — Dr. Sc. (Med.), professor of the Department of General Medical Training and Medical Rehabilitation, Kh.M. Berbekov Kabardian-Balkar State University; 173, Chernyshevskiy str., Nalchik, 360004, Russian Federation; ORCID iD 0000-0003-0378-0754.
Natal’ya L. Pechatnikova — C. Sc. (Med.), Head of Genetic Service, Morozov Children’s City Clinical Hospital; 1/9, 4th Dobryninskiy pass., Moscow, 119049, Russian Federation; ORCID iD 0000-0002-2445-132X.
Irina B. Sosnina — Deputy Head Doctor for Medical Work, Consultative Diagnostic Center for Children; 36 build. 2, Oleko Dundich str., St. Petersburg, 192289, Russian Federation; ORCID iD 0000-0002-0077-9435.
Olga V. Udalova — C. Sc. (Med.), geneticist of the Center of Medical Genetics, Privolzhsk Research Medical University; 10/1, Minin and Pozharskiy sq., Nizhniy Novgorod, 603005, Russian Federation; ORCID iD 0000-0002-8678-4349.
Elena B. Khramova — Dr. Sc. (Med.), Head of the Department of Children’s Diseases of the Pediatric Faculty, Tyumen State Medical University; 54, Odesskaya str., Tyumen, 625023, Russian Federation; ORCID iD 0000-0001-8968-3925.
Contact information: Irina B. Sosnina, e-mail: sosnina_kdcd@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 17.08.2021.
Revised 09.09.2021.
Accepted 04.10.2021.
2. Michigami T., Ohata Y., Fujiwara M. et al. Clinical practice guidelines for hypophosphatasia. Clin Pediatr Endocrinol. 2020;29(1):9–24. DOI: 10.1297/cpe.29.9.
3. Fraser D. Hypophosphatasia. Am J Med. 1957;22(5):730–746. DOI: 10.1016/0002-9343(57)90124-9.
4. Mornet E., Yvard A., Taillandier A. et al. A Molecular-Based Estimation of the Prevalence of Hypophosphatasia in the European Population. Ann Hum Genet. 2011;75(3):439–445. DOI: 10.1111/j.1469-1809.2011.00642.x.
5. Högler et al. Diagnostic delay is common among patients with hypophosphatasia: initial findings from a longitudinal, prospective, global registry. BMC Musculoskeletal Disorders. 2019;20:80.
6. Rockman-Greenberg C. Hypophosphatasia. Pediatr Endocrinol Rev. 2013;10(Suppl 2):380–388.
7. Иванов В.П., Сатанин Л.А., Ким А.В. и др. Неврологические и нейрохирургические аспекты гипофосфатазии. Педиатрическая фармакология. 2018;15(3):249–254. DOI: 10.15690/pf.v15i3.1905.
8. Соснина И.Б., Сукчев М.Б., Ивашикина Т.М. и др. Опыт ретроспективной диагностики гипофосфатазии у детей. РМЖ. 2016;26:1778–1781.
9. Saraff V., Narayanan V.K., Lawson A.J. et al. A diagnostic algorithm for children with low alkaline phosphatase activities: Lessons learned from laboratory screening for hypophosphatasia. J Pediatr. 2016;172:181–186.e1. DOI: 10.1016/j.jpeds.2016.01.045.
10. Баранов А.А., Намазова-Баранова Л.С., Савостьянов К.В. и др. Клинические рекомендации по диагностике и лечению гипофосфатазии у детей. Педиатрическая фармакология. 2016;13(6):539–543.
11. Whyte M.P. Hypophosphatasia. Pediatric bone. Academic Press. 2012;771–794.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
