Кардиометаболические особенности постковидного синдрома у лиц пожилого и старческого возраста с коморбидной патологией
Цель исследования: изучить некоторые кардиологические и метаболические особенности постковидного синдрома у пациентов пожилого и старческого возраста, имеющих коморбидные заболевания.
Материал и методы: в одномоментное сравнительное неинтервенционное исследование было включено 154 пациента с артериальной гипертонией (АГ), ишемической болезнью сердца (ИБС), фибрилляцией предсердий (ФП) и сахарным диабетом 2 типа (СД2) в возрасте 60–89 лет. Пациенты были сопоставимы по частоте, характеру коморбидных нозологий и разделены на 2 группы: 1-я группа включила 79 пациентов (66 [63; 73] лет) без анамнеза перенесенной новой коронавирусной инфекции и 2-я группа — 75 пациентов (65 [63; 72] лет) с перенесенной SARS-CoV-2-инфекцией легкой и среднетяжелой степени. Обследование осуществлялось через 20–24 нед. с момента дебюта COVID-19. В работе оценивались клинические, лабораторные и инструментальные параметры.
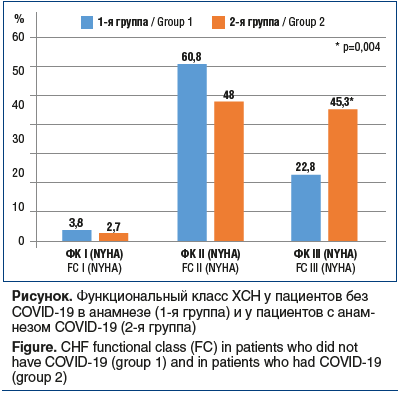
Результаты исследования: у пациентов 2-й группы в сравнении с пациентами 1-й группы с перенесенной новой коронавирусной инфекцией отмечаются более выраженные атерогенные сдвиги (общий холестерин сыворотки 5,44 [4,78; 6,90] ммоль/л против 5,02 [4,05; 5,76] ммоль/л (p=0,008), холестерин липопротеинов низкой плотности 3,11 [2,57; 4,58] ммоль/л против 2,57 [1,95; 3,11] ммоль/л (p<0,001), триглицериды 2,5 [1,53; 4] ммоль/л против 1,5 [1,09; 2,47] ммоль/л (p<0,001). Также во 2-й группе выше уровни глюкозы крови натощак — 8 [6,65; 11,4] ммоль/л против 6,3 [5,75; 8,1] ммоль/л (p<0,001) и ниже скорость клубочковой фильтрации — 63,8 [57,45; 78,34] мл/мин/1,73 м2 против 70,7 [62; 77,18] мл/мин/1,73 м2 (p=0,003). Выявлено более низкое диастолическое артериальное давление (АД) у пациентов с анамнезом SARS-CoV-2-инфекции (68 [60; 74] мм рт. ст. против 76 [69; 82] мм рт. ст. (p<0,001)) и более высокое систолическое АД (154 [141; 165] мм рт. ст. против 150 [143; 165] мм рт. ст. (p=0,009)), также обнаружена более высокая частота сердечных сокращений (ЧСС) у пациентов 2-й группы — 77 [73; 80] против 75 [67; 77] (p=0,002). Во 2-й группе определен больший диаметр аорты в восходящем отделе — 3,5 [3,35; 3,8] см против 3,4 [3,2; 3,7] см (p=0,003), выявлен более высокий функциональный класс (ФК) хронической сердечной недостаточности (ХСН) по NYHA с преобладанием III ФК ХСН у пациентов с перенесенным COVID-19 (45,3% против 22,8% (p=0,004)). Уровень NT-proBNP был статистически значимо выше у больных 2-й группы — 128,05 [85,12; 245,21] пг/мл против 88,4 [38,85; 131,85] пг/мл (p<0,001).
Заключение: выявлены неблагоприятные кардиометаболические сдвиги у пациентов 60–89 лет с АГ, ИБС, ФП, СД2 и анамнезом SARS-CoV-2-инфекции, в том числе проатерогенные липидные нарушения, гипергликемия, почечная дисфункция, высокое пульсовое АД и более высокая ЧСС. Несмотря на преобладание во 2-й группе пациентов с III ФК ХСН и более высокими средними значениями NT-proBNP, структурные маркеры ремоделирования миокарда между группами не различались, за исключением большего диаметра аорты в восходящем отделе у пациентов с анамнезом новой коронавирусной инфекции. Данные отличия можно рассматривать в рамках постковидного синдрома.
Ключевые слова: COVID-19, SARS-CoV-2, новая коронавирусная инфекция, постковидный синдром, состояние после COVID-19, кардиометаболические факторы, пожилой и старческий возраст, коморбидность.
Для цитирования: Старичкова А.А., Цыганкова О.В., Хидирова Л.Д., Лукинов В.Л., Литвиненко П.И., Старичков А.А. Кардиометаболические особенности постковидного синдрома у лиц пожилого и старческого возраста с коморбидной патологией. РМЖ. Медицинское обозрение. 2022;6(9):501-508. DOI: 10.32364/2587-6821-2022-6-9-501-508.
A.A. Starichkova1,2, O.V. Tsygankova1,3, L.D. Khidirova1,4, V.L. Lukinov5, P.I. Litvinenko6, A.A. Starichkov1
1Novosibirsk State Medical University, Novosibirsk, Russian Federation
2Novosibirsk Regional Hospital for War Veterans No. 2, Novosibirsk, Russian Federation
3Research Institute for Therapy and Preventive Medicine — Branch of the Federal Research Center Institute of Cytology and Genetics of the Siberian Branch of the RAS, Novosibirsk, Russian Federation
4Novosibirsk Regional Cardiologic Dispensary, Novosibirsk, Russian Federation
5Institute of Computational Mathematics and Mathematical Geophysics of the Siberian Branch of the RAS, Novosibirsk, Russian Federation
6Clinical Hospital "RZD-Meditsina" of the city of Novosibirsk, Novosibirsk, Russian Federation
Aim: to describe post-COVID-19 cardiometabolic disorders in elderly patients and senile with comorbidities.
Patients and Methods: this cross-sectional comparative non-interventional study included 154 patients aged 60–89 years with arterial hypertension (AH), ischemic heart disease (IHD), atrial fibrillation (AF) and type 2 diabetes mellitus (DM2). The patients had similar frequency and nosology of comorbidities. These patients were split into 2 groups: the first group consisting of 79 patients (66 [63; 73] years old) who did not have the novel coronavirus infection in the medical history and the second group consisting of 75 patients (65 [63; 72] years old) who survived mild or moderate SARS-CoV-2 infection. The examination was carried out within 20–24 weeks after the onset of COVID-19. Clinical, laboratory and instrumental parameters were analyzed in the present study.
Results: аs compared with group 1, patients from group 2 had a more pronounced atherogenic pattern (total cholesterol 5.44 [4.78; 6.9] mmol/l vs 5.02 [4.05; 5.76] mmol/l (p=0.008), low-density lipoprotein (LDL) — cholesterol 3.11 [2.57; 4.58] mmol/l vs 2.57 [1.95; 3.11] mmol/l (p<0.001), triglycerides 2.5 [1.53; 4] mmol/l vs 1.5 [1.09; 2.47] mmol/l (p<0.001). Also, in group 2 fasting blood glucose levels were higher — 8 [6.65; 11.4] mmol/l vs 6.3 [5.75; 8.1] mmol/l (p<0.001) and glomerular filtration rate was lower 63.8 [57.45; 78.34] ml/min/1.73 m2 vs 70.7 [62; 77.18] ml/min/1.73 m2 (p=0.003). Lower diastolic blood pressure (68 [60; 74] mmHg vs 76 [69; 82] mmHg (p<0.001)) and higher systolic blood pressure (154 [141; 165] mmHg 150 [143; 165] mmHg (p=0.009) was found in patients who had SARS-CoV-2 infection in their medical history. Also, group 2 patients had a higher heart rate — 77 [73; 80] vs 75 [67; 77] beats per min (p=0.002). In addition, a larger diameter of ascending aorta was revealed in patients with the previous COVID-19 infection: 3.5 [3.35; 3.8] cm vs 3.4 [3.2; 3.7] cm (p=0.003). Patients who survived COVID-19 had a higher functional class (FC) of chronic heart failure (CHF) (NYHA) with the predominance of III FC (45.3% vs 22.8% (p=0.004). Group 2 patients compared with group 1 patients had a significantly higher level of NT-proBNP: 128.05 [85.12; 245.21] pg/ml vs 88.4 [38.85; 131.85] pg/ml (p<0.001). Conclusion: adverse cardiometabolic sequela, such as proatherogenic changes in lipid metabolism, hyperglycemia, renal dysfunction, high pulse pressure and a higher heart rate, were found in patients aged 60–89 years with AH, IHD, AF and DM2 who had SARS-CoV-2 infection in their medical history. Despite the prevalence of patients with III FC CHF and higher mean values of NT-proBNP in group 2, the structural markers of myocardial remodeling between the two groups did not differ, except for a larger diameter of ascending aorta in patients who survived the novel coronavirus infection. These differences can be considered as a part of the post-COVID-19 syndrome.
Keywords: COVID-19, SARS-CoV-2, novel coronavirus infection, post-COVID-19 syndrome, post-COVID-19 condition, cardiometabolic factors, elderly and senile age, comorbidities.
For citation: Starichkova A.A., Tsygankova O.V., Khidirova L.D. et al. Cardiometabolic characteristics of post-COVID-19 syndrome in elderly and senile patients with comorbidities. Russian Medical Inquiry. 2022;6(9):501–508 (in Russ.). DOI: 10.32364/2587-6821-2022-6-9-501-508.
Введение
По состоянию на конец мая 2022 г. во всем мире зарегистрировано свыше 521 млн подтвержденных случаев COVID-19, в том числе более 6 млн — с летальным исходом. Со второй половины января 2022 г. отмечается тенденция к снижению числа лиц, инфицированных вирусомSARS-CoV-2, но в то же время увеличивается количество лиц с отдаленными последствиями перенесенной новой коронавирусной инфекции и верификацией «состояния после COVID-19» (U09 по МКБ-10). 6 октября 2021 г. ВОЗ представила первое определение постковидного синдрома, дефинировав его как состояние, которое развивается у лиц с анамнезом вероятной или подтвержденной инфекции, вызванной вирусом SARS-CoV-2, как правило, в течение 3 мес. от момента ее дебюта, которое характеризуется наличием симптомов на протяжении не менее 2 мес., а также невозможностью их объяснения альтернативным диагнозом [1, 2]. В ряде исследований, затрагивающих постковидный синдром, подчеркивается уязвимость полиморбидных пациентов, лиц старше 60 лет, усугубление на его фоне кардиоваскулярных и эндокринных дисфункций [3–7].
Уже в начале XXI в. было показано, что пациенты, выздоровевшие от атипичной пневмонии, вызванной SARS-CoV-1, имели большую частоту сердечно-сосудистых заболеваний (ССЗ), нарушений липидного обмена и метаболизма глюкозы через 12 лет наблюдения по сравнению с контрольной группой [8]. Спектр патологии сердечно-сосудистой системы после перенесенной коронавирусной инфекции, вызванной SARS-CoV-2, в том числе возникновение de novo и усугубление течения предсуществующей, достаточно широк: сердечная недостаточность (СН), аритмии, внезапная сердечная смерть, ишемическая болезнь сердца (ИБС), формирование аневризм коронарных артерий и аорты, артериальная гипертония (АГ), лабильная частота сердечных сокращений (ЧСС), ускорение процессов атерогенеза и т. д. [9]. Это находит отражение в увеличении обращаемости пациентов за внеплановой медицинской помощью и повышении уровня летальности среди лиц, перенесших новую коронавирусную инфекцию, в постгоспитальном периоде [3, 10].
Сердечно-сосудистые осложнения, ассоциированные с коронавирусной инфекцией, могут манифестировать после реконвалесценции, но возможна их персистенция с момента развития заболевания. Кроме того, встречается и вариант рецидивирования симптомов с течением времени [2, 11]. Минимальное число симптомов и признаков, необходимых для диагноза «состояние после COVID-19», не определено, соответственно, имеется множество вопросов, касающихся патогенеза, частоты встречаемости, профилактики, диагностики и лечения постковидного синдрома [2, 12].
Цель исследования: изучить некоторые кардиологические и метаболические особенности постковидного синдрома у пациентов пожилого и старческого возраста, имеющих коморбидные заболевания.
Материал и методы
В одномоментное сравнительное неинтервенционное исследование было включено 154 коморбидных пациента мужского и женского пола, которые были разделены на 2 группы: в 1-ю группу вошло 79 пациентов (66 [63; 73] лет) без анамнеза перенесенной новой коронавирусной инфекции и во 2-ю группу — 75 пациентов (65 [63; 72] лет) с перенесенной SARS-CoV-2-инфекцией легкой и среднетяжелой степени тяжести (вирус идентифицирован как минимум однократно по наличию РНК SARS-CoV-2 в мазке из носоглотки и ротоглотки методом полимеразной цепной реакции). Мужчин в 1-й группе было 42 (53,2%) человека, во 2-й группе — 46 (61,3%) человека.
Критерии включения в исследование: возраст пациентов 60–89 лет; наличие ИБС, АГ, фибрилляции предсердий (ФП) и сахарного диабета 2 типа (СД2); для 2-й группы дополнительно — наличие подтвержденного инфицирования SARS-CoV-2 за 20–24 нед. до момента включения в исследование. Пациенты были сопоставимы по частоте, характеру коморбидных нозологий, числу принимавших статины, антигипертензивные и ритмурежающие лекарственные средства.
Критерии невключения в исследование: симптоматическая артериальная гипертония; стенокардия напряжения IV функционального класса (ФК); острый коронарный синдром в течение года до включения в исследование; хроническая болезнь почек 4–5-й стадии; хроническая обструктивная болезнь легких; анемия; выраженная патология опорно-двигательного аппарата; злокачественные новообразования; хронические заболевания в стадии обострения; острые инфекционные заболевания; психические заболевания; алкоголизм, наркомания.
Исследование проведено в соответствии со стандартами надлежащей клинической практики и принципами Хельсинкской декларации, протокол был одобрен этическим комитетом ФГБОУ ВО НГМУ Минздрава России. Все пациенты дали добровольное информированное согласие на участие.
Проводилось общеклиническое обследование, в том числе измерение артериального давления (АД), ЧСС за 1 минуту, тест с шестиминутной ходьбой для оценки ФК хронической сердечной недостаточности (ХСН), согласно классификации сердечной недостаточности Нью-Йоркской кардиологической ассоциации (NYHA). Проведены лабораторные (липидный спектр крови, уровень глюкозы крови натощак, скорость клубочковой фильтрации (СКФ), калий крови, NT-proBNP) и инструментальные (эхокардиография (ЭхоКГ) на аппарате фирмы Acuson Aspen (США)) исследования.
Оценка АД проводилась в медицинской организации (офисное АД) с расчетом средних цифр двух последних измерений из трех проводимых в области плеча на руке с более высоким АД [13]. Диагностика ХСН осуществлялась согласно клиническим рекомендациям Минздрава России по хронической сердечной недостаточности (2020) [14]. В биохимическом анализе крови, взятой утром натощак, оценивались следующие показатели: общий холестерин (ОХС); холестерин липопротеинов низкой плотности (ХС ЛПНП); холестерин липопротеинов высокой плотности (ХС ЛПВП); триглицериды (ТГ); глюкоза; креатинин с расчетом СКФ по формуле CKD-EPI (мл/мин/1,73 м2); калий; биомаркер фиброза и ремоделирования миокарда — натрийуретический пептид (NT-proBNP) (реагенты «Вектор-Бест», г. Новосибирск, Россия). Нормальным уровнем NT-proBNP считали значение менее 125 пг/мл.
Статистическая обработка данных проводилась в программе RStudio (версия 2021.09.2 Build 382 — © 2009–2022 RStudio, Inc., USA, URL https://www.rstudio.com/) на языке R (версия 4.0.2, URL https://www.R-project.org/). Дескриптивные характеристики представлены в виде медианы [первый квартиль; третий квартиль] для числовых данных, процента с вычислением границ доверительных интервалов (ДИ) [нижняя граница 95% ДИ; верхняя граница 95% ДИ] для категориальных данных. Для статистической проверки гипотез о равенстве числовых характеристик выборочных распределений в сравниваемых группах использовался U-критерий Манна — Уитни, производился расчет смещения распределений с построением 95% ДИ для смещения. Проверка статистических гипотез проводилась при критическом уровне значимости р=0,05, т. е. различие считалось статистически значимым при p<0,05.
Результаты исследования
В группе пациентов с анамнезом новой коронавирусной инфекции нами обнаружены проатерогенные сдвиги липидного профиля, в частности уровни ОХС, ХС ЛПНП и ТГ были статистически значимо выше (табл. 1). В дополнение отмечается тенденция к более низким показателям ХС ЛПВП во 2-й группе, которые, однако, не достигли статистической значимости различий. Кроме этого, выявлено, что на фоне различной сахароснижающей терапии у пациентов 2-й группы регистрируются более высокие уровни глюкозы крови натощак (p<0,001). СКФ была статистически значимо ниже в группе пациентов с перенесенной ранее новой коронавирусной инфекцией. Уровни калия во 2-й и 1-й группах статистически значимых отличий не имели.
![Таблица 1. Кардиометаболические и морфофункциональные показатели Table 1. Cardiometabolic and morphofunctional indicators (Mе [Q1; Q3]) Таблица 1. Кардиометаболические и морфофункциональные показатели Table 1. Cardiometabolic and morphofunctional indicators (Mе [Q1; Q3])](/upload/medialibrary/437/494-6.png)
При оценке гемодинамических показателей отмечено более низкое диастолическое АД (ДАД) у пациентов после перенесенного COVID-19 в сравнении с пациентами 1-й группы. Наряду с этим во 2-й группе отмечались бо́льшие цифры систолического АД (САД) в сравнении с пациентами 1-й группы. Статистическая значимость была достигнута для САД и ДАД. В целом выявлено превышение целевых значений САД для лиц пожилого и старческого возраста (≥140 мм рт. ст.) у 80% [70%; 87%] в 1-й группе против 79% [68%; 86%] во 2-й группе (р=0,862). Превышение ДАД ≥80 мм рт. ст. отмечено у 42% [32%; 53%] обследованных без анамнеза COVID-19 и у 12% [6%; 21%] с анамнезом COVID-19 (p<0,001), напротив, снижение ДАД <70 мм рт. ст. — у 30% [21%; 41%] и 57% [46%; 68%] в 1-й и во 2-й группе соответственно (p=0,001). Пульсовое АД ≥60 мм рт. ст. в 1-й группе зарегистрировано у 78% [68%; 86%] против 89% [80%; 94%] во 2-й группе (p=0,082). При оценке ЧСС отмечено, что во 2-й группе медиана ЧСС была статистически выше, чем в 1-й группе.
Во 2-й группе в сравнении с 1-й группой статистически значимо чаще встречались пациенты с III ФК ХСН и реже с I и II ФК (см. рисунок). У обследованных нами пожилых пациентов с АГ, ИБС, ФП и СД2, перенесших COVID-19, отмечен более высокий показатель NT-proBNP в сравнении с нормальными уровнями его медианных значений у пациентов без перенесенной новой коронавирусной инфекции (p<0,001). Несмотря на преобладание во 2-й группе пациентов с III ФК ХСН и более высокими средними значениями NT-proBNP, структурные маркеры ремоделирования миокарда между группами значимо не различались, за исключением бÓльшего диаметра аорты в восходящем отделе у пациентов, перенесших COVID-19. Фракция выброса левого желудочка (ФВ ЛЖ) у пациентов 1-й группы не отличалась от таковой у пациентов 2-й группы.
В таблице 2 представлена лекарственная терапия в 1-й и 2-й группах. Частота назначения статинов была паритетной (р>0,999). В обеих группах пациенты принимали ритмурежающие препараты по поводу ИБС, ФП, ХСН, в том числе β-адреноблокаторы, амиодарон, соталол, дигоксин, различаясь лишь бÓльшей частотой назначения амиодарона у пациентов с перенесенной новой коронавирусной инфекцией (р=0,014).
![Таблица 2. Терапия, которую получали пациенты (% [95% ДИ]) Table 2. Therapy received by patients (% [95% confidence interval] Таблица 2. Терапия, которую получали пациенты (% [95% ДИ]) Table 2. Therapy received by patients (% [95% confidence interval]](/upload/medialibrary/6f0/494-7.png)
Обсуждение
Проатерогенные сдвиги у пациентов с перенесенной новой коронавирусной инфекцией имеют мало подтверждений в научной литературе. S.H. Loosen et al. [15] определили, что дислипидемия, ожирение и принадлежность к старшим возрастным группам являются значимыми факторами риска развития постковидного синдрома. В литературе преимущественно встречаются публикации о динамике уровня липидов в острой фазе инфекции в сторону снижения, и, напротив, в постковидный период отмечено повышение уровня липидов до исходного или выше [12, 16–19]. Выявленные в нашем исследовании более низкие значения ДАД и более высокие значения САД, наряду с повышенным пульсовым АД у пациентов с ранее перенесенным COVID-19, свидетельствуют о наличии дополнительных гемодинамических факторов риска ССЗ, в том числе об увеличении сосудистой жесткости, ассоциированной с высоким пульсовым АД. Высокое пульсовое АД (≥60 мм рт. ст.) у пожилых можно расценивать как поражение органов-мишеней, согласно клиническим рекомендациям по артериальной гипертензии у взрослых (2020) [13].
Вероятно, постковидный период характеризуется преждевременным сосудистым старением, которое проявляется в виде увеличения артериальной жесткости, артериосклероза, эндотелиальной дисфункции, провоспалительной активности и прогрессированием липидных нарушений [13, 20, 21]. Известно, что скорость естественного расширения аорты в течение каждого десятилетия составляет около 0,9 мм для мужчин и 0,7 мм для женщин, эскалируя риски формирования аневризмы аорты на завершающем этапе жизни. Медленное, но прогрессивное расширение аорты рассматривается как результат старения, связанного как с диспропорциональным соотношением коллагена и эластина, так и с повышением жесткости сосудов, являясь маркером сосудистого возраста подобно увеличению пульсового давления, о котором упоминалось ранее [22]. В нашем исследовании выявлен бÓльший диаметр восходящего отдела аорты после перенесенного COVID-19, который, вероятно, имеет патологический механизм в отличие от естественного, описанного выше, и может ассоциироваться с увеличенным риском развития аневризм сосудистого русла, накладываясь на естественные механизмы сосудистого старения. В то же время, согласно методическим рекомендациям «Особенности течения Long-COVID инфекции. Терапевтические и реабилитационные мероприятия» (2021), у пациентов после перенесенной коронавирусной инфекции могут формироваться аневризмы коронарных артерий и аорты [9].
Повышенная ЧСС во 2-й группе может быть ассоциирована с повышенным тонусом симпатической нервной системы за счет гипоксии и затяжного воспалительного статуса, а также с гиперактивностью синусового узла и влиянием воспалительных цитокинов на ионные каналы миокарда. Ряд авторов, учитывая высокую частоту встречаемости тахикардии после перенесенной новой коронавирусной инфекции, вводят термин «синдром постковидной тахикардии». Сохранение повышенной ЧСС и способы ее фармакотерапии после COVID-19 активно обсуждаются в литературе [23–27].
Известно, что к развитию ХСН приводят ИБС, АГ, СД, аритмии и их сочетание, особенно у лиц пожилого возраста [28]. Большая частота ХСН III ФК по NYHA отмечена нами в группе пациентов с перенесенным COVID-19, что подтверждается высокими уровнями маркера фиброза и ремоделирования миокарда — NT-proBNP во 2-й группе. Снижение ФВ ЛЖ не было отмечено, что, вероятно, связано с непродолжительным течением постковидного периода у исследуемых лиц и преобладанием процессов (в том числе воспаления), вызывающих формирование диастолической дисфункции. Ранее в ряде работ было продемонстрировано, что COVID-19 может усугублять течение ХСН, а также приводить к развитию этого состояния de novo [3, 29].
Международная группа ведущих исследователей в области диабетологии создала глобальный реестр диабета, связанного с COVID-19, — CoviDiab Registry, в котором оценивается впервые выявленный СД, ассоциированный с COVID-19, и декомпенсация уже имеющегося СД [30]. Повышение уровня глюкозы плазмы натощак во 2-й группе, вероятно, имеет множественные причины: предшествующая терапия глюкокортикостероидами в острый период и во время реконвалесценции; длительное сохранение провоспалительного статуса (в том числе повышенных уровней цитокинов) после завершения инфекционного процесса; непосредственное влияние SARS-CoV-2 и противовирусных препаратов на β-клетки поджелудочной железы и печень, которая и определяет преимущественно уровни гликемии натощак [7, 31, 32]. Множественность патогенетических механизмов и высокая частота встречаемости диабета, ассоциированного с новой коронавирусной инфекцией, подчеркивает важность мониторинга гликемии не только в остром периоде инфекции, но и при отсроченном наблюдении [3, 7, 9, 33, 34]. Некоторым ограничением проведенного нами исследования является отсутствие определения гликированного гемоглобина.
Заключение
У пациентов пожилого и старческого возраста, имеющих АГ, ИБС, ФП, СД2 и инфицированных вирусом SARS-CoV-2 за 20–24 нед. до включения в исследование, в сравнении с сопоставимыми по коморбидным заболеваниям сверстниками без анамнеза SARS-CoV-2-инфекции зарегистрированы неблагоприятные кардиоренометаболические и гемодинамические особенности, заключающиеся в наличии атерогенной дислипидемии, неконтролируемой гипергликемии, бÓльшей частоте встречаемости клинических и лабораторных маркеров выраженной ХСН, более высоких показателях пульсового АД и ЧСС, большем диаметре восходящего отдела аорты и, напротив, более низких значениях СКФ. Подобные изменения можно отнести к постковидному синдрому при условии исключения альтернативного диагноза, с индивидуальным объемом углубленных исследований и выработкой дальнейшей тактики ведения пациента с приоритетной курацией ведущих хронических неинфекционных заболеваний — АГ, ИБС, ФП и СД2, согласно соответствующим клиническим рекомендациям.
Сведения об авторах:
Старичкова Анастасия Алексеевна — старший лаборант кафедры неотложной терапии с эндокринологией и профпатологией ФПК и ППВ ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; врач-терапевт ГБУЗ НСО «НОГ № 2 ВВ»; 630005, Россия, г. Новосибирск, ул. Семьи Шамшиных, д. 95а; ORCID iD 0000-0002-8093-2371.
Цыганкова Оксана Васильевна — д.м.н., профессор кафедры неотложной терапии с эндокринологией и профпатологией ФПК и ППВ ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; старший научный сотрудник лаборатории клинических биохимических и гормональных исследований терапевтических заболеваний НИИТПМ — филиала ИЦиГ СО РАН; 630089, Россия, г. Новосибирск, ул. Б. Богаткова, д. 175/1; ORCID iD 0000-0003-0207-7063.
Хидирова Людмила Даудовна — д.м.н., профессор кафедры фармакологии, клинической фармакологии и доказательной медицины ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; врач-кардиолог ГБУЗ НСО НОККД; 630047, Россия, г. Новосибирск, ул. Залесского, д. 6, корп. 8; ORCID iD 0000-0002-1250-8798.
Лукинов Виталий Леонидович — к.ф.-м.н., старший научный сотрудник, заведующий лабораторией численного анализа стохастических дифференциальных уравнений ИВМиМГ СО РАН; 630090, г. Новосибирск, пр-т Академика Лаврентьева, д. 6; ORCID iD 0000-0002-3411-508X.
Литвиненко Полина Игоревна — врач — клинический фармаколог ЧУЗ «КБ «РЖД-Медицина» г. Новосибирск»; 630003, Россия, г. Новосибирск, Владимировский спуск, д. 2а; ORCID iD 0000-0002-5823-2555.
Старичков Алексей Алексеевич — д.м.н., профессор кафедры неотложной терапии с эндокринологией и профпатологией ФПК и ППВ ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; ORCID iD 0000-0001-6467-4256. Контактная информация: Цыганкова Оксана Васильевна, е-mail: oksana_c.nsk@mail.ru.
Источник финансирования: работа частично выполнена по государственному заданию в рамках бюджетной темы, рег. № 122031700094-5.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 01.06.2022.
Поступила после рецензирования 27.06.2022.
Принята в печать 20.07.2022.
About the authors:
Anastasia A. Starichkova — senior technician of the Department of Emergency Therapy with Endocrinology and Occupational Pathology, Faculty of Advanced Training and Professional Retraining of Physicians, Novosibirsk State Medical University; 52, Krasnyi prospect, Novosibirsk, 630091, Russian Federation; therapist of Novosibirsk Regional Hospital for War Veterans No. 2; 95a, Shamshiny Family str., Novosibirsk, 630005, Russian Federation; ORCID iD 0000-0002-8093-2371.
Oksana V. Tsygankova — Dr. Sc. (Med.), Professor of the Department of Emergency Therapy with Endocrinology and Occupational Pathology, Faculty of Advanced Training and Professional Retraining of Physicians, Novosibirsk State Medical University; 52, Krasnyi prospect, Novosibirsk, 630091, Russian Federation; senior researcher of the Laboratory of clinical biochemistry and hormonal tests of internal diseases, Research Institute for Therapy and Preventive Medicine — Branch of the Federal Research Center Institute of Cytology and Genetics of the Siberian Branch of the RAS; 175/1, B. Bogatkov str., Novosibirsk, 630089, Russian Federation; ORCID iD 0000-0003-0207-70.
Ludmila D. Khidirova — Dr. Sc. (Med.), Professor of the Department of pharmacology, clinical pharmacology and evidence-based medicine, Novosibirsk State Medical University; 52, Krasnyi prospect, Novosibirsk, 630091, Russian Federation; cardiologist of the Novosibirsk Regional Cardiologic Dispensary; 6, Bldn. 8, Zalessky str., Novosibirsk, 630047, Russian Federation; ORCID iD 0000-0002-1250-8798.
Vitaliy L. Lukinov — C. Sc. (Physics & Math.), senior researcher, head of the laboratory of numerical analysis of stochastic differential equations, Institute of Computational Mathematics and Mathematical Geophysics of the Siberian Branch of the RAS; 6, Academician Lavrent’ev av., Novosibirsk, 630090, Russian Federation; ORCID iD 0000-0002-3411-508X.
Polina I. Litvinenko — clinical pharmacologist, Clinical Hospital "RZD-Meditsina" of the city of Novosibirsk; 2a, Vladimirovsky slope, Novosibirsk, 630003, Russian Federation; ORCID iD 0000-0002-5823-2555.
Aleksey A. Starichkov — Dr. Sc. (Med.), Professor of the Department of Emergency Therapy with Endocrinology and Occupational Pathology, Faculty of Advanced Training and Professional Retraining of Physicians, Novosibirsk State Medical University; 52, Krasnyi prospect, Novosibirsk, 630091, Russian Federation; ORCID iD 0000-0001-6467-4256.
Contact information: Oksana V. Tsygankova, е-mail: oksana_c.nsk@mail.ru.
Funding source: the study was partly carried out under the State Assignment within Budget Topic, Reg. No. 122031700094-5.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 01.06.2022.
Revised 27.06.2022.
Accepted 20.07.2022.
2. World Health Organization. A clinical case definition of post COVID-19 condition by a Delphi consensus. 6 October 2021. (Electronic resource.) URL: https://apps.who.int/iris/bitstream/handle/10665/345824/WHO-2019-nCoV-Post-COVID-19-condition-Clinical-case-definition-2021.1-rus.pdf (access date: 01.05.2022).
3. Арутюнов Г.П., Тарловская Е.И., Арутюнов А.Г. и др. Клинические особенности постковидного периода. Результаты международного регистра «Анализ динамики коморбидных заболеваний у пациентов, перенесших инфицирование SARS-CoV-2 (АКТИВ SARSCoV-2)». Предварительные данные (6 месяцев наблюдения). Российский кардиологический журнал. 2021;26(10):4708. DOI: 10.15829/1560-4071-2021-4708.
4. Lopez-Leon S., Wegman-Ostrosky T., Perelman C. et al. More than 50 long-term effects of COVID-19: a systematic review and meta-analysis. Sci Rep. 2021;11(1):16144. DOI: 10.1038/s41598-021-95565-8.
5. Michelen M., Manoharan L., Elkheir N. et al. Characterising long COVID: a living systematic review. BMJ Global Health. 2021;6:e005427. DOI: 10.1136/bmjgh-2021-005427.
6. Cabrera Martimbianco A.L., Pacheco R.L., Bagattini Â.M., Riera R. Frequency, signs and symptoms, and criteria adopted for long COVID- 19: A systematic review. Int J Clin Pract. 2021;75:e14357. DOI: 10.1111/ijcp.14357.
7. Ojo O., Wang X.H., Ojo O.O. et al. The Effects of COVID-19 Lockdown on Glycaemic Control and Lipid Profile in Patients with Type 2 Diabetes: A Systematic Review and Meta-Analysis. Int J Environ Res Public Health. 2022;19(3):1095. DOI: 10.3390/ijerph19031095.
8. Wu Q., Zhou L., Sun X. et al. Altered Lipid Metabolism in Recovered SARS Patients Twelve Years after Infection. Sci Rep. 2017;7(1):9110. DOI: 10.1038/s41598-017-09536-z.
9. Методические рекомендации «Особенности течения Long-COVID инфекции. Терапевтические и реабилитационные мероприятия» (утверждены на ХVI Национальном конгрессе терапевтов 18.11.2021). Под ред. Мартынова А.И., Горелова А.В., Малявина А.Г. и др. (Электронный ресурс.) URL: https://www.rnmot.ru/public/uploads/2022/rnmot/МЕТОДИЧЕСКИЕ%20РЕКОМЕНДАЦИИ.pdf (дата обращения: 01.05.2022).
10. Бойцов С.А. Грипп, новая коронавирусная инфекция и сердечно-сосудистые заболевания. Кардиологический вестник. 2021;16(1):5–9. DOI: 10.17116/Cardiobulletin2021160115.
11. Бубнова М.Г., Аронов Д.М. COVID-19 и сердечно-сосудистые заболевания: от эпидемиологии до реабилитации. Пульмонология. 2020;30(5):688–699. DOI: 10.18093/0869-0189-2020-30-5-688-699.
12. Старичкова А.А., Цыганкова О.В., Хидирова Л.Д. и др. Кардиометаболические нарушения при SARS-CoV-2-инфекции и постковидном синдроме. Лечащий Врач. 2022;3:49–58. DOI: 10.51793/OS.2022.25.3.008.
13. Клинические рекомендации. Артериальная гипертензия у взрослых. 2020.
14. Клинические рекомендации. Хроническая сердечная недостаточность. 2020.
15. Loosen S.H., Jensen B.O., Tanislav C. et al. Obesity and lipid metabolism disorders determine the risk for development of long COVID syndrome: a cross-sectional study from 50,402 COVID-19 patients. Infection. 2022;50(5):1165–1170. DOI: 10.1007/s15010-022-01784-0.
16. Casari I., Manfredi M., Metharom P., Falasca M. Dissecting lipid metabolism alterations in SARS-CoV-2. Prog Lipid Res. 2021;82:101092. DOI: 10.1016/j.plipres.2021.101092.
17. Surma S., Banach M., Lewek J. COVID-19 and lipids. The role of lipid disorders and statin use in the prognosis of patients with SARS-CoV-2 infection. Lipids Health Dis. 2021;20(1):141. DOI: 10.1186/s12944-021-01563-0.
18. Alketbi E.H., Hamdy R., El-Kabalawy A. et al. Lipid-based therapies against SARS-CoV-2 infection. Rev Med Virol. 2021;31(5):1–13. DOI: 10.1002/rmv.2214.
19. Sorokin A.V., Karathanasis S.K., Yang Z.H. et al. COVID-19-Associated dyslipidemia: Implications for mechanism of impaired resolution and novel therapeutic approaches. FASEB J. 2020;34(8):9843–9853. DOI: 10.1096/fj.202001451.
20. Bavishi C., Goel S., Messerli F.H. Isolated Systolic Hypertension: An Update After SPRINT. Am J Med. 2016;129(12):1251–1258. DOI: 10.1016/j.amjmed.2016.08.032.
21. Хидирова Л.Д., Федорук В.А., Васильев К.О. Роль новой коронавирусной инфекции, вызванной вирусом SARS-CoV-2, в манифестации мультисистемного воспалительного синдрома. Профилактическая медицина. 2021;24(6):110–115. DOI: 10.17116/profmed202124061110.
22. Рекомендации ESC по диагностике и лечению заболеваний аорты. 2014. Российский кардиологический журнал. 2015;7(123):7–72. DOI: 10.15829/1560-4071-2015-07-7-72.
23. Дорофеева Г.Б., Дорофеев В.И., Трофимова Ю.В. Роль гиперактивности симпатической нервной системы в развитии сердечно-сосудистых заболеваний и возможности фармакологической коррекции. Системные гипертензии. 2012;1:18–23.
24. Арутюнов А.Г., Арутюнов Г.П., Тарловская Е.И. и др. Особенности терапии бета-адреноблокаторами и блокаторами кальциевых каналов у пациентов с сердечно-сосудистой патологией в постковидном периоде. Лечащий Врач. 2021;12(24):46–54. DOI: 10.51793/OS.2021.24.12.007.
25. Desai A.D., Boursiquot B.C., Melki L., Wan E.Y. Management of Arrhythmias Associated with COVID-19. Curr Cardiol Rep. 2020;23(1):2. DOI: 10.1007/s11886-020-01434-7.
26. Lazzerini P.E., Laghi-Pasini F., Boutjdir M., Capecchi P.L. Cardioimmunology of arrhythmias: the role of autoimmune and inflammatory cardiac channelopathies. Nat Rev Immunol. 2019;19(1):63–64. DOI: 10.1038/s41577-018-0098-z.
27. Ståhlberg M., Reistam U., Fedorowski A. et al. Post-COVID-19 Tachycardia Syndrome: A Distinct Phenotype of Post-Acute COVID-19 Syndrome. Am J Med. 2021;134(12):1451–1456. DOI: 10.1016/j.amjmed.2021.07.004.
28. Орлова Я.А., Ткачёва О.Н., Арутюнов Г.П. и др. Особенности диагностики и лечения хронической сердечной недостаточности у пациентов пожилого и старческого возраста. Мнение экспертов Общества специалистов по сердечной недостаточности, Российской ассоциации геронтологов и гериатров и Евразийской ассоциации терапевтов. Кардиология. 2018;58(S12):42–72. DOI: 10.18087/cardio.2560.
29. Ramadan M.S., Bertolino L., Zampino R., Durante-Mangoni E.; Monaldi Hospital Cardiovascular Infection Study Group. Cardiac sequelae after coronavirus disease 2019 recovery: a systematic review. Clin Microbiol Infect. 2021;27(9):1250–1261. DOI: 10.1016/j.cmi.2021.06.015.
30. VIDIAB registry. (Electronic resource.) URL: https://covidiab.e-dendrite.com/ (access date: 01.05.2022).
31. Цыганкова О.В., Бадин А.Р., Старичков А.А., Ложкина Н.Г. Неалкогольная жировая болезнь печени — болезнь цивилизации или синдром современности? РМЖ. Медицинское обозрение. 2018;2(3):23–28.
32. Цыганкова О.В., Соколова Т.А., Латынцева Л.Д., Воевода С.М. Синдром холестаза в практике врача-интерниста. РМЖ. Медицинское обозрение. 2017;1(2):110–112.
33. Raveendran A.V., Misra A. Post COVID-19 Syndrome («Long COVID") and Diabetes: Challenges in Diagnosis and Management. Diabetes Metab Syndr. 2021;15(5):102235. DOI: 10.1016/j.dsx.2021.102235.
34. Аметов А.С., Камынина Л.Л. Динамика углеводного обмена, ассоциированная с COVID-19 (роль и место флеш-мониторирования гликемии). Эндокринология: новости, мнения, обучение. 2021;10(1):78–87. DOI: 10.33029/2304-9529-2021-10-1-78-87.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.