Динамика лабораторных показателей атерогенеза у больных субклиническим гипотиреозом на фоне заместительной терапии левотироксином
Субклинический гипотиреоз (СГ) является фактором сердечно-сосудистого риска. Остается спорным вопрос о целесообразности назначения левотироксина натрия пациентам с СГ для профилактики сердечно-сосудистых осложнений в будущем. Поэтому до настоящего момента не разработан четкий алгоритм назначения препаратов левотироксина при СГ.
Цель исследования: изучить лабораторные показатели атерогенеза у молодых больных с субклиническим гипотиреозом и эффективность заместительной терапии левотироксином.
Материал и методы: проведено открытое рандомизированное проспективное исследование по изучению динамики лабораторных показателей атерогенеза у больных СГ на фоне терапии левотироксином. В исследование включено 84 пациента с СГ. Группу контроля составили 22 здоровых человека. Пациенты с СГ были рандомизированы на группу лечения левотироксином и группу наблюдения. Доза левотироксина натрия в группе лечения составляла от 25 до 75 мкг (в среднем 38,00±14,18 мкг). Всем включенным в исследование пациентам определяли показатели липидного спектра крови, уровень гомоцистеина в сыворотке, концентрацию антител класса IgG к липлпротеинам низкой плотности (ЛПНП) в сыворотке крови исходно и в динамике.
Результаты исследования: средний возраст больных СГ составил 37,32±8,62 года. У больных с уровнем ТТГ≥7 мМЕ/л концентрация общего холестерина (ОХ), антител к окисленным ЛПНП (окЛПНП) (АТ-окЛПНП) и гомоцистеина была значимо выше, чем у здоровых лиц (р<0,05). У больных СГ на фоне заместительной терапии левотироксином при достижении целевых значений ТТГ выявлено значимое уменьшение уровня ОХ (р<0,0001), АТ-окЛПНП (р=0,005) и гомоцистеина (р=0,0006). В группе лечения через 1 год наблюдалось значимое уменьшение концентрации АТ-окЛПНП IgG (р=0,0026) и гомоцистеина (р=0,0033) по сравнению с группой наблюдения.
Заключение: у больных СГ с уровнем ТТГ≥7 мМЕ/л концентрация ОХ, АТ-окЛПНП и гомоцистеина была значимо выше, чем в группе здоровых лиц. Заместительная терапия у больных СГ препаратами левотироксина в течение 1 года приводила к значимому снижению содержания АТ-окЛПНП и гомоцистеина по сравнению с исходными значениями.
Ключевые слова: субклинический гипотиреоз, сердечно-сосудистый риск, тиреотропный гормон, левотироксин, липидограмма, гомоцистеин.
Для цитирования: Волкова А.Р., Дыгун О.Д., Лукичев Б.Г., Галкина О.В., Левыкина Е.Н., Абрамова И.М., Алламова Г.Г. Динамика лабораторных показателей атерогенеза у больных субклиническим гипотиреозом на фоне заместительной терапии левотироксином. РМЖ. Медицинское обозрение. 2019;3(10(II)):82-85.
A.R. Volkova, O.D. Dygun, B.G. Lukichev, O.V. Galkina, E.N. Levykina, I.M. Abramova, G.G. Allamova
Pavlov First Saint Petersburg State Medical University
Subclinical hypothyroidism is a cardiovascular risk factor. It is still disputable whether sodium levothyroxine should be prescribed in subclinical hypothyroidism to prevent cardiovascular complications. As a result, there is no clear algorithm for the prescription of levothyroxine in subclinical hypothyroidism.
Aim: to study laboratory parameters of atherogenesis in younger patients with subclinical hypothyroidism and to assess the efficacy of levothyroxine replacement therapy.
Patients and Methods: this open-label randomized prospective study was performed to analyze dynamic changes in the laboratory parameters of atherogenesis in patients with subclinical hypothyroidism receiving levothyroxine. 84 patients with subclinical hypothyroidism were enrolled in the study. Controls were 22 healthy individuals. Patients with subclinical hypothyroidism were randomly assigned to either levothyroxine treatment group or observation group. Sodium levothyroxine dosage was 25 to 75 μg (on average, 38.00±14.18 μg). Lipid parameters, serum homocysteine levels, and serum concentrations of IgG against LDL at baseline and over time were measured.
Results: mean age of the patients with subclinical hypothyroidism was 37.32±8.62 years. In subclinical hypothyroidism patients with TSH levels ≥7 mIU/L, concentrations of total cholesterol (TC), antibodies (Abs) against oxidized LDL, and homocysteine were significantly higher than in healthy controls (р<0.05). In patients with subclinical hypothyroidism receiving levothyroxine replacement therapy, significant reduction in the levels of TC (р<0.0001), Abs against oxidized LDL (р=0.005), and homocysteine (р=0.0006) was demonstrated. After 1 year, significant reduction in the levels of Abs against oxidized LDL (р = 0.0026) and homocysteine (р=0.0033) was demonstrated in the treatment group as compared with the observation group.
Conclusions: In subclinical hypothyroidism patients with TSH levels ≥ 7 mIU/L, concentrations of total cholesterol, antibodies against oxidized LDL, and homocysteine are significantly higher than in healthy controls. 1-year levothyroxine replacement therapy significantly reduces the levels of antibodies against oxidized LDL and homocysteine as compared to the baseline.
Keywords: subclinical hypothyroidism, cardiovascular risk, thyroid-stimulating hormone, levothyroxine, lipidogram, homocysteine.
For citation: Volkova A.R., Dygun O.D., Lukichev B.G. et al. Dynamic changes in the laboratory parameters of atherogenesis in patients with subclinical hypothyroidism receiving levothyroxine replacement therapy. RMJ. Medical Review. 2019;10(II):82–85.
В статье представлены результаты исследования, посвященного изучению лабораторных показателей атерогенеза у молодых больных с субклиническим гипотиреозом и эффективности заместительной терапии левотироксином
Введение
Известно, что субклинический гипотиреоз (СГ) является фактором сердечно-сосудистого риска. Ассоциация между гипотиреозом и сердечно-сосудистыми заболеваниями была показана в многочисленных популяционных исследованиях [1–4]. Установлено, что в условиях гипотиреоза развивается атерогенная дислипидемия, гипергомоцистеинемия, диастолическая дисфункция миокарда, снижается синтез оксида азота, повышается периферическое сосудистое сопротивление [5–8]. Диагноз субклинического гипотиреоза ставится на основании повышения уровня тиреотропного гормона (ТТГ) при условии нормального или низконормального уровня свободного тироксина (Т4). Как правило, формирование гипотиреоза, в т. ч. субклинического, связывают с исходом аутоиммунного тиреоидита [9]. Повышение уровня ТТГ ассоциировано с высокими концентрациями антитиреоидных антител. Однако у ряда пациентов, особенно пожилого возраста, умеренное повышение уровня ТТГ может быть обусловлено множеством других причин: снижением активности дейодиназы 2 типа, приемом ряда лекарственных препаратов (бета-блокаторы, глюкокортикостероиды, амиодарон, препараты лития), проведением рентгеноконтрастных исследований, легким ацидозом в условиях хронической сердечной недостаточности и хронической болезни почек и т. д. [10, 11]. Поэтому небольшое повышение уровня ТТГ у пожилых коморбидных пациентов до 6–7 мМЕ/л, вероятно, допустимо, в большинстве случаев обратимо и не требует заместительной терапии левотироксином. Так, по данным крупного метаанализа 18 проспективных исследований по изучению конечных сосудистых точек у больных СГ было показано, что риск сердечно-сосудистых событий у них значимо увеличивается при уровне ТТГ больше 7 мМЕ/л [12]. Имеются немногочисленные проспективные исследования по изучению влияния терапии левотироксином на сердечно-сосудистые исходы у пациентов с СГ и сосудистым риском [13]. В них показано, что терапия левотироксином пациентов с СГ и сосудистыми заболеваниями целесообразна при уровне ТТГ больше 7 мМЕ/л. Таким образом, изучение лабораторных показателей атерогенеза у больных СГ и оценка динамики этих показателей на фоне терапии левотироксином представляются крайне актуальными для оптимизации лечебной тактики у таких больных. Изучение лабораторных показателей сосудистого риска у больных СГ, как правило, проводят у пациентов молодого возраста без каких-либо сопутствующих патологий («условно здоровые лица») для уточнения вклада СГ в формирование процессов атерогенеза [14].
Цель исследования: изучить лабораторные показатели атерогенеза у молодых больных СГ и эффективность заместительной терапии левотироксином.
Материал и методы
Проведено открытое рандомизированное проспективное исследование по изучению динамики лабораторных показателей атерогенеза у больных СГ на фоне терапии левотироксином. В исследовании приняли участие 84 пациента с СГ, которые наблюдались на кафедре факультетской терапии ПСПбГМУ им. И.П. Павлова. У всех пациентов повышение уровня ТТГ было подтверждено дважды с интервалом в 3 мес. Группу контроля составили 22 здоровых человека, сопоставимых по полу и возрасту, с уровнем ТТГ 0,4–2,4 мМЕ/л.
Критерии включения в исследование:
мужчины и женщины от 18 до 50 лет;
повышение уровня ТТГ≥4,0 мМЕ/л при нормальном уровне свободного Т4;
пациентки до периода менопаузы;
индекс массы тела от 18 до 29,9 кг/м2;
подписанное информированное согласие.
Критерии исключения из исследования:
пациенты, когда-либо получавшие:
терапию левотироксином, амиодароном, тиреостатическими препаратами, глюкокортикостероидами;
оперативное лечение по поводу заболеваний щитовидной железы;
облучение области шеи;
наличие артериальной гипертензии, ишемической болезни сердца и каких-либо кардиоваскулярных событий в анамнезе;
сахарный диабет;
курение;
беременность, период лактации;
ревматологические заболевания;
тяжелые соматические заболевания;
психические заболевания.
Исходно всем включенным в исследование пациентам определяли показатели липидного спектра крови (ОХ, ЛПВП, ЛПНП, ТГ, ЛПОНП), уровень гомоцистеина в сыворотке, концентрацию антител класса IgG к окисленным ЛПНП в сыворотке крови (АТ-окЛПНП). Уровни ТТГ, АТ-окЛПНП IgG и гомоцистеина определялись при помощи иммуноферментного анализа на анализаторе фирмы Beckman Coulter 4300 (США) с использованием тест-систем: «Access HYPERsensitive hTSH Reagent Pack»; «Biomedica oLAB»; «Axis Homocysteine EIA». Показатели липидограммы определены при помощи колориметрической фотометрической методики.
В дальнейшем пациенты с СГ были рандомизированы методом конвертов на 2 группы: группу лечения левотироксином и группу наблюдения. Доза левотироксина была от 25 до 75 мкг и в среднем составила 38,00±14,18 мкг. Титрация дозы левотироксина осуществлялась с интервалом в 3 мес. под контролем уровня ТТГ и самочувствия до целевого значения ТТГ 1,0–2,5 мМЕ/л. Через 1 год пациенты с СГ были приглашены для повторной оценки лабораторных показателей.
Для анализа данных использовалась программа SAS Enterprise Guide. Для оценки значимости различий использовались методы параметрической и непараметрической статистики (ANOVA, критерий Краскела — Уоллиса, U-критерий Манна — Уитни, однофакторный непараметрический анализ). Критерием статистически значимых различий считалась величина p<0,05.
Результаты исследования
В исследование включено 84 «условно здоровых» пациента молодого возраста. Мужчин было 14 (16,7%), женщин — 70 (83,3%). Средний возраст составил 37,32±8,62 года. Мужчины и женщины по возрасту значимо не отличались (р=0,80). По возрасту и полу группа контроля значимо не отличалась от группы больных СГ (р=0,58).
Исходно в группе контроля и в группе субклинического гипотиреоза каких-либо значимых различий по всем изучаемым показателям не выявлено. Однако при выделении группы больных с повышением уровня ТТГ≥7 мМЕ/л были выявлены значимые различия по ряду лабораторных показателей. У больных СГ с уровнем ТТГ≥7 мМЕ/л концентрация ОХ, АТ-окЛПНП и гомоцистеина была значимо выше, чем у здоровых лиц (р<0,05). Таким образом, повышение уровня ТТГ более 7 мМЕ/л, вероятно, ассоциировано с начальными изменениями лабораторных показателей атерогенеза.
Как было указано ранее, в последующем все пациенты с СГ были рандомизированы методом конвертов. Группу лечения левотироксином составили 42 пациента с СГ. В группу наблюдения также включено 42 пациента. Исходно группы больных были сопоставимы по всем изучаемым лабораторным показателям. При повторном обследовании через 1 год пациентам проводилось физикальное обследование и анализ крови для определения динамики лабораторных показателей. Через 1 год на повторный визит явились 36 пациентов из группы лечения левотироксином и 34 пациента из группы наблюдения. На фоне лечения левотироксином у всех больных был достигнут целевой уровень ТТГ. Лечение левотироксином пациенты переносили хорошо. В таблице 1 представлены изучаемые лабораторные показатели у больных СГ исходно и в динамике через 1 год лечения и наблюдения.
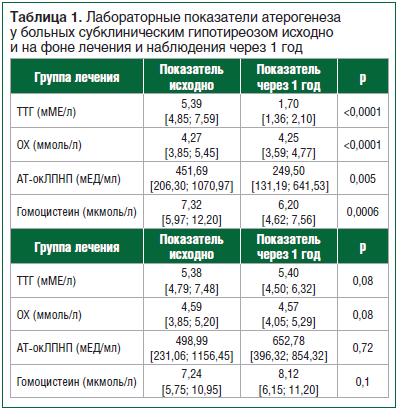
Таким образом, у больных СГ на фоне заместительной терапии левотироксином при достижении целевых значений ТТГ отмечались значимые изменения лабораторных показателей атерогенеза. Было выявлено значимое уменьшение уровня ОХ (р<0,0001), АТ-окЛПНП (р=0,005) и гомоцистеина (р=0,0006).
В таблице 2 представлены лабораторные показатели атерогенеза через 1 год наблюдения в группах лечения и наблюдения.
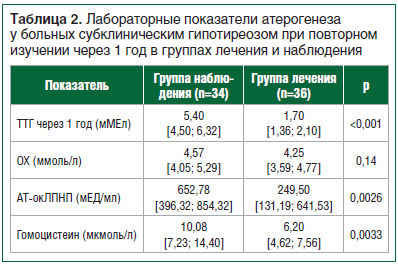
Как видно из представленных данных, среди показателей липидного спектра крови каких-либо значимых различий не выявлено. В группе лечения через 1 год наблюдалось значимое уменьшение концентрации АТ-окЛПНП IgG (р=0,0026) и гомоцистеина (р=0,0033) по сравнению с группой наблюдения. Таким образом, заместительная терапия левотироксином у молодых больных СГ с начальными проявлениями атерогенеза приводила к значимому уменьшению концентраций гомоцистеина и АТ-окЛПНП.
Обсуждение результатов
Представленные в работе результаты изучения лабораторных показателей атерогенеза у больных СГ представляются крайне важными для определения вклада СГ в сосудистый риск. Проведено открытое рандомизированное проспективное исследование по изучению лабораторных показателей сосудистого риска у молодых «условно здоровых лиц» с СГ. Средний возраст больных составил 36 лет, однако у части больных СГ уже в таком молодом возрасте были выявлены минимальные изменения лабораторных показателей сосудистого риска. Концентрации изучаемых лабораторных показателей атерогенеза у всех больных СГ и в группе контроля были в диапазоне референсных значений. Однако у больных СГ с уровнем ТТГ≥7 мМЕ/л концентрации ОХ, гомоцистеина и АТ-окЛПНП были значимо выше, чем в группе контроля. В работе оценивали все показатели липидного спектра крови, однако значимые различия между здоровыми лицами и больными СГ были выявлены только для ОХ. Обмен гомоцистеина хорошо изучен у больных с нарушениями функции щитовидной железы. Как правило, в исследованиях отмечают зависимость между повышением уровня ТТГ и повышением концентрации гомоцистеина. Известно, что тиреоидные гормоны регулируют активность метилентетрагидрофолатредуктазы и кофакторов, опосредующих катаболизм гомоцистеина, таких как витамин В12. Таким образом, субклинический гипотиреоз вносит определенный вклад в формирование сосудистого риска. Содержание АТ-окЛПНП у больных с нарушениями функции щитовидной железы изучено недостаточно. Известно, что АТ-окЛПНП отражают самые ранние этапы атерогенеза. Поэтому представлялось важным изучить концентрацию АТ-окЛПНП у молодых больных СГ. У больных СГ при ТТГ≥7 мМЕ/л концентрация АТ-окЛПНП была значимо выше, чем у здоровых лиц. На фоне лечения левотироксином у всех больных был достигнут целевой уровень ТТГ. Через 1 год лечения левотироксином лабораторные показатели сосудистого риска значимо изменились по сравнению с исходными данными. В группе наблюдения каких-либо значимых изменений уровня ТТГ, ОХ, гомоцистеина и АТ-окЛПНП не получено. Таким образом, заместительная терапия левотироксином у молодых пациентов с СГ представляется целесообразной с точки зрения предупреждения формирования сосудистых рисков. Полученные данные представляются крайне важными для оптимизации лечебной тактики у больных СГ.
Выводы:
У больных СГ с уровнем ТТГ≥7 мМЕ/л концентрация ОХ, АТ-окЛПНП и гомоцистеина была значимо выше, чем в группе здоровых лиц. У больных СГ со значением ТТГ 4–6,9 мМЕ/л значимых различий в концентрациях ОХ, АТ-окЛПНП и гомоцистеина по сравнению со здоровыми лицами не выявлено.
Заместительная терапия у больных СГ препаратами левотироксина в течение 1 года приводила к значимому снижению содержания АТ-окЛПНП и гомоцистеина по сравнению с исходными значениями.
2. Canaris G.J., Manowitz N.R., Mayor G., Ridgway E.C. The Colorado thyroid disease prevalence study. Arch Intern Med. 2000;160(4):526–534.
3. Moon S., Kim M.J., Yu J.M. et al. Subclinical Hypothyroidism and the Risk of Cardiovascular Disease and All-Cause Mortality: A Meta-Analysis of Prospective Cohort Studies. Thyroid. 2018;28(9):1101–1110.
4. Decandia F. Risk factors for cardiovascular disease in subclinical hypothyroidism. Irish J Med Sci. 2018;187(1):39–43.
5. Vayá A., Giménez C., Sarnago A. et al. Subclinical hypothyroidism and cardiovascular risk. Clin Hemorheol Microcircul. 2014;(1):1–7.
6. Udovcic M., Pena R.H, Patham B. et al. Hypothyroidism and the Heart. Methodist DeBakey Cardiovascular Journal. 2017;13(2):55–59.
7. Rodondi N., Newman A.B., Vittinghoff E. et al. Subclinical Hypothyroidism and the Risk of Heart Failure, Other Cardiovascular Events, and Death. Arch Int Med. 2005;165(21):2460–2466.
8. Biondi B., Cooper D.S. The Clinical Significance of Subclinical Thyroid Dysfunction. Endocr Rev. 2008;29(1):76–131.
9. Delitala A.P., Fanciulli G., Maioli M., Delitala G. Subclinical hypothyroidism, lipid metabolism and cardiovascular disease. Eur J Int Med. 2017;38:17–24.
10. Braverman L.E., Cooper D. Werner and Ingbar’s The Thyroid: A Fundamental and Clinical Text. Lippincott Williams and Wilkins; 2013.
11. Jabbar A., Pingitore A., Pearce S.H.S. et al. Thyroid hormones and cardiovascular disease. Nat Rev Cardiol. 2017;14(1):39–55.
12. Floriani C., Gencer B., Collet T-H., Rodondi N. Subclinical thyroid dysfunction and cardiovascular diseases: 2016 update. Eur Heart J. 2018;39(7):503–507.
13. Cojić M., Cvejanov-Kezunović L. Subclinical Hypothyroidism — Whether and When To Start Treatment? Open Access Macedonian J Med Sci. 2017;5(7):1042–1046.
14. Фадеев В.В. По материалам клинических рекомендаций Американской тиреоидной ассоциации по лечению гипотиреоза. Клиническая и экспериментальная тиреоидология. 2015;10(4):9–19. [Fadeev V.V. Comments to guidelines for the treatment of hypothyroidism prepared by the American thyroid association task force on thyroid hormone replacement. Clinical and experimental thyroidology. 2015;10(4):9–19 (in Russ.)].

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
