Склероатрофический лихен аногенитальной локализации: клинико-морфологические, дифференциально-диагностические особенности и комплексный метод лечения
Склероатрофический лихен (СЛ) представляет собой хронический аутоиммунный дерматоз, протекающий с очаговой атрофией кожи и поражением тканей аногенитальной области. Аногенитальная локализация СЛ встречается чаще у женщин, чем у мужчин, в соотношении 3:1.
Цель исследования: выявить частоту поражения аногенитальной зоны при ограниченной склеродермии (ОС), установить дифференциально-диагностические клинические критерии поражения аногенитальной области при ОС, усовершенствовать метод лечения.
Материал и методы: в клинике им. В.А. Рахманова за период с 2017 по 2019 г. было обследовано 104 больных с установленным диагнозом ОС. Из всех пациентов (n=104) отобраны 62 пациента с СЛ аногенитальной локализации, из них мужчины составили 17,7%, женщины — 82,3%. Основная группа больных с поражением половых органов встречалась в возрастной медиане от 41 до 50 лет, что составило 17 человек (27,4%) и от 61 до 70 лет, что составило 15 человек (24,2%). Нами был оптимизирован протокол комплексного метода лечения ОС с учетом СЛ аногенитальной локализации и предложен новый подход, а именно применены бовгиалуронидазы азоксимер в виде суппозиториев, крем эстриол, гель с бактериофагами Фагогин. Всем пациенткам с СЛ аногенитальной зоны проводилось лечение фракционным СО2-лазером. В качестве наружной терапии СЛ аногенитальной зоны у мужчин мы применяли бовгиалуронидазу азоксимер методом фонофореза.
Результаты исследования: впервые выявлены поражения аногенитальной зоны у 59,6% (n=62) больных, среди них количество женщин значительно превышает количество мужчин (82,9% и 17,1% соответственно). Выявлена связь аногенитального СЛ с этиологическими факторами заболевания, в 71% случаев это инфекции, передаваемые половым путем и воспалительные заболевания малого таза.
Заключение: выявленная частота встречаемости СЛ аногенитальной локализации в структуре ОС 59,6%. Оптимизирован протокол комплексного метода лечения ОС с учетом склероатрофических поражений аногенитальной локализации и доказана его высокая клиническая эффективность, достигающая 98%.
Ключевые слова: дерматология, ограниченная склеродермия, склероатрофический лихен, аногенитальная локализация, склероатрофический лихен вульвы, склероатрофический лихен полового члена, частота встречаемости, вирусные инфекции, инфекции передающиеся половым путем, лечение.
Для цитирования: Снарская Е.С., Семенчак Ю.А. Склероатрофический лихен аногенитальной локализации: клинико-морфологические, дифференциально-диагностические особенности и комплексный метод лечения. РМЖ. Медицинское обозрение. 2019;3(12):9-13.
Anogenital lichen sclerosus: clinicopathologic, differential diagnostic features and complex treatment method
E.S. Snarskaya, Yu.A. Semenchak
Sechenov University, Moscow
Background: lichen sclerosus (LS) is a chronic autoimmune dermatosis that occurs with focal skin atrophy and anogenital tissue lesions. Anogenital lichen sclerosus (ALS) occurs more often in women than in men, in a ratio of 3:1.
Aim: to reveal the frequency and to establish differential diagnostic clinical criteria of anogenital lesions in circumscribed scleroderma (CS), to improve the treatment method.
Patients and Methods: for the period from 2017 to 2019, 104 patients with an established CS diagnosis were examined in the V.A. Rakhmanov Department of Skin and Venereal Diseases. Of all (n=104), 62 patients with ALS lesions were selected, of which men — 17.7%, women — 82.3%. Patients with genital lesions were distributed in the median age: 41–50, which was 17 people (27.4%) and 61–70 years, which was 15 people (24.2%). We have optimized the protocol of the complex CS treatment method, taking into account the ALS lesions, and proposed a new approach, namely the use of Bovhyaluronidaze azoximer in the suppository form, Estriol cream, and Phagogin gel with bacteriophages. All patients with ALS lesions were treated with fractional CO2 laser. We used Bovhyaluronidaze azoximer by phonophoresis method as topical treatment of ALS lesions in men.
Results: for the first time, anogenital lesions were detected in 59.6% (n=62) of patients. Among them, the number of women significantly exceeded the number of men (82.9% and 17.1%, respectively). The association of ALS with disease causative factors was revealed. In 71% of cases, STDs and pelvic inflammatory diseases were revealed.
Conclusion: the ALS incidence in the CS structure was detected in 59.6%. The protocol of the complex CS treatment method was optimized, taking into account anogenital sclerosus lesions. Also, its high clinical efficiency, reaching 98%, was proved.
Keywords: dermatology, circumscribed scleroderma, lichen sclerosus, anogenital region, vulvar lichen sclerosus, penile lichen sclerosus, incidence, viral infections, sexually transmitted diseases, treatment.
For citation: Snarskaya E.S., Semenchak Yu.A. Anogenital lichen sclerosus: clinicopathologic, differential diagnostic features and complex treatment method. RMJ. Medical Review. 2019;12:9–13.
В статье представлены результаты исследования, посвященного анализу клинико-морфологических характеристик, дифференциально-диагностическим особенностям и комплексному методу лечения склероатрофического лихена аногенитальной локализации
Введение
Склероатрофический лихен (СЛ) представляет собой хронический аутоиммунный дерматоз, протекающий с очаговой атрофией кожи и поражением тканей аногенитальной области [1–3]. Согласно общеклинической классификации, разработанной S. Peterson, СЛ является одним из клинических вариантов бляшечной ограниченной склеродермии (ОС) [4].
Особенностью клинического течения СЛ являются поражения как кожных покровов, так и тканей аногенитальной области, которые могут быть изолированными или сочетанными [5]. Аногенитальная локализация СЛ встречается чаще у женщин, чем у мужчин, в соотношении 3:1 [6, 7], кроме того, дерматоз может развиться в любом возрасте, однако пик заболеваемости приходится на препубертатный возраст (9–11 лет) и на климактерический и/или постклимактерический период (45–55 лет). У мужчин заболевание развивается обычно после 40 лет [6–8].
Вопросы этиологии и патогенеза СЛ до конца не изучены, однако известно что в патогенезе заболевания важную роль играют: генетическая предрасположенность; угнетение активности гипофизарно-надпочечниковой системы; дисфункция щитовидной и половых желез; вакцинация; травмы; острые и хронические инфекции (иксодовый клещевой боррелиоз (Borrelia burgdorferi), скарлатина, дифтерия, рожа, инфекции передающиеся половым путем (ИППП)); вирус папилломы человека (ВПЧ); вирус простого герпеса (ВПГ); гепатит В и С и др., возможен также паранеопластический генез [9–14]. В последние десятилетия, развитие СЛ аногенитальной локализации связывают с участием эстрогенов и прогестерона и их взаимосвязи с нарушениями в реакции синтеза коллагена и компонентов соединительной ткани [13, 14]. Данные литературы сообщают, что свободная фракция тестостерона и андростендиона значительно понижена у больных с генитальным СЛ, отмечена также аномальная активность фермента 5α-редуктазы [14]. В ряде исследований роль лидирующего фактора отводится гипоэстрогении, т. к. после 30-летнего возраста неуклонно понижается активность стероидогенеза (на 1–3% в год) и к 50 годам он уменьшается почти на 20% [14, 15]. Развитие СЛ в препубертатном периоде в большинстве случаев связано с низким содержанием эстрогенов и эстрогенной насыщенностью органов-мишеней [15]. Однако при развитии СЛ у детей в редких случаях возможен регресс патологических очагов, т. к. с возрастом уровень эстрадиола повышается [15, 16]. Особая роль в патогенезе СЛ отводится патологическому аутоиммунному процессу, развивающемуся в стенках мелких сосудов (капиллярит) и межуточном веществе соединительной ткани, в связи с высоким уровнем антигенной «коллагеновой» стимуляции [15–17].
Уменьшение активности фермента гиалуронидазы, накопление мукополисахаридов и прогрессирующая фибриноидная дегенерация соединительнотканных элементов в сочетании со спазмом сосудов вследствие накопления серотонина приводят к отечно-индуративным изменениям [2, 10, 15]. Запуск целого каскада аутоиммунных, сосудистых и обменных нарушений приводит к усиленному синтезу коллагена (I, III, IV и VII типов) и других компонентов экстрацеллюлярного матрикса, облитерации мелких сосудов, что клинически проявляется прогрессирующим атрофическим процессом тканей [15–17].
В целом ряде случаев поражение половых органов при СЛ может развиваться почти бессимптомно, особенно в начале заболевания [15]. Основными жалобами, предъявляемыми больными при неуклонном прогрессировании процесса, являются болезненность, парестезии, ощущение покалывания и «ползающих мурашек», умеренный зуд, а затем уплотнение тканей в зоне половых органов, выпадение волос и появление трещин. В процессе прогрессирования заболевания, наряду с нарастающими субъективными ощущениями, у больных появляется целый ряд других качественных симптомов. К ним относятся уринарный синдром, включающий персистирующие инфекции мочевыводящих путей, цистоуретрит [16], гастроинтестинальный синдром, проявляющийся болью при дефекации, хроническими запорами [17], и вульвовагинальный синдром, включающий диспареунию и целый спектр дисфункциональных сексуальных расстройств [16, 17].
Типичная клиническая картина СЛ представляет собой множество мелких (диаметром от 3 до 5 мм), четко контурированных участков атрофии, которые имеют тенденцию к слиянию. Элементы высыпаний могут быть рассеянными или сгруппированными. Постепенно их количество и размер увеличиваются, они сливаются и формируют обширные поля истонченного эпидермиса и атрофии, приводя к частичной редукции ткани. Окраска пораженной кожи белесоватая, с перламутровым или ливидным оттенком. Кожу трудно собрать в складку, на ней отсутствуют волосы, апокриновые и потовые железы также отсутствуют [15–18]. Прогрессирование склероатрофических изменений аногенитальной области у мужчин при локализации на коже полового члена, области ануса приводит к истончению крайней плоти, сужению и стриктуре уретры. Нередко развивается парафимоз, фимоз [18, 19]. Серьезным осложнением СЛ полового члена является плоскоклеточная карцинома, составляющая до 50% случаев рака соответствующей локализации [19, 20]. У женщин прогрессирование склероатрофических изменений аногенитальной области приводит к потере структуры вульвы и ее редукции. Вульва легко травмируется, возникает диспареуния. Складки половых губ уплощаются и сглаживаются, клитор и малые половые губы определить практически не удается (как и линию Гарта), из-за выраженного склероза тканей вход во влагалище сужается, уменьшаются размеры его преддверия и наружного отверстия мочеиспускательного канала. СЛ вульвы с хроническим гиперкератозом и эрозиями может осложниться плоскоклеточной карциномой [19–21].
Все эти явления, помимо неприятных субъективных ощущений, причиняют больным значительные моральные страдания и существенно снижают качество жизни, т. к. являются серьезным косметическим дефектом.
Важно также отметить, что пациенты с СЛ аногенитальной локализации наблюдаются в клиниках акушерско-гинекологического профиля, где данное заболевание воспринимается лишь как изолированное поражение гениталий, а не как форма ОС, требующая комплексного обследования и системного подхода к лечению.
Цель исследования: выявить частоту поражения аногенитальной зоны при основных клинических вариантах ОС, установить дифференциально-диагностические клинические критерии поражения аногенитальной области при ОС, усовершенствовать метод лечения с учетом аногенитальной локализации и оценить клиническую эффективность разработанного метода лечения.
Материал и методы
В клинике кожных и венерических болезней им. В.А. Рахманова за период с 2017 по 2019 г. нами было обследовано 104 больных с установленным диагнозом ОС (бляшечная склеродермия, линейная склеродермия, СЛ, атрофодермия Пазини — Пьерини). Из них 86 женщин (82,7%) и 18 мужчин (10,5%). По возрасту больные распределились следующим образом: от 20 до 30 лет — 18 человек (17,3%), от 31 года до 40 лет — 18 (17,3%), от 41 года до 50 лет — 13 (12,5%), от 51 года до 60 лет — 26 (25%), от 61 года до 70 лет — 23 (22,1%), от 71 года и старше — 6 (5,8%).
При проведении клинико-морфологического фенотипирования всех пациентов (n=104) нами были отобраны 62 пациента со склероатрофическими поражениями аногенитальной локализации.
Методика лечения
Курс комплексной терапии включает: инъекции бензилпенициллина в дозе 500 000 ЕД 4 р./сут внутримышечно (в/м) в течение 10 дней (курсовая доза 20 млн ЕД); пентоксифиллин в дозе 100 мг по 1 таблетке 3 р./сут в течение 1 мес.; бовгиалуронидаза азоксимер в виде вагинальных (для женщин) или ректальных (для мужчин) суппозиториев в дозировке 3000 МЕ 1 раз в 2 дня до курсовой дозы 30 тыс. МЕ; эстриол (крем вагинальный) — 1 аппликация (соответствующая 0,5 мг эстриола) 1 р./сут в течение 4 нед., затем 1 аппликация 2 р./нед. в течение 2 мес.; гель с бактериофагами Фагогин по 5–7 мл 3 р./сут в течение 1 мес.
Всем пациенткам со склероатрофическими поражениями аногенитальной зоны проводилось лечение: фракционным СО2-лазером (время облучения 220 мкс, флюенс 3,9 Дж/м2, расстояние между точками 70 мкм). На каждом сеансе было выполнено три прохода, при этом лазер был установлен на низкий уровень (10 Вт) 20 мДж/пиксель, 2 Гц на первом, втором и третьем сеансах и средний (30 Вт) 10 мДж/пиксель, 2 Гц на четвертом и пятом сеансах. Анестезия аппликационная (лидокаин+прилокаин). Время экспозиции составило 25 мин. Курс лечения составил от 3 до 5 сеансов с интервалом 30 дней.
В качестве наружной терапии склероатрофических поражений аногенитальной зоны у мужчин мы применяли бовгиалуронидазу азоксимер методом фонофореза. Курс лечения составил 10–12 процедур с кратностью 1–2 р./нед.
Результаты исследования
Больные с клиническим вариантом в виде бляшечной склеродермии составили 78 человек (75%), линейной склеродермией — 1 человек (0,9%), атрофодермией Пазини — Пьерини — 2 человека (1,9%), СЛ — 23 человека (22,2%).
Склероатрофические поражения аногенитальной локализации наблюдались у 40 больных бляшечной склеродермией (64,5%), у 21 больного СЛ (33,8%), у 1 больного линейной склеродермией (1,7%).
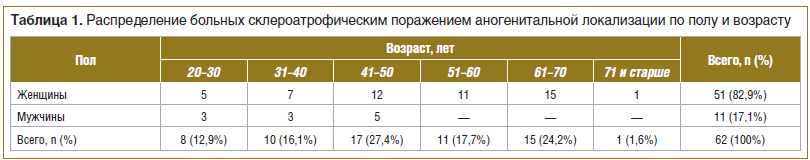
СЛ аногенитальной локализации наблюдался чаще у женщин — 82,9% (51 больная), чем у мужчин — 17,1% (11 больных). Основная группа больных с поражением половых органов встречается в возрастной медиане от 41 до 50 и от 61 до 70 лет, что соответствует периоду пре- и постменопаузы. Половозрастные особенности больных СЛ даны в таблице 1.
При анализе клинических особенностей распространенности склероатрофических поражений кожного покрова и слизистой половых органов нами установлено, что в 32,3% случаев склероатрофический процесс локализовался только в аногенитальной зоне, а в 67,7% случаев процесс носил сочетанный характер.
Так, согласно нашим данным, в 32,3% случаев (n=20) изолированное поражение аногенитальной локализации наблюдалось при склероатрофическом варианте ОС. При анализе сочетанных поражений кожи и аногенитальной зоны в 46,7% случаев (n=29) нами выявлены сочетание двух форм ОС: бляшечной формы на коже и СЛ аногенитальной зоны. В 19,4% случаев (n=12) нами выявлены сочетанные поражения СЛ кожи и аногенитальной зоны. В 1,7% случаев (n=1) очаги по типу СЛ в аногенитальной зоне сочетались с очагами поражения по типу линейной склеродермии на коже туловища.
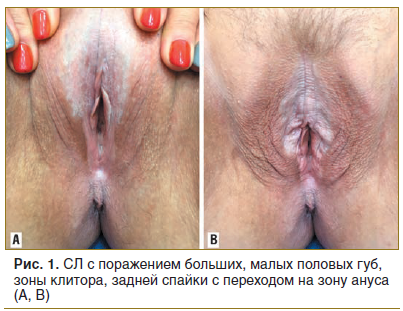
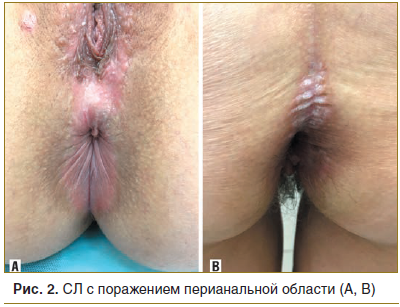
При проведении подробного анализа особенностей локализации склероатрофических поражений аногенитальной зоны у женщин (n=51) установлено, что поражение вульвы встречалось в 41 случае (80,4%), поражение клитора — в 36 (70,5%), поражение ткани промежности — в 38 (74,5%), поражение перианальной области в 24 (47%) (рис. 1, 2).
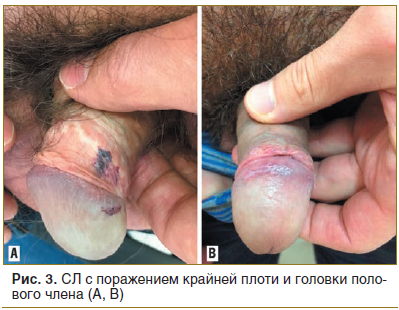
Анализ особенностей склероатрофических поражений у мужчин (n=11) показал склероатрофические поражения головки полового члена в 8 случаях (72,7%), поражение тканей уздечки — в 6 (54,5%), поражение кожи ствола полового члена — в 3 (27,3%), поражение перианальной области — в 4 случаях (36,4%) (рис. 3).
При анализе сопутствующей хронической патологии у исследуемых больных (n=62) нами установлено, что в 71% случаев (44 больных) выявлены ИППП и воспалительные заболевания малого таза, в 86,4% случаев (у 38 женщин) и в 17,1% случаев (у 6 мужчин). В 33,9% (21 больной) случаев обнаружены: ВПЧ высокого канцерогенного риска (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68) и ВПГ I и II типа — у 16 женщин (25,8%) и 5 мужчин (8,1%) (табл. 2).
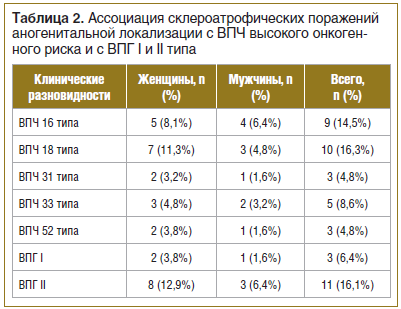
Склероатрофические поражения аногенитальной локализации сочетались с бактериальным вагинозом — в 27,4% случаев (17 больных), хламидиозом (Chlamydia trachomatis) — в 24,2% случаев (15 больных), трихомониазом (Trichomonas vaginalis) — в 17,7% случаев (11 больных), гонореей (Neisseria gonorrhoeae) — в 3,2% случаев (2 больных).
Склероатрофические поражения аногенитальной локализации сочетались с хронической персистирующей вирусной инфекцией: ВПГ II типа — в 16,1% случаев (11 больных), ВПГ I типа — в 6,4% случаев (3 больных) (см. табл. 2).
Также важно отметить, что наличие хронической персистирующей вирусной инфекции ВПЧ с высоким онкогенным потенциалом (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68) у пациентов с склероатрофическими поражениями половых органов вызывает значимый интерес ввиду высоких рисков развития злокачественной трансформации (см. табл. 2).
Нами проведен анализ сопутствующей хронической патологии у группы пациентов (n=62) с поражениями аногенитальной локализации. Большой интерес представляют заболевания органов малого таза, которые были выявлены в 40,3% случаев (n=25): миома матки — у 12 женщин, сальпингоофорит — у 5 женщин, сальпингит — у 3 женщин, цистит — у 2 женщин; простатит выявлен у 2 мужчин, аденома простаты — у 1.
Кроме того, была выявлена хроническая очаговая инфекция различной локализации в 27,4% случаев (n=17): у женщин — ринит у 5, хронический тонзиллит — у 3, хронический фарингит — у 3; у мужчин: ринит — у 3, хронический тонзиллит — у 2, хронический фарингит — у 1. Заболевания сердечно-сосудистой системы выявлены в 19,4% случаев (n=12): у женщин — артериальная гипертензия у 7, аритмия у 1; у мужчин — артериальная гипертензия у 3, сердечная недостаточность — у 1. Патология желудочно-кишечного тракта и гепатобилиарной системы встречалась в 3,2% случаев (n=2): у женщин — гастрит у 1, дискинезия желчного пузыря — у 1. Патология не выявлена в 9,7% случаев (n=6).
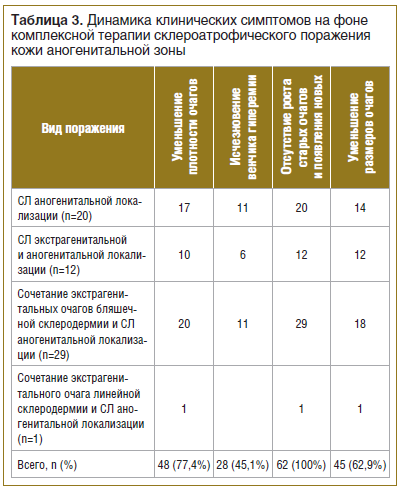
Эффективность курса проведенной терапии оценивали по положительной динамике кожного процесса: уменьшению плотности очагов, исчезновению или побледнению венчика гиперемии, отсутствию роста старых очагов и появления новых, уменьшению размеров старых очагов, уменьшению субъективных ощущений.
После первого курса комплексной терапии следовал перерыв в 1,5–2,0 мес., после которого проводился следующий курс комплексной терапии. При отсутствии и/или незначительности изменений после проведенного курса терапии больным назначался повторный курс (максимальное количество курсов не превышало 5).
Так, из 62 пациентов с ОС и поражением аногенитальной зоны основному количеству больных — 56,5% (35 человек) потребовалось 3 курса комплексной терапии, 16,1% (10 человек) — 4 курса, 11,3% (7 человек) — 2 курса, 6,4% (4 человека) — 1 курс и 8,1% (5 человек) — 5 курсов для полной стабилизации процесса.
На фоне проведенной комплексной терапии уменьшение плотности очагов наблюдалось у 48 (77,4%) больных, побледнение венчика гиперемии — у 28 (45,1%) больных. Отсутствие роста старых очагов и появления новых отмечено у 62 (100%) больных, уменьшение размеров очагов — у 39 (72,6%) больных (табл. 3).
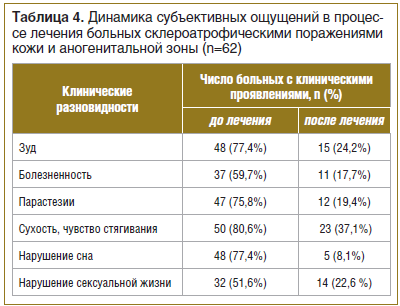
Анализ динамики субъективных ощущений показал положительную тенденцию их уменьшения. Так, до лечения зуд аногенитальной области встречался в 77,4% случаев, после проведения комплексного лечения — в 24,2% случаев. Болезненные ощущения в очагах поражения до лечения наблюдались в 59,7% случаев, после лечения — в 17,7%. Парестезии до лечения наблюдались в 75,8% случаев, после лечения — лишь в 19,4% случаев. Чувство стягивания и сухость до лечения наблюдались в 80,6% случаев, после лечения — в 37,1%. Нарушения сна до лечения определялось в 77,4% случаев, после лечения — лишь в 8,1%. Нарушение сексуальной жизни до лечения встречалось в 51,6% случаев, после лечения — в 22,6% случаев (табл. 4).
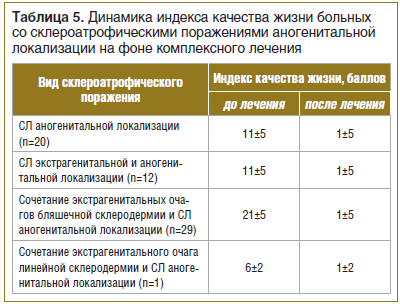
Всем больным (n=62) для оценки степени негативного влияния кожного заболевания на различные аспекты их жизни (отношения в семье с родственниками, с друзьями, коллегами по работе, занятия спортом, сексом, социальная активность и т. д.) был предложен опросник дерматологического индекса качества жизни (ДИКЖ) до и после лечения. После проведения комплексного курса лечения отмечено значительное повышение ДИКЖ у всех больных со склероатрофическими поражениями аногенитальной области (табл. 5).
Заключение
Нами впервые выявлена частота встречаемости СЛ аногенитальной локализации в структуре ОС, которая составила 59,6%.
Выявлена и проанализирована связь аногенитального СЛ с этиологическими факторами заболевания: в 71% случаев выявлены ИППП и воспалительные заболевания малого таза; в 33,8% случаев — ВПЧ высокого канцерогенного риска, ВПГ I и II типа; в 19,3% случаев — хронические воспалительные заболевания органов малого таза; в 27,4% случаев — хроническая очаговая инфекция различной локализации; в 19,4% случаев — заболевания сердечно-сосудистой системы; в 3,2% случаев — патология желудочно-кишечного тракта и гепатобилиарной системы.
Нами был оптимизирован протокол комплексного метода лечения ОС, включая склероатрофические поражения аногенитальной локализации. Протокол может быть рекомендован для усовершенствования лечения пациентов с данной патологией в связи с его высокой клинической эффективностью, достигающей 98%.
2. Бутов Ю.С, Тогузов Р.Т. Некоторые аспекты патогенеза, клиника и терапия склеродермии. Российский журнал кожных и венерических болезней. 2002;4:15–19. [Butov Yu. S., Toguzov R.T. Some aspects of pathogenesis, clinic and therapy of scleroderma. Russian journal of skin and venereal diseases. 2002;4:15–9 (in Russ.)].
3. Молочков В.А., Снарская Е.С., Ромашкина А.С. Очаговая склеродермия, ассоциированная с другими аутотиммунными заболеваниями и спектром различных аутоантител. Российский журнал кожных и венерических болезней. 2011;4:33–36. [Molochkov V.A., Snarskaya E.S., Romashkina A.S. Focal scleroderma associated with other autoimmune diseases and a spectrum of various autoantibodies. Russian journal of skin and venereal diseases. 2011;4:33–36 (in Russ.)].
4. Peterson L.S., Nelson A.M., Su W.P. Classification of Morphea (Localized Scleroderma) Mayo Clin Proc. 1995;70:1068–1076.
5. Higgins C.A., Cruickshank M.E. A population-based case-control study of aetiological factors associated with vulval lichen sclerosus. J Obstet Gynaecol. 2012;32:271–275.
6. Nelson D., Peterson A. Lichen sclerosus: epidemiological distribution in an equal access health care system. J. Urol. 2011;185:522–525.
7. Kreuter A., Kryvosheyeva Y., Terras S. et al. Association of autoimmune diseases with lichen sclerosus in 532 male and female patients. Acta Derm. Venereol. 2013;93:238–241.
8. Kirtschig G., Kuik D.J. A Dutch cohort study confirms familial occurrence of anogenital lichen sclerosus. J Women’s Health Care. 2014;3:209–211.
9. Sherman V., McPherson T., Baldo M. et al. The high rate of familial lichen sclerosus suggests a genetic contribution: an observational cohort study. J Eur Acad Dermatol Venereol. 2010;24:1031–1034.
10. Birenbaum D.L., Young R.C. High prevalence of thyroid disease in patients with lichen sclerosus. J Reprod Med. 2007;52:28–30.
11. Lipscombe T.K., Wayte J., Wojnarowska F. et al. A study of clinical and aetiological factors and possible associations of lichen sclerosus in males. Australas J Dermatol. 1997;38:132–136.
12. Gupta S., Malhotra A.K., Ajith C. Lichen sclerosus: role of occlusion of the genital skin in the pathogenesis. Indian J Dermatol Venereol Leprol. 2010;76:6–8.
13. Aidé S., Lattario F.R., Almeida G. et al. Epstein-Barr virus and human papillomavirus infection in vulvar lichen sclerosus. J. Low Genit. Tract. Dis. 2010;14(4):319–322.
14. Реуцкая М.А., Кулинич С.И. Роль инфекций в генезе заболеваний вульвы. Сибирский медицинский журнал. 2010;6:239–242. [Reutskaya M.A., Kulinich S.I. the Role of infections in the Genesis of vulva diseases. Siberian medical journal. 2010;6:239–242 (in Russ.)].
15. Taylor A.H., Guzail M., Al-Azzawi F. Differential expression of oestrogen receptor isoforms and androgen receptor in the normal vulva and vagina compared with vulval lichen sclerosus and chronic vaginitis. Br. J. Dermatol. 2008;2:319–328.
16. Шарапова Л.Е. К вопросу об этиологии и патогенезе хронических дистрофических заболеваний вульвы. Российский вестник акушерства и гинекологии. 2010;1:29–34. [Sharapova L.E. On the etiology and pathogenesis of chronic dystrophic diseases of the vulva. Russian journal of obstetrics and gynecology. 2010;1:29–34 (in Russ.)].
17. Fleming J.N., Nash R.A., Mahoney W.M. Jr. et al. Is scleroderma a vasculopathy? Curr Rheumatol Rep. 2009;11:2:103–110.
18. Кряжева С.С., Ромашкина А.С. Поражение наружных половых органов при различных формах ограниченной склеродермии. Актуальные вопросы дерматовенерологии и дерматоонкологии. 2009;6:49–50. [Kryazheva S.S., Romashkina A.S. Defeat of external genitals in various forms of limited scleroderma. The actual questions of Dermatovenereology and dermatooncology. 2009;6:49–50 (in Russ.)].
19. Van de Nieuwenhof H.P., van der Avoort I.A.M., de Hullu J.A. Review of squamous premalignant vulvar lesions. Critical Reviwes in Oncology. Hematology. 2008;68(2):131–156.
20. Nasca M.R., Innocenzi D., Micali G. Association of penile lichen sclerosus and oncogenic human papillomavirus infection. International Journal of Dermatology. 2006;45(6):681–683.
21. Соколова А.А., Гребенюк В.Н., Доля О.В. Клинические особенности генитального склероатрофического лихена у мужчин и женщин. Клиническая дерматология и венерология. 2016;1:54–59. [Sokolova A.A., Grebenyuk V.N., Share O.V. Clinical features of genital scleroatrophic lichen in men and women. Clinical dermatology and venereology. 2016;1:54–59 (in Russ.)].

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
