Валидизация предиктивного индекса астмы (API) в российской популяции: данные пилотного исследования
Рубрика:
Болезни дыхательных путей
Эпизоды бронхообструкции отмечаются у трети детей в первые 3 года жизни, но при этом у большинства пациентов бронхиальная астма (БА) в будущем не развивается. Выявление группы высокого риска по развитию БА среди детей, переносящих бронхообструкции, является важной задачей для здравоохранения.
Две разновидности предиктивного индекса астмы (API) — жесткий API (жAPI) и свободный API (сAPI), разработанные Castro-Rodriguez et al., являются наиболее широко применяющимися инструментами прогнозирования развития БА.
Цель исследования: данное пилотное исследование ставит целью валидизировать обе разновидности API в российской популяции детей группы высокого риска.
Материал и методы: были проанализированы истории болезни всех пациентов в возрасте от 0 до 4 лет, поступавших ГБУЗ «ДГКБ № 9 им. Г.Н. Сперанского ДЗМ» с диагнозом «обструктивный бронхит» за 2013 г. Родители пациентов были проинтервьюированы по достижении их детьми возраста 6–7 лет.
Результаты исследования: из 417 родителей 173 (41,5%) согласились на участие в исследовании. 35 (20,2%) детям был поставлен диагноз БА. Возраст пациентов на момент госпитализации составлял 26,8 (σ=7,8) мес., на момент опроса — 78,5 (σ=10,0) мес. Свободный API показал следующие параметры предиктивности: чувствительность — 71,4%, специфичность — 71,7%, положительная прогностическая ценность (PPV) — 39,1%, отрицательная прогностическая ценность (NPV) — 90,8%. Для жAPI показатели составили 50,0%, 87,6%, 53,1% и 86,2% соответственно.
Заключение: предиктивная способность API в российской популяции сравнима с показателями оригинального исследования. Высокая NPV свидетельствует о хорошей способности API, в особенности сАРI, исключать развитие БА в будущем. Однако способность инструмента в отношении предсказания вероятности развития БА оставляет желать лучшего. Последующие исследования должны быть направлены на повышение предиктивной способности инструмента путем его модификации.
Ключевые слова: предиктивный индекс астмы, бронхиальная астма, аллергические заболевания, API, чувствительность, специфичность.
Две разновидности предиктивного индекса астмы (API) — жесткий API (жAPI) и свободный API (сAPI), разработанные Castro-Rodriguez et al., являются наиболее широко применяющимися инструментами прогнозирования развития БА.
Цель исследования: данное пилотное исследование ставит целью валидизировать обе разновидности API в российской популяции детей группы высокого риска.
Материал и методы: были проанализированы истории болезни всех пациентов в возрасте от 0 до 4 лет, поступавших ГБУЗ «ДГКБ № 9 им. Г.Н. Сперанского ДЗМ» с диагнозом «обструктивный бронхит» за 2013 г. Родители пациентов были проинтервьюированы по достижении их детьми возраста 6–7 лет.
Результаты исследования: из 417 родителей 173 (41,5%) согласились на участие в исследовании. 35 (20,2%) детям был поставлен диагноз БА. Возраст пациентов на момент госпитализации составлял 26,8 (σ=7,8) мес., на момент опроса — 78,5 (σ=10,0) мес. Свободный API показал следующие параметры предиктивности: чувствительность — 71,4%, специфичность — 71,7%, положительная прогностическая ценность (PPV) — 39,1%, отрицательная прогностическая ценность (NPV) — 90,8%. Для жAPI показатели составили 50,0%, 87,6%, 53,1% и 86,2% соответственно.
Заключение: предиктивная способность API в российской популяции сравнима с показателями оригинального исследования. Высокая NPV свидетельствует о хорошей способности API, в особенности сАРI, исключать развитие БА в будущем. Однако способность инструмента в отношении предсказания вероятности развития БА оставляет желать лучшего. Последующие исследования должны быть направлены на повышение предиктивной способности инструмента путем его модификации.
Ключевые слова: предиктивный индекс астмы, бронхиальная астма, аллергические заболевания, API, чувствительность, специфичность.
Petrova Yu.V.1, Katrysheva A.S.1, Koroleva D.R.2, Beznosova L.A.2, Lototskaya P.S.2, Sinelnikova T.Yu.2, Samedova F.A.2, Kolotilina A.I.1,2, Korsunsky I.A.1,2, Smirnova G.I.1,2, Eremeeva A.V.1,2, Korsunsky A.A.1,2, Munblit D.B.2
1 Speransky City Children’s Hospital № 9, Moscow
2 Sechenov University, Moscow
Bronchial obstructions occur in a third of children in the first three years of life, but most patients do not develop bronchial asthma (BA) in the future. The identification of a high-risk group for the development of BA among children with bronchial obstruction is an important public health objective.
Two varieties of the Predictive Asthma Index (API): rigid API (rAPI) and free API (fAPI), developed by Castro-Rodriguez et al, are the most widely used tools for predicting the development of BA.
Aim: this pilot study aims to validate both types of API in the Russian population of high-risk children.
Patients and Methods: the medical records of all patients aged 0–4 years, who came to the Speransky CCH № 9 with a diagnosis of obstructive bronchitis during 2013, were analyzed. Parents of the patients were interviewed when their children reached the age of 6–7 years.
Results: out of 417 parents, 173 (41.5%) agreed to participate in the study. 35 (20.2%) children were diagnosed with BA. Patients were 26.8 months old at the time of admission (σ=7.8), 78.5 months old at the time of the survey (σ=10.0), respectively. fAPI showed the following parameters of predictivity: sensitivity 71.4%, specificity 71.7%, positive prognostic value (PPV) 39.1%, negative prognostic value (NPV) 90.8%. For rAPI the indicators were 50.0%, 87.6%, 53.1% and 86.2%, respectively.
Conclusions: the predictive ability of the API in the Russian population is comparable to that of the original study. High NPV indicates a good ability of API, especially “free” API, to exclude the development of BA in the future. However, the tool’s ability to predict the probability of BA development leaves much to be desired. Subsequent studies should aim to improve the predictive ability of the instrument by modifying it.
Keywords: asthma index, bronchial asthma, allergic diseases, API, sensitivity, specificity.
For citation: Petrova Yu.V., Katrysheva A.S., Koroleva D.R. et al. Asthma Predictive Index (API) validation in the Russian population: pilot study data. RMJ. Medical Review. 2019;2(I):2–6.
1 Speransky City Children’s Hospital № 9, Moscow
2 Sechenov University, Moscow
Bronchial obstructions occur in a third of children in the first three years of life, but most patients do not develop bronchial asthma (BA) in the future. The identification of a high-risk group for the development of BA among children with bronchial obstruction is an important public health objective.
Two varieties of the Predictive Asthma Index (API): rigid API (rAPI) and free API (fAPI), developed by Castro-Rodriguez et al, are the most widely used tools for predicting the development of BA.
Aim: this pilot study aims to validate both types of API in the Russian population of high-risk children.
Patients and Methods: the medical records of all patients aged 0–4 years, who came to the Speransky CCH № 9 with a diagnosis of obstructive bronchitis during 2013, were analyzed. Parents of the patients were interviewed when their children reached the age of 6–7 years.
Results: out of 417 parents, 173 (41.5%) agreed to participate in the study. 35 (20.2%) children were diagnosed with BA. Patients were 26.8 months old at the time of admission (σ=7.8), 78.5 months old at the time of the survey (σ=10.0), respectively. fAPI showed the following parameters of predictivity: sensitivity 71.4%, specificity 71.7%, positive prognostic value (PPV) 39.1%, negative prognostic value (NPV) 90.8%. For rAPI the indicators were 50.0%, 87.6%, 53.1% and 86.2%, respectively.
Conclusions: the predictive ability of the API in the Russian population is comparable to that of the original study. High NPV indicates a good ability of API, especially “free” API, to exclude the development of BA in the future. However, the tool’s ability to predict the probability of BA development leaves much to be desired. Subsequent studies should aim to improve the predictive ability of the instrument by modifying it.
Keywords: asthma index, bronchial asthma, allergic diseases, API, sensitivity, specificity.
For citation: Petrova Yu.V., Katrysheva A.S., Koroleva D.R. et al. Asthma Predictive Index (API) validation in the Russian population: pilot study data. RMJ. Medical Review. 2019;2(I):2–6.
В статье представлены результаты пилотного исследования посвященного валидизации предиктивного индекса астмы (API) в российской популяции.
Введение
Бронхиальная астма (БА) — гетерогенное хроническое заболевание, проявляющееся целым спектром таких респираторных симптомов, как свистящие хрипы, бронхообструкция, затрудненное дыхание, ощущение стеснения в грудной клетке и кашель [1]. Астма является значимой проблемой для здравоохранения, от данной патологии страдают около 300 млн людей во всем мире [2]. Каждый пятый школьник переносит хотя бы один эпизод бронхообструкции в течение года [3]. Распространенность БА варьирует от одного географического региона к другому, достигая наиболее высоких цифр в развитых странах [4].Постановка диагноза БА в раннем возрасте представляет собой определенную сложность, т. к. маленькие дети не могут осуществить необходимые дыхательные маневры при проведении диагностических тестов [5]. Оценка данных исследования функции внешнего дыхания (ФВД) у детей в возрасте до 5 лет возможна исключительно в высокоспециализированных академических учреждениях. Эпизоды свистящих хрипов — достаточно распространенное явление среди детей раннего возраста, при этом только у небольшого количества детей, у которых отмечались эпизоды свистящего дыхания в раннем возрасте, развивается БА в будущем [6]. Проблема прогрессирования свиста при БА по-прежнему остается не до конца ясной. Считается, что есть некоторая зависимость от «фенотипа свистящих хрипов» [7], однако причины этой взаимосвязи по-прежнему непонятны [8]. Разница в применяемой методологии может объяснить расхождения в результатах исследований. Возможно, применение многофакторного анализа (например, латентного кластерного анализа) может помочь в определении клинически значимых фенотипов [9].
Ранние эпизоды свистящих хрипов являются поводом для беспокойства большого числа семей, а также несут большие издержки для системы здравоохранения [10]. Так, в США прямые расходы оцениваются в 50,1 млрд долл. (наибольшие затраты связаны с госпитализацией), а непрямые составляют 5,9 млрд долл. [11]. Проактивный подход к лечению аллергических заболеваний продемонстрировал несомненные преимущества в масштабах страны. Наиболее ярким примером является Национальная программа астмы (Финляндия), реализованная в 1994–2004 гг., которая ставила своей основной целью улучшение качества ухода за больным БА и предотвращение роста затрат, связанных с данным заболеванием [12]. Итогом стало снижение издержек национальной системы здравоохранения, уменьшение количества незапланированных визитов к врачу, сокращение числа смертельных исходов, связанных с БА, и общих расходов на БА.
Наличие инструментов, с помощью которых можно предсказать вероятность развития БА у детей с эпизодами свистящих хрипов в первые 3 года жизни, может предоставить дополнительные возможности для разработки новых превентивных стратегий [13]. Это также позволит выявить наиболее уязвимые категории детей, находящихся в группе высокого риска по развитию данного заболевания и, возможно, расширить существующие знания о «фенотипах свистящего дыхания». Данная неудовлетворенная потребность привела к активному росту числа исследований, направленных на разработку предиктивных моделей развития БА. Самым первым предиктивным инструментом, учитывающим факторы риска, отмечавшиеся у детей в течение первых 3 лет жизни, стал предиктивный индекс астмы (Asthma Predictive Index, API), разработанный в рамках Tucson Children’s Respiratory Study [14]. Отрицательный API в возрасте 2–3 лет с вероятностью 91–94% свидетельствовал о том, что у ребенка не разовьется астма к 6–8 годам, однако положительный API не обладал положительной прогностической значимостью (PPV) (26–29%).
С момента своего создания API используется во всех странах мира. Несмотря на свои недостатки, он является самым популярным инструментом прогнозирования развития БА у детей. Данное пилотное исследование ставит целью провести валидизацию индекса API в российской популяции и оценить его предиктивные возможности.
Материал и методы
Исследование проводилось на базе ГБУЗ «ДГКБ № 9 им. Г.Н. Сперанского ДЗМ» (ДГКБ № 9) после получения одобрения локального этического комитета. Алгоритм проведения исследования представлен на рисунке 1.
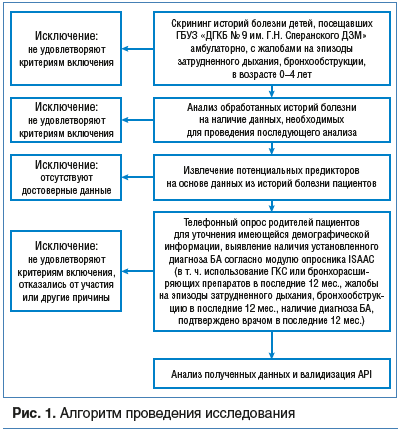
Нами был проведен ретроспективный анализ историй болезни всех детей в возрасте от 0 до 4 лет, поступивших в ДГКБ № 9 с диагнозом «обструктивный бронхит» в 2013 г., а также интервьюирование матерей по достижении детьми возраста 6–7 лет. Собранная информация включала: возраст матери; пол ребенка; возраст ребенка на момент госпитализации; возраст ребенка на момент опроса для уточнения наличия диагноза БА; аллергоанамнез родителей; аллергоанамнез ребенка; уровень эозинофилов в крови на момент госпитализации; наличие эпизодов бронхообструкции (свистящего дыхания или свистов в грудной клетке) в первые 3 года жизни, а также их частоту.
Критерии индекса API
В основе индекса API лежат комбинации больших и малых критериев. К большим критериям относятся: наличие диагноза БА у одного или обоих родителей пациента, диагностированный врачом атопический дерматит у ребенка; к малым: наличие диагностированного врачом аллергического ринита у ребенка, наличие эпизодов бронхообструкции вне вирусной инфекции, уровень эозинофилов в крови ≥4%.В данной работе была исследована предиктивная способность двух разновидностей API: жесткого API (жAPI) и свободного API (сAPI). Для того чтобы API считался положительным, необходимо сочетание следующих критериев:
сAPI — ранние бронхообструкции + минимум 1 большой критерий или 2 малых критерия;
жAPI — ранние частые бронхообструкции + минимум 1 большой критерий или 2 малых критерия (строгий API).
Ранними бронхообструкциями в рамках данного исследования считали наличие хотя бы 1 эпизода в первые 3 года жизни; ранними частыми бронхообструкциями — частоту эпизодов ≥3 по шкале от 1 (очень редко) до 5 (большую часть времени).
Использованные в исследовании критерии API полностью идентичны тем, которые были применены в оригинальном исследовании Castro-Rodriguez et al. [14].
Определение БА в рамках исследования
По достижении ребенком возраста 6–7 лет его родители были опрошены относительно наличия эпизодов бронхообструкции в течение последнего года и их частоты. В рамках данного исследования БА определяется как наличие диагноза БА, поставленного врачом, и как минимум 1 эпизода бронхообструкции в течение предыдущего года или более 3 эпизодов бронхообструкции в течение последнего года, вне зависимости от диагноза БА, поставленного врачом.Статистический анализ
В рамках статистического анализа была оценена чувствительность, специфичность, положительная прогностическая ценность (PPV) и отрицательная прогностическая ценность (NPV) для обеих разновидностей API в отношении развития БА у детей в возрасте 6–7 лет. Чувствительность определяется как вероятность того, что у ребенка, у которого в возрасте 6–7 лет развилась БА, ранее отмечался положительный API. Специфичность определяется как вероятность того, что у ребенка, у которого в возрасте 6–7 лет не развилась БА, ранее отмечался отрицательный API. PPV определяется как вероятность того, что у ребенка с положительным API диагностировалась БА в возрасте 6–7 лет. NPV определяется как вероятность того, что ребенку с отрицательным API не была диагностирована БА в возрасте 6–7 лет.Для оценки предиктивных способностей API был использован метод хи-квадрат.
Результаты исследования
Характеристики участников исследования
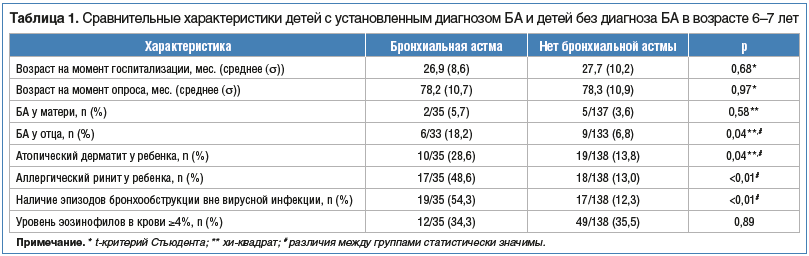
Из 417 родителей 173 (41,5%) дали добровольное согласие на участие в исследовании и предоставили все необходимые для определения API данные. 35 (20,2%) детям был поставлен диагноз БА. Средний возраст пациентов на момент госпитализации составлял 26,8 мес. (σ=7,8), на момент опроса — 78,5 мес. (σ=10,0) соответственно. Статистически значимой разницы между детьми, у которых диагностирована БА к возрасту 6–7 лет, и детьми без симптомов БА выявлено не было.Характеристики участников исследования в зависимости от наличия диагноза БА представлены в таблице 1.
Риск развития БА и предиктивная способность API
Дети с положительным cAPI имели в 6,3 раза более высокий риск развития БА в возрасте 6–7 лет, чем пациенты с отрицательным cAPI. В то же время риск развития БА в возрасте 6–7 лет увеличивался до 7,1 у детей с положительным жAPI.В результате статистического анализа была дана оценка предиктивной способности двух разновидностей API. Свободный API показал следующие параметры предиктивности: чувствительность — 71,4%, специфичность — 71,7%, PPV — 39,1%, NPV — 90,8%.
Жесткий API характеризовался следующими предиктивными способностями: чувствительность — 50,0%, специфичность — 87,6%, PPV — 53,1%, NPV — 86,2%. Показатели предиктивности API, по данным нашего исследования, а также по результатам оригинального исследования Castro-Rodriguez et al. [14] и валидизационного исследования Rodriguez-Martinez (2011), приведены в таблице 2.
![Таблица 2. Сравнение предиктивной способности API, показанной в оригинальном исследовании Castro-Rodriguez (2000) [14], валидизационном исследовании на детях из группы высокого риска Rodriguez-Martinez (2011) [15] и нашем исследовании Таблица 2. Сравнение предиктивной способности API, показанной в оригинальном исследовании Castro-Rodriguez (2000) [14], валидизационном исследовании на детях из группы высокого риска Rodriguez-Martinez (2011) [15] и нашем исследовании](/upload/medialibrary/e87/2-3.png)
Обсуждение
Обычно БА диагностируется на основании клинических симптомов, а также наличия атопии в анамнезе и снижения параметров ФВД. Однако в связи с отсутствием высокоспецифичных критериев, позволяющих с уверенностью поставить диагноз БА пациентам данной возрастной группы, диагностика БА у детей первых лет жизни до сих пор вызывает сложности [16, 17]. Маленькие дети не могут осуществить необходимые дыхательные маневры при проведении диагностических тестов [5], и выполнение спирометрии представляется возможным только в высокоспециализированных учреждениях. Таким образом, специалистам приходится ориентироваться на клинические проявления, т. е. на эпизоды свистящего дыхания. Сами по себе эпизоды свистящего дыхания является не заболеванием, а симптомокомплексом [18] и часто встречаются у детей раннего возраста. При этом только у небольшого количества детей с эпизодами бронхиальной обструкции в раннем возрасте развивалась БА в будущем [6]. Проблема прогрессирования бронхиальных обструкций раннего возраста в БА по-прежнему остается не до конца ясной.На особую значимость ранних эпизодов бронхообструкции указывают исследования [19–21], показавшие, что более 80% всех случаев БА начинаются в первые 3 года жизни, проявляясь повторными эпизодами обструкции нижних дыхательных путей на фоне респираторной инфекции [22].
Вопросы прогнозирования развития БА и ее ранней диагностики актуальны как для семей пациентов, так и для системы здравоохранения. Отсроченный диагноз БА
(в среднем на 3,3 года) имеет место у 2/3 детей и влечет за собой неадекватную терапию или ее отсутствие. Своевременная диагностика и раннее начало лечения БА связаны с такими долгосрочными преимуществами, как меньшее количество респираторных симптомов; уменьшение дозы противовоспалительных препаратов, необходимых для контроля БА; уменьшение числа побочных эффектов лечения; снижение потребности в дополнительных препаратах, использовании антибактериальных средств; уменьшение количества обострений заболевания и пропусков школьных занятий; сохранение функции легких и предотвращение ремоделирования дыхательных путей; снижение риска смертельного исхода и улучшение качества жизни пациента.
Попытки разработать предиктивный инструмент предпринимались как в общей популяции [14, 23–30], так и у детей группы риска [31–40]. Первым и наиболее широко известным инструментом, прогнозирующим развитие БА в будущем, стал API, а точнее, две его разновидности — сAPI и жAPI. В данном пилотном исследовании была проведена оценка предиктивной способности обеих разновидностей API в российской популяции. Валидизация предиктивных инструментов развития БА в условиях разных популяций является важнейшим критерием для подтверждения жизнеспособности модели, т. к. количество валидационных исследований очень ограниченно [15, 41–44], их результаты пока не позволяют рекомендовать применение какойлибо модели в клинической практике.
В рамках проведенного пилотного исследования сAPI и жAPI показали предиктивность, сравнимую с данными оригинального исследования Castro-Rodriguez et al., несмотря на то, что в нашей работе были использованы данные пациентов группы высокого риска. Было показано, что наличие положительного cAPI и жAPI связано с намного более высоким риском развития БА в возрасте 6–7 лет. Сильной стороной API также является способность исключать развитие астмы в будущем, однако низкая положительная прогностическая ценность API не позволяет рекомендовать его к применению в рутинной клинической практике. Возможно, модификация API путем добавления дополнительных критериев позволит улучшить его предиктивные способности.
Заключение
Несмотря на попытки клиницистов и ученых разработать качественный инструмент, позволяющий с высокой уверенностью прогнозировать вероятность развития БА, на сегодняшний день нет модели, которая бы показала высокую эффективность, удобство в применении и воспроизводимость в различных популяциях. Основными недостатками существующих инструментов являются гетерогенность данных (например, большой спектр предикторов и различия в определении диагноза БА) исследований, а также большие различия в распространенности БА между исследуемыми популяциями. Персистирование свистящих хрипов, часто используемое в качестве одного из потенциальных предикторов, не может быть достоверно оценено проспективно, что делает невозможным применение данного предиктора в клинической практике [45].
Литература
1. Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention. 2016.
2. Masoli M., Fabian D., Holt S. et al. The global burden of asthma: executive summary of the GINA Dissemination Committee report. Allergy. 2004;59(5):469–478.
3. Lai C.K., Beasley R., Crane J. et al. Global variation in the prevalence and severity of asthma symptoms: phase three of the International Study of Asthma and Allergies in Childhood (ISAAC). Thorax. 2009;64(6):476–483.
4. Asher M.I., Montefort S., Bjorksten B. et al. Worldwide time trends in the prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and eczema in childhood: ISAAC Phases One and Three repeat multicountry cross-sectional surveys. Lancet. 2006;368(9537):733–743.
5. Nystad W., Samuelsen S.O., Nafstad P. et al. Feasibility of measuring lung function in preschool children. Thorax. 2002;57(12):1021–1027.
6. Martinez F.D., Wright A.L., Taussig L.M. et al. Asthma and wheezing in the first six years of life. The Group Health Medical Associates. N Engl J Med. 1995;332(3):133–138.
7. Henderson J., Granell R., Heron J. et al. Associations of wheezing phenotypes in the first 6 years of life with atopy, lung function and airway responsiveness in mid-childhood. Thorax. 2008;63(11):974–980.
8. Spycher B.D., Silverman M., Kuehni C.E. Phenotypes of childhood asthma: are they real? Clin Exp Allergy. 2010;40(8):1130–1141.
9. Spycher B.D., Silverman M., Brooke A.M. et al. Distinguishing phenotypes of childhood wheeze and cough using latent class analysis. Eur Respir J. 2008;31(5):974–981.
10. Stevens C.A., Turner D., Kuehni C.E. et al. The economic impact of preschool asthma and wheeze. Eur Respir J. 2003;21(6):1000–1006.
11. Barnett S.B., Nurmagambetov T.A. Costs of asthma in the United States: 2002–2007. J Allergy Clin Immunol. 2011;127(1):145–152.
12. Haahtela T., Tuomisto L.E., Pietinalho A. et al. A 10 year asthma programme in Finland: major change for the better. Thorax. 2006;61(8):663–670.
13. Guilbert T.W., Mauger D.T., Lemanske R.F. Jr. Childhood asthma-predictive phenotype. J Allergy Clin Immunol Pract. 2014;2(6):664–670.
14. Castro-Rodriguez J.A., Holberg C.J., Wright A.L., Martinez F.D. A clinical index to define risk of asthma in young children with recurrent wheezing. Am J Respir Crit Care Med. 2000;162(4 Pt 1):1403–1406.
15. Rodriguez-Martinez C.E., Sossa-Briceno M.P., Castro-Rodriguez J.A. Discriminative properties of two predictive indices for asthma diagnosis in a sample of preschoolers with recurrent wheezing. Pediatric Pulmonology. 2011;46(12):1175–1181.
16. Bush A., Grigg J., Saglani S. Managing wheeze in preschool children. BMJ. 2014;348:g15.
17. De Benedictis F.M., Bush A. Infantile wheeze: rethinking dogma. Arch Dis Child. 2017;102(4):371–375.
18. Ducharme F.M., Tse S.M., Chauhan B. Diagnosis, management, and prognosis of preschool wheeze. Lancet. 2014;383(9928):1593–1604.
19. Bisgaard H., Hermansen M.N., Bonnelykke K. et al. Association of bacteria and viruses with wheezy episodes in young children: prospective birth cohort study. BMJ. 2010;341:c4978.
20. Kloepfer K.M., Lee W.M., Pappas T.E. et al. Detection of pathogenic bacteria during rhinovirus infection is associated with increased respiratory symptoms and asthma exacerbations. J Allergy Clin Immunol. 2014;133(5):1301–1307.
21. Stokholm J., Chawes B.L., Vissing N.H. et al. Azithromycin for episodes with asthma-like symptoms in young children aged 1–3 years: a randomised, double-blind, placebo-controlled trial. Lancet Respir Med. 2016;4(1):19–26.
22. Мизерницкий Ю.Л., Павленко В.А., Мельникова И.М. Клинико-функциональные критерии прогноза бронхиальной астмы в раннем детском возрасте. Российский вестник перинатологии и педиатрии. 2015;4:82–88 [Mizernitsky Yu.L., Pavlenko B.A., Melnikova I.M. Clinical and functional criteria for the prediction of bronchial asthma in early childhood. Russian Bulletin of Perinatology and Pediatrics. 2015;4:82–88 (in Russ.)].
23. Balemans W.A.F., van der Ent C.K., Schilder A.G.M. et al. Prediction of asthma in young adults using childhood characteristics: Development of a prediction rule. Journal of Clinical Epidemiology. 2006;59(11):1207–1212.
24. Hunger T., Rzehak P., Wichmann H.E., Heinrich J. Prognostic values of specific respiratory sounds for asthma in adolescents. Eur J Pediatr. 2010;169(1):39–46.
25. Lodrup Carlsen K.C., Soderstrom L., Mowinckel P. et al. Asthma prediction in school children; The value of combined IgE-antibodies and obstructive airways disease severity score. Allergy: European Journal of Allergy and Clinical Immunology. 2010;65(9):1134–1140.
26. Van der Werff S.D., Junco Diaz R., Reyneveld R. et al. Prediction of asthma by common risk factors: a follow-up study in Cuban schoolchildren. J Investig Allergol Clin Immunol. 2013;23(6):415–420.
27. Cano-Garcinuno A., Mora-Gandarillas I., Group S.S. Wheezing phenotypes in young children: an historical cohort study. Primary Care Respiratory Journal. 2014;23(1):60–66.
28. Pescatore A.M., Dogaru C.M., Duembgen L. et al. A simple asthma prediction tool for preschool children with wheeze or cough. Journal of Allergy and Clinical Immunology. 2014;133(1):111–118.
29. Van der Mark L.B., van Wonderen K.E., Mohrs J. et al. Predicting asthma in preschool children at high risk presenting in primary care: Development of a clinical asthma prediction score. Primary Care Respiratory Journal. 2014;23(1):52–59.
30. Ro A.D., Simpson M.R., Storro O. et al. The predictive value of allergen skin prick tests and IgE tests at pre-school age: The PACT study. Pediatric Allergy and Immunology. 2014;25(7):691–698.
31. Kotaniemi-Syrjanen A., Reijonen T.M., Romppanen J. et al. Allergen-specific immunoglobulin E antibodies in wheezing infants: the risk for asthma in later childhood. Pediatrics. 2003;111(3):e255– e261.
32. Eysink P.E.D., ter Riet G., Aalberse R.C. et al. Accuracy of specific IgE in the prediction of asthma: Development of a scoring formula for general practice. British Journal of General Practice. 2005;55(511):125–131.
33. Hyvarinen M.K., Kotaniemi-Syrjanen A., Reijonen T.M. et al. Teenage asthma after severe early childhood wheezing: an 11-year prospective follow-up. Pediatric Pulmonology. 2005;40(4):316–323.
34. Jackson D.J., Gangnon R.E., Evans M.D. et al. Wheezing rhinovirus illnesses in early life predict asthma development in high-risk children. Am J Respir Crit Care Med. 2008;178(7):667–672.
35. Caudri D., Wijga A., CM A.S. et al. Predicting the long-term prognosis of children with symptoms suggestive of asthma at preschool age. Journal of Allergy and Clinical Immunology. 2009;124(5):903–910.
36. Caudri D., Wijga A.H., Hoekstra M.O. et al. Prediction of asthma in symptomatic preschool children using exhaled nitric oxide, Rint and specific IgE. Thorax. 2010;65(9):801–807.
37. Chang T.S., Lemanske R.F., Guilbert T.W. et al. Evaluation of the modified asthma predictive index in high-risk preschool children. Journal of Allergy and Clinical Immunology: In Practice. 2013;1(2):152–156.
38. Chatzimichail E., Paraskakis E., Sitzimi M., Rigas A. An intelligent system approach for asthma prediction in symptomatic preschool children. Computational and mathematical methods in medicine. 2013;2013:240182.
39. Sahiner U.M., Buyuktiryaki B., Cavkaytar O. et al. Recurrent wheezing in the first three years of life: short-term prognosis and risk factors. Journal of Asthma. 2013;50(4):370–375.
40. Amin P., Levin L., Epstein T. et al. Optimum Predictors of Childhood Asthma: Persistent Wheeze or the Asthma Predictive Index? Journal of Allergy and Clinical Immunology: In Practice. 2014;2(6):709–715.
41. Devulapalli C.S., Carlsen K.C., Haland G. et al. Severity of obstructive airways disease by age 2 years predicts asthma at 10 years of age. Thorax. 2008;63(1):8–13.
42. Leonardi N.A., Spycher B.D., Strippoli M.P.F. et al. Validation of the Asthma Predictive Index and comparison with simpler clinical prediction rules. Journal of Allergy and Clinical Immunology. 2011;127(6):1466–1472.e6.
43. Hafkamp-de Groen E., Lingsma H.F., Caudri D. et al. Predicting asthma in preschool children with asthma-like symptoms: validating and updating the PIAMA risk score. Journal of Allergy and Clinical Immunology. 2013;132(6):1303–1310.
44. Grabenhenrich L.B., Reich A., Fischer F. et al. The novel 10-item asthma prediction,tool: external validation in the german, MAS Birth cohort. PLoS ONE. 2014;9(12):e115852.
45. Brand P.L., Baraldi E., Bisgaard H. et al. Definition, assessment and treatment of wheezing disorders in preschool children: an evidence-based approach. Eur Respir J. 2008;32(4):1096–1110.
2. Masoli M., Fabian D., Holt S. et al. The global burden of asthma: executive summary of the GINA Dissemination Committee report. Allergy. 2004;59(5):469–478.
3. Lai C.K., Beasley R., Crane J. et al. Global variation in the prevalence and severity of asthma symptoms: phase three of the International Study of Asthma and Allergies in Childhood (ISAAC). Thorax. 2009;64(6):476–483.
4. Asher M.I., Montefort S., Bjorksten B. et al. Worldwide time trends in the prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and eczema in childhood: ISAAC Phases One and Three repeat multicountry cross-sectional surveys. Lancet. 2006;368(9537):733–743.
5. Nystad W., Samuelsen S.O., Nafstad P. et al. Feasibility of measuring lung function in preschool children. Thorax. 2002;57(12):1021–1027.
6. Martinez F.D., Wright A.L., Taussig L.M. et al. Asthma and wheezing in the first six years of life. The Group Health Medical Associates. N Engl J Med. 1995;332(3):133–138.
7. Henderson J., Granell R., Heron J. et al. Associations of wheezing phenotypes in the first 6 years of life with atopy, lung function and airway responsiveness in mid-childhood. Thorax. 2008;63(11):974–980.
8. Spycher B.D., Silverman M., Kuehni C.E. Phenotypes of childhood asthma: are they real? Clin Exp Allergy. 2010;40(8):1130–1141.
9. Spycher B.D., Silverman M., Brooke A.M. et al. Distinguishing phenotypes of childhood wheeze and cough using latent class analysis. Eur Respir J. 2008;31(5):974–981.
10. Stevens C.A., Turner D., Kuehni C.E. et al. The economic impact of preschool asthma and wheeze. Eur Respir J. 2003;21(6):1000–1006.
11. Barnett S.B., Nurmagambetov T.A. Costs of asthma in the United States: 2002–2007. J Allergy Clin Immunol. 2011;127(1):145–152.
12. Haahtela T., Tuomisto L.E., Pietinalho A. et al. A 10 year asthma programme in Finland: major change for the better. Thorax. 2006;61(8):663–670.
13. Guilbert T.W., Mauger D.T., Lemanske R.F. Jr. Childhood asthma-predictive phenotype. J Allergy Clin Immunol Pract. 2014;2(6):664–670.
14. Castro-Rodriguez J.A., Holberg C.J., Wright A.L., Martinez F.D. A clinical index to define risk of asthma in young children with recurrent wheezing. Am J Respir Crit Care Med. 2000;162(4 Pt 1):1403–1406.
15. Rodriguez-Martinez C.E., Sossa-Briceno M.P., Castro-Rodriguez J.A. Discriminative properties of two predictive indices for asthma diagnosis in a sample of preschoolers with recurrent wheezing. Pediatric Pulmonology. 2011;46(12):1175–1181.
16. Bush A., Grigg J., Saglani S. Managing wheeze in preschool children. BMJ. 2014;348:g15.
17. De Benedictis F.M., Bush A. Infantile wheeze: rethinking dogma. Arch Dis Child. 2017;102(4):371–375.
18. Ducharme F.M., Tse S.M., Chauhan B. Diagnosis, management, and prognosis of preschool wheeze. Lancet. 2014;383(9928):1593–1604.
19. Bisgaard H., Hermansen M.N., Bonnelykke K. et al. Association of bacteria and viruses with wheezy episodes in young children: prospective birth cohort study. BMJ. 2010;341:c4978.
20. Kloepfer K.M., Lee W.M., Pappas T.E. et al. Detection of pathogenic bacteria during rhinovirus infection is associated with increased respiratory symptoms and asthma exacerbations. J Allergy Clin Immunol. 2014;133(5):1301–1307.
21. Stokholm J., Chawes B.L., Vissing N.H. et al. Azithromycin for episodes with asthma-like symptoms in young children aged 1–3 years: a randomised, double-blind, placebo-controlled trial. Lancet Respir Med. 2016;4(1):19–26.
22. Мизерницкий Ю.Л., Павленко В.А., Мельникова И.М. Клинико-функциональные критерии прогноза бронхиальной астмы в раннем детском возрасте. Российский вестник перинатологии и педиатрии. 2015;4:82–88 [Mizernitsky Yu.L., Pavlenko B.A., Melnikova I.M. Clinical and functional criteria for the prediction of bronchial asthma in early childhood. Russian Bulletin of Perinatology and Pediatrics. 2015;4:82–88 (in Russ.)].
23. Balemans W.A.F., van der Ent C.K., Schilder A.G.M. et al. Prediction of asthma in young adults using childhood characteristics: Development of a prediction rule. Journal of Clinical Epidemiology. 2006;59(11):1207–1212.
24. Hunger T., Rzehak P., Wichmann H.E., Heinrich J. Prognostic values of specific respiratory sounds for asthma in adolescents. Eur J Pediatr. 2010;169(1):39–46.
25. Lodrup Carlsen K.C., Soderstrom L., Mowinckel P. et al. Asthma prediction in school children; The value of combined IgE-antibodies and obstructive airways disease severity score. Allergy: European Journal of Allergy and Clinical Immunology. 2010;65(9):1134–1140.
26. Van der Werff S.D., Junco Diaz R., Reyneveld R. et al. Prediction of asthma by common risk factors: a follow-up study in Cuban schoolchildren. J Investig Allergol Clin Immunol. 2013;23(6):415–420.
27. Cano-Garcinuno A., Mora-Gandarillas I., Group S.S. Wheezing phenotypes in young children: an historical cohort study. Primary Care Respiratory Journal. 2014;23(1):60–66.
28. Pescatore A.M., Dogaru C.M., Duembgen L. et al. A simple asthma prediction tool for preschool children with wheeze or cough. Journal of Allergy and Clinical Immunology. 2014;133(1):111–118.
29. Van der Mark L.B., van Wonderen K.E., Mohrs J. et al. Predicting asthma in preschool children at high risk presenting in primary care: Development of a clinical asthma prediction score. Primary Care Respiratory Journal. 2014;23(1):52–59.
30. Ro A.D., Simpson M.R., Storro O. et al. The predictive value of allergen skin prick tests and IgE tests at pre-school age: The PACT study. Pediatric Allergy and Immunology. 2014;25(7):691–698.
31. Kotaniemi-Syrjanen A., Reijonen T.M., Romppanen J. et al. Allergen-specific immunoglobulin E antibodies in wheezing infants: the risk for asthma in later childhood. Pediatrics. 2003;111(3):e255– e261.
32. Eysink P.E.D., ter Riet G., Aalberse R.C. et al. Accuracy of specific IgE in the prediction of asthma: Development of a scoring formula for general practice. British Journal of General Practice. 2005;55(511):125–131.
33. Hyvarinen M.K., Kotaniemi-Syrjanen A., Reijonen T.M. et al. Teenage asthma after severe early childhood wheezing: an 11-year prospective follow-up. Pediatric Pulmonology. 2005;40(4):316–323.
34. Jackson D.J., Gangnon R.E., Evans M.D. et al. Wheezing rhinovirus illnesses in early life predict asthma development in high-risk children. Am J Respir Crit Care Med. 2008;178(7):667–672.
35. Caudri D., Wijga A., CM A.S. et al. Predicting the long-term prognosis of children with symptoms suggestive of asthma at preschool age. Journal of Allergy and Clinical Immunology. 2009;124(5):903–910.
36. Caudri D., Wijga A.H., Hoekstra M.O. et al. Prediction of asthma in symptomatic preschool children using exhaled nitric oxide, Rint and specific IgE. Thorax. 2010;65(9):801–807.
37. Chang T.S., Lemanske R.F., Guilbert T.W. et al. Evaluation of the modified asthma predictive index in high-risk preschool children. Journal of Allergy and Clinical Immunology: In Practice. 2013;1(2):152–156.
38. Chatzimichail E., Paraskakis E., Sitzimi M., Rigas A. An intelligent system approach for asthma prediction in symptomatic preschool children. Computational and mathematical methods in medicine. 2013;2013:240182.
39. Sahiner U.M., Buyuktiryaki B., Cavkaytar O. et al. Recurrent wheezing in the first three years of life: short-term prognosis and risk factors. Journal of Asthma. 2013;50(4):370–375.
40. Amin P., Levin L., Epstein T. et al. Optimum Predictors of Childhood Asthma: Persistent Wheeze or the Asthma Predictive Index? Journal of Allergy and Clinical Immunology: In Practice. 2014;2(6):709–715.
41. Devulapalli C.S., Carlsen K.C., Haland G. et al. Severity of obstructive airways disease by age 2 years predicts asthma at 10 years of age. Thorax. 2008;63(1):8–13.
42. Leonardi N.A., Spycher B.D., Strippoli M.P.F. et al. Validation of the Asthma Predictive Index and comparison with simpler clinical prediction rules. Journal of Allergy and Clinical Immunology. 2011;127(6):1466–1472.e6.
43. Hafkamp-de Groen E., Lingsma H.F., Caudri D. et al. Predicting asthma in preschool children with asthma-like symptoms: validating and updating the PIAMA risk score. Journal of Allergy and Clinical Immunology. 2013;132(6):1303–1310.
44. Grabenhenrich L.B., Reich A., Fischer F. et al. The novel 10-item asthma prediction,tool: external validation in the german, MAS Birth cohort. PLoS ONE. 2014;9(12):e115852.
45. Brand P.L., Baraldi E., Bisgaard H. et al. Definition, assessment and treatment of wheezing disorders in preschool children: an evidence-based approach. Eur Respir J. 2008;32(4):1096–1110.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
