Пациент с тяжелой бронхиальной астмой: биологическая терапия vs системные кортикостероиды
DOI: 10.32364/2587-6821-2022-6-7-393-398
Тяжелая бронхиальная астма (ТБА) ассоциирована со значительным снижением качества жизни и увеличением летальности. Среди пациентов с бронхиальной астмой доля ТБА составляет 3–10%. Диагноз ТБА подразумевает использование высоких доз ингаляционных глюкокортикостероидов (ИГКС) и длительно действующих бета-2-агонистов (ДДБА) или фиксированной комбинации ИГКС/ДДБА с длительно действующими антихолинергическими (ДДАХ) препаратами. При неэффективности такой терапии пациентам зачастую назначаются системные глюкокортикостероиды (СГКС), использование которых связано с повышенным риском нежелательных явлений, в том числе переломов, нарушений углеводного обмена, желудочно-кишечных кровотечений, инфекций и нарушений зрения. Развитие ТБА у большинства пациентов связано с активацией Т2-воспаления, при котором отмечается высокий уровень эозинофилов в периферической крови, ассоциированный с повышенной частотой обострений и резистентностью к стандартной противовоспалительной терапии. Подавление активности эозинофилов является перспективным направлением патогенетической терапии ТБА. Современная биологическая терапия моноклональными антителами позволяет улучшить контроль заболевания, снизить количество обострений и дозу СГКС вплоть до их полной отмены. В настоящее время таргетная терапия ТБА включает препараты, действие которых направлено на циркулирующие ИЛ-5 (меполизумаб, реслизумаб), альфа-субъединицу ИЛ-5RA (бенрализумаб) и альфа-субъединицу рецептора ИЛ-4 (дупилумаб). Бенрализумаб индуцирует активный апоптоз эозинофилов, вызывая быстрое и почти полное истощение эозинофилов в крови и тканях-мишенях. В статье рассмотрены результаты ключевых клинических исследований бенрализумаба и выполнен разбор клинического наблюдения.
Ключевые слова: тяжелая бронхиальная астма, биологическая терапия, бенрализумаб, интерлейкин-5, эозинофильное воспаление, системные глюкокортикостероиды.
Для цитирования: Титова О.Н., Кузубова Н.А., Склярова Д.Б. Пациент с тяжелой бронхиальной астмой: биологическая терапия vs системные кортикостероиды. РМЖ. Медицинское обозрение. 2022;6(7):393-398. DOI: 10.32364/2587-6821-2022-6-7-393-398.
O.N. Titova, N.A. Kuzubova, D.B. Sklyarova
I.P. Pavlov First St. Petersburg State Medical University, St. Petersburg, Russian Federation
Severe bronchial asthma (SBA) is associated with a significantly lower quality of life and increased mortality. The prevalence of SBA is 3–10% of all patients with asthma. The diagnosis of SBA means that patients require high doses of inhaled corticosteroids/long-acting beta agonists (ICS/LABA) or a fixed dose combination of ICS/LABA and long-acting anticholinergics (ICS/LABA/LAAC). If the above therapy is not effective, systemic glucocorticoids (GCs) are commonly prescribed to treat patients with SBA. However, their use increases the risk of such adverse events as fractures, disorders of carbohydrate metabolism, gastrointestinal bleeding, infections, and visual disturbances. In most cases the SBA development is linked to T2-high inflammation which is manifested by elevated eosinophil level in the peripheral blood. In turn, eosinophilia is associated with an increased rate of asthma exacerbations and resistance to the standard anti-inflammatory therapy. Suppression of eosinophil activity is a promising approach to pathogenetic therapy of SBA. The up-to-date biological therapy with monoclonal antibodies helps to improve asthma control, reduce the number of exacerbations and to reduce systemic GCs or even to avoid them. Currently, targeted therapy for SBA includes medicines to circulating IL-5 (mepolizumab, reslizumab), its receptor alpha-subunit, IL-5RA (benralizumab), or IL-4 receptor alpha-subunit (dupilumab). Benralizumab induces potent eosinophil apoptosis, resulting in rapid and nearly complete depletion of eosinophils in the blood and target tissues.
Keywords: severe bronchial asthma, biological therapy, benralizumab, interleukin-5, eosinophilic inflammation, systemic corticosteroids.
For citation: Titova O.N., Kuzubova N.A., Sklyarova D.B. A patient with severe bronchial asthma: biological therapy vs systemic corticosteroids. Russian Medical Inquiry. 2022;6(7):393–398 (in Russ.). DOI: 10.32364/2587-6821-2022-6-7-393-398.
Введение
Тяжелая бронхиальная астма (ТБА) — форма трудно поддающейся лечению бронхиальной астмы (БА), которая остается неконтролируемой, несмотря на приверженность максимально оптимизированной терапии и лечению сопутствующих заболеваний, или ухудшается при снижении высоких доз глюкокортикостероидов (ГКС) [1].
Согласно рекомендациям Global Initiative for Asthma за 2022 г. (GINA 2022) предпочтительными препаратами для 5-й ступени терапии БА являются высокие дозы ингаляционных глюкокортикостероидов (ИГКС) и длительно действующих β2-агонистов (ДДБА) или тройных фиксированных комбинаций ИГКС/ДДБА с длительно действующими антихолинергическими (ДДАХ) препаратами [2]. Применение системных глюкокортикостероидов (СГКС) рекомендовано только в качестве альтернативы другим группам препаратов. GINA 2022 рекомендует проводить короткие (5–7 дней) курсы терапии СГКС только при обострениях БА. Длительное применение этих препаратов не рекомендуется из-за повышенного риска развития нежелательных явлений (НЯ). Однако, по данным литературы, порядка 15–57% пациентов с тяжелой или рефрактерной БА постоянно используют СГКС [3–6]. Так, в США примерно 15–22% пациентов с ТБА постоянно получают СГКС, в Европе — 46–57%, в частности в Италии — 62% [4–6].
Первые сообщения о повышенной частоте переломов, нарушениях углеводного обмена, желудочно-кишечных кровотечениях, инфекциях и нарушениях зрения у пациентов, длительно принимающих СГКС в дозах 20–60 мг/сут, появились в 1950-е годы [7]. Уже с 1990-х медицинские специалисты стремятся применять более низкие (5 мг/сут) дозы СГКС или использовать альтернативные лекарственные средства (ЛС) [7]. Однако даже низкая (0,5–1 г) кумулятивная доза СГКС может стать причиной серьезных неблагоприятных исходов [8]. Кроме того, риск НЯ повышается с увеличением накопительной дозы СГКС [8]. Применение СГКС ассоциировано со снижением качества жизни, увеличением затрат системы здравоохранения и показателей смертности [9]. Учитывая побочные эффекты, применение СГКС необходимо минимизировать. Снижению дозы СГКС и их последующей отмене способствует биологическая терапия моноклональными антителами. На данный момент отсутствует общепринятый алгоритм снижения дозы СГКС, несмотря на то что этот этап требует внимания как с точки зрения риска обострения БА, так и с точки зрения функционального состояния надпочечников. Развитие ТБА у большинства пациентов связано с активацией Т2-воспаления, в формировании которого участвуют эозинофилы, Th2-лимфоциты и врожденные лимфоидные клетки 2-го типа (ILC2), генерирующие цитокины Т2-профиля: интерлейкин (ИЛ) 4, ИЛ-5, ИЛ-13. В настоящее время таргетная терапия ТБА направлена на нейтрализацию циркулирующих ИЛ-5 (меполизумаб, реслизумаб), блокаду альфа-субъединицы рецептора ИЛ-5 (ИЛ-5Rα) (бенрализумаб) и альфа-субъединицы рецептора ИЛ-4, что нивелирует активность ИЛ-4 и ИЛ-13 (дупилумаб) [10].
Большинство (82%) пациентов с ТБА отнесены к эозинофильному фенотипу, который характеризуется более тяжелым течением, повышенной частотой обострений и резистентностью к стандартной противовоспалительной терапии [11]. Таким образом, подавление активности эозинофилов является перспективным направлением патогенетической терапии ТБА.
Одним из ЛС, подавляющих активность эозинофилов, является бенрализумаб. Препарат представляет собой моноклональное антитело, которое напрямую связывается с альфа-субъединицей рецептора ИЛ-5, индуцирует активный апоптоз эозинофилов за счет антителозависимой клеточно-опосредованной цитотоксичности, что приводит к быстрому и устойчивому, почти полному истощению эозинофилов в крови и тканях-мишенях [12].
Краткий обзор клинических исследований
Эффективность бенрализумаба и его влияние на контроль БА, частоту обострений, показатели функции внешнего дыхания (ФВД) были продемонстрированы в многоцентровых рандомизированных клинических исследованиях (РКИ) III фазы SIROCCO и CALIMA [13, 14]. Основная анализируемая популяция включала пациентов, получавших высокие дозы ИГКС в сочетании с ДДБА, с уровнем эозинофилов в крови ≥300 клеток/мкл. Пациенты были рандомизированы в 3 группы: 1-я группа — инъекции бенрализумаба в дозе 30 мг каждые 4 нед.; 2-я группа — инъекции бенрализумаба в дозе 30 мг каждые 4 нед. (первые 3 дозы) с последующим назначением бенрализумаба в дозе 30 мг каждые 8 нед.; 3-я группа — плацебо.
Активная фаза исследования SIROCCO продолжалась 48 нед., затем до 56-й недели длился период наблюдения без введения бенрализумаба. НЯ были зарегистрированы у 72% пациентов в группах бенрализумаба и у 76% в группе плацебо. Частота НЯ не зависела ни от дозы препарата, ни от уровня эозинофилов. Большая часть побочных эффектов не была связана с терапией бенрализумабом. В исследовании CALIMA длительность терапии бенрализумабом составила 56 нед. Post hoc анализ данных этих РКИ продемонстрировал статистически значимое снижение частоты обострений БА на 36% (p<0,001) и 42% (p<0,001) в исследованиях CALIMA и SIROCCO соответственно [15]. Также отмечалось улучшение ФВД: у пациентов с уровнем эозинофилов в крови ≥300 клеток/мкл показатель ОФВ1 увеличился на 159 мл через 4 нед. после введения первой дозы ЛС [13]. В результате терапии бенрализумабом был достигнут контроль БА и снижение количества эозинофилов в крови.
Пациенты, участвовавшие в РКИ CALIMA и SIROCCO, продолжили участие в расширенном исследовании по оценке безопасности и эффективности бенрализумаба — BORA [16]. Продолжительность исследования BORA составила 56 нед. у взрослых пациентов и 108 нед. у подростков. Результаты исследования показали, что на 2-й год наблюдения на фоне терапии 74% пациентов не имели обострений. Отмечено также увеличение ОФВ1 уже к 4-й неделе, которое сохранялось на протяжении 2 лет терапии у пациентов с числом эозинофилов >300 клеток/мкл. Профиль безопасности бенрализумаба был сопоставим с плацебо.
Продолжением исследования BORA стало другое расширенное исследование безопасности бенрализумаба — MELTEMI, — комплексный анализ результатов которого показал, что у пациентов с эозинофильной ТБА, получавших бенрализумаб в течение 5 лет, длительная деплеция эозинофилов не была связана с повышенным риском серьезной инфекции или какими-либо неизвестными ранее НЯ [17]. Эти результаты дополнительно подтвердили долгосрочную безопасность и эффективность бенрализумаба в достижении и поддержании контроля ТБА.
Результаты опорного исследования III фазы ZONDA показали, что бенрализумаб статистически значимо (p<0,001) снижает потребность в оральных глюкокортикостероидах (ОГКС) у пациентов с БА и эозинофилией крови, принимающих высокие дозы ИГКС/ДДБА и ОГКС: снижение потребности в ОГКС составило 75% и 25% для групп бенрализумаба и плацебо соответственно [18]. Вероятность снижения дозы ОГКС была более чем в 4 раза выше при использовании бенрализумаба в сравнении с плацебо. Две трети пациентов, получавших бенрализумаб, снизили дозу ОГКС на ≥50%. Порядка 50% пациентов, получавших преднизолон в дозе ≤12,5 мг, полностью прекратили использование ОГКС. При этом частота обострений БА была статистически значимо ниже при использовании бенрализумаба по сравнению с плацебо: до 70% снизилось общее число обострений (p<0,001), до 93% — число обострений, требующих обращения в отделение неотложной терапии или госпитализации. Помимо этого, у пациентов отмечено увеличение ОФВ1 уже после введения первой дозы бенрализумаба, которое сохранялось на протяжении всего периода лечения.
Возможность снижения дозы СГКС на фоне лечения бенрализумабом была подтверждена также в многоцентровом открытом клиническом исследовании PONENTE [19], которое включало 138 центров; исследуемая популяция включала 598 пациентов в возрасте ≥18 лет с эозинофильной ТБА (количество эозинофилов в крови ≥150 клеток/мкл на момент включения в исследование или ≥300 клеток/мкл в предыдущем году), которые получали СГКС в течение как минимум 3 мес. до включения в исследование. В рамках открытого когортного исследования IIIb фазы PONENTE пациенты получали бенрализумаб в дозе 30 мг каждые 4 нед. в течение 3 мес. и далее каждые 8 нед. Снижение дозы СГКС начиналось на 4-й неделе от начала терапии бенрализумабом на 1–5 мг каждые 1–4 нед. в зависимости от начальной дозы, контроля астмы и функционального состояния надпочечников (рис. 1).
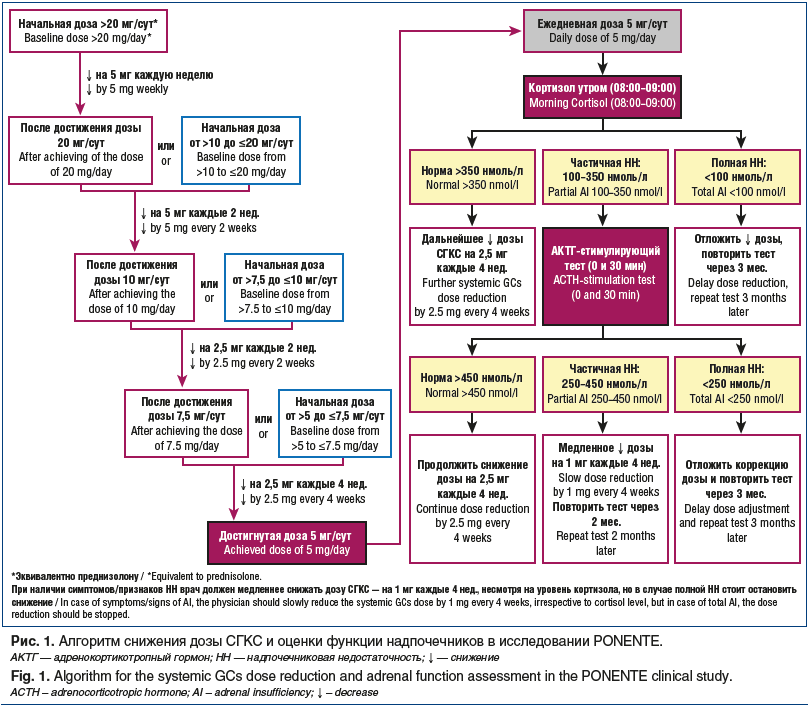
Если на старте пациент получал СГКС в дозе более 20 мг/сут, то снижение составляло 5 мг в неделю до первого промежуточного этапа — достижения дозы 20 мг/сут. Затем дозу СГКС снижали на 5 мг каждые 2 нед. до достижения дозы 10 мг/сут. После чего уменьшение СГКС проводилось на 2,5 мг каждые 2 нед. до достижения дозы 7,5 мг/сут. Далее снижение СГКС проводилось на 2,5 мг каждые 4 нед. до достижения дозы 5 мг/сут. Когда ежедневная доза СГКС достигала 5 мг/сут, проводился анализ крови на содержание утреннего (08:00–09:00) кортизола. Если уровень кортизола был в норме (>350 нмоль/л), дозу СГКС продолжали снижать на 2,5 мг каждые 4 нед. Если концентрация кортизола была <100 нмоль/л, что говорило о наличии полной надпочечниковой недостаточности (НН), снижение дозы СГКС откладывали на 3 мес. Содержание кортизола в диапазоне 100–350 нмоль/л свидетельствовало о наличии частичной НН, в этом случае проводился АКТГ-стимулирующий тест: после определения базального уровня кортизола пациенту внутривенно вводили 250 мкг 1–24-АКТГ и через 30 мин повторно исследовали уровень кортизола. Уровень кортизола >450 нмоль/л позволял рекомендовать дальнейшее снижение дозы СГКС на 2,5 мг каждые 4 нед. При уровне кортизола <250 нмоль/л снижение дозы СГКС не проводили, повторный анализ выполняли через 3 мес. Если концентрация кортизола была в диапазоне 250–450 нмоль/л, проводили медленное снижение дозы на 1 мг каждые 4 нед.; повторный тест выполняли через 2 мес.
Первичными конечными точками в исследовании PONENTE были процент пациентов, прекративших ежедневное применение СГКС в течение не менее 4 нед., и процент пациентов, достигших отмены приема преднизолона или снижения дозы до ≤5 мг/сут в течение не менее 4 нед. (если причиной отказа от дальнейшего снижения была НН). Прием СГКС прекратили 376 (62,88%; 95% ДИ 58,86–66,76) из 598 пациентов, 490 (81,94%; 95% ДИ 78,62–84,94) пациентов прекратили прием или достигли дозы ≤5 мг/сут (в случае НН) [20]. Анализ подгрупп показал, что снижение дозы было достигнуто независимо от исходного количества эозинофилов, базовой дозы СГКС или продолжительности лечения ОГКС. Бенрализумаб был эффективен у пациентов, принимавших ОГКС, в том числе со средним уровнем эозинофилии (≥150 клеток/мкл). Недостаточность функции надпочечников была выявлена у 321 (60%) из 533 пациентов при первом обследовании и у 205 (38%) через 2–3 мес. исследования. У большинства — 448 (75%) — пациентов не было обострений БА в период снижения дозы СГКС [20].
Данные проведенных РКИ подтверждают многочисленные публикации исследований реальной клинической практики [21–23]. В Городском пульмонологическом центре на базе ГБУЗ «Введенская городская клиническая больница» (Санкт-Петербург, Россия) также активно используются генно-инженерные биологические ЛС для лечения пациентов с ТБА, в том числе и бенрализумаб, неоднократно подтвердивший свою эффективность в достижении контроля БА, уменьшении числа обострений, улучшении ФВД и снижении дозы СГКС. Ниже приводится клиническое наблюдение больной ТБА, получавшей терапию бенрализумабом.
Клиническое наблюдение
Больная С., 48 лет, 18.04.2021 была доставлена в стационар каретой скорой медицинской помощи с диагнозом: бронхиальная астма, обострение. При поступлении пациентка предъявляла жалобы на одышку в покое, малопродуктивный кашель, приступы затрудненного дыхания до 8–10 раз в день, которые купировались ингаляцией двух доз комбинированного препарата ипратропия бромид/фенотерол. Ухудшение состояния отмечалось в течение последних 5 дней.
По результатам объективного осмотра у пациентки выявлена тахикардия (ЧСС 110 в минуту), увеличение частоты дыхания (ЧДД 28 в минуту), снижение сатурации (SpO2 92–93%), сухие свистящие хрипы над всей поверхностью легких. Со стороны других органов и систем патологии не выявлено. Оценка по опроснику контроля симптомов астмы ACQ-5 составила 1,9 балла.
Диагноз БА был установлен в 2000 г. Начиная с 2016 г. пациентка стала отмечать частые обострения заболевания, требующие стационарного лечения до 4–5 раз в год. Во время госпитализаций больная получала терапию ГКС в течение 10–14 дней (дексаметазон в дозе 16 мг с постепенным снижением дозировки), ингаляционную терапию (будесонид 4 г/сут, ипратропия бромид/фенотерол по потребности). При обострениях, не требующих госпитализаций (2–3 р/год), проходила короткие (7–10 дней) курсы терапии преднизолоном в дозе 30 мг/сут с постепенным снижением дозировки. С 2018 г. пациентка получала: комбинированное ЛС салметерол/флутиказон 50/500 мкг по 2 вдоха в сутки, тиотропия бромид 2,5 мкг по 2 вдоха в сутки, ипратропия бромид/фенотерол по потребности, преднизолон 10 мг/сут.
Пациентка никогда не курила. В анамнезе имела аллергическую реакцию на новокаин в виде отека Квинке. Работала менеджером, наличие профессиональных вредностей отрицала. Сопутствующие заболевания: хронический пиелонефрит, полипозный риносинусит, по поводу которого дважды проводилась полипотомия (в 1991 и 2015 гг.).
В клиническом анализе крови при поступлении в стационар обращала на себя внимание эозинофилия (814 клеток/мкл). В биохимическом анализе крови отмечалось незначительное повышение концентрации СРБ (6,75 мг/л). Содержание IgЕ не превышало нормальных значений (96 кЕ/л). Рентгенологическое обследование органов грудной клетки выявило повышение прозрачности легочной ткани. Спирометрия с бронхолитической пробой, выполненная при поступлении в стационар, выявила резкое снижение форсированной жизненной емкости легких (ФЖЕЛ) (35,34%) и проходимости дыхательных путей (ОФВ1 21,18%; ОФВ1/ФЖЕЛ 59,59%). Бронходилатационная проба отрицательная (прирост ОФВ1 +2,3%).
При поступлении был поставлен диагноз: ТБА, персистирующее течение, неаллергическая эозинофильная форма, неконтролируемая.
Пациентке были назначены ГКС внутривенно в течение 10 дней (дексаметазон 16 мг/сут с постепенным снижением дозы), эуфиллин, ингаляционная терапия (будесонид 4 г/сут, ипратропия бромид/фенотерол). На фоне проводимой терапии отмечалась положительная динамика в виде исчезновения приступов затрудненного дыхания, уменьшения потребности в скоропомощных препаратах (1 раз в 2 дня на фоне лечения), снижения баллов ACQ-5 (до 1,5), улучшения показателей ФВД (ОФВ1 66,31%), нормализации SpO2 (97%).
Пациентка была выписана через 12 дней, после купирования обострения БА, с диагнозом: ТБА, персистирующее течение, неаллергическая эозинофильная форма, частично контролируемая. Рекомендовано: ингаляционная терапия (салметерол/флутиказон 50/500 мкг по 1 вдоху 2 р/сут, тиотропия бромид 2,5 мкг по 2 вдоха 1 р/сут), преднизолон 10 мг/сут и бенрализумаб 30 мг подкожно каждые 4 нед. (первые 3 инъекции), в последующем 30 мг подкожно каждые 8 нед.
Терапия бенрализумабом была инициирована с июля 2021 г. Препарат вводился в виде инъекций в условиях дневного стационара. НЯ не отмечались. Через 1 мес. у пациентки выявлено: уменьшение содержания эозинофилов в клиническом анализе крови до 35 клеток/мкл; улучшение контроля БА по опроснику ACQ-5 (снижение до 0,95 балла); увеличение ОФВ1 до 77,52% по данным спирометрии. К моменту проведения 3-й инъекции препарата (сентябрь 2021 г.) был достигнут контроль над заболеванием (0,48 балла по ACQ-5) (рис. 2) и рекомендовано снижение текущей дозы СГКС (преднизолон 10 мг/сут) на 2,5 мг.
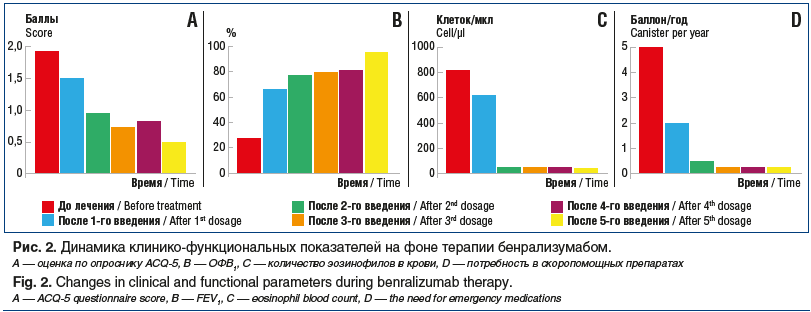
В течение двух последующих недель помимо базисной терапии БА пациентка получала преднизолон 7,5 мг/сут. Снижение ГКС не вызывало ухудшения клинической симптоматики, и через 2 нед. больной было рекомендовано уменьшить дозировку преднизолона до 5 мг/сут. Дальнейшее снижение дозы СГКС также не отразилось на контроле БА. Через 1 мес. был выполнен анализ крови на кортизол с целью решения вопроса о дальнейшей тактике снижения дозы СГКС. Содержание кортизола составило 320 нмоль/л, что свидетельствовало о наличии у больной частичной НН. Был проведен АКТГ-стимулирующий тест. Уровень кортизола в крови через 30 мин после инъекции АКТГ составил 450 нмоль/л. Было принято решение о продолжении снижения дозы СГКС на 2,5 мг каждые 4 нед. Через 2 мес. пациентке удалось полностью отказаться от приема преднизолона в соответствии с регламентированными сроками. Через 2 нед. после отмены СГКС была проведена 5-я инъекция бенрализумаба. Оценка по опроснику ACQ-5 — 0,5 балла — свидетельствовала о полном контроле над заболеванием; показатели вентиляционной функции легких достигли нормальных значений (ОФВ1 95%). За 6 мес. после начала биологической терапии не отмечалось ни одного обострения БА; пациентка переведена на терапию комбинацией беклометазона дипропионат/формотерол 100/6 мкг по 2 ингаляции в сутки. Основные этапы клинического наблюдения приведены на рис. 3.

В описанном клиническом наблюдении у пациентки был высокий исходный уровень эозинофилов периферической крови, однако необходимо отметить, что, по данным исследований, бенрализумаб демонстрирует свою эффективность при уровне эозинофилов начиная от 150 клеток/мкл [15].
Заключение
У пациентов с ТБА бенрализумаб улучшает контроль заболевания, показатели вентиляционной функции легких, снижает потребность в короткодействующих бронхолитиках, уменьшает количество эпизодов обострения заболевания. Бенрализумаб демонстрирует высокий уровень безопасности, сопоставимый с плацебо.
Результаты РКИ подтверждаются данными реальной клинической практики: использование бенрализумаба способствует отмене СГКС у пациентов с ТБА, что позволяет предотвратить развитие НЯ, обусловленных длительной терапией СГКС, при сохранении контроля заболевания.
Представленное клиническое наблюдение больной ТБА, получавшей терапию бенрализумабом, подтверждает результаты ранее проведенных многоцентровых РКИ.
Сведения об авторах:
Титова Ольга Николаевна — д.м.н., профессор, директор НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0003-4678-3904.
Кузубова Наталия Анатольевна — д.м.н., заместитель директора по научной работе НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0002-1166-9717.
Склярова Дарья Борисовна — к.м.н., старший научный сотрудник НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Рентгена, д. 12; ORCID iD 0000-0001-7052-6903.
Контактная информация: Кузубова Наталия Анатольевна, e-mail: kuzubova@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах.
Конфликт интересов отсутствует.
Статья поступила 04.07.2022.
Поступила после рецензирования 27.07.2022.
Принята в печать 19.08.2022.
About the authors:
Olga N. Titova — Dr. Sc. (Med.), Professor, Director of the Research Institute of Pulmonology, I.P. Pavlov First St. Petersburg State Medical University; 12, Roentgen str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0003-4678-3904.
Natalia A. Kuzubova — Dr. Sc. (Med.), Deputy Director for Science of the Research Institute of Pulmonology, I.P. Pavlov First St. Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0002-1166-9717.
Daria B. Sklyarova — C. Sc. (Med.), Senior Researcher of the Research Institute of Pulmonology of the I.P. Pavlov First St. Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0001-7052-6903.
Contact information: Natalia A. Kuzubova, e-mail: kuzubova@mail.ru.
Financial Disclosure: no authors have no a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 04.07.2022.
Revised 27.07.2022.
Accepted 19.08.2022.
2. Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention (Updated 2022). 2022. (Electronic resource.) URL: https://ginasthma.org/wp-content/uploads/2022/07/GINA-Main-Report-2022-FINAL-22–07–01-WMS.pdf (access date: 25.05.2022).
3. Broder M.S., Raimundo K., Ngai K.M. et al. Cost and health care utilization in patients with asthma and high oral corticosteroid use. Ann Allergy Asthma Immunol. 2017;118(5):638–639. DOI: 10.1016/j.anai.2017.02.023.
4. Phipatanakul W., Mauger D.T., Sorkness R.L. et al. Effects of Age and Disease Severity on Systemic Corticosteroid Responses in Asthma. Am J Respir Crit Care Med. 2017;195(11):1439–1448. DOI: 10.1164/rccm.201607-1453OC.
5. Shaw D.E., Sousa A.R., Fowler S.J. et al. Clinical and inflammatory characteristics of the European U-BIOPRED adult severe asthma cohort. Eur Respir J. 2015;46(5):1308–1321. DOI: 10.1183/13993003.00779-2015.
6. Sweeney J., Brightling C.E., Menzies-Gow A. et al. Clinical management and outcome of refractory asthma in the UK from the British Thoracic Society Difficult Asthma Registry. Thorax. 2012;67(8):754–756. DOI: 10.1136/thoraxjnl-2012-201869.
7. Rice J.B., White A.G., Scarpati L.M. et al. Long-term Systemic Corticosteroid Exposure: A Systematic Literature Review. Clin Ther. 2017;39(11):2216–2229. DOI: 10.1016/j.clinthera.2017.09.011.
8. Price D.B., Trudo F., Voorham J. et al. Adverse outcomes from initiation of systemic corticosteroids for asthma: long-term observational study. J Asthma Allergy. 2018;11:193–204. DOI: 10.2147/JAA.S176026.
9. Voorham J., Xu X., Price D.B. et al. Healthcare resource utilization and costs associated with incremental systemic corticosteroid exposure in asthma. Allergy. 2019;74(2):273–283. DOI: 10.1111/all.13556.
10. Ненашева Н.М. Биологическая терапия тяжелой астмы: новые цели и новые возможности лечения. Медицинский совет. 2019;(15):50–61. DOI: 10.21518/2079-701X-2019-15-50-61. [Nenasheva N.M. Biological treatment of severe asthma: new objectives and new treatment options. Meditsinskiy sovet=Medical Council. 2019;(15):50–61 (in Russ.)]. DOI: 10.21518/2079-701X-2019-15-50-61.
11. Pavord I.D. Eosinophilic phenotypes of airway disease. Ann Am Thorac Soc. 2013;10(l):143–149. DOI: 10.1513/AnnalsATS.201306-168AW.
12. Tan L.D., Bratt J.M., Godor D. et al. Benralizumab: a unique IL-5 inhibitor for severe asthma. J Asthma Allergy. 2016;9:71–81. DOI: 10.2147/JAA.S78049.
13. Bleecker E.R., FitzGerald J.M., Chanez P. et al. Efficacy and safety of benralizumab for patients with severe asthma uncontrolled with high-dosage inhaled corticosteroids and long-acting β2-agonists (SIROCCO): a randomised, multicentre, placebo-controlled phase 3 trial. Lancet. 2016;388(10056):2115–2127. DOI: 10.1016/S0140-6736(16)31324-1.
14. FitzGerald J.M., Bleecker E.R., Nair P. et al. Benralizumab, an anti-interleukin-5 receptor α monoclonal antibody, as add-on treatment for patients with severe, uncontrolled, eosinophilic asthma (CALIMA): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet. 2016;388(10056):2128–2141. DOI: 10.1016/S0140-6736(16)31322-8.
15. Goldman M., Hirsch I., Zangrilli J.G. et al. The association between blood eosinophil count and benralizumab efficacy for patients with severe, uncontrolled asthma: subanalyses of the Phase III SIROCCO and CALIMA studies. Curr Med Res Opin. 2017;33(9):1605–1613. DOI: 10.1080/03007995.2017.1347091.
16. Busse W.W., Bleecker E.R., FitzGerald J.M. et al. Long-term safety and efficacy of benralizumab in patients with severe, uncontrolled asthma: 1-year results from the BORA phase 3 extension trial. Lancet Respir Med. 2019;7(1):46–59. DOI: 10.1016/S2213-2600(18)30406-5.
17. Korn S., Bourdin A., Chupp G. et al. Integrated Safety and Efficacy Among Patients Receiving Benralizumab for Up to 5 Years. J Allergy Clin Immunol Pract. 2021;9(12):4381–4392.e4. DOI: 10.1016/j.jaip.2021.07.058.
18. Nair P., Wenzel S., Rabe K.F. et al. Oral Glucocorticoid-Sparing Effect of Benralizumab in Severe Asthma. N Engl J Med. 2017;376(25):2448–2458. DOI: 10.1056/NEJMoa1703501.
19. Menzies-Gow A., Corren J., Bel E.H. et al. Corticosteroid tapering with benralizumab treatment for eosinophilic asthma: PONENTE Trial. ERJ Open Res. 2019;5(3):00009–2019. DOI: 10.1183/23120541.00009-2019.
20. Menzies-Gow A., Gurnell M., Heaney L.G. et al. Oral corticosteroid elimination via a personalised reduction algorithm in adults with severe, eosinophilic asthma treated with benralizumab (PONENTE): a multicentre, open-label, single-arm study. Lancet Respir Med. 2022;10(1):47–58. DOI: 10.1016/S2213-2600(21)00352-0.
21. Pelaia C., Busceti M.T., Vatrella A. et al. Real-life rapidity of benralizumab effects in patients with severe allergic eosinophilic asthma: Assessment of blood eosinophils, symptom control, lung function and oral corticosteroid intake after the first drug dose. Pulm Pharmacol Ther. 2019;58:101830. DOI: 10.1016/j.pupt.2019.101830.
22. Renner A., Marth K., Patocka K. et al. Benralizumab rapidly improves asthma control in Austrian real-life severe eosinophilic asthmatics. Allergy. 2020;75:3272–3275. DOI: 10.1111/all.14441.
23. Kavanagh J.E., Hearn A.P., Dhariwal J. et al. Real-World Effectiveness of Benralizumab in Severe Eosinophilic Asthma. Chest. 2021;159(2):496–506. DOI: 10.1016/j.chest.2020.08.2083.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.