Особенности иммунного ответа у больных внебольничной пневмонией с сочетанной сердечно-сосудистой патологией
Цель исследования: выявить особенности иммунного статуса у больных внебольничной пневмонией (ВП) с сочетанной сердечно-сосудистой патологией (ССП) и его влияние на клиническое течение, легочно-сердечную гемодинамику и прогноз заболевания.
Материал и методы: обследовано 58 больных, которые были разделены на 2 группы. В 1-ю группу вошли 43 пациента с ВП (74%), имеющих клинически значимую коморбидную ССП (средний возраст — 62±10 лет). 2-ю группу составили 15 пациентов с ВП (26%) без сопутствующих заболеваний (средний возраст — 56±15 лет).
Результаты исследования: у больных 1-й группы определен более низкий уровень гемоглобина (117,04±6,05 г/л) и более низкие значения сывороточных интерлейкинов ИЛ-8 и -6 — в 2 и 2,3 раза соответственно, в то время как среднее значение величины ИЛ-17 было почти в 2 раза выше, чем у больных 2-й группы. Установлено наличие прямых сильных достоверных связей между увеличенным значением ИЛ-17 и содержанием нейтрофилов и молодых форм лейкоцитов (r=0,85 и r=0,91 соответственно, р<0,05). У больных 1-й группы выявлена прямая средней силы связь, приближающаяся к сильной, между уровнем ИЛ-17 в сыворотке крови и временем достижения максимальной скорости выброса в выносящем тракте правого желудочка (r=0,61, р<0,05), а также прямая сильная связь с диаметром нижней полой вены (r=0,86, р<0,05).
Заключение: выявленная корреляция между ИЛ-17, миелопероксидазой и эхокардиографическими показателями у этих больных свидетельствует о том, что нарастающий уровень провоспалительного цитокина обусловлен не только развитием воспалительного процесса, но и наличием сопутствующей ССП. Динамика уровня ИЛ-17 в сыворотке крови больных ВП может служить прогностическим критерием степени выраженности патологического процесса и функционального состояния легочно-сердечного кровообращения.
Ключевые слова: внебольничная пневмония, коморбидная сердечно-сосудистая патология, провоспалительные цитокины, интерлейкин, миелопероксидаза, легочно-сердечная гемодинамика.
Для цитирования: Титова О.Н., Кузубова Н.А., Александров А.Л., Перлей В.Е., Тихонова К.А. Особенности иммунного ответа у больных внебольничной пневмонией с сочетанной сердечно-сосудистой патологией. РМЖ. Медицинское обозрение. 2020;28(11):59-63.
Immune response characteristics in patients with community-acquired pneumonia and comorbid cardiovascular pathology
O.N. Titova1, N.A. Kuzubova1, A.L. Alexandrov1, V.E. Perley1, K.A. Tikhonova2
1National Research Institute of Pulmonology of the Pavlov First Saint Petersburg State Medical University, Saint-Petersburg
2Vvedenskaya City Clinical Hospital, Saint-Petersburg
Aim: to identify the characteristics of the immune status in patients with community-acquired pneumonia (CAP) and comorbid cardiovascular pathology (CCP), and its effect on the clinical course, cardiopulmonary hemodynamics and disease prognosis.
Patients and Methods: 58 patients, were examined and divided into two groups. The first group included 43 patients with CAP (74%) who had clinically significant CCP (average age 62±10 years). The second group consisted of 15 patients with CAP (26%) without concomitant diseases, (average age 56±15 years).
Results: a lower hemoglobin level was determined in group 1 (117.04±6.05 g/l), lower values of serum IL-8 and IL-6 — 2 and 2.3 times, respectively, while the average IL-17 values were almost more than two times higher than in group 2. The presence of direct, strong, reliable associations between the increased value of IL-17 and the content of neutrophils and young forms of WBC (r=0.85, and r=0.91, respectively, p<0.05) was established. In group 1, there was a direct medium-strong association, between the level of serum IL-17 and the time to reach the maximum ejection rate in the right ventricular outflow tract (r=0.61, p<0.05), as well as a direct strong association with the diameter of the inferior vena cava (r=0.86, p<0.05).
Conclusion: the revealed correlation between IL-17, myeloperoxidase and echocardiographic parameters in these patients indicated that the increasing level of pro-inflammatory cytokine was not only due to the development of the inflammatory process but also to the presence of concomitant CCP . The dynamics of the serum IL-17 level in patients with CAP can serve as a prognostic criterion for the severity of the pathological process and the functional state of the cardiopulmonary circulation.
Keywords: community-acquired pneumonia, comorbid cardiovascular pathology, proinflammatory cytokines, interleukin, myeloperoxidase, cardiopulmonary hemodynamics.
For citation: Titova O.N., Kuzubova N.A., Alexandrov A.L. et al. Immune response characteristics in patients with community-acquired pneumonia and comorbid cardiovascular pathology. RMJ. 2020;11:59–63.
Введение
Внебольничная пневмония (ВП) остается в ряду наиболее актуальных болезней, занимая 4-е место в структуре смертности (после сердечно-сосудистых, цереброваскулярных заболеваний и злокачественных новообразований) [1]. В России среди лиц старше 18 лет регистрируются 3,9 смертельного случая на 1000 человек в год [2]. Этот показатель значительно возрастает у людей старше 70 лет — 25–44 случая на 1000 человек в год. Наличие сопутствующей патологии сердечно-сосудистой системы, особенно осложненной хронической сердечной недостаточностью, является неизменным фактором риска неблагоприятного течения и прогноза ВП [3].
В патогенезе ВП существенная роль отводится иммунологической реактивности организма, в первую очередь это относится к состоянию местной неспецифической защиты легких. Для адекватного иммунного ответа необходим определенный цитокиновый уровень. В норме спектр биологически активных веществ в крови сравнительно узок, а регуляторное действие ограничено специфическими ингибиторами. При развитии патологического процесса количественный и качественный состав цитокинов, обладающих местной и дистантной регуляторной активностью, расширяется [4].
Известно, что нарушения адекватного ответа иммунной системы вызывают осложненное и затяжное течение ВП [4]. Вместе с тем данные о состоянии иммунного ответа при воспалительном процессе у различных групп пациентов с ВП фрагментарны и требуют дальнейшего изучения. В этой связи представляет интерес изучение цитокинов, регулирующих силу, продолжительность иммунного ответа и характер воспалительного процесса, обеспечивая тем самым позитивную или негативную иммунорегуляцию [5–7]. Согласно данным M.S. Paats (2013) системные уровни интерлейкинов ИЛ-6 и -10 были достоверно выше у больных тяжелой ВП в отличие от пациентов с нетяжелой ВП и имели достоверную корреляцию с индексом тяжести пневмонии [8]. Ряд авторов выявили существенно возрастающие уровни ИЛ-1α, -6, -10, фактора некроза опухоли α по мере нарастания тяжести течения ВП [7, 8].
Ранее была выявлена зависимость концентрации некоторых цитокинов от этиологического фактора ВП. Так, во время заболеваний, вызванных Staphylococcus aureus, наблюдается повышение экспрессии ИЛ-12 [9–11].
Однако до сих пор не установлена роль таких не менее значимых цитокинов, как ИЛ-8, -17, воспалительных белков (миелопероксидазы (МПО), эозинофильного катионного белка (ЭКБ)) в контексте иммунопатогенеза ВП, осложненной сердечно-сосудистыми заболеваниями (ССЗ), что также требует дальнейших исследований.
Так, провоспалительный ИЛ-17 активно участвует в индукции нейтрофильно-опосредованного защитного ответа, способствует клиренсу бактериальных агентов нейтрофилами, что может наблюдаться и при отсутствии специфических антител. Также ИЛ-17 участвует в развитии специфического антительного ответа на вторжение Streptococcus pneumoniae — самого частого возбудителя пневмонии [12, 17].
В связи с этим разработка новых и более эффективных лабораторных способов оценки тяжести ВП и нарушений иммунного статуса, безусловно, позволит с большей вероятностью прогнозировать течение ВП даже у больных с сопутствующими ССЗ. Поэтому дальнейшее изучение влияния провоспалительных цитокинов и иммунного гомеостаза на течение и исход ВП, особенно осложненной кардиоваскулярной патологией, является весьма своевременным.
Цель исследования: выявить особенности иммунного статуса у больных ВП с сочетанной сердечно-сосудистой патологией и его влияние на клиническое течение, легочно-сердечную гемодинамику и прогноз заболевания.
Материал и методы
Исследование проводилось на клинической базе НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России в СПб ГБУЗ «Введенская больница». Было обследовано 58 больных ВП (средний возраст — 60±18 лет), среди них было 30 мужчин (средний возраст — 60±12 лет) и 28 женщин (средний возраст — 55±18 лет). Все больные были госпитализированы в пульмонологическое отделение с подтвержденным рентгенологическим диагнозом и разделены на 2 группы. В 1-ю группу вошли 43 пациента с ВП (74%), имеющих клинически значимую коморбидную сердечно-сосудистую патологию (средний возраст — 62±10 лет). 2-ю группу составили 15 пациентов с ВП (26%) без сопутствующих заболеваний (средний возраст — 56±15 лет).
Пациенты включались в данное исследование только после подписания ими информированного согласия.
При опросе больных анализировались жалобы, длительность настоящего заболевания, перенесенные ранее заболевания, наличие сопутствующей патологии, проведение вакцинации от гриппа и пневмококковой инфекции, физикальные данные. Проводились клинический анализ крови, биохимическое исследование сыворотки крови. Этиологическая принадлежность пневмонии устанавливалась по данным бактериологического, вирусологического, серологического методов исследования.
Всем пациентам было проведено исследование крови на пневмококковую бактериемию методом полимеразной цепной реакции (ПЦР) в реальном времени, вирусологическое исследование мазков из носоглотки методом ПЦР с обратной транскрипцией в режиме реального времени (Rotor-Gene 6000, Corbett Research, Австралия) с ПЦР-комплектами варианта «АмплиСенс Influenzае virus A/B-FL», «АмплиСенс Influenzае virus A-тип-FL», «АмплиСенс ОРВИ-скрин-FRT» (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Россия). Всем пациентам была проведена рентгенография легких в прямой и боковой проекциях при поступлении и после курса терапии при помощи аппарата Digital Radiography System Model QXR-9 (Vieworks, Китай) [13]. Для измерения уровня сатурации кислородом капиллярной крови всем пациентам проводилась пульсоксиметрия (SpO2). Определение тяжести заболевания и риска летального исхода — факторов, определяющих место лечения, объем диагностических процедур и тактику ведения пациентов, проводили по шкале CRB-65 для оценки 4 критериев: нарушения сознания (confusion), уровня азота мочевины в сыворотке крови (urea), частоты дыхания (respiratory rate), артериального давления (blood pressure), а также возраста пациента (≥65 лет) [14, 15].
Исследование уровня цитокинов (ИЛ-6, ИЛ-8, ИЛ-17), МПО в сыворотке крови больных ВП при поступлении в стационар проводилось количественно-иммуноферментным методом с использованием стандартных тест-систем.
Исследование центральной гемодинамики осуществлялось методом эходопплеркардиографии с помощью ультразвуковой диагностической системы экспертного класса GEVIVID 7 Dimension (General Electrics, США) и с использованием матриксного мультичастотного датчика 2–4 МГц. Исследование проводили в М- и В-режимах. Рассчитывались, в соответствии с рекомендациями Европейского общества кардиологов и Европейского респираторного общества (2015), основные показатели, характеризующие глобальную функцию правых и левых отделов сердца [16].
Математическая обработка результатов исследования проводилась с помощью пакета прикладных статистических программ Statistica for Windows V.7,0. Определение числовых характеристик переменных с вычислением средней арифметической и средней квадратической ошибки было проведено с помощью методов описательной статистики. С целью выявления взаимосвязи между переменными рассчитывался коэффициент корреляции Пирсона (r). Для оценки достоверности различий сравниваемых показателей пользовались критерием Стьюдента, различия считались достоверными при р<0,05.
Результаты и обсуждение
Степень тяжести течения ВП устанавливалась по шкале CRB-65. У пациентов 1-й группы средний балл составил 1,71, у больных 2-й группы — 1,40 (р<0,05), что свидетельствовало о более тяжелом течении заболевания пациентов с ССЗ и обоснованности стационарного лечения.
При оценке клинических данных у больных 1-й группы на момент поступления интоксикационный синдром был менее выражен. Средняя температура тела у них составила 38,1±1,2 °C, тогда как у больных ВП без ССЗ — 38,8±0,8 °C (р<0,05). Время от манифестации симптомов до поступления в стационар у пациентов с ССЗ составило 12±4 дня, у больных без сопутствующих ССЗ — 6±4 дня, т. е. клиническая симптоматика у больных 1-й группы развивалась постепенно, и, как следствие этого, наблюдалась поздняя диагностика заболевания (спустя 72 ч и более от момента появления первых симптомов).
По данным бактериологического исследования мокроты, у 7% больных (n=4) была выделена Klebsiella pneumoniae, у 9% (n=5) — S. aureus, у 2% (n=1) — Рseudomonas aeruginosa. У 45% (n=26) пациентов микроорганизмы определялись в клинически незначимой концентрации, у 34% (n=20) рост патологической микрофлоры не был выявлен. Хотя по данным опубликованного международного исследования, проведенного в странах Европы в 2005–2012 гг., было показано, что Str. pneumoniae является виновником развития ВП в 12,0–85,0% случаев [17, 18], в данном исследовании этот возбудитель определялся лишь у 1 пациента (2%). Ни у кого из обследованных пациентов не было выявлено пневмококка в крови методом ПЦР в реальном времени.
При исследовании мазков из носоглотки у 11 больных были выделены вирусы: у 3 (27%) — вирус гриппа А/H3N2, у 2 (18%) — респираторно-синцитиальный вирус, у 4 (37%) — риновирус, у 2 (18%) — коронавирус.
У пациентов 1-й группы при поступлении имелись ограничения в этиологической диагностике ввиду того, что у большинства из них отсутствовал продуктивный кашель, а получаемые образцы мокроты были контаминированы орофарингеальными микроорганизмами, лишь у 4 больных (9%) удалось выявить инфекционный агент при бактериологическом исследовании мокроты: у 2 пациентов это был S. aureus, у 1 — вирус гриппа А, у 1 — K. pneumoniae.
Результаты рентгенологического исследования у больных ССЗ выявили превалирование нижнедолевой локализации патологического процесса (86%), у половины из них (49%) — с обеих сторон.
Сравнительные данные средних значений общего анализа крови при поступлении представлены в таблице 1.
Обращает на себя внимание снижение уровня гемоглобина и более высокий показатель тромбоцитов у больных 1-й группы. Анемию у этих больных, вероятно, можно связать с гиперпродукцией гепцидина в печени, появляющейся во время инфекции и воспаления. Этот процесс инициируется провоспалительными цитокинами, которые блокируют выход железа из макрофагов и абсорбцию его в кишечнике, что приводит к гипоферремии и в дальнейшем — к анемии при воспалительном процессе [19–23].
Биохимический анализ крови у пациентов 2-й группы при поступлении показал более высокое значение величины С-реактивного белка. В то же время уровень трансаминаз, глюкозы и креатинина у них был ниже, чем у больных 1-й группы, что, вероятно, связано с более выраженным генерализованным ответом на инфекционную альтерацию (табл. 1).
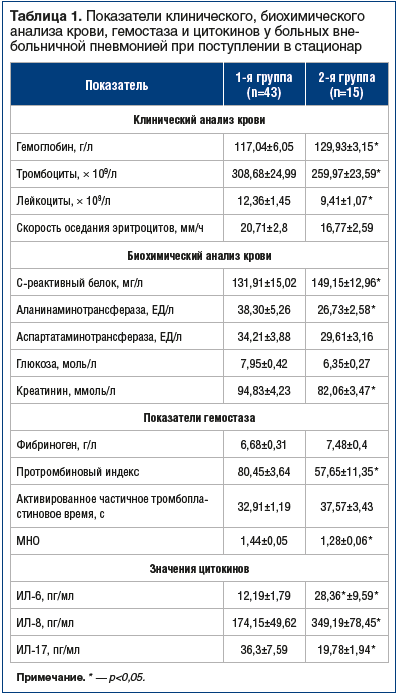
Статистически достоверных различий средних величин показателей фибриногена и активированного частичного тромбопластинового времени (АЧТВ) между 2 группами больных не было выявлено (табл. 1).
Определено повышение протромбинового индекса и международного нормализованного отношения (МНО) у больных ВП 1-й группы по сравнению с пациентами 2-й группы, что свидетельствует о коагуляционной дестабилизации крови. Поскольку МНО обратно пропорционально времени свертываемости плазмы, т. е. чем больше МНО, тем меньше в плазме протромбина и факторов свертываемости, то повышенное значение МНО может оказать положительное влияние на течение коморбидных ССЗ у больных 1-й группы.
При сравнении показателей сывороточного ИЛ-6 в исследуемых группах было выявлено повышение уровня этого цитокина в 2,3 раза у пациентов 2-й группы (табл. 1). ИЛ-6 характеризует отсутствие адекватного ответа адаптивной иммунной системы, индуцирует острофазовый воспалительный ответ, который ассоциируется с гиперэкспрессией цитокина в печени, что проявляется увеличением синтеза острофазовых белков (С-реактивного белка, фибриногена, сывороточного амилоидного белка А, α-антитрипсина и гаптоглобина) и нарушением метаболизма липидов и липопротеидов крови — независимых предикторов сердечно-сосудистых осложнений [7]. Следовательно, низкая продукция ИЛ-6 у больных 1-й группы может привести к дополнительному благоприятному влиянию на функциональное состояние сердечно-сосудистой системы, в то время как повышение уровня этого показателя у пациентов 2-й группы создает условия для возникновения возможных нежелательных осложнений со стороны сердечно-сосудистой системы.
Средний уровень ИЛ-8 у пациентов 2-й группы был почти в 2 раза выше, чем у больных 1-й группы. Повышенный уровень цитокина характеризует развитие выраженной воспалительной реакции у больных 2-й группы. М.Е. Меняйло и др. (2017) иммуноферментным методом исследовали гепаринизированную венозную кровь 14 условно здоровых доноров обоего пола в возрасте от 21 до 35 лет и установили, что ИЛ-8 принимает участие в механизмах, регулирующих формирование долговременной иммунной памяти, вызывает направленную миграцию нейтрофилов и лимфоцитов в очаг воспаления [24, 25]. Повышенный уровень ИЛ-8 у больных 2-й группы объясняется более выраженным интоксикационным синдромом при поступлении.
При корреляционном анализе у пациентов 2-й группы была выявлена прямая сильная достоверная связь между ИЛ-8 и МНО (r=0,85, р<0,05), т. е. чем более выраженный воспалительный процесс, тем большее значение приобретает показатель МНО, а следовательно, тем ниже будет содержание протромбина и факторов свертываемости крови, что, в свою очередь, может благоприятным образом сказаться на функциональном состоянии сердечно-сосудистой системы.
Среднее значение величины ИЛ-17 у пациентов 1-й группы было практически в 2 раза выше, чем у больных 2-й группы. Повышение уровня цитокина у пациентов 1-й группы происходит, во‑первых, за счет развития воспалительного процесса, хоть и вялотекущего. У этих больных при поступлении определялся маловыраженный интоксикационный синдром, наблюдалось медленное развитие клинической симптоматики, определялись более низкие значения величин острофазовых белков воспаления и ИЛ-6, чем у больных 2-й группы. Во-вторых, повышение уровня цитокина у пациентов 1-й группы происходит за счет имеющихся коморбидных ССЗ, в формировании и развитии которых ИЛ-17 играет немаловажную роль, значительно ухудшая течение сопутствующего заболевания.
При изучении корреляции между уровнем ИЛ-17 в сыворотке крови и маркерами воспаления у пациентов 1-й группы установлено наличие сильных прямых достоверных связей между увеличенным значением ИЛ-17, содержанием нейтрофилов и молодых форм лейкоцитов (r=0,85 и r=0,91, р<0,05), что свидетельствует о ключевой роли этого цитокина в защите организма от внеклеточных бактериальных инфекций [26].
При расчете корреляции между цитокинами, МПО и эхокардиографическими показателями у больных 1-й группы выявлена прямая, средней силы связь, приближающаяся к сильной между уровнем ИЛ-17 в сыворотке крови и временем достижения максимальной скорости выброса в выносящем тракте правого желудочка (r=0,61, р<0,05), а также прямая сильная связь с диаметром нижней полой вены (r=0,86, р<0,05). У больных 1-й группы ИЛ-17 способствовал развитию легочной гипертензии (систолическое давление в легочной артерии возросло до 43±13,0 мм рт. ст.). Все указанное может служить свидетельством того, что у больных ВП с ССЗ повышенный уровень ИЛ-17 способствует развитию недостаточности правых отделов сердца. Это подтверждается исследованиями М.А. Saleh (2016), установившими, что при ингибировании передачи сигналов ИЛ-17 с помощью моноклональных антител к ИЛ-17A или ИЛ-17RA в эксперименте снижалось систолическое давление на 30 мм рт. ст. [27]. М. Orejudo et al. (2020) считают, что ИЛ-17A участвует в формировании аутоиммунных хронических воспалительных процессов и сердечно-сосудистых заболеваний, главным образом, посредством регуляции провоспалительных факторов. Кроме того, этот цитокин может играть существенную роль в регуляции системного артериального давления, в ремоделировании и жесткости мелких артерий. Механизм действия ИЛ-17A связывают с развитием гипертрофии гладкомышечных волокон сосудистой стенки и изменением фенотипа при отсутствии накопления белков внеклеточного матрикса [28]. Можно предположить, что на фоне развивающейся начальной декомпенсации правого желудочка у этих больных формируется иммунный ответ, опосредуемый активацией системы ИЛ-17. Однако вопрос о степени заинтересованности ИЛ-17 в развитии поражения сосудистой стенки и необратимости развития патологических процессов остается дискуссионным [29].
При вычислении корреляции между уровнем МПО и ЭхоКГ-показателями у больных 1-й группы обнаружена прямая сильная связь с индексом эксцентриситета левого желудочка (r=0,79, р<0,05) и обратная, приближающаяся к сильной — с диаметром нижней полой вены (r= -0,69, р<0,05). МПО — фермент лизосом нейтрофилов, обладающий неспецифическим бактерицидным действием за счет образования гипохлорит-аниона, который является сильным окислителем. По мере деструктуризации нейтрофилов концентрация МПО постепенно возрастает, а миокард по мере уменьшения воздействия инфекционно-токсического фактора начинает восстанавливать сократительную способность, при этом застой крови в большом круге кровообращения постепенно снижается и диаметр нижней полой вены уменьшается, т. е. возрастающий уровень МПО создает условия для улучшения кардиогемодинамики.
Таким образом, степень активности воспалительного процесса может оказывать существенное влияние на состояние легочно-сердечного кровообращения у больных ВП с коморбидными ССЗ, а динамическое наблюдение за изменением провоспалительных цитокинов и иммунного гомеостаза расширяет возможности суждения о функциональном состоянии легочно-сердечной гемодинамики, позволяет своевременно начать кардиопротекторную терапию и осуществлять контроль за ее эффективностью.
Выводы
У больных ВП с коморбидными ССЗ определена менее выраженная, чем у больных 2-й группы, активация иммунной системы, проявляющаяся в маловыраженном интоксикационном синдроме, медленном нарастании клинической симптоматики, низкой продукции острофазовых белков и провоспалительных цитокинов (ИЛ-6, -8).
На фоне начального развития декомпенсации правого желудочка у больных 1-й группы формируется иммунный ответ, опосредуемый активацией системы ИЛ-17. Повышенный уровень цитокина обусловлен не только развитием воспалительного процесса, но и наличием сопутствующих ССЗ. Динамика уровня ИЛ-17 в сыворотке крови больных ВП может служить прогностическим критерием степени выраженности патологического процесса и функционального состояния легочно-сердечного кровообращения.
Дальнейшее изучение динамики уровней провоспалительных цитокинов и острофазовых белков при ВП у пациентов с клинически значимыми ССЗ является перспективным, т. к. направлено на разработку новых подходов к диагностике, раннее распознавание осложнений, проведение адекватной терапии и оценку эффективности лечения.
2. Чучалин А.Г. Пневмония: актуальная проблема медицины ХХΙ века. Пульмонология. 2015;25(2):133–142. [Chuchalin A.G. Pneumonia as an actual medical problem of the 21th century. Pulmonologiya. 2015;25(2):133–142 (in Russ.)]. DOI: 10.18093/0869-0189-2015-25-2-133-142.
3. Бобылев А.А., Рачина С.А., Авдеев С.Н. и др. Внебольничная пневмония у пациентов пожилого и старческого возраста. Пульмонология. 2015;25(3):261–276. [Bobylev A.A., Rachina S.A., Avdeev S.N. et al. Community-acquired pneumonia in elderly and very elderly patients. Pulmonologiya. 2015;25(3):261–276 (in Russ.)]. DOI: 10.18093/0869-0189-2015-25-3-261-276.
4. Караулов А.В. Иммунология внебольничных пневмоний. Под ред. Чучалина А.Г., Синопальникова А.И., Чернеховской Н.Е. Пневмония. М.: Экономика и информатика; 2002 [Karaulov A.V. Immunology of community-acquired pneumonia. Ed. Chuchalin A.G., Sinopal’nikov A.I., Chernehovskaja N.E. Pneumonia. M.: Economics and informatics; 2002 (in Russ.)].
5. Воробьев А.А. Иммунология и аллергология (цветной атлас): учебное пособие для студентов медицинских вузов. Под ред. Воробьева А.А., Быкова А.С., Караулова А.В. М.: Практическая медицина; 2006. [Vorob’ev A.A. Immunologyand Allergology (color atlas): textbook for medical students. Ed. Vorob’ev A.A., Bykov A.S., Karaulov A.V. M.: Practical medicine; 2006 (in Russ.)].
6. Серебренникова С.Н., Семинский И.Ж. Роль цитокинов в воспалительном процессе. Сибирский медицинский журнал. 2008;6:5–8. [Serebrennikova S.N., Seminskij I. Zh. The role of cytokines in the inflammatory process. Siberian medical journal. 2008;6:5–8 (in Russ.)].
7. Верлан Н.В. Цитокины и воспаление. 2016;15(1):12–21. [Verlan N.V. Cytokines and inflammation. 2016;15(1):12–21 (in Russ.)].
8. Paats M.S. Local and systemic cytokine profiles in nonsevere and severe community-acquired pneumonia. Eur Respir J. 2013;6:1378–1385.
9. Маркелова Е.В., Костюшко А.В., Красников В.Е. Патогенетическая роль нарушений в системе цитокинов при инфекционно-воспалительных заболеваниях. Тихоокеанский медицинский журнал. 2008;3:24–29. [Markelova E.V., Kostjushko A.V., Krasnikov V.E. Pathogenetic role of the in cytokine system changes at infectious and inflammatory diseases. Pacific Medical Journal. 2008;3:24–29 (in Russ.)].
10. Бацкалевич Н.А., Веревщиков В.К., Лагерева Ю.Г. Оценка иммунитета и иммунотропной терапии энтеровирусных менингитов. Инфекционные болезни. 2009;7(3):30–34. [Вackalevich N.A., Verevshhikov V.K., Lagereva Ju.G. Assessment of immunity and immunotropic therapy of enterovirus meningitis. Infectious disease. 2009;7(3):30–34 (in Russ.)].
11. Кетлинский С.А., Симбирцев A.C. Цитокины. СПб.: Фолиант; 2008 [Ketlinskij S.A., Simbircev A.C. Cytokines. SPb.: Foliant; 2008 (in Russ.) ].
12. Lu Y.J., Gross J., Bogaert D. et al. Interleukin17A mediates acquired immunity to pneumococcal colonization. PLoS Pathog. 2008;4(9): e1000159. DOI: 10.1371/journal.ppat.1000159.
13. Чучалин А.Г., Синопальников А.И., Козлов Р.С. и др. Внебольничная пневмония у взрослых: практические рекомендации по диагностике, лечению и профилактике: пособие для врачей. 3-е изд. М.; 2010. [Chuchalin A.G., Sinopal’nikov A.I., Kozlov R.S. et al. Practical guidelines for the prevention, diagnosis, and treatment of community acquired pneumonia in adults (physician’s manual). 3. M.; 2010 (in Russ.)].
14. Lim W.S., van der Eerden M.M., Laing R. et al. Defining community acquired pneumonia severity on presentation to hospital: an international derivation and validation study. Thorax. 2003;58(5):377–382. DOI: 10.1136/thorax. 58. 5. 377.
15. Torres A., Blasi F., Peetermans W.E. et al. The etiology and antibiotic management of community-acquired pneumonia in adults in Europe: a literature review. Eur J Clin Microbiol Infect Dis. 2014;33(7):1065–1079. DOI: 10.1007/s10096-014-2067-1.
16. ЕSC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension (2015). Eur Heart J. 2016;37(1):67–119. DOI: 10.1093/eurheartj/ehv317.
17. Watkins R.R., Lemonovich T.L. Diagnosis and management of community-acquired pneumonia in adults. Am Fam Physician. 2011;83(11):1299–1306.
18. Patrick G.P., Wolfe C.R., Whitby M. et al. Australian Community-Acquired Pneumonia Study Collaboration M. Lindsay Grayson SMART-COP: A Tool for Predicting the Need for Intensive Respiratory or Vasopressor Support in Community-Acquired Pneumonia. Clinical Infectious Diseases. 2008;47(3):375–384. DOI: 10.1086/589754.
19. Krause A., Neitz S., Magert H.J. et al. LEAP-1, a novel highly disulfide-bonded human peptide, exhibit antimicrobial activity. FEBS Lett. 2000;480(2):147–150.
20. Park C.H., Valore E.V., Waring A.J. et al. Hepcidin, a urinary antimicrobial peptide synthesized in the liver. J Biol CHem. 2001;276(11):7806–7810.
21. Павлов А.Д., Морщаков Е.Ф., Румянцев А.Г. Эритропоэз, эритропоэтин, железо. М.: ГЭОТАР-Медиа; 2011. [Pavlov A.D., Morshhakov E.F., Rumjancev A.G. Erythropoiesis, erythropoietin, iron. M.: GJeOTAR-Media; 2011 (in Russ.)].
22. Смирнов О.А. Железо-регуляторный гормон печени гепцидин и его место в системе врожденного иммунитета. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2010;5:10–15. [Smirnov O.A. Iron-regulatory liver hormone hepcidin and its place in the system of congenital immunity. Rossijskij zhurnal gastrojenterologii, gepatologii, koloproktologii. 2010;5:10–15 (in Russ.)].
23. Kim H.R., Kim K.W., Yoon S.Y. et al. Serum pro-hepcidin could reflect disease activity in patients with rheumatoid arthritis. J. Korean Med. Sci. 2010;25(3):348–352.
24. Меняйло М.Е., Малащенко В.В., Шмаров В.А. и др. Роль интерлейкина-8 в непосредственной регуляции функциональной активности Т-лимфоцитов. Медицинская иммунология. 2017;19(5):529–536. DOI: 10.15789/1563-0625-2017-5-529-536. [Meniailo M.E., Malashchenko V.V., Shmarov V.A. еt al. A role for interleukin 9 in direct regulation of t cell functional activity. Medical Immunology (Russia). 2017;19(5):529-536 (in Russ.)]. DOI: 10.15789/1563-0625-2017-5-529-536.
25. Bickel M. The role of interleukin-8 in inflammation and mechanisms of regulation. J. Periodontol. 1993;64(5):456–460.
26. Cypowyj S., Picard C., Maródi L. et al. Immunity to infection in IL-17-deficient mice and humans. Eur. J. Immunol. 2012;42:2246–2254.
27. Saleh M.A., Norlander A.E., Madhur M.S. Inhibition of Interleukin 17-A but not Interleukin-17F Signaling Lowers Blood Pressure and Reduces End-organ Inflammation in Angiotensin II-induced Hypertension. JACC Basic Transl Sci. 2016;1(7):606–616. DOI: 10.1016/j.jacbts.2016.07.009.
28. Orejudo M., García-Redondo A.B., Rodrigues-Diez R.R. et al. Interleukin-17A induces vascular remodeling of small arteries and blood pressure elevation. Clin Sci (Lond). 2020;134(5):513–527. DOI: 10.1042/CS20190682.
29. Allam G., Abdel-Moneim A., Gaber A.M. The pleiotropic role of interleukin-17 in atherosclerosis. Biomed Pharmacother. 2018;106:1412–1418. DOI: 10.1016/j.biopha.2018.07.110.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
