Состояние системы иммунитета у пациентов с варикозной болезнью вен нижних конечностей
РМЖ. №6(II) от 12.12.2018 стр. 54-60
Рубрика:
Ангиология
Цель исследования: изучение состояния врожденного и адаптивного иммунитета у пациентов с варикозной болезнью вен нижних конечностей (ВБВНК) С4 и С6 клинических классов по классификации СЕАР.
Материал и методы: в исследовании приняли участие 34 пациента с ВБВНК, находившихся на амбулаторном лечении во флебологическом центре ГКБ № 1 им. Н.И. Пирогова. Контрольную группу составили 17 практически здоровых добровольцев. В периферической крови оценивали абсолютное и относительное содержание: моноцитов и гранулоцитов, экспрессирующих рецепторы TLR2, TLR4, TLR6, CD11b, CD16, CD18, CD24, CD36, CD54, CD206; лимфоцитов, экспрессирующих на своей поверхности рецепторы CD16, CD56, CD3, CD4, CD8, CD19, CD25, СD45RA, CD45RO.
Результаты исследования: анализ рецепторного репертуара клеточных факторов естественной резистентности выявил у пациентов с ВБВНК С4–С6 классов изменения в системе образраспознающих рецепторов, связанные со значительным увеличением (р<0,05) содержания в периферической крови гранулоцитов и/или моноцитов, экспрессирующих на своей поверхности сигнальные Toll-подобные рецепторы — TLR2, TLR4 и TLR6, по сравнению со здоровыми добровольцами.
Исследование относительного и абсолютного содержания в периферической крови клеточных факторов системы естественной цитотоксичности — зрелых циркулирующих ЕК-клеток у больных с ВБВНК выявило, что эти показатели существенно не отличались от показателей у практически здоровых лиц.
Анализ уровня в периферической крови субпопуляций Т-лимфоцитов позволил отметить некоторые особенности фенотипа клеток Т-звена адаптивного иммунитета в зависимости от тяжести течения ХВН.
Заключение: исследования системного иммунитета у пациентов с ВБВНК различных клинических классов показали, что у больных ВБВНК С4 клинического класса, так же как и у больных ВБВНК С6 клинического класса, имеются изменения субпопуляционного состава иммунокомпетентных клеток и их функциональной активности.
Ключевые слова: варикозная болезнь вен нижних конечностей, венозная трофическая язва, врожденный иммунитет, адаптивный иммунитет.
Для цитирования: Васильев И.М., Рыкова М.П., Богданец Л.И., Пономарев С.А., Антропова Е.Н., Калинин С.А., Тагирова С.К., Селезнев В.В., Марченко И.П. Состояние системы иммунитета у пациентов с варикозной болезнью вен нижних конечностей. РМЖ. Медицинское обозрение. 2018;26(6(II)):54-60.
Материал и методы: в исследовании приняли участие 34 пациента с ВБВНК, находившихся на амбулаторном лечении во флебологическом центре ГКБ № 1 им. Н.И. Пирогова. Контрольную группу составили 17 практически здоровых добровольцев. В периферической крови оценивали абсолютное и относительное содержание: моноцитов и гранулоцитов, экспрессирующих рецепторы TLR2, TLR4, TLR6, CD11b, CD16, CD18, CD24, CD36, CD54, CD206; лимфоцитов, экспрессирующих на своей поверхности рецепторы CD16, CD56, CD3, CD4, CD8, CD19, CD25, СD45RA, CD45RO.
Результаты исследования: анализ рецепторного репертуара клеточных факторов естественной резистентности выявил у пациентов с ВБВНК С4–С6 классов изменения в системе образраспознающих рецепторов, связанные со значительным увеличением (р<0,05) содержания в периферической крови гранулоцитов и/или моноцитов, экспрессирующих на своей поверхности сигнальные Toll-подобные рецепторы — TLR2, TLR4 и TLR6, по сравнению со здоровыми добровольцами.
Исследование относительного и абсолютного содержания в периферической крови клеточных факторов системы естественной цитотоксичности — зрелых циркулирующих ЕК-клеток у больных с ВБВНК выявило, что эти показатели существенно не отличались от показателей у практически здоровых лиц.
Анализ уровня в периферической крови субпопуляций Т-лимфоцитов позволил отметить некоторые особенности фенотипа клеток Т-звена адаптивного иммунитета в зависимости от тяжести течения ХВН.
Заключение: исследования системного иммунитета у пациентов с ВБВНК различных клинических классов показали, что у больных ВБВНК С4 клинического класса, так же как и у больных ВБВНК С6 клинического класса, имеются изменения субпопуляционного состава иммунокомпетентных клеток и их функциональной активности.
Ключевые слова: варикозная болезнь вен нижних конечностей, венозная трофическая язва, врожденный иммунитет, адаптивный иммунитет.
Для цитирования: Васильев И.М., Рыкова М.П., Богданец Л.И., Пономарев С.А., Антропова Е.Н., Калинин С.А., Тагирова С.К., Селезнев В.В., Марченко И.П. Состояние системы иммунитета у пациентов с варикозной болезнью вен нижних конечностей. РМЖ. Медицинское обозрение. 2018;26(6(II)):54-60.
Immune system condition in patients with lower limb varicose vein disease
I.M. Vasiliev1,2, M.P. Rykova2, L.I. Bogdanets3, S.A. Ponomarev2, E.N. Antropova2, S.A. Kalinin2, S.K. Tagirova1,2,
V.V. Seleznev1, I.P. Marchenko1
1 Bauman City Clinical Hospital No.29, Moscow
2 Institute of Medical and Biological Problems of the Russian Academy of Sciences, Moscow
3 Pirogov Russian National Research Medical University, Moscow
Aim: to study the state of innate and adaptive immunity in patients with lower limb varicose vein disease (LLVVD) of C4 and C6 clinical class according to CEAP classification.
Patients and Methods: the study involved 34 patients with LLVVD who were on outpatient treatment in phlebological center of the Pirogov City Clinical Hospital No.1. The control group consisted of 17 healthy volunteers. In the peripheral blood were assessed by the absolute and relative count of:
1) monocytes and granulocytes, expressing receptors TLR2, TLR4, TLR6, CD11b, CD16, CD18, CD24, CD36, CD54, CD206;
2) lymphocytes, expressing receptors on its surface CD16, CD56, CD3, CD4, CD8, CD19, CD25, СD45RA, CD45RO.
Results: an analysis of the receptor repertoire of cellular factors of natural resistance in patients with LLVVD of C4–C6 classes of changes in the system of pattern recognition receptors associated with a significant increase (p<0.05) of granulocytes and/or monocytes in the peripheral blood, expressing signal Toll-like receptors — TLR2, TLR4 and TLR6, on their surface, compared with healthy volunteers.
The study of the relative and absolute count in the peripheral blood of cellular factors of the natural cytotoxicity system — mature circulating NK-cells — in patients with LLVVD showed that these indicators did not significantly differ from those in healthy persons.
Analysis of the T-lymphocyte subpopulations level in the peripheral blood allowed noting some features of the T-cells phenotype of adaptive immunity depending on the severity of CVI.
Conclusion: this study of systemic immunity in patients with lower limb varicose vein disease of various clinical classes has shown that patients with LLVVD of C4 clinical class, as well as patients with LLVVD of C6 clinical class, have changes in the subpopulation count of immune competent cells and their functional activity.
Key words: lower limb varicose vein disease, venous trophic ulcer, innate immunity, adaptive immunity.
For citation: Vasiliev I.M., Rykova M.P., Bogdanets L.I. et al. Immune system condition in patients with lower limb varicose vein disease // RMJ. 2018. № 6(II). P. 54–60.
I.M. Vasiliev1,2, M.P. Rykova2, L.I. Bogdanets3, S.A. Ponomarev2, E.N. Antropova2, S.A. Kalinin2, S.K. Tagirova1,2,
V.V. Seleznev1, I.P. Marchenko1
1 Bauman City Clinical Hospital No.29, Moscow
2 Institute of Medical and Biological Problems of the Russian Academy of Sciences, Moscow
3 Pirogov Russian National Research Medical University, Moscow
Aim: to study the state of innate and adaptive immunity in patients with lower limb varicose vein disease (LLVVD) of C4 and C6 clinical class according to CEAP classification.
Patients and Methods: the study involved 34 patients with LLVVD who were on outpatient treatment in phlebological center of the Pirogov City Clinical Hospital No.1. The control group consisted of 17 healthy volunteers. In the peripheral blood were assessed by the absolute and relative count of:
1) monocytes and granulocytes, expressing receptors TLR2, TLR4, TLR6, CD11b, CD16, CD18, CD24, CD36, CD54, CD206;
2) lymphocytes, expressing receptors on its surface CD16, CD56, CD3, CD4, CD8, CD19, CD25, СD45RA, CD45RO.
Results: an analysis of the receptor repertoire of cellular factors of natural resistance in patients with LLVVD of C4–C6 classes of changes in the system of pattern recognition receptors associated with a significant increase (p<0.05) of granulocytes and/or monocytes in the peripheral blood, expressing signal Toll-like receptors — TLR2, TLR4 and TLR6, on their surface, compared with healthy volunteers.
The study of the relative and absolute count in the peripheral blood of cellular factors of the natural cytotoxicity system — mature circulating NK-cells — in patients with LLVVD showed that these indicators did not significantly differ from those in healthy persons.
Analysis of the T-lymphocyte subpopulations level in the peripheral blood allowed noting some features of the T-cells phenotype of adaptive immunity depending on the severity of CVI.
Conclusion: this study of systemic immunity in patients with lower limb varicose vein disease of various clinical classes has shown that patients with LLVVD of C4 clinical class, as well as patients with LLVVD of C6 clinical class, have changes in the subpopulation count of immune competent cells and their functional activity.
Key words: lower limb varicose vein disease, venous trophic ulcer, innate immunity, adaptive immunity.
For citation: Vasiliev I.M., Rykova M.P., Bogdanets L.I. et al. Immune system condition in patients with lower limb varicose vein disease // RMJ. 2018. № 6(II). P. 54–60.
В статье представлены результаты оригинального исследования, посвященного изучению состояния врожденного и адаптивного иммунитета у пациентов с варикозной болезнью вен нижних конечностей.
Введение
Варикозная болезнь вен нижних конечностей (ВБВНК) является одним из наиболее распространенных заболеваний периферических сосудов нижних конечностей, которое встречается у 25–50% населения развитых стран [1], причем в 15% случаев течение данного заболевания осложняется образованием венозных трофических язв (ВТЯ).За последние три десятилетия достигнуты значительные успехи в диагностике и лечении заболеваний вен нижних конечностей, однако проблема лечения осложненных форм ВБВНК далека от решения [2]. В научной европейской программе, посвященной хронической венозной недостаточности (ХВН), отмечено, что в результате применения современных методов лечения 50% язв закрываются в течение первых 4 мес., 20% остаются открытыми на протяжении 2 лет, 38% не заживают при 5-летнем наблюдении. Примечательно, что даже в случае заживления ВТЯ процент их рецидива остается высоким и колеблется от 4,8 до 31,6% после хирургического лечения и от 15 до 100% в результате комплексного консервативного лечения [3, 4]. Становится все более очевидным, что попытки воздействия на отдельные звенья патогенеза заболевания обречены на неудачу. Только патогенетически обоснованный комплексный подход с применением современных методов хирургического и консервативного лечения, адекватных стадии заболевания, позволит улучшить непосредственные и отдаленные результаты лечения.
Большинство авторов считают, что в основе формирования трофических нарушений у пациентов с ВБВНК лежит флебогипертензия, инициирующая каскад патологических реакций на молекулярном, клеточном и тканевом уровнях, макро- и микроциркуляторные расстройства в венозном русле, биофизические, биохимические и иммунологические процессы [5]. В настоящий момент исследования роли иммунных нарушений в патогенезе ВБВНК находятся на стадии накопления данных. Немногочисленные и достаточно противоречивые результаты изучения состояния иммунной системы у больных с открытыми ВТЯ нижних конечностей С6 клинического класса свидетельствуют о том, что тяжесть развивающихся трофических нарушений обусловлена не только анатомическими особенностями венозного русла, но и неадекватным ответом иммунокомпетентных клеток на флебогипертензию как хронический повреждающий фактор [6–9]. До сих пор остаются нерешенными многие вопросы, в частности: каковы характерные иммунологические особенности ВБВНК на различных стадиях заболевания; предшествуют ли изменения в иммунной системе развитию ВТЯ или являются следствием возникшего патологического процесса.
Цель исследования: изучить состояния врожденного и адаптивного иммунитета у пациентов с ВБВНК С4 и С6 клинических классов по классификации СЕАР.
Материал и методы
В исследовании приняли участие 34 пациента с ВБВНК(25 женщин и 9 мужчин) в возрасте 58,3±12,3 года, находившихся на амбулаторном лечении во флебологическом центре ГКБ № 1 им. Н.И. Пирогова. Работа проведена в соответствии с Хельсинкской декларацией «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. Все пациенты дали письменное информированное согласие на участие в клиническом исследовании. Критерием включения в исследование явилось наличие ВБВНК, подтвержденной посредством ультразвукового ангиосканирования. Из исследования исключали пациентов с сопутствующей соматической патологией (сахарный диабет 1 и 2 типа, облитерирующий атеросклероз артерий нижних конечностей, системный васкулит, ревматоидный артрит, заболевания, для лечения которых требуется проведение гормонотерапии и иммунокоррекции). Пациенты были разделены на 2 группы согласно тяжести заболевания по классификации СЕАР: 1-я группа — 17 пациентов с ВБВНК С4 клинического класса, 2-я группа — 17 пациентов с открытыми ВТЯ нижних конечностей площадью до 30 см2 (С6 клинический класс). Контрольную группу составили 17 практически здоровых добровольцев (средний возраст — 51,2±6,7 года).
Взятие проб венозной крови для иммунологических исследований проводили натощак путем венепункции с использованием вакуумных систем типа Vacutainer (Германия). Определение содержания лейкоцитов, а также абсолютного и относительного количества лимфоцитов в периферической крови, стабилизированной ЭДТА, выполняли на автоматическом гематологическом анализаторе Celltac-α МЕК 6318K (Nihon Kohden, Япония). Исследование поверхностных рецепторных структур моноцитов, гранулоцитов и лимфоцитов осуществляли мультипараметрическим методом иммунофлюоресцентного анализа с использованием моноклональных антител (IQ Products, Нидерланды). В периферической крови оценивали абсолютное и относительное содержание: моноцитов и гранулоцитов, экспрессирующих рецепторы TLR2, TLR4, TLR6, CD11b, CD16, CD18, CD24, CD36, CD54, CD206; лимфоцитов, экспрессирующих на своей поверхности рецепторы CD16, CD56, CD3, CD4, CD8, CD19, CD25, СD45RA, CD45RO. Определение раннего активационного маркера CD69 проводили в культурах нестимулированных и стимулированных мононуклеарных клеток (МНК) через 18 ч от начала культивирования. Для стимуляции лимфоцитов использовали интерлейкин 2 (ИЛ-2, Sigma) в концентрации 40 Мед/мл, фитогемагглютинин (ФГА, Sigma) в концентрации 20 мкг/мл и митоген лаконоса (МЛ, Sigma) в концентрации 20 мкг/мл.
Учет результатов исследований методом проточной лазерной цитометрии проводили на цитофлюориметре FACSCalibur (Becton Dickinson, США) в программах Simulset и CellQuest. Уровень иммуноглобулинов трех основных классов (IgA, IgM и IgG) в плазме крови определяли турбидиметрическим методом с применением наборов реактивов фирмы HUMAN (Германия). Исследования содержания цитокинов в сыворотке крови проводили с помощью полуавтоматического биочипового иммунохемилюминесцентного анализатора Evidence investigator (Randox Labs, Великобритания). Оценку результатов выполняли путем сравнения зарегистрированных значений хемилюминесценции с калибровочными кривыми зависимости концентрации от хемилюминесцентного сигнала, полученными при анализе контрольных сывороток.
Результаты исследований были обработаны с использованием пакета прикладных программ Statistica for Windows 6.0. Достоверность различий между сравниваемыми группами определяли с использованием теста Стьюдента. Статистически значимыми изменения средних величин считались при р<0,05. Данные представлены в виде среднего значения ± стандартная ошибка среднего (М±m).
Результаты
Исследование лимфоцитарного, моноцитарного и гранулоцитарного ростков периферической крови показало, что у пациентов с ВБВНК С4 и С6 клинических классов наблюдались отличия от здоровых лиц: достоверное повышение уровня лейкоцитов и относительного содержания гранулоцитов при одновременном снижении относительного количества лимфоцитов (табл. 1).
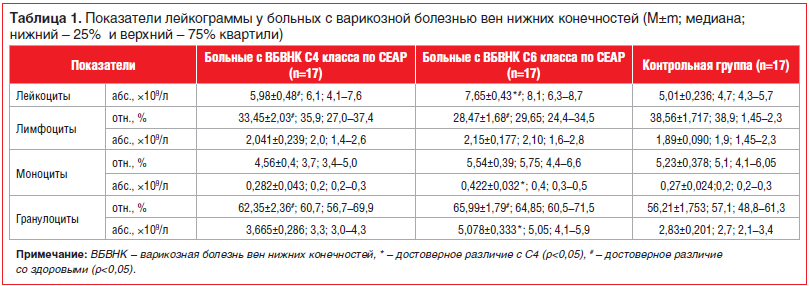
Анализ рецепторного репертуара клеточных факторов естественной резистентности выявил у пациентов с ВБВНК С4–С6 классов изменения в системе образраспознающих рецепторов (pattern-recognition receptor, PRR), связанные со значительным увеличением (р<0,05) содержания в периферической крови гранулоцитов и/или моноцитов, экспрессирующих на своей поверхности сигнальные Toll-подобные рецепторы (TLR) — TLR2, TLR4 и TLR6, по сравнению со здоровыми добровольцами.
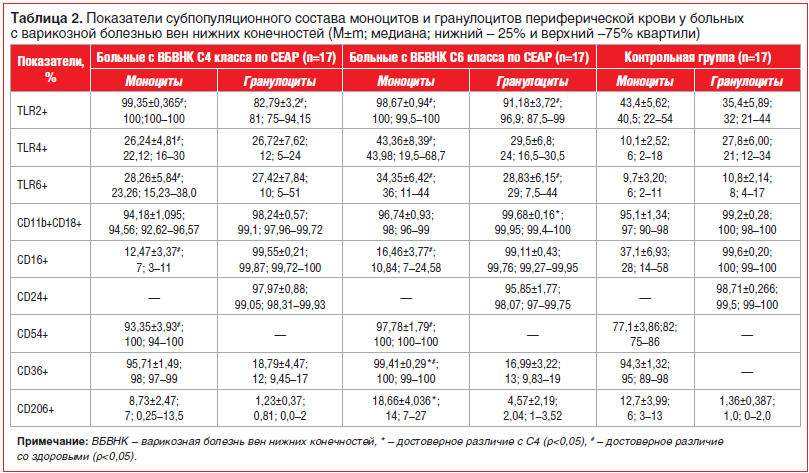
Было изучено содержание в периферической крови обследованных больных моноцитов и гранулоцитов, экспрессирующих на своей мембране эндоцитозные (маннозный рецептор — CD206, скавенджер-рецептор — CD36) PRR, а также интегрины — CD18 (β2-интегрин) и CD11b (CR3), FcR-рецептор CD16 (FcγRIII) и активационные молекулы (CD54 и CD24). Как у пациентов с ВБВНК С4 класса, так и у пациентов с ВБВНК С6 класса в сравнении со здоровыми добровольцами наблюдалось снижение относительного содержания среди CD14+-клеток моноцитов, экспрессирующих рецептор CD16, непосредственно участвующих в реакциях фагоцитоза, при одновременном повышении уровня моноцитов, экспрессирующих рецептор CD54, основной функцией которого является обеспечение адгезии моноцитов к активированному сосудистому эндотелию с последующей их экстравазацией и миграцией в очаг воспаления. Особенностями фенотипа моноцитов у больных с ВБВНК С6 класса по сравнению с фенотипом моноцитов у больных с ВБВНК С4 класса является повышение уровня моноцитов, экспрессирующих на клеточной мембране еще один рецептор, участвующий в реакциях фагоцитоза, — маннозный рецептор CD206. Наряду с этим при анализе рецепторного репертуара гранулоцитов не было отмечено статистически значимых изменений содержания клеток, несущих вышеперечисленные рецепторы (табл. 2).
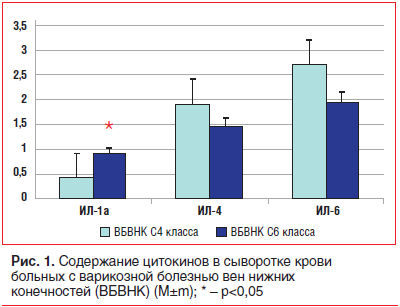
При исследовании в сыворотке крови содержания ИЛ-1α было отмечено, что у больных с ВБВНК С6 класса уровень этого цитокина был существенно выше, чем у больных с ВБВНК С4 класса (р<0,05). Вместе с тем содержание в сыворотке крови таких цитокинов, как ИЛ-4 и ИЛ-6, у больных ВБВНК С6 класса не отличалось достоверно от аналогичных показателей у больных ВБВНК С4 класса (рис. 1).
Исследование относительного и абсолютного содержания в периферической крови клеточных факторов системы естественной цитотоксичности — зрелых циркулирующих ЕК-клеток (CD3-CD16+CD56+) у больных с ВБВНК С4 и С6 клинических классов показало, что в обеих группах обследованных пациентов эти показатели существенно не отличались от показателей у практически здоровых лиц. Вместе с тем в группе обследованных больных С6 клинического класса процент лиц, у которых уровень ЕК находился в пределах 20–30%, был выше, чем в группах практически здоровых лиц и больных С4 клинического класса (соответственно 23,0; 7,0; 12,9; 17,6). Обращает на себя также внимание снижение содержания CD3+CD16+CD56+-Т-клеток, экспрессирующих маркеры ЕК, у больных этой группы. Более детальный анализ особенностей фенотипа ЕК-клеток периферической крови выявил у больных ВБВНК С4 клинического класса статистически значимое снижение относительного содержания в периферической крови CD16+-клеток, связанное со снижением содержания CD16+CD56- лимфоцитов в сравнении с больными ВБВНК С6 клинического класса и здоровыми добровольцами. У больных ВБВНК С4–С6 клинических классов по сравнению с практически здоровыми добровольцами было выявлено также повышение содержания в периферической крови лимфоцитов, несущих на своей мембране лейкоцитарный интегрин CD11b, который играет важную роль в осуществлении такой функции лимфоцитов, как миграция из кровеносного русла в ткани. При этом наблюдалась выраженная тенденция к повышению уровня ЕК, имеющих фенотип CD56+CD11b+ (табл. 3).
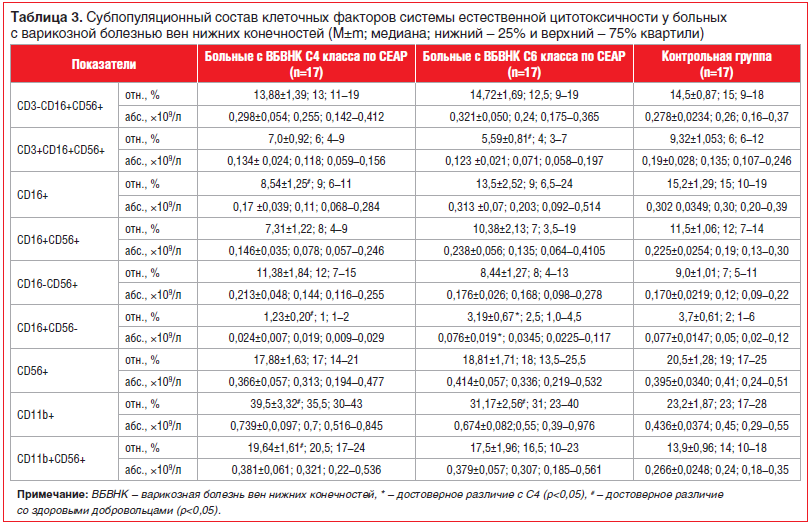
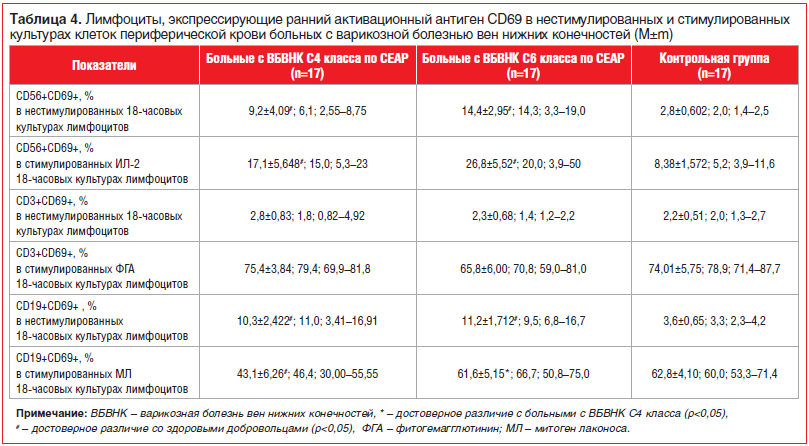
При исследовании экспрессии раннего активационного маркера CD69 на ЕК-клетках периферической крови оказалось, что содержание CD69+CD56+-лимфоцитов в клеточных культурах, активированных ИЛ-2, было существенно снижено у больных ВБВНК С4 класса (17,13%) не только по сравнению с практически здоровыми добровольцами (37,65%), но и по сравнению с больными ВБВНК С6 класса (46,13%). Наряду с этим экспрессия данного маркера у больных ВБВНК С6 класса существенно не отличалась от уровня экспрессии в группе здоровых лиц. В то же время уровень CD69+CD56+-лимфоцитов в клеточных культурах в отсутствие стимуляции в группе больных с ВТЯ был значимо выше по сравнению с больными ВБВНК С4 клинического класса и практически здоровыми лицами (табл. 4).
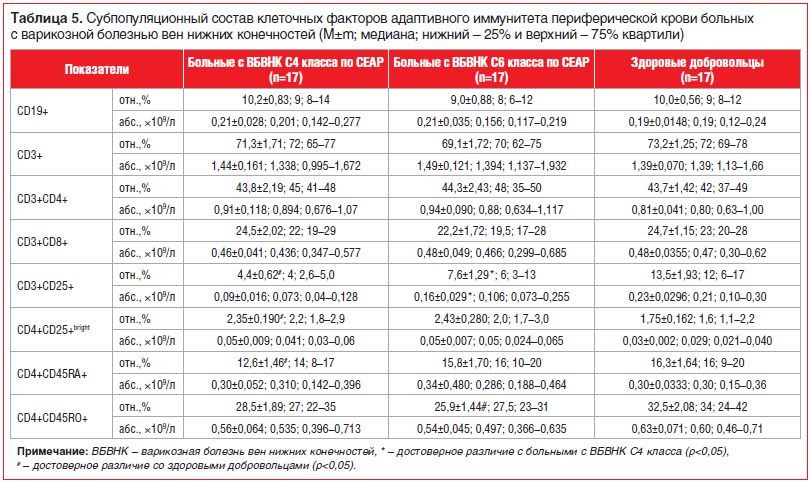
Исследование количественных характеристик основных субпопуляций клеточных факторов адаптивного иммунитета показало, что относительное и абсолютное содержание В-лимфоцитов (CD19+-клеток) и Т-лимфоцитов (CD3+-клеток), а также основных субпопуляций зрелых Т-лимфоцитов, имеющих фенотип CD3+CD4+ и CD3+CD8+, в периферической крови у пациентов с ВБВНК С4–С6 классов не имело статистически значимых отличий от аналогичных показателей практически здоровых людей (см. табл. 1, 2). Анализ уровня в периферической крови таких субпопуляций Т-лимфоцитов, как «наивные» CD4+-Т-клетки (CD4+CD45RA+) и CD4+-Т-клетки памяти (CD4+CD45RО+), позволил отметить некоторые особенности фенотипа клеток Т-звена адаптивного иммунитета в зависимости от тяжести течения ХВН. Так, по сравнению с практически здоровыми людьми у больных с ВБВНК С4 класса наблюдалось снижение относительного содержания CD4+CD45RA+-лимфоцитов, а у больных с ВБВНК С6 класса — CD4+CD45RО+-лимфоцитов. Кроме того, при изучении экспрессии мембранной молекулы CD25 у больных с ВБВНК С4 класса было отмечено существенное снижение относительного и абсолютного содержания в периферической крови CD3+CD25+-клеток, при этом у больных ВБВНК С4 и С6 классов наблюдалось увеличение количества регуляторных CD4+CD25Bright-клеток (табл. 5).
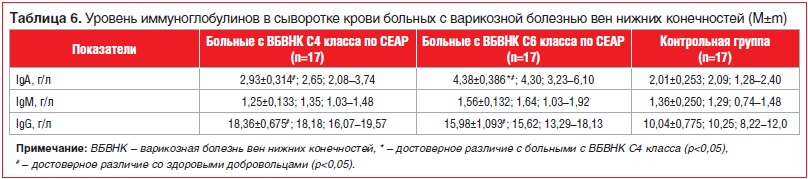
Анализ показателей, характеризующих гуморальные факторы адаптивного иммунитета — содержание иммуноглобулинов трех основных классов (IgA, IgM, IgG), выявил статистически достоверное повышение уровня IgA и IgG в сыворотке крови больных ВБВНК С4–6 классов по сравнению с данными показателями у практически здоровых добровольцев (табл. 6), что, возможно, являлось следствием воспалительного процесса.
Исследование способности Т- и В-лимфоцитов экспрессировать на поверхности ранний активационный антиген CD69 показало, что, по усредненным данным, процентное содержание CD3+-Т-лимфоцитов, экспрессирующих этот активационный маркер, в нестимулированных и стимулированных ФГА культурах мононуклеарных клеток in vitro у больных ВБВНК и здоровых лиц существенно не отличалось (см. табл. 3). Вместе с тем при определении активационного потенциала В-клеток оказалось, что в нестимулированных культурах мононуклеарных клеток наблюдалось повышение уровня CD19+-лимфоцитов, экспрессирующих антиген CD69, у больных ВБВНК
С4 и С6 классов по сравнению с данными показателями у практически здоровых добровольцев (см. табл. 2), что являлось, вероятно, отражением поликлональной активации В-звена иммунитета. Однако при стимуляции МЛ у больных ВБВНК С4 класса экспрессия маркера CD69 на В-лимфоцитах была достоверно ниже, чем в группе больных с ВБВНК C6 и в группе практически здоровых лиц (см. табл. 4).
Обсуждение
Возникновение трофических нарушений мягких тканей у пациентов с ВБВНК проходит определенные ступени развития по мере прогрессирования хронической венозной недостаточности от косметического дефекта с последующим развитием липодерматосклероза и непрерывно рецидивирующих трофических язв. Это требует выбора определенного алгоритма лечения, включающего сочетание хирургических и консервативных методов. Наряду с этим клинические и инструментальные методы исследования не всегда позволяют прогнозировать скорость развития осложнений и, следовательно, своевременно определить тактику адекватного лечения. Вполне возможно, что тяжесть развивающихся трофических нарушений обусловлена не только анатомическими особенностями венозного русла, но и неадекватным ответом иммунокомпетентных клеток на флебогипертензию как хронический повреждающий фактор [7, 9–11]. Однако в настоящее время отсутствуют иммунологические критерии, позволяющие прогнозировать образование трофических язвенных расстройств.Проведенные исследования выявили у пациентов
с ВБВНК С4–С6 классов значительные изменения в системе PRR: увеличение содержания в периферической крови моноцитов и гранулоцитов, экспрессирующих на своей мембране сигнальные (TLR 2, TLR 4, TLR 6), маннозные (CD206) и адгезивные (CD54) рецепторы, а также повышение уровня ИЛ-1α в сыворотке крови, что свидетельствует о повышении активности системы PRR врожденного иммунитета. Эти результаты не противоречат имеющимся в литературе данным, свидетельствующим о повышении экспрессии молекул адгезии на гранулоцитах и/или моноцитах CD11b, CD18, CD54, CD49d, CD62L, CD15 у пациентов с ВБВНК как С2–C4 классов, так и с длительно незаживающими язвами [7, 8].
Представляется вероятным, что активация PRR, выявленная у пациентов с ВБВНК С4 и С6 классов, является следствием повышения как экзогенных, так и эндогенных лигандов. Согласно данным исследований микробиологической структуры ВТЯ, было установлено увеличение частоты выделения ассоциаций микроорганизмов, в первую очередь грамположительных (60,8%), из которых в большинстве случаев определялся патогенный золотистый стафилококк (78%), а грамотрицательная флора (39,2%) была представлена в основном Proteus mirabilis (16,0%) и Pseudomonas aeruginoza (13,1%) [12]. Неменьший интерес представляют сведения о повышении уровня такого эндогенного лиганда TLR, как фибриноген, в интерстициальной жидкости при ХВН нижних конечностей [13].
Необходимо отметить, что после взаимодействия клеток врожденного иммунитета, несущих TLRs, с лигандом происходят передача сигнала внутрь клетки и последовательная активация дополнительных молекул: адапторных белков (например, MyD88), протеинкиназ (например, IRAK-IV) и транскрипционных факторов (например, NF-κB), результатом чего является изменение экспрессии большого количества генов и, в частности, генов провоспалительных цитокинов [14, 15].
Представляет интерес тот факт, что в процессе проведенного нами исследования не было выявлено существенных различий между показателями, характеризующими PRRs врожденного иммунитета, у больных ВБВНК С4 класса и С6 класса. Отмеченное отсутствие различий между ними позволяет предположить, что длительная активация системы TLR на ранних стадиях ВБВНК может приводить к гиперпродукции провоспалительных цитокинов, развитию хронической воспалительной реакции, прогрессированию трофических нарушений и возникновению венозных язв. Наряду с этим полученные нами данные о повышении содержания в сыворотке крови провоспалительного цитокина ИЛ-1α у больных с длительно незаживающими ВТЯ нижних конечностей могут свидетельствовать о важной роли баланса позитивных и негативных стимулов, в частности баланса продукции про- и противовоспалительных цитокинов, как непосредственно в раневом очаге, так и на организменном уровне в развитии пролонгированного воспаления и снижении репаративных процессов в ранах.
В немногочисленных работах представлены данные о повышении уровня ЕК в периферической крови больных ВБВНК С2–С6 классов [6, 8]. Наши исследования продемонстрировали различия количественных и качественных характеристик субпопуляций ЕК между группами больных ВБВНК С4 и С6 классов, в частности, у пациентов с ВТЯ в периферической крови отмечен более высокий процент активированных in vivo ЕК. Вероятно, выявленное в отсутствие активационного стимула in vitro повышение экспрессии молекулы CD69 на ЕК отражает активность воспалительного процесса: чем активнее воспаление, тем интенсивнее происходит экспрессия этой молекулы.
Результаты исследований ряда параметров, характеризующих состояние адаптивного иммунитета, показали, что у больных ВБВНК С4 и С6 классов отмечены изменения количественных и функциональных характеристик
Т- и В-лимфоцитов по сравнению с контрольной группой практически здоровых лиц. Известно, что при инфекционных процессах индукция анергии Т-лимфоцитов сопряжена с увеличением доли естественных регуляторных клеток с супрессорной активностью (CD4+CD25Bright Т-лимфоцитов) и снижением пролиферативного ответа Т-клеток на различные стимулы [16]. Можно предположить, что увеличение содержания в периферической крови CD4+CD25+Bright-Т-клеток является одним из факторов, играющих существенную роль в развитии и хронизации раневого процесса в ВТЯ. Кроме того, в обеих группах у больных обнаружены повышение уровня иммуноглобулинов классов А и G, а также увеличение количества CD19+-В-лимфоцитов, экспрессирующих ранний активационный маркер в нестимулированных клеточных культурах, свидетельствующие о состоянии активации этого звена иммунной системы in vivo в результате длительной антигенной стимуляции.
Необходимо подчеркнуть, что изученные иммунологические показатели, характеризующие состояние системы образраспознающих рецепторов врожденного иммунитета, системы естественной цитотоксичности и системы адаптивного иммунитета, у больных с ВБВНК С4–С6 классов и здоровых добровольцев имели большие разбросы, отражающие индивидуальные особенности иммунологической реактивности. Поэтому выявленные различия указывают лишь на общие тенденции изменения показателей в обследованных группах и не являются абсолютными для всех индивидуумов.
Заключение
Проведенные исследования системного иммунитета у пациентов с ВБВНК различных клинических классов показали, что у больных ВБВНК С4 клинического класса, так же как и у больных ВБВНК С6 клинического класса, имеются изменения субпопуляционного состава иммунокомпетентных клеток и их функциональной активности. С одной стороны, эти данные подтверждают известную закономерность: воспалительный процесс сопровождается системной реакцией иммунитета, в которой важную роль играют факторы врожденного и адаптивного иммунитета. С другой стороны, изменения в системе иммунитета могут быть одним из важнейших факторов, определяющих исход таких процессов, как воспаление, регенерация, пролиферация, метаплазия и склероз (склерогенез), и играть важную роль в хронизации заболевания, частых рецидивах и резистентности к консервативному лечению у больных ВБВНК С6 клинического класса.
Литература
1. Савельев В.С., Кириенко А.И., Богачев В.Ю. Хронические заболевания вен в Российской Федерации. Результаты международной исследовательской программы VEIN CONSULT // Флебология. 2010. Т. 4. № 3. С. 9–12 [Savel’yev V.S., Kiriyenko A.I., Bogachev V.Yu. Khronicheskiye zabolevaniya ven v Rossiyskoy Federatsii. Rezul’taty mezhdunarodnoy issledovatel’skoy programmy VEIN CONSULT // Flebologiya. 2010. T. 4. № 3. S. 9–12 (in Russian)].
2. Липницкий Е.М. Лечение трофических язв нижних конечностей. М.: Медицина. 2001. 160 c. [Lipnitskiy Ye.M. Lecheniye troficheskikh yazv nizhnikh konechnostey. M.: Meditsina. 2001. 160 s. (in Russian)].
3. European Venous Forum Scientific. Programme and Book of Abstracts. Turin: Edizioni Minerva Medica, 2002.
4. Ханевич М.Д., Хрупкин В.И., Щелоков А.Л., Фоминых Е.М. Осложненные формы хронической венозной недостаточности нижних конечностей. М.: МедЭкспертПресс. Петрозаводск: ИнтелТек, 2004. 176 c. [Khanevich M.D., Khrupkin V.I., Shchelokov A.L., Fominykh Ye.M. Oslozhnennyye formy khronicheskoy venoznoy nedostatochnosti nizhnikh konechnostey. M.: MedEkspertPress. Petrozavodsk: IntelTek, 2004. 176 s. (in Russian)].
5. Швальб П.Г., Грязнов С.В., Швальб A.П. Некоторые вопросы патогенеза трофических язв венозного происхождения // Ангиол. и сосуд. хирургия. 2005. Т. 11. № 1. С. 61–64[Shval’b P.G., Gryaznov S.V., Shval’b A.P. Nekotoryye voprosy patogeneza troficheskikh yazv venoznogo proiskhozhdeniya // Angiol. i sosud. khirurgiya. 2005. T. 11. № 1. S. 61–64 (in Russian)].
6. Kirienko A.I., Ataullakhanov R.I., Bogachev V.Iu. et al. Trophic venous ulcers and their relationship with the immune status // Angiology and vascular surgery. 2007. Vol. 13(1). P. 76–85.
7. Powell C.C., Barnard M.R., Peyton B.D. et al. Chronic venous insufficiency is associated with increased platelet and monocyte activation and aggregation // J Vasc Surg. 1999. Vol. 30(5). P. 844–853.
8. Štvrtinova V., Jahnova E., Labaš P. et al. Expression of adhesion molecules on leukocytes of patients with chronic venous insufficiency // Phlebologie. 2002. Vol. 31(3). P. 63−68.
9. Takase S., Bergan J.J., Schmid-Schonbein G. Expression of adhesion molecules and cytokines on saphenous veins in chronic venous insufficiency // Ann Vase. Surg. 2000. Vol. 14(5). P. 427–435.
10. Зуева Е.Е., Вахитов М.Ш., Миронова Л.С. Иммунологические аспекты ответа на ортостатическую нагрузку при осложненной форме варикозной болезни вен нижних конечностей // Медицинская иммунология. 2002. Т. 4. № 4–5. С. 601–608 [Zuyeva Ye.Ye., Vakhitov M.Sh., Mironova L.S. Immunologicheskiye aspekty otveta na ortostaticheskuyu nagruzku pri oslozhnonnoy forme. Meditsinskaya immunologiya. 2002. T. 4. № 4–5. S. 601–608 (in Russian)].
11. Coleridge-Smith P., Thomas P., Scurr J.H., Dormandy J.A. Causes of venous ulceration: a new hypothesis // BMJ. 1988. Vol. 296. P. 1726–1727.
12. Богданец Л.И., Березина С.С., Гельфанд Е.Б. Место и эффективность антимикробных средств в лечении трофических язв у больных с венозной недостаточностью нижних конечностей // Инфекции в хирургии. 2007. № 2. C. 38–41 [Bogdanets L.I., Berezina S.S., Gel’fand Ye.B. Mesto i effektivnost’ antimikrobnykh sredstv v lechenii troficheskikh yazv u bol’nykh s venoznoy nedostatochnost’yu nizhnikh konechnostey // Infektsii v khirurgii. 2007. № 2. S. 38–41 (in Russian)].
13. Гороховская Г.Н., Юн В.Л. Отеки при хронической венозной недостаточности нижних конечностей: клинические проявления, медикаментозное и хирургическое лечение // Терапевтический архив. 2013. Т. 85. № 4. С. 93–96 [Gorokhovskaya G.N., Yun V.L. Meditsina i zdravookhraneniye // Terapevticheskiy arkhiv. 2013. T. 85. № 4. S. 93–96 (in Russian)].
14. Симбирцев А.С. Toll-белки: специфические рецепторы неспецифического иммунитета // Иммунология. 2005. № 6. С. 386–377 [Simbirtsev A.S. Toll-belki: spetsificheskiye retseptory nespetsificheskogo immuniteta // Immunologiya. 2005. № 6. S. 386–377 (in Russian)].
15. Лебедев К.А., Понякина И.Д. Иммунология образраспознающих рецепторов (интегральная иммунология). М.: Книжный дом «Либриком», 2009. 256 с. [Lebedev K.A., Ponyakina I.D. Immunologiya obrazraspoznayushchikh retseptorov (integral’naya immunologiya). M.: Knizhnyy dom «Librikom», 2009. 256 s. (in Russian)].
16. Sakaguchi S., Wing K., Onishi Y. et al. Regulatory T cells: how do they suppress immune responses? // Int. Immunol. 2009. Vol. 21(10). P. 1105–1111.
2. Липницкий Е.М. Лечение трофических язв нижних конечностей. М.: Медицина. 2001. 160 c. [Lipnitskiy Ye.M. Lecheniye troficheskikh yazv nizhnikh konechnostey. M.: Meditsina. 2001. 160 s. (in Russian)].
3. European Venous Forum Scientific. Programme and Book of Abstracts. Turin: Edizioni Minerva Medica, 2002.
4. Ханевич М.Д., Хрупкин В.И., Щелоков А.Л., Фоминых Е.М. Осложненные формы хронической венозной недостаточности нижних конечностей. М.: МедЭкспертПресс. Петрозаводск: ИнтелТек, 2004. 176 c. [Khanevich M.D., Khrupkin V.I., Shchelokov A.L., Fominykh Ye.M. Oslozhnennyye formy khronicheskoy venoznoy nedostatochnosti nizhnikh konechnostey. M.: MedEkspertPress. Petrozavodsk: IntelTek, 2004. 176 s. (in Russian)].
5. Швальб П.Г., Грязнов С.В., Швальб A.П. Некоторые вопросы патогенеза трофических язв венозного происхождения // Ангиол. и сосуд. хирургия. 2005. Т. 11. № 1. С. 61–64[Shval’b P.G., Gryaznov S.V., Shval’b A.P. Nekotoryye voprosy patogeneza troficheskikh yazv venoznogo proiskhozhdeniya // Angiol. i sosud. khirurgiya. 2005. T. 11. № 1. S. 61–64 (in Russian)].
6. Kirienko A.I., Ataullakhanov R.I., Bogachev V.Iu. et al. Trophic venous ulcers and their relationship with the immune status // Angiology and vascular surgery. 2007. Vol. 13(1). P. 76–85.
7. Powell C.C., Barnard M.R., Peyton B.D. et al. Chronic venous insufficiency is associated with increased platelet and monocyte activation and aggregation // J Vasc Surg. 1999. Vol. 30(5). P. 844–853.
8. Štvrtinova V., Jahnova E., Labaš P. et al. Expression of adhesion molecules on leukocytes of patients with chronic venous insufficiency // Phlebologie. 2002. Vol. 31(3). P. 63−68.
9. Takase S., Bergan J.J., Schmid-Schonbein G. Expression of adhesion molecules and cytokines on saphenous veins in chronic venous insufficiency // Ann Vase. Surg. 2000. Vol. 14(5). P. 427–435.
10. Зуева Е.Е., Вахитов М.Ш., Миронова Л.С. Иммунологические аспекты ответа на ортостатическую нагрузку при осложненной форме варикозной болезни вен нижних конечностей // Медицинская иммунология. 2002. Т. 4. № 4–5. С. 601–608 [Zuyeva Ye.Ye., Vakhitov M.Sh., Mironova L.S. Immunologicheskiye aspekty otveta na ortostaticheskuyu nagruzku pri oslozhnonnoy forme. Meditsinskaya immunologiya. 2002. T. 4. № 4–5. S. 601–608 (in Russian)].
11. Coleridge-Smith P., Thomas P., Scurr J.H., Dormandy J.A. Causes of venous ulceration: a new hypothesis // BMJ. 1988. Vol. 296. P. 1726–1727.
12. Богданец Л.И., Березина С.С., Гельфанд Е.Б. Место и эффективность антимикробных средств в лечении трофических язв у больных с венозной недостаточностью нижних конечностей // Инфекции в хирургии. 2007. № 2. C. 38–41 [Bogdanets L.I., Berezina S.S., Gel’fand Ye.B. Mesto i effektivnost’ antimikrobnykh sredstv v lechenii troficheskikh yazv u bol’nykh s venoznoy nedostatochnost’yu nizhnikh konechnostey // Infektsii v khirurgii. 2007. № 2. S. 38–41 (in Russian)].
13. Гороховская Г.Н., Юн В.Л. Отеки при хронической венозной недостаточности нижних конечностей: клинические проявления, медикаментозное и хирургическое лечение // Терапевтический архив. 2013. Т. 85. № 4. С. 93–96 [Gorokhovskaya G.N., Yun V.L. Meditsina i zdravookhraneniye // Terapevticheskiy arkhiv. 2013. T. 85. № 4. S. 93–96 (in Russian)].
14. Симбирцев А.С. Toll-белки: специфические рецепторы неспецифического иммунитета // Иммунология. 2005. № 6. С. 386–377 [Simbirtsev A.S. Toll-belki: spetsificheskiye retseptory nespetsificheskogo immuniteta // Immunologiya. 2005. № 6. S. 386–377 (in Russian)].
15. Лебедев К.А., Понякина И.Д. Иммунология образраспознающих рецепторов (интегральная иммунология). М.: Книжный дом «Либриком», 2009. 256 с. [Lebedev K.A., Ponyakina I.D. Immunologiya obrazraspoznayushchikh retseptorov (integral’naya immunologiya). M.: Knizhnyy dom «Librikom», 2009. 256 s. (in Russian)].
16. Sakaguchi S., Wing K., Onishi Y. et al. Regulatory T cells: how do they suppress immune responses? // Int. Immunol. 2009. Vol. 21(10). P. 1105–1111.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья