Периферическая нейропатия при критической ишемии нижней конечности
РМЖ. №6(II) от 12.12.2018 стр. 70-73
Рубрика:
Ангиология
Критическая ишемия нижних конечностей (КИНК) представляет собой актуальную проблему современной медицины ввиду роста заболеваемости, тяжести исходов и наличия сопутствующей патологии. На настоящий момент остаются малоизученными особенности развития периферической нейропатии (ПН) у больных КИНК, не определен вклад хронической ишемии в развитие ПН.
Цель исследования: изучить частоту и характер поражения периферических нервных стволов у пациентов с КИНК, а также оценить роль ишемии в развитии периферической нейропатии у больных критической ишемией.
Материал и методы: в исследование включили 36 пациентов с окклюзией подколенно-берцового сегмента артерий нижней конечности (тип D по классификации TASC II) в стадии критической ишемии для оценки характера и частоты ПН. Средний возраст пациентов составил 62±7,8 года. Пациенты были разделены на 2 группы в зависимости от наличия сахарного диабета 2 типа (СД2) для оценки роли ишемии в развитии ПН: 1-я группа — 10 (28%) пациентов без СД2, 2-я группа — 26 (72%) пациентов с СД2. У всех пациентов оценивались субъективные и клинические признаки ПН, а также проводилась электронейромиография (ЭНМГ) большеберцового и малоберцового нервов голени.
Результаты исследования: поражение периферических нервных стволов голени выявлено у 100% пациентов с КИНК. Дисфункция выявлялась как минимум по одному нерву голени и характеризовалась как клиническими симптомами, так и снижением скорости распространения возбуждения по двигательным волокнам пораженного нерва. Клинические симптомы и результаты ЭНМГ в группах с СД2 и без СД2 статистически значимо не различались (р>0,05), что может свидетельствовать о ведущей роли ишемии в развитии поражения периферических нервных стволов голени.
Выводы: ПН преимущественно демиелинизирующего характера является облигатным проявлением КИНК. Ключевую роль в развитии ПН у больных с КИНК играет ишемия.
Ключевые слова: критическая ишемия нижних конечностей, периферическая нейропатия, облитерирующий атеросклероз сосудов нижних конечностей, электронейромиография, сахарный диабет.
Для цитирования: Кудыкин М.Н., Шейко Г.Е., Белова А.Н. Периферическая нейропатия при критической ишемии нижней конечности. РМЖ. Медицинское обозрение. 2018;26(6(II)):70-73.
Цель исследования: изучить частоту и характер поражения периферических нервных стволов у пациентов с КИНК, а также оценить роль ишемии в развитии периферической нейропатии у больных критической ишемией.
Материал и методы: в исследование включили 36 пациентов с окклюзией подколенно-берцового сегмента артерий нижней конечности (тип D по классификации TASC II) в стадии критической ишемии для оценки характера и частоты ПН. Средний возраст пациентов составил 62±7,8 года. Пациенты были разделены на 2 группы в зависимости от наличия сахарного диабета 2 типа (СД2) для оценки роли ишемии в развитии ПН: 1-я группа — 10 (28%) пациентов без СД2, 2-я группа — 26 (72%) пациентов с СД2. У всех пациентов оценивались субъективные и клинические признаки ПН, а также проводилась электронейромиография (ЭНМГ) большеберцового и малоберцового нервов голени.
Результаты исследования: поражение периферических нервных стволов голени выявлено у 100% пациентов с КИНК. Дисфункция выявлялась как минимум по одному нерву голени и характеризовалась как клиническими симптомами, так и снижением скорости распространения возбуждения по двигательным волокнам пораженного нерва. Клинические симптомы и результаты ЭНМГ в группах с СД2 и без СД2 статистически значимо не различались (р>0,05), что может свидетельствовать о ведущей роли ишемии в развитии поражения периферических нервных стволов голени.
Выводы: ПН преимущественно демиелинизирующего характера является облигатным проявлением КИНК. Ключевую роль в развитии ПН у больных с КИНК играет ишемия.
Ключевые слова: критическая ишемия нижних конечностей, периферическая нейропатия, облитерирующий атеросклероз сосудов нижних конечностей, электронейромиография, сахарный диабет.
Для цитирования: Кудыкин М.Н., Шейко Г.Е., Белова А.Н. Периферическая нейропатия при критической ишемии нижней конечности. РМЖ. Медицинское обозрение. 2018;26(6(II)):70-73.
Peripheral neuropathy in critical limb ischemia
M.N. Kudykin, G.E. Sheiko, A.N. Belova
Volga Research Medical University, Nizhny Novgorod
Critical limb ischemia (CLI) is an actual problem of modern medicine due to the increasing incidence, severity of outcomes and the presence of comorbidities. At the present moment, the features of the development of peripheral neuropathy (PN) in patients with CLI remain poorly studied, the contribution of chronic ischemia to the development of PN is not determined.
Aim: to study the frequency and nature of a lesion of peripheral nerve trunks in patients with critical limb ischemia, and to evaluate the role of ischemia in the development of peripheral neuropathy in patients with critical ischemia.
Patients and Methods: the study included 36 patients with the popliteal-tibial artery segment occlusion of the lower extremity (type D according to TASC II classification) in the stage of critical ischemia to assess the nature and frequency of PN. The average age of patients was 62±7.8 years. Patients were divided into two groups depending on the presence of type 2 diabetes mellitus (DM2) to assess the role of ischemia in the development of PN. Group 1 — 10 (28%) patients without DM2, group 2 — 26 (72%) with DM2. Subjective and clinical signs of PN were evaluated in all patients, and electroneuromyography (ENMG) of the tibial and peroneal nerves was also performed.
Results: peripheral nerve trunks lesion of the tibia was detected in 100% of patients with CLI. Disfunction was detected by at least one nerve of the tibia and was characterized by both clinical symptoms and a decrease in the nerve conduction velocity along the motor fibers of the affected nerve. The clinical symptoms and results of ENMG in groups with and without DM2 did not statistically significantly differ (p>0.05), which may indicate the leading role of ischemia in the development of peripheral nerve trunks lesions of the tibia.
Conclusion: PN predominantly of demyelinating character is an obligate manifestation of CLI. Ischemia plays a key role in the development of PN in patients with CLI.
Key words: critical limb ischemia, peripheral neuropathy, obliterating atherosclerosis of the lower extremities vessels, electroneuromyography, diabetes mellitus.
For citation: Kudykin M.N., Sheiko G.E., Belova A.N. Peripheral neuropathy in critical limb ischemia // RMJ. 2018. № 6(II). P. 70–73.
M.N. Kudykin, G.E. Sheiko, A.N. Belova
Volga Research Medical University, Nizhny Novgorod
Critical limb ischemia (CLI) is an actual problem of modern medicine due to the increasing incidence, severity of outcomes and the presence of comorbidities. At the present moment, the features of the development of peripheral neuropathy (PN) in patients with CLI remain poorly studied, the contribution of chronic ischemia to the development of PN is not determined.
Aim: to study the frequency and nature of a lesion of peripheral nerve trunks in patients with critical limb ischemia, and to evaluate the role of ischemia in the development of peripheral neuropathy in patients with critical ischemia.
Patients and Methods: the study included 36 patients with the popliteal-tibial artery segment occlusion of the lower extremity (type D according to TASC II classification) in the stage of critical ischemia to assess the nature and frequency of PN. The average age of patients was 62±7.8 years. Patients were divided into two groups depending on the presence of type 2 diabetes mellitus (DM2) to assess the role of ischemia in the development of PN. Group 1 — 10 (28%) patients without DM2, group 2 — 26 (72%) with DM2. Subjective and clinical signs of PN were evaluated in all patients, and electroneuromyography (ENMG) of the tibial and peroneal nerves was also performed.
Results: peripheral nerve trunks lesion of the tibia was detected in 100% of patients with CLI. Disfunction was detected by at least one nerve of the tibia and was characterized by both clinical symptoms and a decrease in the nerve conduction velocity along the motor fibers of the affected nerve. The clinical symptoms and results of ENMG in groups with and without DM2 did not statistically significantly differ (p>0.05), which may indicate the leading role of ischemia in the development of peripheral nerve trunks lesions of the tibia.
Conclusion: PN predominantly of demyelinating character is an obligate manifestation of CLI. Ischemia plays a key role in the development of PN in patients with CLI.
Key words: critical limb ischemia, peripheral neuropathy, obliterating atherosclerosis of the lower extremities vessels, electroneuromyography, diabetes mellitus.
For citation: Kudykin M.N., Sheiko G.E., Belova A.N. Peripheral neuropathy in critical limb ischemia // RMJ. 2018. № 6(II). P. 70–73.
Статья посвящена изучению частоты и характера поражения периферических нервных стволов у пациентов с критической ишемией нижних конечностей, а также оценке роли ишемии в развитии периферической нейропатии у больных критической ишемией.
Введение
Критическая ишемия нижних конечностей (КИНК) представляет собой актуальную проблему современной медицины по причине высокого уровня заболеваемости, тяжести исходов и коморбидного фона [1]. Частота КИНК составляет 500–1000 случаев на 1 млн населения в год [1, 2]. Больные с КИНК и мультифокальным поражением артерий голени и стопы характеризуются наиболее высоким риском потери конечности и снижения продолжительности жизни [3]. Развитие КИНК характеризуется постоянным прогрессированием, при этом компенсаторные механизмы не способны обеспечить перфузию тканей нижней конечности на должном уровне. В пораженном участке конечности все ткани, в т. ч. и нервная, подвергаются ишемии [1]. Несмотря на то, что на данный момент наиболее изученной является периферическая нейропатия (ПН) при сахарном диабете 2 типа (СД2) у больных КИНК [4–7], невыясненными остаются роль ишемии в развитии ПН у данной категории пациентов, а также характер и частота поражения периферических нервов ишемизированной конечности.Цель исследования: оценка характера и частоты ПН у больных КИНК, а также изучение роли ишемии в развитии ПН.
Материал и методы
В исследование включили 36 пациентов с КИНК, из них мужчин — 22 (61%), женщин — 14 (39%). Средний возраст пациентов составил 62±7,8 года. Исходные характеристики пациентов представлены в таблице 1.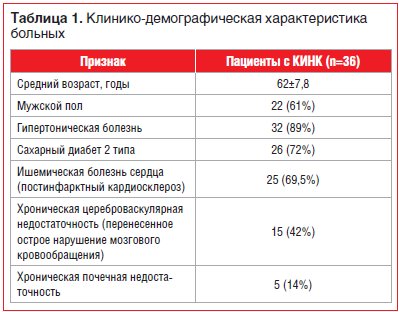
В исследование включали пациентов с ишемией III–IV стадии по классификации Покровского — Фонтейна и с изолированным поражением артерий голени или с сочетанным поражением артерий голени и бедренно-подколенного сегмента, что в целом соответствовало типу D по классификации TASC II [2].
Критериями исключения являлись: гангрена сегмента конечности, ампутация или реконструкции сосудистого русла в анамнезе, эмбологенная природа ишемии конечности (фибрилляция предсердий, эпизоды тромбоэмболических осложнений в анамнезе), декомпенсированная сопутствующая патология, хронический гемодиализ, а также перенесенный за 6 мес. до включения в исследование инфаркт миокарда или острое нарушение мозгового кровообращения, активный онкологический процесс.
Для изучения роли ишемии в развитии ПН пациентов разделили на 2 группы в зависимости от наличия СД2. В 1-ю группу включили 10 (28%) пациентов без СД2, во 2-ю группу — 26 (72%) больных с СД2. Группы не различались по основным клинико-демографическим показателям (p>0,05 во всех случаях).
Обследование больных включало осмотр сосудистым хирургом, общим хирургом, терапевтом и неврологом. Невролог проводил клиническое исследование нарушения иннервации нижних конечностей путем оценки жалоб и неврологического статуса c использованием 10-балльной визуально-аналоговой шкалы (ВАШ), шкалы общих неврологических симптомов (Total Symptoms Score, TSS) и шкалы нейропатического дисфункционального счета (НДС) [8, 9]. Оценку температурной чувствительности проводили с использованием термического наконечника (Thip-term), болевую чувствительность исследовали колесом Вартенберга и специальной безопасной неврологической иглой, тактильную чувствительность определяли с помощью монофиламента массой 10 г. Для оценки вибрационной чувствительности использовали градуированный камертон с частотой вибрации 128 Гц. Проприоцептивную чувствительность оценивали путем пассивного сгибания пальцев стопы пациента в положении лежа с закрытыми глазами [10].
Для интегральной оценки выраженности поражения периферических нервных стволов у пациентов с КИНК использовали классификацию Toronto Diabetic Neuropathy Expert Group (TDNEG-2010) [11].
Для исследования функционального состояния периферических нервов ишемизированной конечности всем пациентам выполнялась электронейромиография (ЭНМГ) нижних конечностей с помощью 4-канального компьютерного электронейромиографа «Нейро-МВП-4» и программного обеспечения на платформе NET. Для двигательных нервов (малоберцовый нерв, или n. peroneus, отведение с m. extensor digitorum brevis), большеберцовый нерв, или n. tibialis, отведение с m. abductor hallucis) определялись скорость распространения возбуждения (СРВ), амплитуда М-ответа и резидуальная латентность (РЛ). Нормой являлись следующие значения: СРВ — ≥40 м/с, амплитуда М-ответа — ≥3,5 мВ, РЛ — ≤3 мс [12].
Статистическую обработку результатов проводили с использованием программы MedCalc Statistical Software и Microsoft Office Excel, 2010. Для проверки нормальности распределения количественных признаков использовался критерий Шапиро – Уилка. Выборочные параметры, приводимые далее, имеют следующие обозначения: Ме — медиана, Q1 — верхний квартиль, Q3 — нижний квартиль, n — объем анализируемой подгруппы, р — величина статистической значимости различий. Использовали непараметрические методы: для анализа несвязанных выборок —
критерий Манна – Уитни; для оценки статистической значимости различий при сравнении групп по качественному признаку — точный критерий Фишера. Критическое значение уровня значимости принимали равным 5% (р≤0,05).
Научное исследование одобрено локальным этическим комитетом ФГБОУ ВО «ПИМУ» Минздрава России (выписка из протокола №10 от 26.07.2016 г.).
Результаты исследования
У всех пациентов с КИНК была выявлена ПН. Основными неврологическими жалобами пациентов являлись боли, парестезии, крампи и чувство онемения в нижних конечностях. Проведен сопоставительный анализ выявления данных жалоб в группах с наличием и с отсутствием сопутствующего СД2. Средняя продолжительность СД2 во 2-й группе составила 8±2,11 года. Субъективные симптомы поражения периферических нервов у больных с КИНК в группах статистически значимо не различались (рис. 1): жжение выявлено у 3 (30%) пациентов в 1-й группе и у 7 (27%) во 2-й группе (p=1,0); болевой синдром отмечали у 100% пациентов в обеих группах. Жалобы на судороги мышц выявляли в 1-й группе у 8 (80%) пациентов, во 2-й группе — у 17 (65%) пациентов (р=0,6888). При этом судороги в икроножной группе мышц определялись у пациентов обеих групп. Онемение отмечалось у 8 (80%) пациентов без СД2 и у 23 (88,5%) пациентов с СД (р=0,6034). Парестезии выявили в 1-й группе у 2 (20%) пациентов и во 2-й группе у 6 (23%) пациентов (р=1,0).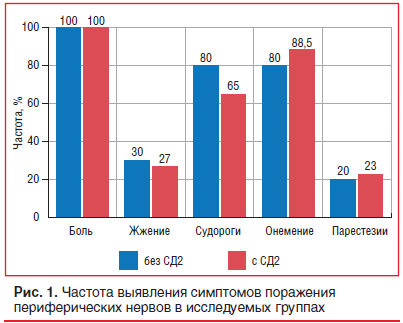
У 5 (50%) пациентов в 1-й группе обнаруживались одностороннее выпадение ахиллова и снижение коленного рефлекса в ишемизированной конечности. У остальных 5 (50%) пациентов без СД2 было выявлено двустороннее снижение коленного и выпадение ахиллового рефлексов. Во 2-й группе у 4 (15%) пациентов обнаруживались одностороннее снижение коленного и выпадение ахиллового рефлекса ишемизированной конечности, продолжительность СД2 у данных пациентов составила 5,8±0,4 года. У 22 (85%) пациентов (длительность СД2 составляла 8,5±2 года, p=0,0015) во 2-й группе выявлены двустороннее снижение коленных и выпадение ахилловых рефлексов. Гипотрофия мышц голени была выявлена у 4 (40%) пациентов 1-й группы и у 10 (38,5%) пациентов 2-й группы (р=1,0). Парезы были выявлены в 1-й группе у 9 (90%) пациентов, во 2-й группе — у 22 (85%) пациентов (р=1,0).
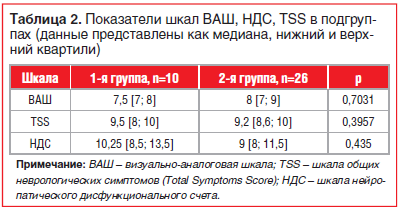
При оценке субъективных симптомов и степени тяжести поражения периферических нервов статистически значимых различий по шкалам ВАШ (р=0,7031), TSS (р=0,3957), НДС (р=0,435) не выявлено (табл. 2).
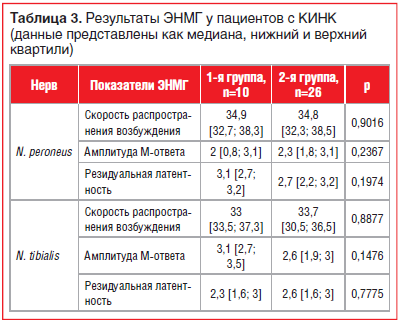
Также статистически значимых различий между группами по показателям ЭНМГ ни по одному из нервов определено не было (табл. 3).
Отсутствие различий в группах пациентов с СД2 и без СД2 по субъективным и клиническим признакам, а также данным инструментального исследования свидетельствует о ведущей роли ишемии в развитии ПН у больных с КИНК.
Обсуждение и выводы
Периферические нервы отвечают за все виды чувствительности и иннервацию мышц, а также выполняют вегетативную функцию [13]. Нервная ткань обладает повышенной восприимчивостью к ишемии, что проявляется в развитии соответствующей симптоматики и нарушениях функций. При этом нервная ткань характеризуется колоссальными репаративными способностями [14]. К примеру, скорость восстановления периферического нерва с учетом сохранения эндоневральной трубки (нейропраксия, аксонотмезис) составляет около 2–4 мм/сут [15].Состояние нервной ткани, по нашему мнению, может отражать состояние всех тканей ишемизированной конечности, а также эффективность проведенного
лечения [16]. Однако в литературе имеются описания лишь экспериментальных работ на данную тему [17] либо клинических случаев [18].
Результаты исследования показали, что поражение периферических нервных стволов голени является облигатным проявлением КИНК и при этом носит преимущественно демиелинизирующий характер. Дисфункция выявлялась как минимум по одному нерву голени пораженной конечности и характеризовалась клиническими симптомами и снижением показателей ЭНМГ по двигательным волокнам пораженного нервного ствола. Согласно классификации TDNEG-2010, у всех пациентов с КИНК ПН соответствовала подтвержденной, т. е. у всех пациентов было выявлено снижение показателей по данным ЭНМГ в сочетании с одним или несколькими симптомами и признаками.
Заключение
Несмотря на наличие СД2 у пациентов 2-й группы, выявленные клинические симптомы (оценки по шкалам ВАШ, р=0,7031; TSS, p=0,3957; НДС, р=0,4350), а также результаты ЭНМГ (СРВ, p=0,9016; амплитуда М-ответа, р=0,2367; РЛ, р=0,1974) в сравниваемых группах статистически значимо не различались. Полученные результаты могут свидетельствовать о ведущей роли ишемии в развитии поражения периферических нервных стволов голени. Таким образом, ПН преимущественно демиелинизирующего характера является облигатным проявлением КИНК у пациентов с облитерирующими заболеваниями артерий нижних конечностей. Ключевую роль в развитии ПН у больных с КИНК играет ишемия.
Литература
1. Бокерия Л.А., Гудкова Р.Г. Сердечно-сосудистая хирургия — 2013. Болезни и врожденные аномалии сердечно-сосудистой системы. М.: НЦССХ им. А.Н. Бакулева. 2014. 220 с. [Bokeriya L.A., Gudkova R.G. Serdechno-sosudistaya khirurgiya — 2013. Bolezni i vrozhdennyye anomalii serdechno-sosudistoy sistemy. M.: NtSSSKH im. A.N. Bakuleva. 2014. 220 s. (in Russian)].
2. Norgren L., Hiatt W.R., Dormandy J.A. et al. TASC II Working Group. Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II) // Eur. J. Vasc. Surg. 2007. 45 Suppl S. P. 5–67.
3. Gray B.H., Grant A.A., Kalbaugh C.A. et al. The impact of isolated tibial disease on outcomes in the critical limb ischemic population // Ann. Vasc. Surg. 2010. Vol. 24 (3). P. 349–359.
4. Дедов И.И., Шестакова М.В., Майоров А.Ю. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. 8-й выпуск. М.: УП ПРИНТ. 2017. 112 с. [Dedov I.I., Shestakova M.V., Mayorov A.Yu. Algoritmy spetsializirovannoy meditsinskoy pomoshchi bol’nym sakharnym diabetom. 8-y vypusk. M.: UP PRINT. 2017. 112 s. (in Russian)].
5. Левин О.С. Полиневропатии. М.: МИА, 2011. 498 c. [Levin O.S. Polinevropatii. M.: MIA, 2011. 498 s. (in Russian)].
6. Vincent A.M., Callaghan B.C., Smith A.L., Feldman E.L. Diabetic neuropathy: cellular mechanisms as therapeutic targets // Nature Reviews Neurology. 2011. Vol. 7 (10). P. 573–583.
7. Wukich D.K., Shen W., Raspovic K.M. et al. Noninvasive Arterial Testing in Patients With Diabetes: A Guide for Foot and Ankle Surgeons // Foot Ankle Int. 2015. Vol. 36 (12). P. 1391–1399.
8. Григорьева В.Н., Белова А.Н. Клиническое неврологическое обследование. М.: Практическая медицина, 2018. 400 c. [Grigor’eva V.N., Belova A.N. Klinicheskoe nevrologicheskoe obsledovanie. M.: Prakticheskaya medicina, 2018; 400 s. (in Russian)].
9. Ziegler D. Treatment of symptomatic diabetic peripheral neuropathy with the anti-oxidant — lipoic acid (ALADIN study group) // Diabetologia. 1995. Vol. 38. P. 1425–1433.
10. Haanpaa M.L., Backonja M.M., Bennett M.I. et al. Assessment of neuropathic pain in primary care // Am. J. Med. 2009. Vol. 122 (10). P. 13–21.
11. Tesfaye S., Boulton A.J., Dyck P.J. et al. Diabetic Neuropathies: Update on definitions, diagnostic criteria, estimation of severity, and treatments // Diabetes Care. 2010. Vol. 33 (10). P. 2285–2293.
12. Николаев С.Г. Атлас по электромиографии. Иваново: ИПК «ПресСто», 2010. 468 c. [Nikolaev S.G. Atlas po ehlektromiografii. Ivanovo: IPK «PresSto», 2010. 468 s. (in Russian)].
13. Скоромец А.А., Скоромец А.П., Скоромец Т.А. Нервные болезни: учебн. пособие. 9-е изд. М.: Медпрессинформ. 2016. 367 c. [Skoromec A.A., Skoromec A.P., Skoromec T.A. Nervnye bolezni: uchebn. posobie. 9-e izd. M.: Medpressinform. 2016. 367 s. (in Russian)].
14. Nukada H. Ischemia and diabetic neuropathy // Handb. Clin. Neurol. 2014. Vol. 126. P. 469–487.
15. Адо А.Д., Адо М.А., Пыцкий В.И. и др. Патологическая физиология. М.: Триада-Х. 2000. 315 c. [Ado A.D., Ado M.A., Pyckij V.I. i dr. Patologicheskaya fiziologiya. M.: Triada-H. 2000. 315 s. (in Russian)].
16. Шейко Г.Е., Кудыкин М.Н., Белова А.Н. и др. Электронейромиография как новый способ оценки эффективности реваскуляризации // Вестник Национального медико-хирургического центра им. Н.И. Пирогова. 2018. Т. 13, вып. 1. C. 116–120 [Shejko G.E., Kudykin M.N., Belova A.N. i dr. Ehlektronejromiografiya, kak novyj sposob ocenki ehffektivnosti revaskulyarizacii // Vestnik Nacional’nogo mediko-hirurgicheskogo сentra im. N.I. Pirogova. 2018. T.13, vyp.1. S. 116–120 (in Russian)].
17. Nukada H. Ischemia and diabetic neuropathy // Handb. Clin. Neurol. 2014. Vol. 126. P. 469–487.
18. Сорокин Ю.Н., Сагарадзе С.А., Мельников А.В. Острая ишемическая нейропатия // Международный неврологический журнал. 2014. Т. 64, вып. 2. С. 100–105. [Sorokin Yu.N., Sagaradze S.A., Mel’nikov A.V. Ostraya ishemicheskaya nejropatiya // Mezhdunarodnyj nevrologicheskij zhurnal. 2014. T. 64, vyp. 2. S. 100–105 (in Russian)].
2. Norgren L., Hiatt W.R., Dormandy J.A. et al. TASC II Working Group. Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II) // Eur. J. Vasc. Surg. 2007. 45 Suppl S. P. 5–67.
3. Gray B.H., Grant A.A., Kalbaugh C.A. et al. The impact of isolated tibial disease on outcomes in the critical limb ischemic population // Ann. Vasc. Surg. 2010. Vol. 24 (3). P. 349–359.
4. Дедов И.И., Шестакова М.В., Майоров А.Ю. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. 8-й выпуск. М.: УП ПРИНТ. 2017. 112 с. [Dedov I.I., Shestakova M.V., Mayorov A.Yu. Algoritmy spetsializirovannoy meditsinskoy pomoshchi bol’nym sakharnym diabetom. 8-y vypusk. M.: UP PRINT. 2017. 112 s. (in Russian)].
5. Левин О.С. Полиневропатии. М.: МИА, 2011. 498 c. [Levin O.S. Polinevropatii. M.: MIA, 2011. 498 s. (in Russian)].
6. Vincent A.M., Callaghan B.C., Smith A.L., Feldman E.L. Diabetic neuropathy: cellular mechanisms as therapeutic targets // Nature Reviews Neurology. 2011. Vol. 7 (10). P. 573–583.
7. Wukich D.K., Shen W., Raspovic K.M. et al. Noninvasive Arterial Testing in Patients With Diabetes: A Guide for Foot and Ankle Surgeons // Foot Ankle Int. 2015. Vol. 36 (12). P. 1391–1399.
8. Григорьева В.Н., Белова А.Н. Клиническое неврологическое обследование. М.: Практическая медицина, 2018. 400 c. [Grigor’eva V.N., Belova A.N. Klinicheskoe nevrologicheskoe obsledovanie. M.: Prakticheskaya medicina, 2018; 400 s. (in Russian)].
9. Ziegler D. Treatment of symptomatic diabetic peripheral neuropathy with the anti-oxidant — lipoic acid (ALADIN study group) // Diabetologia. 1995. Vol. 38. P. 1425–1433.
10. Haanpaa M.L., Backonja M.M., Bennett M.I. et al. Assessment of neuropathic pain in primary care // Am. J. Med. 2009. Vol. 122 (10). P. 13–21.
11. Tesfaye S., Boulton A.J., Dyck P.J. et al. Diabetic Neuropathies: Update on definitions, diagnostic criteria, estimation of severity, and treatments // Diabetes Care. 2010. Vol. 33 (10). P. 2285–2293.
12. Николаев С.Г. Атлас по электромиографии. Иваново: ИПК «ПресСто», 2010. 468 c. [Nikolaev S.G. Atlas po ehlektromiografii. Ivanovo: IPK «PresSto», 2010. 468 s. (in Russian)].
13. Скоромец А.А., Скоромец А.П., Скоромец Т.А. Нервные болезни: учебн. пособие. 9-е изд. М.: Медпрессинформ. 2016. 367 c. [Skoromec A.A., Skoromec A.P., Skoromec T.A. Nervnye bolezni: uchebn. posobie. 9-e izd. M.: Medpressinform. 2016. 367 s. (in Russian)].
14. Nukada H. Ischemia and diabetic neuropathy // Handb. Clin. Neurol. 2014. Vol. 126. P. 469–487.
15. Адо А.Д., Адо М.А., Пыцкий В.И. и др. Патологическая физиология. М.: Триада-Х. 2000. 315 c. [Ado A.D., Ado M.A., Pyckij V.I. i dr. Patologicheskaya fiziologiya. M.: Triada-H. 2000. 315 s. (in Russian)].
16. Шейко Г.Е., Кудыкин М.Н., Белова А.Н. и др. Электронейромиография как новый способ оценки эффективности реваскуляризации // Вестник Национального медико-хирургического центра им. Н.И. Пирогова. 2018. Т. 13, вып. 1. C. 116–120 [Shejko G.E., Kudykin M.N., Belova A.N. i dr. Ehlektronejromiografiya, kak novyj sposob ocenki ehffektivnosti revaskulyarizacii // Vestnik Nacional’nogo mediko-hirurgicheskogo сentra im. N.I. Pirogova. 2018. T.13, vyp.1. S. 116–120 (in Russian)].
17. Nukada H. Ischemia and diabetic neuropathy // Handb. Clin. Neurol. 2014. Vol. 126. P. 469–487.
18. Сорокин Ю.Н., Сагарадзе С.А., Мельников А.В. Острая ишемическая нейропатия // Международный неврологический журнал. 2014. Т. 64, вып. 2. С. 100–105. [Sorokin Yu.N., Sagaradze S.A., Mel’nikov A.V. Ostraya ishemicheskaya nejropatiya // Mezhdunarodnyj nevrologicheskij zhurnal. 2014. T. 64, vyp. 2. S. 100–105 (in Russian)].

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья

