МР-флебография в диагностике гемодинамических нарушений у пациентов с хроническими заболеваниями вен нижних конечностей
Представлен анализ исследований патологии венозного кровотока в системе нижней полой вены с помощью магнитно-резонансной томографии. Рассмотрены попытки использования этого метода в диагностике хронических заболеваний вен нижних конечностей посредством проведения магнитно-резонансной венографии (magnetic resonance venography, MRV). Показано поэтапное внедрение методов MRV в диагностику тромбоза вен нижних конечностей и венозного тромбоэмболизма. Методы бесконтрастной MRV, основанные на эффекте потока крови, подразделяются на две группы: методы, основанные на амплитудных эффектах времени пролета (Time-of-Flight), и методы, основанные на фазовых эффектах (Phase Contrast). Подробно описаны техники проведения бесконтрастной MRV, которая вновь получила интенсивное развитие в последние годы. Одним из таких методов стала прямая визуализация тромба с использованием быстрых импульсных последовательностей: bSSFP, BBTI, DANTE. Последние исследования в отношении этого метода диагностики тромбоза глубоких вен нижних конечностей были опубликованы в 2019 г., в них показана высокая диагностическая ценность метода. В отношении всех наиболее часто используемых методов проведения MRV показаны специфичность и чувствительность. Проведение MRV у пациентов с хроническими заболеваниями вен является перспективной диагностической задачей в флебологии.
Ключевые слова: магнитно-резонансная томография, магнитно-резонансная флебография, компьютерная томография, компьютерно-томографическая флебография, хронические заболевания вен, тромбоз вен нижних конечностей, варикозное расширение вен.
Для цитирования: Шайдаков Е.В., Санников А.Б., Емельяненко В.М., Крюкова Л.Н., Баранова А.Е., Рачков М.А. МР-флебография в диагностике гемодинамических нарушений у пациентов с хроническими заболеваниями вен нижних конечностей. РМЖ. Медицинское обозрение. 2021;29(1):34-42.
MRI venography in the diagnosis of hemodynamic disorders in patients with chronic venous diseases of the lower extremities
E.V. Shaidakov1, A.B. Sannikov2,3, V.M. Emelianenko3, L.N. Kryuchkova2, A.E. Baranova2, M.A. Rachkov2
1N.P. Bechtereva Institute of the Human Brain of the Russian Academy of Sciences, Saint Petersburg
2Clinic of Innovative Diagnostics "Medica", Vladimir
3Pirogov Russian National Research Medical University, Moscow
The article presents the analysis concerning studies of venous circulation pathology in the inferior vena cava system using magnetic resonance imaging (MRI). Special attention is paid to the attempts to use this method in the diagnosis of chronic venous diseases (CVD) of the lower limbs with magnetic resonance venography (MRV). The gradual introduction of MRV methods in the diagnosis of deep vein thrombosis (DVT) of the lower limbs and venous thromboembolism (VTE) has been shown. Methods of non-contrast-enhanced MRV based on the effect of blood flow are divided into two groups: methods based on the amplitude of Time-of-Flight (TOF) and methods based on Phase Contrast (PC). The techniques of conducting non-contrast-enhanced MRV, which has again received intensive development in recent years, are described in detail. One of these methods was direct visualization of a blood clot using fast pulse sequences: bSSFP, BBTI, DANTE. The latest studies on this method of diagnosing DVT of the lower limbs were published in 2019, and they showed the high diagnostic value of the method. Specificity and sensitivity are shown for all commonly used MRV methods. Conducting MRV in patients with CVD is a promising diagnostic task in phlebology.
Keywords: magnetic resonance imaging, magnetic resonance venography, computed tomography, CT venography, chronic venous diseases, deep vein thrombosis of the lower limbs, varicosity.
For citation: Shaidakov E.V., Sannikov A.B., Emelianenko V.M. et al. MRI venography in the diagnosis of hemodynamic disorders in patients with chronic venous diseases of the lower extremities. RMJ. 2021;1:34–42.
Введение
Среди распространенных клинических проявлений хронических заболеваний вен (Chronic Venous Disorders, CVD) тромбоз глубоких вен (Deep Vein Thrombosis, DVT) занимает особое место [1–3]. В большой степени это связано с развитием угрожающего жизни осложнения — тромбоэмболии легочной артерии (Pulmonary Embolism, PE) [4–6]. Частота выявления непосредственно тромбоза глубоких вен нижних конечностей (Lower Extremities Deep Vein Thrombosis, LEDVT) у пациентов с симптоматической PE, по данным различных авторов, в мире составляет 60–63%. При этом около 90% бессимптомной PE возникает из-за DVT, развившегося в системе нижней полой вены и венах таза [7–11].
Ультразвуковое дуплексное сканирование (duplex UltraSound, US) является «золотым стандартом» установления гемодинамических нарушений у пациентов с CVD с почти 100% общей специфичностью и чувствительностью при выявлении LEDVT. Однако в отношении самых проксимальных венозных сегментов информативность данного метода снижается и в непосредственной диагностике DVT вен таза может составляет менее 90% [3]. Определенные проблемы могут возникнуть при использовании US и в диагностике DVT на уровне голени [12]. Таким образом, c одной стороны, US, являясь полностью неинвазивным, легкодоступным и чувствительным методом диагностики, должно по-прежнему рассматриваться в качестве «золотого стандарта» при скрининговом обследовании пациентов с CVD и первого диагностического шага у пациентов с подозрением на LEDVT, с другой стороны, очевидны недостатки US: недостаточная чувствительность метода при развитии тромбоза в тазовых венах [13, 14] и внешнем окклюзионном сдавлении при синдроме Мэя — Тернера [15, 16]. По мнению многих авторов, полученные при проведении US данные могут быть неубедительными в выявлении бессимптомного LEDVT при обследовании пациентов с ожирением, выраженным отеком или слоновостью нижних конечностей и после проведенных ортопедических операций с имплантацией металлических конструкций [17–19]. Не может предоставить подробную информацию US и в ряде случаев развития рецидивирующего тромбоза [20].
Учитывая определенные ограничения использования US при DVT, начиная с середины 2000-х гг. некоторые специалисты предпринимают попытки повышения качества US-визуализации вен в труднодоступных регионах сосудистой системы с помощью дополнительного введения контрастных препаратов с различной химической структурой (Contrast-Enhanced Ultrasound, CEUS) или внутрисосудистого ультразвука (Interventional Ultrasound, INVUS) [21–23]. Однако, несмотря на то, что эти исследования проводятся в последние годы системно, данные методики пока не внедрены в широкую клиническую диагностическую практику и не стандартизированы [24–26].
На протяжении многих десятилетий для решения сложных диагностических задач, связанных с тромботическими и окклюзионными поражениями как центральной, так и периферической венозной системы, применялась рентгеноконтрастная флебография (Contrast Venography, CV), интерес к которой вновь возрос в связи с развитием в последние годы эндовазальных венозных интервенций [27, 28]. Понятно, что в данном случае речь идет о проведении катетерной субтракционной цифровой флебографии (Digital Subtraction Angiography, DSA). Также не утратила актуальности в диагностике венозного тромбоэмболизма (venous thromboembolism, VTE) и компьютерно-томографическая флебография (Computed Tomography Venography, CTV). Особо важное значение приобретает CT-Angiography при проведении ангиопульмонографии (Computed Tomography Pulmono-Angiography, CTPA) при обследовании пациентов с подозрением на развитие PE [31–39]. Основными аргументами против более широкого внедрения CTV в диагностику гемодинамических нарушений у пациентов с CVD остаются инвазивность исследования и лучевая нагрузка на пациентов [40].
Недостатки CTV способствовали разработке и внедрению во флебологическую практику магнитно-резонансных исследований (Magnetic Resonance Imaging, MRI) [41–44]. Однако на сегодняшний день метод магнитно-резонансной флебографии (Magnetic Resonance Venography, MRV) в диагностике гемодинамических нарушений непосредственно у пациентов с СVD (даже при подозрении на DVT в проксимальных отделах венозной системы) всеобщего признания пока не получил. Главным препятствием к более широкому внедрению MRV во флебологическую практику, с нашей точки зрения, являются сложности получения, обработки и интерпретации данных. В немалой степени это связано с более сложными, чем CTV, для восприятия клиницистами (кроме радиологов) физическими явлениями и сутью эффектов, лежащих в основе получения MRI, которые были рассмотрены нами ранее [45]. При этом теоретически все методы, разработанные для получения MRI артериального сосудистого русла, могут быть c большой пользой использованы и для проведения MRV, обсуждение преимуществ и недостатков которой является основной целью данной публикации.
Бесконтрастные методы выполнения магнитно-резонансной флебографии
Методы бесконтрастной MRV, основанные на эффекте потока крови, как и в случае применения MR-Angiography подразделяются на две принципиальные группы: методы, основанные на амплитудных эффектах времени пролета (Time-of-Flight, TOF), и методы, основанные на фазовых эффектах (Phase Contrast, PC) [41].
Времяпролетная венография (TOF)
Публикации, посвященные возможностям бесконтрастной MRV в диагностике тромботических поражений вен нижних конечностей и таза, появились в начале 1990-х гг. Так, результаты первого проспективного исследования по сравнению диагностической ценности US, СV и бесконтрастной MRV в диагностике LEDVT были опубликованы J.P. Carpenter et al. в 1993 г. [42]. Проведенный авторами сравнительный анализ информативности контрастной флебографии и бесконтрастной MRV показал не только высокую диагностическую ценность последней, но и явные ее преимущества. На основании полученных данных авторами был сделан вывод, что MRV-исследование является точным неинвазивным методом визуализации вен, имеющим в сравнении с US и CV чувствительность 100%, специфичность 96% и прогностическую ценность 94%. Были определены MRV-критерии LEDVT, среди которых наиболее значимыми являлись: наличие на MRI центральной сигнальной пустоты с окружающим гиперинтенсивным сигналом; отсутствие потока в вене с визуализацией множественных коллатеральных сосудов; отсутствие потока на MRV c наличием внутрипросветного тромба [42]. Кроме того, MRV одновременно предоставляла точную и подробную информацию об отношении вен к окружающим их структурам мягких тканей и позволяла определить, например, опухоль, сдавливающую просвет вены извне [43–46]. Исследование С.Е. Spritzer et al. (2001) касалось установления частоты выявления изолированного тромбоза вен таза и диагностической ценности использования в этих случаях всех доступных методов диагностики DVT: US, CV и MRV [11]. Также был проведен сравнительный анализ количества ситуаций зарождения тромба в тазовых венах, частота которого в сравнении с ранее опубликованными данным оказалась гораздо выше и составила 21,7% [47–49]. B.L. Davidson et al. (1992) и P.S. Wells (1995) подтвердили, что риск развития PE из более крупных вен таза является более значимым, чем из дистально расположенных венозных сегментов, и US ненадежна в визуализации тромба в тазовых венах [50, 51]. B. Dupas et al. (1995) на основании полученных результатов сделали вывод о большей информативности MRV в сравнении с US при исследовании не только тазовых вен, но и подвздошно-бедренного сегмента. Так, по их данным, чувствительность и специфичность MRV составили 100% и 98% соответственно, в то время как US имела специфичность 97%, а чувствительность — 91% [52].
J.H. Gao и J.C. Gore впервые продемонстрировали значительно более высокое качество изображения вен, получаемое при использовании градиентной последовательности 2D TOF GRE, чем при более медленной 2D TOF, в связи с потерей сигнала из-за турбулентности кровотока в венах [53–55]. S. Meckel et al. (2010) и J.M. Siegel et al. (1997) было высказано предположение, что наличие турбулентных потоков крови в области венозных клапанов может дополнительно индуцировать дисперсию фазы, что в итоге и приводит к появлению ложноположительных случаев диагностики стеноза или ложного дефекта внутрипросветного наполнения [56–58].
Учитывая отрицательные стороны проведения MRV с использованием последовательности 2D TOF, некоторые авторы продолжили рассматривать различные варианты повышения точности диагностики тромботических поражений за счет усовершенствования программных решений. Результатом новых разработок стало усиление MRV за счет использования перефокусировки потока крови (FR-FBI) и методов вычитания артериального кровотока (SPADE) [59]. По мнению же C.M. Lindquist et al. (2010), при дополнительном использовании режима устойчивого сбалансированного состояния свободной процессии (balanced Steady State Free Procession, SSFP) бесконтрастная MRV может стать быстрым и высокоточным инструментом диагностики LEDVT с чувствительностью 94,7% и специфичностью 100% [60]. Еще одним ограничением использования бесконтрастных методик проведения MRV, даже с учетом введенных в обработку изображения изменений, была достаточно выраженная в отдельных наблюдениях передаточная на вены пульсация с артерий, что приводило к развитию дополнительного поперечного дефазирования и к появлению в итоге множества артефактов [61, 62]. Причина была в том, что при получении Т1-взвешенного изображения визуализация как артерий, так и вен происходила в условиях получения одинакового сигнала «яркой крови», что затрудняло их дифференцирование. Ряд авторов попытались решить эту задачу с помощью пространственных полос предварительного насыщения потока в зависимости от его разного направления в артериях и венах [63–65]. В основе этого лежало физическое понимание G.W. Lenz et al. (1988) того, что спины, вымываемые в срез из предварительно насыщенной области, не несут никакой намагниченности [66]. Результатом этих теоретических предположений стало появление для обработки изображения при проведении 2D TOF MRV двух новых дополнительных последовательностей. Первая из них была основана только на притоке крови для создания сосудистого сигнала под небольшим углом — FLASH (Fast Low Angle Shot) [67]. В основу второй последовательности было положено значительное удлинение TR и укорочение времени эхо (TE). Также была разработана градиентная последовательность GRASS (Gradient-Recalled Acquisition in a Steady State) и еще более быстрая последовательность с частичной перефокусировкой FISP (Fast Imaging Sequence with Partial refocusing) [62, 68]. Однако для успешного использования этих последовательностей при проведении 2D TOF MRV особо важное значение приобретал выбор наиболее подходящего угла поворота, т. к. слишком большой угол поворота мог привести к насыщению венозного сигнала, а слишком малый угол поворота давал при визуализации вен появление излишнего «шума».
Фазово-контрастная венография
Проведение фазово-контрастной MRV (не путать с контрастно-усиленной MRV) было основано на том, что спины, движущиеся через градиент магнитного поля, приобретают иную фазу (фазовый сдвиг) по сравнению со статистическими спинами, а добавленный в данном случае биполярный градиент влияет только на движущиеся спины, которые приобретали фазу в зависимости от их специфических характеристик потока. Таким образом, разница между фазовыми данными двух последовательно полученных изображений ограничивалась только фазовыми сдвигами от движущихся спинов [68]. При этом измеренная разность фаз в отдельных пикселях потока непосредственно была связана со скоростью потока вдоль направления изменения первого момента, которое получило название направления, закодированного скоростью (Velocity-Encoded Direction, VED), реагирующего в зависимости от направленности кровотока вдоль оси Х, Y или Z. Значение кодирования скорости в этом случае (Velocity ENCoding value, VENC) могло определять наибольшую измеряемую скорость. Соответствующее значение VENC при проведении MRV должно быть выбрано таким образом, чтобы оно превышало максимальную ожидаемую скорость примерно на 25% [69, 70].
Все вышеописанные бесконтрастные методики проведения MRV позволили косвенно идентифицировать тромбоз вен нижних конечностей и таза, поскольку окружающая сосуд неподвижная мягкая ткань показывала за счет намагниченности сигнальную пустоту — «черную кровь» в венозном просвете при Т2-взвешенном изображении или повышенный сигнал от потока движения внутри сосуда — «яркую кровь» при Т1-взвешенном изображении. Недостатки этих методик были связаны с недостаточным качеством визуализации вен во всех анатомических областях из-за высокой вероятности появления артефактов. Кроме того, они не позволили непосредственно добиться визуализации тромба с помощью получения от него сигнала после прохождения РЧ-импульса [71].
Использование метода прямой визуализации венозного тромба (DTI)
Еще одним бесконтрастным методом визуализации венозной системы, который не упоминался при рассмотрении базовых вопросов MR-Angipgraphy, но являлся приемлемым для его использования при проведении MRV, стал метод прямой визуализации тромба (Direct Thrombus Imaging, DTI). В основе данного метода лежит анализ изображения в Т1-взвешенной магнитно-резонансной последовательности в режиме 2D, получившей название Magnetic Resonance Direct Thrombus Imaging (MRDTI) [71]. В отличие от большинства бесконтрастных методов MRI, которые определяли тромб как пустоту потока или дефект контрастного заполнения, магнитно-резонансная прямая MRV тромба визуализировала его на подавленном фоне в виде яркого сигнала. Первым этот прием при выполнении MRV с целью диагностики LEDVT в 1997 г. апробировали A.R. Moody et al. [72]. Однако, как показали дальнейшие исследования, этих MRDTI-приемов для хорошей визуализации острого DVT в режиме 2D при различной временной перспективе оказалось недостаточно [73]. M. Tan et al. (2014) отметили, что данная методика обладает 95% чувствительностью и 100% специфичностью исключительно при визуализации подострых и рецидивирующих тромбов, в которых образовавшийся метгемоглобин может выступать в роли эндогенного контрастного агента, но она малопригодна при острых венозных тромбах [74].
В последнее время для диагностики LEDVT без применения контрастного вещества были разработаны новые трехмерные 3D Т1-взвешенные методы MRV [75, 76]. Принцип, лежащий в основе этих методов, заключается в том, что сигнал венозного кровотока подавляется, чтобы позволить визуализировать внутрипросветный тромб в пределах венозного просвета. В основе нового метода, предложенного K.M. Treitl et al. (2015), лежит принцип прямой визуализации тромба, основанный на создающемся эффекте «черной крови» посредством использования быстрой 3D-последовательности турбо спин-эхо (turbo spin-echo, TSE) с переменным углом поворота [75]. Неверно подобранный угол поворота, как показал анализ I.A. Mendichovszky et al. (2017), мог быть недостаточным для полного подавления сигнала от чрезвычайно медленного венозного кровотока, что явилось причиной появления в некоторых случаях артефактов [76]. Усовершенствованная методика, получившая название Black-blood Thrombus Imaging (BBTI), сочетала в себе тот же 3D TSE с дополнительным, обеспечивающим специальной программой обработки изображения приемом подавления черного цвета, получившим сегодня название DANTE (Delay Alternating with Nutation for Tailored Excititation) [76]. Предварительное исследование, проведенное с использованием MR-сканера с магнитным полем в 3 Тл показало, что бесконтрастная 3D BBTI MRV может обнаруживать DVT с высокой чувствительностью (90,4%) и специфичностью (99,0%). В качестве сравнения авторами использовался метод контрастно-усиленной 3D MRV (Contrast-Enhanced MRV, CE MRV) [77]. Аналогичные и даже более убедительные данные были получены на примере использования наиболее распространенного MR-сканера в 1,5 Тл [78].
Бесконтрастная магнитно-резонансная визуализация ТЭЛА (MRA PE)
Вторым основополагающим направлением развития МRI в диагностике VTE стала возможность использования данных MR-Angiography в диагностике PE. Основным преимуществом магнитно-резонансной ангиопульмонографии (MR-AngioPulmonography, MR-РА) в решении данной диагностической задачи по сравнению с компьютерно-томографическим исследованием зарубежными авторами называлось отсутствие радиационного воздействия [79]. Используемые на начальных этапах проведения исследований медленные двухмерные методы (2D TOF и 2D РС) с ограниченным анатомическим охватом и плохой дифференцировкой медленного кровотока приводили к появлению большого количества артефактов, что сделало использование этих методик проведения MR-PA, по мнению ряда авторов, малоперспективным с целью ангиопульмонографии [79–81]. Появление более быстрой последовательности, основанной на смене градиента (GRE) и лучших алгоритмов визуализации в режиме 3D, показало определенные перспективы дальнейшего использования MR-Angiography в распознавании PE [82, 83]. Однако, несмотря на эти достижения, продолжающиеся ограничения пространственного разрешения и невозможность со стороны некоторых пациентов длительно задержать дыхание не позволили добиться отчетливой визуализации на уровне сегментарных и субсегментарных легочных артерий [84]. Кроме того, сама методика проведения MR-PA требовала дальнейшего совершенствования и своей стандартизации, т. к. трактовка результатов в очень многих случаях носила субъективный характер и на сегодня, несмотря на все попытки, не смогла в своей информативности превзойти CTPA.
Контрастно-усиленная MP-венография
Учитывая отрицательные стороны применения в диагностике LEDVT любых бесконтрастных методов MRV (негативные для получения стабильного качественного изображения вен эффекты насыщения в продольной плоскости при использовании времяпролетной 2D TOF MRV или артефакты, возникающие при поперечной релаксации во время использования фазово-контрастной градиентной последовательности 2D PC MRV GRE), специалисты пришли к заключению, что повысить качество изображения можно путем усиления MRI контрастным веществом (CE MRV) [85–90]. Однако первые попытки использования контрастирования вен при MRV были неудачными и не приводили к положительному запланированному эффекту. Все дело в том, что обычно доступные в то время внеклеточные контрастные средства имели относительно короткоживущую сосудистую фазу, т. к. достаточно быстро перераспределялись в пространстве внеклеточной жидкости [91, 92].
Препаратами, с помощью которых были предприняты попытки улучшения контрастирования венозной системы нижних конечностей и таза, стали контрастные вещества, содержащие в своей основе гадолиний (Gd). Связываясь с альбумином плазмы, Gd продлевал время нахождения контраста в крови [93]. Использование Gd в условиях быстрого сканирования позволило достигнуть лучшего соотношения сигнала и шума (Signal to Noise Ratio) и достичь гораздо большей точности исследования в условиях медленного потока, даже при большой извитости вен [94]. Связанный с альбумином Gd значительно увеличивал время Т1 релаксации, в результате чего и удавалось достигнуть стойкого и качественного изображения венозной магистрали [95, 96]. Подтверждением этому стали результаты исследований [97–99]. Кроме того, использование гадофосвесита тринатрия в качестве контрастного усилителя MRV позволило устранить развитие помутнения просвета вен, расположенных дистальнее клапана [100], а также помутнение магистрального потока, происходящее сегментарно на уровне впадения притока, т. к. «тяжелый» Gd не давал развиться дополнительной турбулентности и изменить ламинарный кровоток в вене [101]. В отличие от ранее предложенных контрастных веществ, при использовании гадофосфата тринатрия полное сосудистое распределение контрастного вещества, называемое также установившимся состоянием, наступало в течение 4–5 мин после кубитальной инъекции контраста, устраняя любые дополнительные помутнения, что позволяло добиться значительного повышения качества визуализации вен на всех уровнях конечности (рис. 1) [102].
![Рис. 1. Контрастно-усиленная гадолинием Gd CE MRVenography в режиме 3D с использованием градиентной импульсной последовательности GRE, Т1-взвешенное изображение [10] Рис. 1. Контрастно-усиленная гадолинием Gd CE MRVenography в режиме 3D с использованием градиентной импульсной последовательности GRE, Т1-взвешенное изображение [10]](/upload/medialibrary/ae7/34-1.png)
Определенные перспективы при использовании Gd наметились и в диагностике PE (рис. 2).
![Рис. 2. Контрастно-усиленная гадолинием Gd CE MRAngioPulmonography легких (MRPA) в режиме 3D GRE. Т1-взвешенное изображение [46] Рис. 2. Контрастно-усиленная гадолинием Gd CE MRAngioPulmonography легких (MRPA) в режиме 3D GRE. Т1-взвешенное изображение [46]](/upload/medialibrary/a01/34-2.png)
Учитывая потенциальную токсическую опасность контрастных препаратов на основе Gd, специалисты с целью контрастного усиления MRI провели разработку, а затем и клинические испытания новых контрастных препаратов, получивших название «контрастные соединения пула крови» и содержащих в своем составе оксид железа (Fe3О4). В основе механизма действия данных препаратов лежал тот же принцип, что и при использовании Gd-содержащих контрастных веществ, а именно замедление эвакуации контраста из дистальных сегментов нижних конечностей за счет их тропности и связи с альбумином плазмы крови. Однако решалась эта задача за счет другого химического соединения. К тому же, если Gd с физической точки зрения был парамагнетиком, то частицы Fe3О4 при попадании в кровь давали супермагнитный эффект (superparamagnetic particle of iron).
Первым контрастным препаратом, содержащим в своем составе частицы Fe3О4, была субстанция NC100150, которая представляла собой коллоидный препарат, состоящий из суперпарамагнитных наночастиц Fe3О4 в количестве 30 мг (Fe) / мл, стабилизированных углеводно-полиэтиленгликолевым покрытием [104, 105]. О возможности использования NC100150 с целью проведения рентгеноконтрастной MRV сообщили M. Aschauer et al. (2003) [106]. Результаты проведенных исследований в сравнении с рентгеноконтрастной флебографией, которая выступала в роли стандарта сравнения, показали, что чувствительность и специфичность использования NC100150 при проведении СЕ MRV составила соответственно: для подвздошных и бедренных вен — 100%, для подколенных вен — 100% и 83,3%, для вен голени — 83,3% и 95,3%. Таким образом, общая чувствительность составила 93,3%, а специфичность — 96,5% [106].
В исследовании E.M. Larsson et al. (2003) был использован контрастный препарат, содержащий Fe3О4, Исследование носило экспериментально-клинический характер (рис. 3). Техника использования этого контрастного вещества во время проведения СЕ MRV таза и нижних конечностей была аналогичной, однако непосредственно 3D-визуализация магистральных вен на всех уровнях конечности и таза осуществлялась посредством новой последовательности TFLAS (Turbo-Fast Low-Angle Shot) [107].
![Рис. 3. Контрастно-усиленная CE MR-Venography в режиме 3D с использованием импульсной последовательности Turbo-Fast Low-Angle Shot. Т1-взвешенное изображение. Использован контрастный препарат, содержащий Fe3О4 [107] Рис. 3. Контрастно-усиленная CE MR-Venography в режиме 3D с использованием импульсной последовательности Turbo-Fast Low-Angle Shot. Т1-взвешенное изображение. Использован контрастный препарат, содержащий Fe3О4 [107]](/upload/medialibrary/0bd/34-3.png)
Еще одним контрастным препаратом, содержащим в своем составе Fe3О4, по мнению американских радиологов, мог бы стать ферумокситол. В отличие от ранее предложенных контрастных препаратов, в данном препарате ядро молекулы, представленное Fe3О4, было покрыто оболочкой из карбоксиметилэфира полиглюкозного сорбита с меньшим размером наночастиц — 30 нм. Изначально и на протяжении многих лет данный препарат с успехом использовался исключительно для коррекции железодефицитной анемии и был особенно рекомендован для коррекции этого состояния при лечении пациентов с хронической почечной недостаточностью [108]. Первая публикация о потенциальной возможности использования данного препарата железа при проведении MRI-исследований появилась в 2007 г. [109]. С физической точки зрения основной эффект контрастного усиления MRI при использовании ферумокситола при визуализации вен заключался в существенном укорочении Т1- и Т2-релаксаций [110]. По мнению ряда авторов, комбинированное использование в анализе MRV 3 режимов (преконтрастного 2D-TOF, а также двойного контрастирования в режиме 3D с дополнительным введением ферумокситола при сравнении данных в режимах просмотра сосудистой системы Т1 и Т2, т. е. в условиях так называемой «яркой» и «темной» крови) позволяло отчетливо дифференцировать отсутствие или наличие окклюзии магистральных вен нижних конечностей и таза [109]. Кроме того, данный контрастный препарат, по мнению разработчиков, в сравнении с веществами, содержащими Gd, обладал высоким уровнем безопасности, т. к. изначально был разработан специально для использования у пациентов с хроническими заболеваниями почек [111]. Сравнительный анализ эффективности применения контрастных веществ линейки «пула крови», имеющих в своем составе Gd и Fe3О4 при проведении 3D СЕ MRV, был выполнен M.R. Bashir et al. (2014) [112]. Авторы показали почти аналогичные по своей информативности результаты в группах сравнения, однако с учетом гораздо большей токсичности контрастных препаратов на основе Gd применение препаратов, содержащих Fe3О4, становилось более перспективным
(рис. 4 и 5).
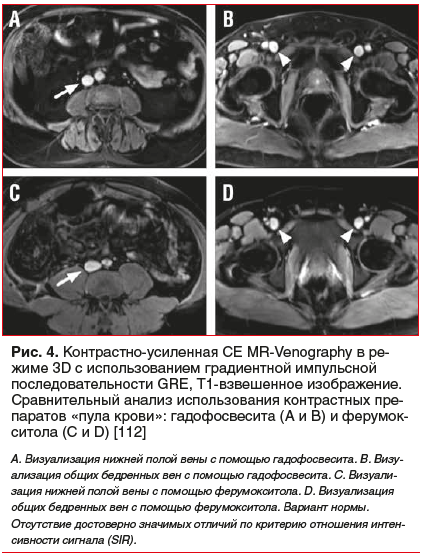
![Рис. 5. Контрастно-усиленная CE MR-Venography в режиме 3D с использованием градиентной импульсной последовательности GRE, Т1-взвешенное изображение [112] Рис. 5. Контрастно-усиленная CE MR-Venography в режиме 3D с использованием градиентной импульсной последовательности GRE, Т1-взвешенное изображение [112]](/upload/medialibrary/ce5/34-5.png)
Очередной проблемой, с которой столкнулись все специалисты при визуализации вен нижних конечностей посредством выполнения контрастно-усиленной MRV, стала сложность точного определения начала времени сканирования интересующего сегмента конечности после завершения введения контрастного препарата в вену (определение равновесной фазы). Во всех вышепредставленных исследованиях введение препарата осуществлялось пункцией кубитальной вены на стороне скомпрометированной нижней конечности (непрямая 3D CE MRV). В результате этого для достижения интересующего венозного сегмента контраст должен был пройти длительный артериальный путь. Ведущими специалистами MR-диагностики практически сразу было отмечено, что ограниченность использования контрастной MRV связана со сложностью прогнозирования точного времени поступления контраста в дистальные вены, который, прежде чем достигнуть исследуемой венозной области, уже подвергался значительному разбавлению [11, 93]. Это требовало повторного введения контрастного препарата и проведения дополнительного сканирования, что неминуемо влекло за собой увеличение общей дозы и продолжительности обследования [113, 114]. Кроме того, во время проведения исследования артериальный MR-сигнал наслаивался на венозный, что также затрудняло окончательный процесс визуализации. Для устранения этого недостатка необходимо было решить техническую задачу вычитания артериальной фазы. Частично это удалось решить путем использования новой последовательности VESPA (Venous Enhanced Subtracted Peak Arterial) (рис. 6), в основе которой лежало проведение последовательных двух ранних и двух запаздывающих сканирований, при условии вычитания ранней артериальной фазы из измерений, полученных при поздней артериально-венозной фазе [115].
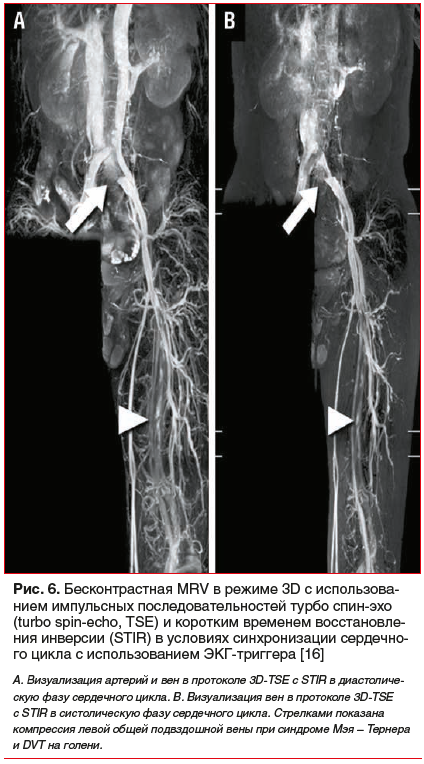
Дополнительное использование в этих случаях автоматизированного алгоритма сегментации, основанной на пороге времени прихода контраста (Contrast Arrival Time), давало увеличение отношения венозного к артериальному сигналу после подавления артериального сигнала с 1,58 до 4,82, т. е. в 3 раза [116]. Однако, несмотря на позитивные результаты использования новых последовательностей при выполнении 3D CE MRV в диагностике DVT подвздошных и бедренных вен, до конца эту проблему устранить так и не удалось [115].
Окончательное решение этого вопроса лежало на поверхности и заключалось в использовании прямой 3D CE MRV, во время которой контрастный препарат вводился в одну из вен тыла стопы исследуемой конечности. Практически сразу в нескольких исследованиях были отмечены преимущества этого метода в сравнении с непрямой CE MRV [117–120]. Так, в исследованиях, проведенных S.G. Ruehm et al. (2000), была показана 100% чувствительность и 98% специфичность метода прямой 3D CE MRV не только в выявлении посттромботических изменений глубоких вен [117], но и в морфологической оценке поверхностных варикозно измененных вен (94% и 96% соответственно), что делало этот метод перспективным в оценке пригодности большой подкожной вены для использования ее в шунтирующих операциях [118]. По сравнению с непрямым подходом метод прямого введения контраста приводил к более высоким значениям коэффициента контраст-шум при значительно меньшем количестве используемого контрастного вещества [119]. Для сбора данных в режиме прямой 3D CE MRV использовались параметры с очень короткими значениями TR и TE и углом поворота 30–40° [117]. Визуализация начиналась после инъекции первых 50–60 мл разбавленного контраста в концентрации 1:15 (20) мл. Введение второй порции контрастного вещества в таком же объеме продолжалось посредством автоматического инжектора во время сбора данных.
Использование такой техники проведения прямой 3D CE MRV позволило полностью избежать появления артефактов при диагностике LEDVT, возникающих при изменении концентрации контраста, которое неизбежно наступало во время его непрямого введения [119]. Детальному анализу эффективности выполнения прямой CE MRV в диагностике синдрома Мэя — Тернера были посвящены работы Y.C. Hsu et al. (2019) и K. Gurel et al. (2011) [16, 120] (рис. 7).
![Рис. 7. Непрямая контрастно-усиленная Gd CE MRVenography в режиме 3D с использованием импульсных последовательностей турбо спин-эхо (turbo spin-echo, TSE) [61] Рис. 7. Непрямая контрастно-усиленная Gd CE MRVenography в режиме 3D с использованием импульсных последовательностей турбо спин-эхо (turbo spin-echo, TSE) [61]](/upload/medialibrary/b2b/34-7.png)
Исследования по изучению эффективности использования контрастных препаратов «пула крови», сбору данных и определению уровня информативности при 3D CE MRV с применением различных импульсных последовательностей и режимов постобработки активно продолжались. Однако в 2011 г. все клинические и экспериментальные исследования по изучению возможностей усиленной MRI гадолиниевыми контрастами в различных диагностических клинических ситуациях были приостановлены. Это было связано с появлением в открытых источниках информации о возможности высвобождения чистого Gd из соединения, в котором он находился, поступления его в кровь и накопления в тканях головного мозга с возможным развитием токсического воздействия на ЦНС, даже развития у некоторых пациентов нефрогенного системного фиброза [121–124]. В связи с имеющейся информацией в 2016 г. Комитет по лекарственным средствам для использования человеком Европейского медицинского агентства (European Medicines Agency’s Committee for Medicinal Products for Human Use, CHMP EMA) инициировал проведение углубленного анализа данных безопасности контрастных лекарственных средств на основе Gd для MRI. По результатам этой проверки 21 июля 2017 г. CHMP EMA были приняты рекомендации об ограничении применения некоторых линейных гадолиниевых контрастных препаратов при проведении MRI и приостановлено действие регистрационных удостоверений на них. При этом заключительные решения уполномоченных структур различных стран значительно отличались. Так, Управление по санитарному надзору над качеством пищевых продуктов и медикаментов США (US Food and Drug Administration, FDA), проанализировав всю имеющуюся в распоряжении информацию, не посчитало необходимым ограничивать использование при MRI всех ранее зарегистрированных контрастных гадолиниевых препаратов. В Японии рекомендовали полностью отказаться от использования любых линейных контрастов, содержащих Gd. В подписанном руководителем Росздравнадзора официальном заключении № 01u-1380/18 от 31.05.2018 отмечено, что «на сегодняшний день никаких признаков развития неблагоприятных последствий для здоровья, связанных с наличием Gd в тканях головного мозга, не выявлено», а соотношение «польза — риск» наиболее активно используемых и зарегистрированных в России препаратов является благоприятным
Заключение
В качестве заключения проведенного нами анализа представляется рациональным попытаться ответить на основной вопрос: какие из описанных методов проведения MRV целесообразно на сегодня использовать с целью диагностики гемодинамических нарушений у пациентов с CVD? Бесспорно, наиболее ценную информацию о состоянии венозного русла нижних конечностей, таза и нижней полой вены может дать проведение контрастно-усиленной MRV. Для выполнения этого исследования оптимальным является использование последовательности 2D СE MRV в режиме градиентного эхо (GRE) или визуализации в 3D-режиме. В зависимости от имеющегося в распоряжении оператора дополнительного программного обеспечения визуализация венозной системы будет иметь лучшее или среднее качество, а следовательно, предоставит больше или меньше информации для подтверждения диагноза. Но если с выбором оптимальной базовой последовательности MR-сканирования сложностей не возникает и результат MRI будет зависеть в немалой степени от умения оператора использовать весь программный арсенал, то относительно выбора контрастного агента для проведения СE MRV вопросов в последние годы появилось немало. Но, так или иначе, исследования по использованию контрастных препаратов линии «пула крови» для проведения СE MRV с целью исключения DVT необходимо продолжить. С нашей точки зрения, с учетом того, что препараты гадоксетовой кислоты и гадопентетовой кислоты являются линейными, наиболее безопасным при проведении любых MR-ангиографических исследований является зарегистрированный в России циклический контрастный препарат, содержащий гадобутрол. В связи с имеющимися относительными ограничениями в применении линейных гадолиниевых контрастных препаратов при проведении MRI-исследований перспективными являются исследования по использованию при проведении 3D CE MRV контрастных препаратов, содержащих Fe3O4.
Таким образом, на сегодняшний день использование в клинической практике контрастных препаратов из серии «пула крови» для СE MRV остается в мире предметом активных дискуссий [125, 126]. Однако в связи с имеющимися ограничениями в более активном использовании контрастных препаратов «пула крови» перспективным является усовершенствование методик проведения бесконтрастной MRV, т. к. большое количество ранее проведенных исследований показывает, что быстро и полно визуализировать вены нижних конечностей и таза возможно и без дополнительного использования любых контрастных препаратов. Основная проблема заключается в умении правильно использовать уже разработанное или имеющееся в распоряжении специалистов программное обеспечение. Одним из таких инструментов является метод усиления MRV за счет вычитания пиковой артериальной составляющей (VESPA) [16]. Доказательством этого могут быть исследования, проведенные в 2019 г. H. Chen et al. (2018) (рис. 8) [78].
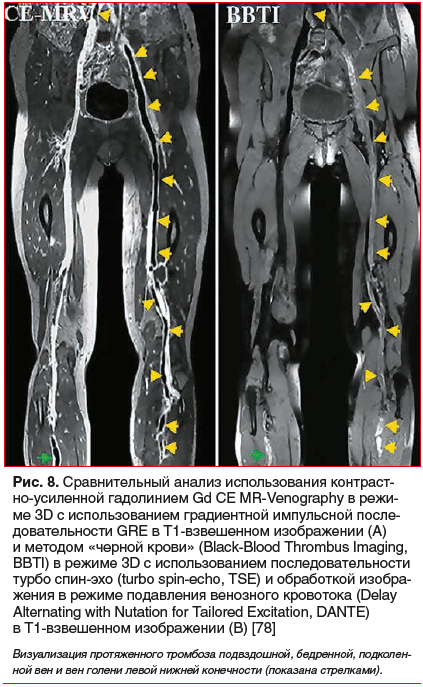
Отдельного внимания заслуживает обсуждение вопроса комплексной диагностики VTE. Как нами было отмечено выше, первые попытки использования MRI в режиме ангиопульмонографии были безуспешными. Появление более быстрых градиентов и лучших алгоритмов при выполнении 3D MR-Angiography показало определенные перспективы использования этого метода в диагностике VTE. В связи с этим, с нашей точки зрения, необходимы исследования возможности одновременного проведения непрямой 3D CE MR-Angiopulmonography и 3D CE MR-Venography, причем, если того требует ситуация, с дополнительным усилением изображения путем прямого дистального введения контраста непосредственно в венозную магистраль. Таких работ на сегодняшний момент нет. Насколько оправдан будет такой подход, покажет время. Но, в принципе, на сегодня в диагностике DVT, этого грозного осложнения, 3D MR-AngioPulmonography тяжело соперничать с 3D СE СТ-AngioPulmonography, основными недостатками которой остаются лучевая нагрузка на пациента и определенная нефротоксичность йодсодержащих препаратов. Что касается последнего аспекта, то, как было показано и с Gd-содержащими контрастными препаратами, при их использовании во время проведения MRI не все так однозначно. В отношении же дополнительной лучевой нагрузки на пациента во время проведения любых СТ-исследований можно заметить, что использование в последние годы многодетекторных систем, работающих в режиме не только 128, но и 320 срезов, позволяет проводить обследование быстро, а следовательно, с минимальной лучевой нагрузкой. При этом не будем забывать, что и технический прогресс в разработке новых сканирующих MR-систем не стоит на месте и в настоящее время уже проводятся клинические исследования по использованию MR-систем с магнитным полем, равным не только 3 и 5 Тл, но и 10 Тл. В отношении диагностики гемодинамических нарушений у пациентов с хроническими заболеваниями вен пока нет исследований с использованием этих самых современных томографических систем.
2. Eklof B., Perrin M., Delis K.T. et al. Updated terminology of chronic venous disorders: the Vein–Term transatlantic interdisciplinary consensus document. J Vasc Surg. 2009;49(2):498–501. DOI: 10.1016/j.jvs.2008.09.014.
3. Yamaki T., Nozaki M., Sakurai H. et al. Presence of lower limb deep vein thrombosis and prognosis in patients with symptomatic pulmonary embolism: preliminary report. Eur J Vasc Endovasc Surg. 2009;37:225–231. DOI: 10.1016/j.ejvs.2008.08.018.
4. Goldhaber S.Z., Bounameaux H. Pulmonary embolism and deep vein thrombosis. Lancet. 2012;379:1835–1846. DOI: 10.1016/s0140-6736 (11) 61904-1.
5. Silverstein M.D., Heit J.A., Mohr D.N. et al. Trends in the incidence of deep vein thrombosis and pulmonary embolism: a 25-year population-based study. Arch Intern Med. 1998;158:585–593. DOI: 10.1001/archinte.158.6.585.
6. Houman F.M., Lopes R.D., Stashenko G.J. Treatment of venous thromboembolism: guidelines translated for the clinician. J Thromb Thrombolysis. 2009;28:270–275. DOI: 10.1007/s11239-009-0374-7.
7. Kearon C. Natural history of venous thromboembolism. Circulation. 2003;107:122–130. DOI: 10.1161/01.cir.0000078464.82671.78.
8. Yamaki T., Nozaki M., Sakurai H. et al. Uses of different D-dimer levels can reduce the need for venous duplex scanning to rule out deep vein thrombosis in patients with symptomatic pulmonary embolism. J Vasc Surg. 2007;46:526–532. DOI: 10.1016/j.jvs.2007.05.026.
9. Girard P., Sanchez O., Leroyer C., Musset D., Meyer G. Deep venous thrombosis in patients with acute pulmonary embolism: prevalence, risk factors, and clinical significance. Chest. 2005;128:1593–1600. DOI: 10.1378/chest.128.3.1593.
10. Christie A., Rodidti G. Radiological Imaging and Intervention in Venous Thrombosis. Chapter in Book: Deep Vein Thrombosis, edited by Cheng Gregory. IntechOpen. 2012:78–98. DOI: 10.5772/33605.
11. Spritzer C.E., Arata M.A., Freed K.S. Isolated pelvic deep venous thrombosis: relative frequency as detected with MR imaging. Radiology. 2001;219:521–525. DOI: 10.1148/radiology.219.2.r01ma25521.
12. Miller N., Satin R., Tousignant L., Sheiner N.M. A prospective study comparing duplex scan and venography for diagnosis of lower-extremity deep vein thrombosis. Cadiovasc Surg. 1996;4(4):505–508. DOI: 10.1016/0967-2109 (95) 00148-4.
13. Suwanabol P.A., Tefera G., Schwarze M.L. Syndromes associated with the deep veins: phlegmasia cerulean dolens, May-Thurner syndrome, and nutcracker syndrome. Perspect Vasc Surg Endovasc Ther. 2010;22(4):223–230. DOI: 10.1177/1531003511400426.
14. Marston W., Fish D., Unger J., Keagy B. Incidence of and risk factors for iliocaval venous obstruction in patients with active or healed venous leg ulcers. J Vasc Surg. 2011;53(5):1303-1308. DOI: 10.1016/j.jvs.2010.10.120.
15. Oguzkurt L., Ozkan U., Ulusan S. et al. Compression of the Left Common Iliac Vein in Asymptomatic Subjects and Patients with Left Iliofemoral Deep Vein Thrombosis. Journal of Vascular and International Radiology. 2008;19(3):366–370. DOI: 10.1016/j.jvir.2007.09.007.
16. Hsu Y.C., Huang Y.K., Hsu L.S. et al. Using non-contrast-enhanced magnetic resonance venography for the evaluation of May-Thurner syndrome in patients with renal insufficiency. Medicine. 2019;98(52):18427. DOI: 10.1097/MD.0000000000018427.
17. Davidson B.L., Elliot C.G., Lensing A.W. Low accuracy of color Doppler ultrasound in the detection of proximal leg vein thrombosis in asymptomatic high-risk patients: the RD heparin arthroplasty group. Ann Int Med. 1992;117:735–738. DOI: 10.7326/0003-4819-117-9-735.
18. Holtz D.J., Debatin J.K., McKinnon G.C. et al. MR venography of the calf: value of flow-enhanced time-of-flight echoplaner imaging. Amer J of Roentgenology. 1996;166(3):663–668. DOI: 10.2214/air.166.3.8623646.
19. Wells P.S., Lensing A.W., Davidson B.L. et al. Accuracy of ultrasound for the diagnosis of deep venous thrombosis in asymptomatic patients after orthopedic surgery: a meta-analysis. Ann Intern Med. 1995;122:47–52. DOI: 10.7326/0003-4819-122-1-199501010-00008.
20. Aschauer M., Deutschmann H.A., Stollberger R. et al. Value of blood pool contrast agent in MR venography of the lower extremities and pelvis: Preliminary results in 12 patients. J Magnetic Resonance in Medicine. 2003;50(5):993–1002. DOI: 10.1002/mrm.10607.
21. Leen E., Averkiou M., Arditi M. et al. Dynamic contrast enhanced ultrasound assessment of the vascular effects of novel therapeutics in early stage trials. Eur Radiol. 2012;22:1442–1450. DOI: 10.1007/s00330-011-2373-2.
22. Hocke M., Dietrich C.F. New technology–combined use of 3D contrast enhanced endoscopic ultrasound techniques. Ultraschall Med. 2011;32(3):317–318. DOI: 10.1055/s-0031-1274695.
23. Claudon M., Cosgrove D., Albrecht T. et al. Guidelines and good clinical practice recommendations for contrast enhanced ultrasound (CEUS) — Update 2008. Ultraschall Med. 2008;29(1):28–44. DOI: 10.1055/s-2007-963785.
24. Dietrich C.F., Averkiou M., Barr R.G. et al. How to perform Contrast-Enhanced Ultrasound — CEUS. Ultrasound Int Open. 2018;4(1):2–15. DOI: 10.1055/s-0043-123931.
25. Jenssen C., Hocke M., Fusaroli P. et al. EFSUMB Guidelines on Interventional Ultrasound (INVUS), Part IV — EUS-guided Interventions: General aspects and EUS-guided sampling (Long Version). Ultraschall Med. 2015;37(2):33–76. DOI: 10.1055/s-0035-1553785.
26. Dietrich C.F., Averkiou M., Barr R.G. et al. How to perform Contrast-Enhanced Ultrasound — CEUS. Ultrasound Int Open. 2018;4(1):2–15. DOI: 10.1055/s-0043-123931.
27. Delis K.T., Bjarnanson H., Wennberg P.W. Successful iliac vein and inferior vena cava stenting ameliorates venous claudication and improves venous outflow, calf muscle pump function, and clinical status in post-thrombotic syndrome. Ann Surg. 2007;245(1):130–139. DOI: 10.1097/01.sla.0000245550.36159.93.
28. Garg N., Gloviczki P., Karimi K.M. et al. Factors affecting outcome of open and hybrid reconstructions for malignant obstruction of iliofemoral veins and inferior vena. J Vasc Surg. 2011;53(2):383–393. DOI: 10.1016/j.jvs.2010.08.086.
29. Ghaye B., Szapiro D., Willems V., Dondelinger R.F. Pitfalls in CT venography of lower limbs and abdominal veins. Am J Roentgenol. 2002;178(6):1465–1471. DOI: 10.2214/ajr.178.6.1781465.
30. Shi W.Y., Wang L.W., Wang S.J. et al. Combined Direct and Indirect CT Venography (Combined CTV) in Detecting Lower Extremity Deep Vein Thrombosis. Medicine. 2016;95(11):1–7. DOI: 10.1097/md.0000000000003010.
31. Loud P.A., Katz D.S., Bruce D.A. et al. Deep venous thrombosis with suspected pulmonary embolism: detection with combined CT venography and pulmonary angiography. Radiology. 2001;219(2):498–502. DOI: 10.1148/radiology.219.2.r01ma26498.
32. Righini M., Le gal G., Aujesky D. et al. Diagnosis of pulmonary embolism by multidetector CT alone or combined with venous ultrasonography of the leg: a randomized non-inferiority trial. Lancet. 2008;371(9621):1343–1352. DOI: 10.1016/s0140-6736 (08) 60594-2.
33. Kalva S.P., Jagannathan J.P., Hahn P.F., Wicky S.T. Venous thromboembolism: indirect CT venography during CT pulmonary angiography should the pelvis be imaged? Radiology. 2008;246:605–611. DOI: 10.1148/radiol.2462070319.
34. Davies A.H. Management of Chronic Venous Disease. Clinical Practice Guidelines of European Society for Vascular Surgery (ESVS). Eur J Endovasc Surg. 2016;51(1):156. DOI: 10.1016/j.ejvs.2015.09.024.
35. Uhl J.F., Verdeille S., Martin-Bouyer Y. Three-dimensional spiral CT venography for the preoperative assessment of varicose patients. Vasa. 2003;32(2):91–94. DOI: 10.1024/0301-1526.32.2.91.
36. Uhl J.F., Caggiati A. Three-dimensional evaluation of the venous system in varicose limbs by multidetector spiral CT. In: Catalano C. Passariello, eds. Multidetector-Row CT Angiography. Springer Berlin Heidelberg; 2005:199–206. DOI: 10.1007/3-540-26984-3_15.
37. Uhl J.F. A New Tool to Study the 3D Venous Anatomy of the Human Embryo: The Computer-Assisted Anatomical Dissection. J. Vasc Surg: Venous and Limphatic Disorders. 2014;2(1):111–112. DOI: 10.1016/j.jvsv.2013.10.025.
38. Uhl J.F., Gillot C. Anatomy of the foot venous pump: physiology and influence on chronic venous disease. Phlebology: The Journal of Venous Disease. 2012;27(5):219–230. DOI: 10.1258/phleb.2012.012b01.
39. Uhl J.F., Gillot C. Anatomy of the veno-muscular pumps of the lower limb. Phlebology: The Journal of Venous Disease. 2015;30(3):180–193. DOI: 10.1177/0268355513517686.
40. Gloviczki P., Comerota A.J., Dalsing M.C. et al. The care of patients with varicose veins and associated chronic venous diseases: Clinical Practice Guidelines of the Society for Vascular Surgery and the American Venous Forum. Journal of Vascular Surgery. 2011;53(5):2–48. DOI: 10.1016/j.jvs.2011.01.079.
41. Schneider G., Prince M.R., Meaney J.F.M., Ho V.B. Magnetic Resonance Angiography. Techniques, Indications and Practical Applications, foreword by E.J. Potchen. Italia: Springer-Verlag; 2005. ISBN 88–470–0266–4. https://www.springer.com. DOI: 10.1007/b138651.
42. Carpenter J.P., Holland G.A., Baum R.A. et al. Magnetic resonance venography for the detection of deep venous thrombosis: Comparison with contrast venography and duplex Doppler ultrasonography. Journal of Vascular Surgery. 1993;18(5):734–741. DOI: 10.1016/0741-5214 (93) 90325-g.
43. Spritzer C.E. Progress in MR imaging of the venous system. Perspect Vasc Surg Endovasc Ther. 2009;21(2):105–116. DOI: 10.1177/1531003509337259.
44. Laissy J.P., Cinqualbre A., Loshkajian A. Assessment of deep venous thrombosis in the lower limbs and pelvic: MR venography versus duplex Doppler sonography. AJR Am J Roentgenol. 1996;167:971–975. DOI: 10.2214/ajr.167.4.8819396.
45. Шайдаков Е.В., Санников А.Б., Емельяненко В.М. и др. Возможности МРТ-исследований в визуализации сосудистого русла нижних конечностей. РМЖ. 2020;13:33–44 [Shaidakov E.V., Sannikov A.B., Emeliyanenko V.M. et al. Possibilities of MRI studies in visualization of the vascular bed of the lower extremities. RMJ. 2020;13:33–44 (in Russ.)].
46. Kanne J.P., Lalani T.A. Role of Computed Tomography and Magnetic Resonance Imaging for Deep Venous Thrombosis and Pulmonary Embolism. J Circulation. 2004;12(1):15–21. DOI: 10.1161/01.CIR.0000122871.86662.72.
47. Nicolaides A.N., Kakkar W., Field E.S. The origin of deep venous thrombosis: a venographic study. Br J Radiol. 1971;44:653–663. DOI: 10.1259/0007-1285-44-525-653.
48. Cronan J.J. Ultrasound evaluation of deep venous thrombosis. Seminars in Roentgenology. 1992;27(1):39–52. DOI: 10.1016/0037-198x (92) 90045-4.
49. Evans A.J., Sostman H.D., Knelson M.H. et al. Detection of deep venous thrombosis: prospective comparison of MR imaging with contrast venography. AJR Am J Roentgenol. 1993;161:131–139. DOI: 10.2214/ajr.161.1.8517292.
50. Davidson B.L., Elliott G., Lensing A.W.A. Low accurancy of color Doppler ultrasound in the detection of proximal leg vein thrombosis in asymptomatic high-risk patients. Ann Intern Med. 1992;117:735–738. DOI: 10.7326/0003-4819-117-9-735.
51. Wells P.S., Lensing S.W.A., Davidson B.L. Accuracy of ultrasound for the diagnosis of deep venous thrombosis in asymptomatic patients after orthopedic surgery. Ann Intern Med. 1995;122:47–53. DOI: 10.7326/0003-4819-122-1-199501010-00008.
52. Dupas B., El Kouri D., de Fancal P. et al. Angiomagnetic resonance imaging of iliofemorocaval venous thrombosis. Lancet. 1995;346:17–19. DOI: 10.1016/s0140-6736 (95) 92650-x.
53. Gao J.H., Gore J.C. NMR signal from flowing nuclei in fast gradient‐echo pulse sequences with refocusing. Phys Med Biol. 1994;39(12):2305–23218. DOI: 10.1088/0031-9155/39/12/012.
54. Oshinski J.N., Ku D.N., Pettigrew R.I. Turbulent fluctuation velocity: the most significant determinant of signal loss in stenotic vessels. Magn Reson Med. 1995;33(2):193–199. DOI: 10.1002/mrm.1910330208.
55. Evans A.J., Blinder R.A., Herfkens R.J. et al. Effects of turbulence on signal intensity in gradient echo images. Invest Radiol. 1988;23(7):512–518. DOI: 10.1097/00004424-198807000-00006.
56. Meckel S., Reisinger C., Bremerich J. et al. Cerebral Venous Thrombosis: Diagnostic Accuracy of Combined, Dynamic and Static, Contrast-Enhanced 4D MR Venography. AJNR. Am J Neuroradiol. 2010;31(3):527–535. DOI: 10.3174/ajnr.a1869.
57. Siegel J.M. Jr., Oshinski J.N., Pettigrew R.I., Ku D.N. Computational simulation of turbulent signal loss in 2D time‐of‐flight magnetic resonance angiograms. Magn Reson Med. 1997;37(4):609–614. DOI: 10.1002/mrm.1910370421.
58. Babiarz L.S., Romero J.M., Murphy E.K. et al. Contrast-Enhanced MR Angiography Is Not More Accurate Than Unenhanced 2D Time-of-Flight MR Angiography for Determining ≥70% Internal Carotid Artery Stenosis. AJNR Am J Neuroradiol. 2009;30(4):761–768. DOI: 10.3174/ajnr.a1464.
59. Ono A., Murase K., Taniguchi T. et al. Deep venous thrombosis: Diagnostic value of non-contrast-enhanced MR venography using electrocardiography triggered three-dimensional half-fourier FSE. Magn Reson Med. 2010;64:88–97. DOI: 10.1002/mrm.22374.
60. Lindquist C.M., Karlicki F., Lawrence P. et al. Utility of balanced stready-state free procession MR venography in the diagnosis of lower extremity deep venous thrombosis. AJR Am J Roentgenol. 2010;194:1357–1364. DOI: 10.2214/ajr.09.3552.
61. Plein S., Geenwood J., Ridgway J.P. Cardiovascular MR Manual. Springer International Publishing; 2015. ISBN 978–3—319–20940–1. DOI: 10.1007/978-3-319-20940-1.
61. Ruehm S.G. MR Venography. Chapter in Book: Magnetic Resonance Angiography. Springer. 2005:3–22. ISBN 88–470–0266–4.
63. Bradley W.G. Jr, Waluch V. Blood flow: magnetic resonance imaging. J Radiology. 1985;154(2):443–450. DOI: 10.1148/radiology.154.2.3966131.
64. Dumoulin C.L., Hart H.R. Jr. Magnetic resonance angiography. J Radiology. 1986;161(3):717–720. DOI: 10.1148/radiology.161.3.3786721.
65. Edelman R.R., Wentz K.U., Mattle H. et al. Projection arteriography and venography: initial clinical results with MR. J Radiology. 1989;172(2):351–357. DOI: 10.1148/radiology.172.2.2748814.
66. Lenz G.W., Haacke E.M., Masaryk T.J., Laub G. In plane vascular imaging: pulse sequence design and strategy. J Radiology. 1988;166(3):875–882. DOI: 10.1148/radiology.166.3.3340788.
67. Frahm J., Merboldt K.D., Hanicke W. et al. Rapid line scan NMR angiography. Magn Reson Med. 1988;7:79–87. DOI: 10.1002/mrm.1910070109.
68. Constantinesco A., Mallet J.J., Bonmartin A. et al. Spatial or flow velocity phase encoding gradients in NMR imaging. Magn Reson Imaging. 1984;2:335–340. DOI: 10.1016/0730-725x (84) 90200-5.
69. Edelman R.R., Zhao B., Liu C. et al. MR angiography and dynamic flow evaluation of the portal venous system. AJR Am J Roentgenol. 1989;153:755–760. DOI: 10.2214/ajr.153.4.755.
70. Pelc N.J., Herfkens R.J., Shimakawa A. Phase contrast cine magnetic resonance imaging. Magn Reson. 1991;7:229–254. https://www.ncbi.nim.nih.gov.
71. Saha P., Andia M.E., Modarai B. Magnetic resonance T1 relaxation time of venous thrombus is determined by iron processing and predicts susceptibility to lysis. Circulation. 2013;128:729–736. DOI: 10.1161/circulationaha.113.001371.
72. Moody A.R., Pollock J.G., O’Connor A.R., Bagnall M. Lower-limb deep venous thrombosis: direct MR imaging of the thrombus. J Radiology. 1998;209(2):349–355. DOI: 10.1148/radiology.209.2.9807558.
73. Westerbeek R.E., Van Rooden C.J., Tan M. et al. Magnetic resonance direct thrombus imaging of the evolution of acute deep vein thrombosis of the leg. J Thromb Haemost. 2008;6:1087–1092. DOI: 10.1111/j.1538-7836.2008.02986.x.
74. Tan M., Mol G.C., van Rooden C.J. Magnetic resonance direct thrombus imaging differentiates acute recurrent ipsilateral deep vein thrombosis from residual thrombosis. Blood. 2014;124:623–627. DOI: 10.1182/blood-2014-04-566380.
75. Treitl K.M., Treitl M., Kooijman-Kurfuerst H. et al. Three-dimentional black-blood T1-weighted tirbo spin-echo techniques for the diagnosis of deep vein thrombosis in comparison with contrast-enhanced magnetic resonance imaging: a pilot study. Investig Radiol. 2015;50:401–408. DOI: 10.1097/rli.0000000000000142.
76. Mendichovszky I.A., Priest A.N., Bowden D.J. et al. Combined MR direct thrombus imaging and non-contrast magnetic resonance venography reveal the evolution of deep vein thrombosis: a feasibility study. Eur Radiol. 2017;27:2326–2332. DOI: 10.1007/s00330-016-4555-4.
77. Xie G., Chen H., He X. et al. Black-blood thrombus imaging (BTI): a contrast-free cardiovascular magnetic resonance approach for the diagnosis of non-acute deep vein thrombosis. Journal of Cardiovascular Magnetic Resonance. 2017;19(1):4. DOI: 10.1186/s12968-016-0320-8.
78. Chen H., He X., Xie G. et al. Cardiovascular magnetic resonance black-blood thrombus imaging for the diagnosis of acute deep vein thrombosis at 1,5 Tesla. J of Cardiovascular Magnetic Resonance. 2018;20(1):42. DOI: 10.1186/s12968-018-0459-6.
79. Meaney J.F., Johansson L.O., Ahlstrom H., Prince M.R. Pulmonary magnetic resonance angiography. J Magn Reson Imaging. 1999;10:326–338. DOI: 10.1002/ (sici) 1522-2586 (199909) 10.
80. Zhang H.L., Kaki J.H., Prince M.R. 3D contrast-enhanced MR angiography. J Magn Reson Imaging. 2007;25(1):13–25. DOI: 10.1002/jmri.20767.
81. Vrachliotis T.G., Bis K.G., Shetty A.N., Ravikrshan K.P. Contrast-enhanced three-dimensional MR angiography of the pulmonary vascular tree. Int J Cardiovasc Imaging. 2002;18:283–293. DOI: 10.1023/a:1015541931895.
82. Haage P., Piroth W., Krombach G. et al. Pulmonary embolism: comparison of angiography with spiral computed tomography, magnetic resonance angiography, and real-time magnetic resonance imaging. Am J Respir Crit Care Med. 2003;167:729–734. DOI: 10.1164/rccm.200208-899oc.
83. Oudkerk M, van Beek E.J., Wielopolski P., van Ooijen P. Comparison of contrast-enhanced magnetic resonance angiography and conventional pulmonary angiography for the diagnosis of pulmonary embolism: a prospective study. Lancet. 2002;359:1643–1647. DOI: 10.1016/s0140-6736 (02) 08596-3.
84. Vrachliotis T.G., Bis K.G., Shetty A.N., Ravikrshan K.P. Contrast-enhanced three-dimensional MR angiography of the pulmonary vascular tree. Int J Cardiovasc Imaging. 2002;18:283–293. DOI: 10.1023/a:1015541931895.
85. Kirchhof K., Welzel T., Jansen O., Sartor K. More reliable noninvasive visualization of the cerebral veins and dural sinuses: comparison of three MR angiographic techniques. Radiology. 2002;224(3):804–810. DOI: 10.1148/radiol.2243011019.
86. Rollins N., Ison C., Reyes T., Chia J. Cerebral MR venography in children: comparison of 2D time‐of‐flight and gadolinium‐enhanced 3D gradient‐echo techniques. Radiology. 2005;235(2):1011–1017. DOI: 10.1148/radiol.2353041427.
87. Bosmans H., Marchal G., Lukito G. et al. Time‐of‐flight MR angiography of the brain: comparison of acquisition techniques in healthy volunteers. AJR Am J Roentgenol. 1995;164(1):161–167. DOI: 10.2214/ajr.164.1.7998531.
88. Klingebiel R., Bauknecht H.C., Bohner G. et al. Comparative evaluation of 2D time‐of‐flight and 3D elliptic centric contrast‐enhanced MR venography in patients with presumptive cerebral venous and sinus thrombosis. Eur J Neurol. 2007;14(2):139–143. DOI: 10.1111/j.1468-1331.2006.01574.x.
89. Blatter D.D., Parker D.L., Robison R.O. Cerebral MR angiography with multiple overlapping thin slab acquisition. Part I. Quantitative analysis of vessel visibility. Radiology. 1991;179(3):805–811. DOI: 10.1148/radiology.179.3.2027996.
90. Gupta A., Baradaran H., Kamel H. et al. Intraplaque High-Intensity Signal on 3D Time-of-Flight MR Angiography Is Strongly Associated with Symptomatic Carotid Artery Stenosis AJNR Am J Neuroradiol. 2014;35(3):557–561. DOI: 10.3174/ajnr.a3732.
91. Doepp F., Wurfel J.T., Pfueller C.F. et al. Venous drainage in multiple sclerosis: a combined MRI and ultrasound study. Neurology. 2011;77(19):1745–1751. DOI: 10.1212/wnl.0b013e318236f0ea.
92. Huang S.Y., Kim C.Y., Miller M.J. et al. Abdominopelvic and lower extremity deep venous thrombosis: Evaluation with contrast-enhanced MR Venography with a blood-pool agent. AJR Am J Roentgenol. 2013;201:208–214. DOI: 10.2214/ajr.12.9611.
93. Cantwell C.P., Cradock A., Bruzzi J. et al. MR venography with true fast imaging with steady-state procession for suspected lower-limb deep vein thrombosis. J Vasc Interv Radiol. 2006;17:1763–1769. DOI: 10.1097/01.rvi.0000242502.40626.53.
94. Prince M.R., Grist T.M., Debatin J.F. 3D Contrast MR Angiography. 3rd ed. New York: Springer Berlin Heidelberg, 2003: 163–172. Prince M.R., Grist T.M., Debatin J.F. 3D Contrast MR Angiography. 3rd ed. New York: Springer Berlin Heidelberg, 2003:163–172.
95. Parmelee D.J., Walovitch R.C., Ouellet H.S., Lauffer R.B. Preclinical evaluation of the pharmacokinetics, biodistribution, and elimination of MS‐325, a blood pool agent for magnetic resonance imaging. Invest Radiol. 1997;32(12):741–747. DOI: 10.1097/00004424-199712000-00004.
96. Lauffer R.B., Parmelee D.J., Dunham S.U. et al. MS‐325: albumin‐targeted contrast agent for MR angiography. Radiology. 1998;207(2):529–538. DOI: 10.1148/radiology.207.2.9577506.
97. Kramer L.A., Cohen A.M., Hasan K.M. et al. Contrast enhanced MR venography with gadofosveset trisodium: Evalution of the intracranial and extracranial venous system. Journal of Magnetic Resonance. 2014;40(3):630–640. DOI: 10.002/jmri.24409.
98. Hadizadeh D.R., Kukuk G.M., Fahlenkamp U.L. et al. Simultaneous MR arteriography and venography with blood pool contrast agent detects deep venous thrombosis in suspected arterial disease. AJR Am J Roentgenol. 2012;198(5):1188–1195. DOI: 10.2214/ajr.11.7306.
99. Duan X., Ling F., Shen Y. et al. Venous spasm during contrast‐guided axillary vein puncture for pacemaker or defibrillator lead implantation. Europace. 2012;14(7):1008–1011. DOI: 10.1093/europace/eus066.
100. Barber C.J. Central venous catheter placement for intravenous digital subtraction angiography: an assessment of technical problems and success rate. Br J Radiol. 1989;62:599–602. DOI: 10.1259/0007-1285-62-739-599.
101. Singh R.N., Salvoza M.I. Laminar flow due to venous valves masquerading as vein graft spasm. Cathet Cardiovasc Diagn. 1983;9:569–575. DOI: 10.1002/ccd.1810090606.
102. Nikolaou K., Kramer H., Grosse C. et al. High‐spatial‐resolution multistation MR angiography with parallel imaging and blood pool contrast agent: initial experience. Radiology. 2006;241:861–872. DOI: 10.1148/radiol.2413060053.
103. Lebowitz J.A., Rofsky N.M., Krinsky G.A., Weinreb J.C. Gadolinium‐enhanced body MR venography with subtraction technique. AJR Am J Roentgenol. 1997;169(3):755–758. DOI: 10.2214/ajr.169.3.9275892.
104. Weishaupt D., Hetzer F.H., Rühm S.G. et al. Three‐dimensional contrast enhanced MRI using an intravascular contrast agent for detection of traumatic intra‐abdominal hemorrhage and abdominal parenchymal injuries: an experimental study. Eur Radiol. 2000;10(12):1958–1564. DOI: 10.1007/s003300000519.
105. Weishaupt D., Rühm S.G., Binkert C.A. et al. Equilibrium‐phase MR angiography of the aortoiliac and renal arteries using a blood pool contrast agent. Am J Roentgenol. 2000;175(1):189–195. DOI: 10.2214/ajr.175.1.1750189.
106. Aschauer M., Deutschmann H.A., Stollberger R. et al. Value of a blood pool contrast agent in MR venography of the lower extremities and pelvis: Preliminary results in 12 patients. Magnetic Resonance in Medicine. 2003;50(5):993–1002. DOI: 10.1002/mrm.10607.
107. Larsson E.M., Sunden P., Olsson C.G. et al. MR Venography an Intravascular Contrast Agent: Results from a Multicenter Phase 2 Study of Dosage. American Journal of Roentgenology. 2003;180(1):227–232. DOI: 10.2214/air.180.1.1800227.
108. Spinowitz B.S., Kausz A.T., Baptista J. et al. Ferumoxytol for treating iron deficiency anemia in CKD. J Am Soc Nephrol. 2008;19:1599–1605. DOI: 10.1681/asn.2007101156.
109. Li W., Salanitri J., Tutton S. et al. Lower extremity deep venous thrombosis: Evaluation with Ferumoxytol-enhanced MR Imaging and dual-contrast mechanism-ereliminary experience. Radiology. 2007;242:873–881. DOI: 10.1148/radiol.2423052101.
110. Hamilton B.E., Nesbit G.M., Dosa E. et al. Comparative analysis of ferumoxytol and gadoteridol enhancement using T1‐ and T2‐weighted MRI in neuroimaging. AJR Am J Roentgenol. 2011;197(4):981–988. DOI: 10.2214/ajr.10.5992
111. Singh A., Patel T., Hertel J. et al. Safety of Ferumoxytol in Patients With Anemia and CKD. Am J of Kidney Diseases. 2008;52(5):907–905. DOI: 10.1053/j.ajkd.2008.08.001.
112. Bashir M.R., Jaffe T.A., Brennan T.V. et al. Renal transplant imaging using magnetic resonance angiography with a nonnephrotoxic contrast agent. Transplantation.2013;96:91–96. DOI: 10.1097/tp.0b013e318295464c.
113. Shinde T.S., Lee V.S., Rofsky N.M. Three-dimensional gadolinium-enhanced MR venographic evaluation of patency of central veins in the thorax: initial experience. J Radiology. 1999;213:555–560. DOI: 10.1148/radiology.213.2.r99nv27555.
114. Lebowitz J.A., Rofsky N.M., Krinsky G.A., Weinreb J.C. Gadolinium-enhanced body MR venography with subtraction technique. AJR Am J Roentgenol. 1997;169:755–758. DOI: 10.2214/ajr.169.3.9275892.
115. Fraser D.G., Moody A.R., Davidson I.R. et al. Deep venous thrombosis: Diagnosis by using venous enhanced subtracted peak arterial MR Venography versus conventional venography. Radiology. 2003;226:812–820. DOI: 10.1148/radiol.2263012205.
116. Du J., Thornton F., Mistretta C., Grist T.M. Dynamic MR venography: An intrinsic benefit of time-resolved MR angiography. J Magn Reson Imaging. 2006;24(2):922–927. DOI: 10.1002/jmri.20716.
117. Ruehm S.G., Wiesner W., Debatin J.F. Pelvic and Lower Extremity Veins: Contrast-enhanced Three-dimensional MR Venography with a Dedicated Vascular Coil-Initial Experiencel. J. Radiology. 2000;215(2):421–427. DOI: 10.1148/radiology. 215.2.r00ap27421.
118. Ruehm S.G., Wiesner W., Debatin J.F. Direct contrast-enhanced 3D MR venjgraphy. J Eurupean Radiology. 2001;11(1):102–112. DOI: 10.1007/s003300000586.
119. Ruehm S.G. MR Venography. Chapter in Book: Magnetic Resonance Angiography. Springer. 2005:3–22. ISBN 88–470–0266–4.
120. Gurel S., Karavas E., Buharalioglu Y. et al. Direct contrast-enhanced MR venography in the diagnosis of May-Thurner Syndrome. European J of Radiology. 2011;80(2):533–536. DOI: 10.1016/j.ejrad.2010.04.033A.
121. Girardi M., Kay J., Elston D.M. et al. Nephrogenic systemic fibrosis: clinicopathological definition and workup recommendations. J Am Acad Dermatol. 2011;65(6):1095–1106.e7. DOI: 10.1016/j.jaad.2010.08.041.
122. Ramalho J., Castillo M., Al Obaidy M. et al. High signal intensity in globus pallidus and dentate nucleus on unenhanced T1-weighted MR images: evaluation of two linear gadolinium-based contrast agents. Radiology. 2015;276:836–844. DOI: 10.1016/j.jaad.2010.08.041.
123. Bae S., Lee H.J., Han K. et al. Gadolinium deposition in the brain: association with various GBCAs using a generalized additive model. Eur Radiol. 2017;27(8):3353–3361. DOI: 10.1007/s00330-016-4724-5.
124. Abu-Alfa A.K. Nephrogenic Systemic Fibrosis and Gadalinium Based Contrast Agents. Advances in Chronic Kidney Disease. 2011;18(3):188–198. DOI: 10.1053/j.ackd.2011.03.001.
125. Bjarnason H. Direct contrast venography. Book Chapter in Handbook of Venous and Lymphatic Disorders. 4th ed. Guidelines of the American Venous Forum by ed: Glovezki P. 2017:169–176. DOI: 10.1201/9781315382449-15.
126. Stein P.D. Ascending CT-Venography and Venous Phase CT-Venography for Diagnosis of Deep Venous Thrombosis. Book Chapter in Pulmonary Embolism 3th ed. Wiley. 2016:250–254. ISBN 9781119039082. DOI: 10.1002/9781119039112.ch51.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.