Комплексная оценка эффективности генно-терапевтического лечения пациентов с хронической ишемией нижних конечностей
РМЖ. №2 от 30.05.2019 стр. 21-25
Рубрика:
Ангиология
Цель исследования: оценка эффективности консервативного лечения пациентов с хронической ишемией нижних конечностей (ХИНК) с использованием генно-инженерной терапии (препарат Неоваскулген).
Материал и методы: в исследовании приняли участие 49 пациентов с различной степенью поражения артериального русла нижних конечностей. Пациенты были разделены на 2 группы: больные 1-й группы получали стандартную консервативную терапию, медикаментозное лечение пациентов 2-й группы было дополнено препаратом Неоваскулген, который вводился внутримышечно в икроножные мышцы пораженной конечности по 1,2 мг с интервалом в 14 дней двукратно. Эффективность проводимого лечения оценивали на основании как субъективных (дистанция безболевой ходьбы (ДБХ)), так и объективных (показатель VEGF-A (vascular endothelial growth factor А, эндотелиальный фактор роста сосудов А) в периферической крови, показатель BNIP3 (BCL2/adenovirus E1B 19 kDa protein-interacting protein 3, проапоптозный белок семейства B-клеточных лимфом 2 (BCL2) в биоптате икроножной мышцы пораженной конечности) критериев.
Результаты исследования: через 6 мес. у пациентов 1-й группы значимой динамики (как положительной, так и отрицательной) по любому из показателей отмечено не было. У пациентов 2-й группы было зафиксировано достоверное увеличение ДБХ, увеличение VEGF-A в периферической крови, непосредственно оттекающей от ишемизированных мышц, уменьшение уровня BNIP3, особенно выраженное у пациентов с перемежающейся хромотой, соответствующей II стадии ишемии по классификации Покровского — Фонтейна.
Заключение: результаты исследования показали, что генную терапию следует рекомендовать как часть схемы консервативного лечения ХИНК, преимущественно на ранних стадиях заболевания, а именно у пациентов со IIA и IIБ стадиями ишемии. Помимо этого, стоит подчеркнуть важность использования объективных критериев оценки (определение фактора роста эндотелия VEGF-A в периферической крови, содержания проапоптозного белка BNIP3 семейства BCL2) — именно внедрение гистохимических и биохимических критериев позволит сделать следующий шаг к созданию «золотого стандарта» консервативного лечения ХИНК.
Ключевые слова: хроническая ишемия нижних конечностей, морфологические критерии, биохимические критерии, апоптоз, VEGF-A, BNIP3, генная терапия, терапевтический ангиогенез.
Для цитирования: Шабунин А.В., Кузнецов М.Р., Матвеев Д.В., Федоров Е.Е., Матвеев А.Д. Комплексная оценка эффективности генно-терапевтического лечения пациентов с хронической ишемией нижних конечностей. РМЖ. Медицинское обозрение. 2019;27(2):21-25.
Материал и методы: в исследовании приняли участие 49 пациентов с различной степенью поражения артериального русла нижних конечностей. Пациенты были разделены на 2 группы: больные 1-й группы получали стандартную консервативную терапию, медикаментозное лечение пациентов 2-й группы было дополнено препаратом Неоваскулген, который вводился внутримышечно в икроножные мышцы пораженной конечности по 1,2 мг с интервалом в 14 дней двукратно. Эффективность проводимого лечения оценивали на основании как субъективных (дистанция безболевой ходьбы (ДБХ)), так и объективных (показатель VEGF-A (vascular endothelial growth factor А, эндотелиальный фактор роста сосудов А) в периферической крови, показатель BNIP3 (BCL2/adenovirus E1B 19 kDa protein-interacting protein 3, проапоптозный белок семейства B-клеточных лимфом 2 (BCL2) в биоптате икроножной мышцы пораженной конечности) критериев.
Результаты исследования: через 6 мес. у пациентов 1-й группы значимой динамики (как положительной, так и отрицательной) по любому из показателей отмечено не было. У пациентов 2-й группы было зафиксировано достоверное увеличение ДБХ, увеличение VEGF-A в периферической крови, непосредственно оттекающей от ишемизированных мышц, уменьшение уровня BNIP3, особенно выраженное у пациентов с перемежающейся хромотой, соответствующей II стадии ишемии по классификации Покровского — Фонтейна.
Заключение: результаты исследования показали, что генную терапию следует рекомендовать как часть схемы консервативного лечения ХИНК, преимущественно на ранних стадиях заболевания, а именно у пациентов со IIA и IIБ стадиями ишемии. Помимо этого, стоит подчеркнуть важность использования объективных критериев оценки (определение фактора роста эндотелия VEGF-A в периферической крови, содержания проапоптозного белка BNIP3 семейства BCL2) — именно внедрение гистохимических и биохимических критериев позволит сделать следующий шаг к созданию «золотого стандарта» консервативного лечения ХИНК.
Ключевые слова: хроническая ишемия нижних конечностей, морфологические критерии, биохимические критерии, апоптоз, VEGF-A, BNIP3, генная терапия, терапевтический ангиогенез.
Для цитирования: Шабунин А.В., Кузнецов М.Р., Матвеев Д.В., Федоров Е.Е., Матвеев А.Д. Комплексная оценка эффективности генно-терапевтического лечения пациентов с хронической ишемией нижних конечностей. РМЖ. Медицинское обозрение. 2019;27(2):21-25.
Comprehensive assessment of the effectiveness of gene therapy in patients with chronic ischemia of the lower limbs
A.V. Shabunin1, M.R. Kuznetsov2,3, D.V. Matveev1, E.E. Fedorov3, A.D. Matveev1
1Russian Medical Academy of Continuous Professional Education, Moscow
2Pirogov Russian National Research Medical University, Moscow
3Bauman City Clinical Hospital No. 29, Moscow
Aim: to evaluate the efficacy of conservative treatment of patients with chronic lower limb ischemia (CLLI) using genetically engineered therapy (Neovasculgen).
Patients and Methods: 49 patients with different degrees of arterial damage to the lower limbs participated in the study. Patients were divided into 2 groups: patients of the 1st group received standard conservative therapy, drug treatment of the 2nd group patients was supplemented with Neovasculgen, which was injected intramuscularly into the calf muscles of the affected limb by 1.2 mg at intervals of 14 days twice. The effectiveness of the treatment was assessed both on the basis of subjective (pain-free walking distance – PFWD) and objective (VEGF-A (vascular endothelial growth factor A) in peripheral blood, BNIP3 (BCL2/adenovirus E1B 19 kDa protein-interacting protein 3, proapoptosis protein of the B-cell lymphoma 2 family (BCL2) in the biopsy of the calf muscle affected limb) criteria.
Results: after 6 months, no significant dynamics, both positive and negative, were observed in 1st group patients for any of the indicators. Patients of the 2nd group had a significant increase in PFWD, an increase in VEGF-A in peripheral blood flowing directly from ischemic muscles, and a decrease in BNIP3 levels, especially in patients with intermittent claudication, corresponding to the II stage of ischemia according to the Fontaine-Pokrovsky classification.
Conclusion: the results of the study have shown that gene therapy should be recommended as part of a conservative treatment regimen for CLLI, primarily in patients with IIA and IIB ischemia. In addition, it is worth emphasizing the importance of using objective evaluation criteria (determination of the endothelial growth factor VEGF-A in peripheral blood, determination of the proapoptosis protein BNIP3 of the BCL2 family): it is the introduction of histochemical and biochemical criteria that can make the next step towards the creation of a «golden standard» of conservative treatment of CLLI.
Keywords: chronic ischemia of the lower limbs, morphological criteria, biochemical criteria, apoptosis, VEGF-A, BNIP3, gene therapy, therapeutic angiogenesis.
For citation: Shabunin A.V., Kuznetsov M.R., Matveev D.V. et al. Comprehensive assessment of the effectiveness of gene therapy in patients with chronic ischemia of the lower limbs. RMJ. 2019;2:21–25.
A.V. Shabunin1, M.R. Kuznetsov2,3, D.V. Matveev1, E.E. Fedorov3, A.D. Matveev1
1Russian Medical Academy of Continuous Professional Education, Moscow
2Pirogov Russian National Research Medical University, Moscow
3Bauman City Clinical Hospital No. 29, Moscow
Aim: to evaluate the efficacy of conservative treatment of patients with chronic lower limb ischemia (CLLI) using genetically engineered therapy (Neovasculgen).
Patients and Methods: 49 patients with different degrees of arterial damage to the lower limbs participated in the study. Patients were divided into 2 groups: patients of the 1st group received standard conservative therapy, drug treatment of the 2nd group patients was supplemented with Neovasculgen, which was injected intramuscularly into the calf muscles of the affected limb by 1.2 mg at intervals of 14 days twice. The effectiveness of the treatment was assessed both on the basis of subjective (pain-free walking distance – PFWD) and objective (VEGF-A (vascular endothelial growth factor A) in peripheral blood, BNIP3 (BCL2/adenovirus E1B 19 kDa protein-interacting protein 3, proapoptosis protein of the B-cell lymphoma 2 family (BCL2) in the biopsy of the calf muscle affected limb) criteria.
Results: after 6 months, no significant dynamics, both positive and negative, were observed in 1st group patients for any of the indicators. Patients of the 2nd group had a significant increase in PFWD, an increase in VEGF-A in peripheral blood flowing directly from ischemic muscles, and a decrease in BNIP3 levels, especially in patients with intermittent claudication, corresponding to the II stage of ischemia according to the Fontaine-Pokrovsky classification.
Conclusion: the results of the study have shown that gene therapy should be recommended as part of a conservative treatment regimen for CLLI, primarily in patients with IIA and IIB ischemia. In addition, it is worth emphasizing the importance of using objective evaluation criteria (determination of the endothelial growth factor VEGF-A in peripheral blood, determination of the proapoptosis protein BNIP3 of the BCL2 family): it is the introduction of histochemical and biochemical criteria that can make the next step towards the creation of a «golden standard» of conservative treatment of CLLI.
Keywords: chronic ischemia of the lower limbs, morphological criteria, biochemical criteria, apoptosis, VEGF-A, BNIP3, gene therapy, therapeutic angiogenesis.
For citation: Shabunin A.V., Kuznetsov M.R., Matveev D.V. et al. Comprehensive assessment of the effectiveness of gene therapy in patients with chronic ischemia of the lower limbs. RMJ. 2019;2:21–25.
Статья посвящена оценке эффективности консервативного лечения пациентов с хронической ишемией нижних конечностей с использованием генно-инженерной терапии.
Введение
Одной из самых часто встречаемых сердечно-сосудистых патологий в популяции являются хронические облитерирующие заболевания артерий нижних конечностей, вызывающие развитие хронической ишемии.Заболевания периферических артерий составляют 3–4% от числа всех хирургических заболеваний. Распространенность перемежающейся хромоты в зависимости от возраста варьируется от 0,9 до 7,0% с увеличением в старших возрастных группах (1–5% у лиц моложе 50 лет, 10–14% — среди людей 50–70 лет) [1]. Хирургические методы лечения хронических облитерирующих заболеваний артерий нижних конечностей продолжают стремительно развиваться, постоянно увеличивается доля рентгенэндоваскулярных вмешательств. Говоря же о консервативном лечении, достоверных выводов о пользе тех или иных фармакологических препаратов сделать нельзя. Очевидными столпами консервативного лечения остаются лечебная физическая культура и корректировка факторов риска, но что касается препаратов, чье действие направлено непосредственно на лечение перемежающейся хромоты, то имеющиеся исследования не свидетельствуют о пользе какого-либо из них [2]. Главная причина этого — отсутствие объективных критериев, на основании которых можно было бы сравнивать существующие схемы консервативного лечения. Проводились исследования, которые оценивали морфологические изменения в структуре мышц пораженной конечности, однако значительных различий между контрольной группой и группой консервативного лечения получено не было [3]. Также существуют исследования, которые оценивали функции нервов [4], изменения в метаболизме АДФ, фосфокреатинина [5] в биоптате пораженной конечности, но и при оценке этих факторов не было получено каких-либо значимых различий между контрольной и исследуемой группами.
Действие большинства препаратов для лечения перемежающейся хромоты, используемых в актуальных схемах, направлено на корректировку симптомов, не на этиологию и патогенез заболевания. Одним из немногих методов, которые оказывают влияние на патогенез развития хронической ишемии нижних конечностей, являются генно-терапевтические технологии. Стимуляцию ангиогенеза на генетическом уровне можно считать перспективным направлением развития терапии некоторых заболеваний, в частности перемежающейся хромоты. К настоящему моменту существуют исследования использования различных факторов роста для лечения:
фактор роста эндотелия (VEGF, изоформы: VEGF-A до -E) [6, 7];
факторы роста плаценты (PLGF, изоформы: PLGF-1 и -2);
факторы роста фибробластов (FGF, изоформы:
23 от FGF-1 до FGF-23) [8];
факторы роста гепатоцитов (HGF, изоформы HGF/NK1 и HGF/NK2) [9];
факторы роста, полученные из тромбоцитов (PDGF, изоформы: PDGF-AA, -AB, -BB, -CC и -DD);
ангиопротеин (Ang, изоформы: Ang-1, -2, -3, и -4);
эритропоэтин (EPO).
При ишемии конечностей препараты на основе гена VEGF 165 лидируют как по критериям безопасности, так и по эффективности, поскольку эта изоформа VEGF-А, состоящая из 165 аминокислот, обладает наибольшим митотическим эффектом по сравнению с остальными изоформами. Наиболее безопасной стратегией переноса нужного гена в клетки-мишени является использование невирусных систем, в частности плазмид. Плазмиды — экстрахромосомные кольцевые двуцепочечные молекулы ДНК, обнаруживаемые в клетках бактерий и давно ставшие одним из самых распространенных инструментов генной инженерии. При любом способе введения отмечается экспрессия трансгена в мышечных волокнах ишемизированной ткани, локальное повышение концентрации продуцируемого белка, в частности VEGF, и улучшение перфузии тканей за счет развития новых капилляров.
Первым зарегистрированным в РФ генно-терапевтическим препаратом на основе плазмиды является Неоваскулген (РУ № ЛП-000671 от 28.09.2011). Он представляет собой высокоочищенную сверхскрученную форму плазмиды pCMV–VEGF165, кодирующую эндотелиальный фактор роста сосудов (VEGF — vascular endothelial growth factor) под контролем промотора (управляющего участка ДНК). Препарат рекомендуется вводить внутримышечно в среднюю или нижнюю треть задней поверхности икроножной мышцы [6]. Имеются исследования, которые говорят о положительном влиянии данного препарата на субъективные показатели оценки, такие как максимально проходимая дистанция [6] в ближайшем (3 мес.) и отдаленном периоде (до 5 лет) [10].
Целью настоящей работы явилась оценка эффективности консервативного лечения пациентов с хронической ишемией нижних конечностей (ХИНК) с использованием генно-инженерной терапии (препарат Неоваскулген) на основании комплекса как субъективных, так и объективных критериев. Из объективных критериев использовались гистохимические (определение BNIP3 — BCL2/adenovirus E1B 19 kDa protein-interacting protein 3, проапоптозный белок семейства B-клеточных лимфом 2 (BCL2) в биоптате икроножной мышцы пораженной конечности) и биохимические (определение фактора роста эндотелия (VEGF-А) в периферической крови, непосредственно оттекающей от ишемизированных мышц).
Фактор роста эндотелия VEGF-А представляет собой сигнальный белок, вырабатываемый клетками для стимулирования васкулогенеза (образование эмбриональной сосудистой системы) и ангиогенеза (рост новых сосудов в уже существующей сосудистой системе).
Определение маркеров апоптоза (BNIP3) в биоптате икроножной мышцы пациентов позволяет оценить морфологические и гистологические изменения в пораженной конечности. Выраженность апоптоза используют для оценки уровня ишемии органов: так, например, существуют исследования, четко указывающие, что апоптоз кардиомиоцитов играет наиважнейшую роль в прогрессировании ишемической болезни сердца и острого инфаркта миокарда [11].
В нашей ранее опубликованной работе представлены данные, указывающие на прямую зависимость между степенью ишемии конечности и экспрессией BNIP3 с достижением максимальных значений на IIБ стадии заболевания по классификации Покровского — Фонтейна, когда максимально активизируется программируемая смерть клетки [12].
Материал и методы
В исследование были включены 49 пациентов с различными стадиями ХИНК в соответствии с классификацией Покровского — Фонтейна. Пациенты были разделены на 2 группы, в каждой из групп были пациенты с I, II, III и IV стадиями ишемии (табл. 1). Несмотря на то, что основной целевой группой лечения генно-терапевтическими препаратами являются пациенты с перемежающейся хромотой, соответствующей II стадии ишемии по классификации Покровского — Фонтейна, в исследование также включались пациенты с начальными изменениями и с критической ишемией. Пациенты с I стадией ишемии не требуют специфического лечения хронической артериальной недостаточности, но их включение в исследование было необходимо для оценки степени выраженности изменений, происходящих в ишемизированных тканях на гистохимическом уровне на каждом из этапов развития основного заболевания. По этой же причине в исследовании принимали участие пациенты с ишемией, угрожающей жизнеспособности конечности, соответствующей III и IV стадиями ишемии по классификации Покровского — Фонтейна. Группа 1 получала терапию в соответствии с Национальными рекомендациями по ведению пациентов с заболеваниями артерий нижних конечностей, которая включала: антитромбоцитарную (ацетилсалициловая кислота 100 мг), липидоснижающую (аторвастатин 10 мг), гипотензивную (бисопролол 2,5 мг) терапию. Терапия пациентов группы 2 была дополнена препаратом Неоваскулген, который вводился внутримышечно в ишемизированную зону икроножной мышцы двукратно по 1,2 мг с интервалом в 14 дней. Группы были сопоставимы по полу, возрасту, сопутствующей патологии и уровню поражения сосудистого русла (см. табл. 1).
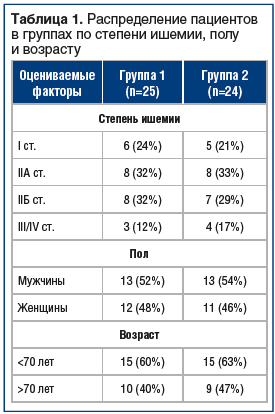
Период наблюдения за пациентами составил 6 мес. Перед началом исследования пациентам выполнялись как лабораторные (общий анализ крови, биохимический анализ крови, коагулограмма, общий анализ мочи), так и инструментальные (цветное дуплексное сканирование (ЦДС) артерий нижних конечностей, определение лодыжечно-плечевого индекса (ЛПИ)) исследования. Для оценки эффективности проводимого лечения использовались как субъективные (оценка дистанции безболевой ходьбы (ДБХ)), так и объективные критерии оценки (определение фактора роста эндотелия (VEGF-А) в периферической крови, непосредственно оттекающей от ишемизированных мышц, определение BNIP3 в биоптате икроножной мышцы пораженной конечности). ДБХ оценивалась по данным тредмил-теста (скорость беговой дорожки 3 км/ч, угол наклона 10%). Фактор роста эндотелия определялся в венозной крови, взятой из v. marginalis lateralis на стопе пораженной конечности. Кровь для оценки местных изменений в конечности необходимо забирать именно из вен пораженной конечности в непосредственной близости от ишемизированных тканей, т. к. венозная кровь в различных участках организма существенно различается по общим показателям (таким как парциальное давление кислорода и углекислого газа), из чего можно сделать вывод, что и показатели ангиогенеза в разных зонах также отличаются. Биоптат икроножной мышцы был получен посредством пистолетной автоматической биопсии (использовался пистолет Sterylab Colt) икроножной мышцы на границе верхней и средней трети голени пораженной конечности [13]. Забор материала для биопсии необходим именно на этом уровне, т. к. пациенты в исследовании страдали «низкой» перемежаюшейся хромотой, проявлявшейся болями непосредственно в икроножных мышцах. Уровень VEGF-А в сыворотке крови оценивался с помощью иммуноферментного анализа с использованием реактивов RandD (США).
Биопсия выполнялась в 1-й день исследования и через 6 мес. после начала. Материал фиксировался в двух различных средах: первая часть — в 10% растворе формалина, вторая часть — в фосфатном буфере с добавлением 2,5% раствора глутарового альдегида. Световая микроскопия полученного препарата проводилась с помощью микроскопа LeicaDM 2500. Окраска препаратов проводилась гематоксилином и эозином. Для иммуногистохимического исследования использовались ткани, фиксированные в растворе формалина. Исследование проводилось на срезах толщиной 4–5 мкм на покрытых поли-L-лизином предметных стеклах. Использовали первичные поликлональные антитела к BNIP3 фирмы Santa Kruz Biotechnology (США) и набор реактивов для пероксидазной реакции UniversalLSAB2 DAKO (США). Результат оценивался следующим образом: 0 — реакция отсутствует, 1 — малое количество вступивших в реакцию клеток, 2 — умеренное количество, 3 — значительное количество.
Результаты исследования
Основными критериями оценки эффективности проводимого лечения были показатели ДБХ, определение VEGF-A в периферической крови, непосредственно оттекающей от ишемизированных мышц, и определение BNIP3 в биоптате икроножной мышцы пораженной конечности посредством электронной микроскопии. В группе 1 были зафиксированы неудовлетворительные результаты — какого-либо значимого изменения вышеуказанных показателей у пациентов отмечено не было.В группе 2 была зафиксирована динамика по всем показателям: отмечено увеличение ДБХ, повышение VEGF-A, а также достоверное уменьшение уровня BNIP3 (табл. 2, 3).
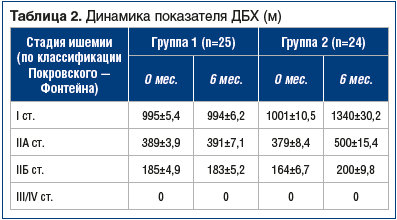
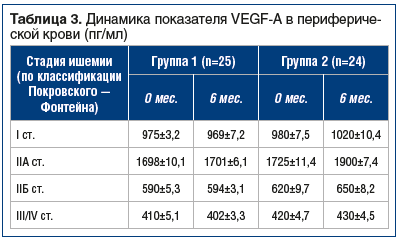
Обращает на себя внимание высокий как начальный, так и через 6 мес. уровень VEGF у пациентов со IIА стадией по сравнению с таковым во всех других группах. Это объясняется тем, что IIА стадия является своего рода пограничной линией, когда компенсаторные механизмы задействованы максимально, в дальнейшем при прогрессировании заболевания сопротивление организма заболеванию снижается [13].
Наилучшие результаты были получены у пациентов с начальными стадиями заболевания (стадии I и II по классификации Покровского — Фонтейна).
Обсуждение
В организме человека, как здорового, так и больного, процессы ангиогенеза и апоптоза идут постоянно, но при поражении артериального русла конечности с развитием хронической артериальной недостаточности в дальнейшем эти процессы меняют степень своей интенсивности. По результатам нашего исследования видно, что IIА стадия является пограничной степенью ишемии, когда морфофункциональные нарушения еще носят обратимый характер, поэтому именно в это время у пациентов максимально выражен ангиогенез. С прогрессированием заболевания морфологические и функциональные изменения становятся постоянными, поэтому компенсаторные возможности организма снижаются.Как в группе 1, так и группе 2 не было отмечено значимых побочных реакций, которые можно было бы ассоциировать с проводимым лечением. В результате исследования была отмечена положительная внутригрупповая динамика относительно исходных субъективных (ДБХ) и объективных (VEGF в периферической крови и BNIP3 в биоптате икроножной мышцы) параметров для группы, которая получала генно-терапевтическое лечение, при этом лучшие результаты были получены для пациентов с начальными проявлениями заболевания и с перемежающейся хромотой. У пациентов с критической ишемией нельзя говорить о значимой динамике — ни отрицательной, ни положительной. У пациентов группы 1, получавших стандартное лечение, какой-либо значительной динамики исследуемых показателей зафиксировано не было.
Непосредственное лечение перемежающейся хромоты (генно-терапевтические препараты, ингибиторы фосфодиэстеразы, антигипоксические препараты) позволяет пациентам на протяжении определенного времени избегать развития критической ишемии. Большинство препаратов для непосредственного лечения хромоты не оказывают влияния на этиологию заболевания. Поэтому пациентам с критической ишемией (соответствующей III и IV стадии по классификации Покровского — Фонтейна) следует рекомендовать лечение в специализированных ангиохирургических стационарах, где основным методом лечения следует выбирать оперативное (открытое или рентгенэндоваскулярное). Говоря о консервативном лечении ишемии, угрожающей жизнеспособности конечности, следует отдавать предпочтение другим группам препаратов, в частности простагландинам.
Заключение
В нашем исследовании генетическая терапия препаратом Неоваскулген показала положительные результаты, и генно-терапевтическое лечение можно расценивать как одну из главных современных возможностей консервативного лечения пациентов с ХИНК, в частности с перемежающейся хромотой. Для включения данного препарата в «золотой стандарт» медикаментозного лечения ХИНК необходимо большее количество рандомизированных исследований, а также постоянное использование объективных критериев оценки качества проводимого консервативного лечения: биохимических (показатель уровня VEGF в периферической крови) и морфологических (показатель маркеров апоптоза (BNIP3) в биоптате икроножной мышцы пораженной конечности).
Литература
1. Patel S.K., Surowiec S.M. Intermittent Claudication. Treasure Island (FL): StatPearls. (Электронный ресурс). URL: https://www.ncbi.nlm.nih.gov/books/NBK430778/ Дата обращения: 14.03.2019.
2. Aboyans V., Ricco J.B., Marie-Louise E.L. et al. 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS). Eur Heart J. 2018;39(9):763–816. DOI: 10.1093/eurheartj/ehx095.
3. Harwood A.E., King S., Totty J. et al. A systematic review of muscle morphology and function in intermittent claudication. J Vasc Surg. 2017;66(4):1241–1257.
4. Garg P.K., Liu K., Ferrucci L. et al. Lower extremity nerve function, calf skeletal muscle characteristics, and functional performance in peripheral arterial disease. J Am Geriatr Soc. 2011;59:1855–1863.
5. Anderson J.D., Epstein F.H., Meyer C.H. et al. Multifactorial determinants of functional capacity in peripheral arterial disease: uncoupling of calf muscle perfusion and metabolism. J Am Coll Cardiol. 2009;54:628–635.
6. Deev R., Bozo I., Mzhavanadze N. et al. pCMV-vegf165 intramuscular gene transfer is an effective method of treatment for patients with chronic lower limb ischemia. Journal of Cardiovascular Pharmacology and Therapeutics. 2015;20(5):473–482.
7. Rajagopalan S., Mohler E., Lederman R.J. et al. Regional angiogenesis with vascular endothelial growth factor (VEGF) in peripheral arterial disease: design of the RAVE trial. American Heart Journal. 2003;145(6):1114–1118.
8. Nikol S., Baumgartner I., van Belle E. et al. Therapeutic angiogenesis with intramuscular NV1FGF improves amputation-free survival in patients with critical limb ischemia. Molecular Therapy. 2008;16(5):972–978.
9. Kibbe M.R., Hirsch A.T., Mendelsohn F.O. et al. Safety and efficacy of plasmid DNA expressing two isoforms of hepatocyte growth factor in patients with critical limb ischemia. Gene Therapy. 2016; 23:306–312.
10. Червяков Ю.В., Староверов И.Н., Власенко О.Н. и др. Пятилетние результаты лечения больных хронической ишемией нижних конечностей с использованием генной терапии. Ангиология и сосудистая хирургия. 2016;22(4):38–43. [Chervyakov Y.V., Staroverov I.N., Vlasenko O.N. et al. Five-year results of treating patients with chronic lower limb ischaemia by means of gene engineering. Angiol Sosud Khir. 2016;22(4):38–43 (in Russ.)].
11. Kitsis R.N., Mann D.L. Apoptosis and the heart: a decade of progress. J Mol Cell Cardiol. 2005;38:1–2.
12. Кузнецов М.Р., Черников В.П., Тепляков С.А., Габиева М.Г. Клинико-морфологические параллели различных степеней хронической артериальной недостаточности нижних конечностей. Ангиология и сосудистая хирургия. 2010;16(3):152–157. [Kuznetsov M.R., Chernikov V.P., Teplyakov S.A., Gabieva M.G. Clinical and morphological parallels of different stages of chronic lower limb ischemia. Angiol Sosud Khir. 2010;16(3):152–157 (in Russ.)].
13. Кузнецов М.Р., Черников В.П., Болдин Б.В. и др. Экспрессия фактора роста эндотелия сосудов VEGF в скелетных мышцах при хронической артериальной недостаточности нижних конечностей. Ангиология и сосудистая хирургия. 2010;16(4):224–225 [Kuznetsov M.R., Chernikov V.P., Boldin B.V. et al. Endothelial growth factor VEGF expression in sceletal muscules during chronic lower limb ischemia. Angiol Sosud Khir. 2010;16(4):224–225 (in Russ.)].
2. Aboyans V., Ricco J.B., Marie-Louise E.L. et al. 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS). Eur Heart J. 2018;39(9):763–816. DOI: 10.1093/eurheartj/ehx095.
3. Harwood A.E., King S., Totty J. et al. A systematic review of muscle morphology and function in intermittent claudication. J Vasc Surg. 2017;66(4):1241–1257.
4. Garg P.K., Liu K., Ferrucci L. et al. Lower extremity nerve function, calf skeletal muscle characteristics, and functional performance in peripheral arterial disease. J Am Geriatr Soc. 2011;59:1855–1863.
5. Anderson J.D., Epstein F.H., Meyer C.H. et al. Multifactorial determinants of functional capacity in peripheral arterial disease: uncoupling of calf muscle perfusion and metabolism. J Am Coll Cardiol. 2009;54:628–635.
6. Deev R., Bozo I., Mzhavanadze N. et al. pCMV-vegf165 intramuscular gene transfer is an effective method of treatment for patients with chronic lower limb ischemia. Journal of Cardiovascular Pharmacology and Therapeutics. 2015;20(5):473–482.
7. Rajagopalan S., Mohler E., Lederman R.J. et al. Regional angiogenesis with vascular endothelial growth factor (VEGF) in peripheral arterial disease: design of the RAVE trial. American Heart Journal. 2003;145(6):1114–1118.
8. Nikol S., Baumgartner I., van Belle E. et al. Therapeutic angiogenesis with intramuscular NV1FGF improves amputation-free survival in patients with critical limb ischemia. Molecular Therapy. 2008;16(5):972–978.
9. Kibbe M.R., Hirsch A.T., Mendelsohn F.O. et al. Safety and efficacy of plasmid DNA expressing two isoforms of hepatocyte growth factor in patients with critical limb ischemia. Gene Therapy. 2016; 23:306–312.
10. Червяков Ю.В., Староверов И.Н., Власенко О.Н. и др. Пятилетние результаты лечения больных хронической ишемией нижних конечностей с использованием генной терапии. Ангиология и сосудистая хирургия. 2016;22(4):38–43. [Chervyakov Y.V., Staroverov I.N., Vlasenko O.N. et al. Five-year results of treating patients with chronic lower limb ischaemia by means of gene engineering. Angiol Sosud Khir. 2016;22(4):38–43 (in Russ.)].
11. Kitsis R.N., Mann D.L. Apoptosis and the heart: a decade of progress. J Mol Cell Cardiol. 2005;38:1–2.
12. Кузнецов М.Р., Черников В.П., Тепляков С.А., Габиева М.Г. Клинико-морфологические параллели различных степеней хронической артериальной недостаточности нижних конечностей. Ангиология и сосудистая хирургия. 2010;16(3):152–157. [Kuznetsov M.R., Chernikov V.P., Teplyakov S.A., Gabieva M.G. Clinical and morphological parallels of different stages of chronic lower limb ischemia. Angiol Sosud Khir. 2010;16(3):152–157 (in Russ.)].
13. Кузнецов М.Р., Черников В.П., Болдин Б.В. и др. Экспрессия фактора роста эндотелия сосудов VEGF в скелетных мышцах при хронической артериальной недостаточности нижних конечностей. Ангиология и сосудистая хирургия. 2010;16(4):224–225 [Kuznetsov M.R., Chernikov V.P., Boldin B.V. et al. Endothelial growth factor VEGF expression in sceletal muscules during chronic lower limb ischemia. Angiol Sosud Khir. 2010;16(4):224–225 (in Russ.)].

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
