Клинико-иммунологические характеристики тяжелой бронхиальной астмы с сенсибилизацией к грибам рода Aspergillus
Цель исследования: оценить клинико-иммунологические характеристики больных тяжелой бронхиальной астмой (БА) с сенсибилизацией к Aspergillus и изучить возможности применения теста активации базофилов с использованием проточной цитометрии для выявления микогенной сенсибилизации.
Материал и методы: проведено обследование 93 больных тяжелой БА. Объем терапии соответствовал 4-й или 5-й ступени по GINA 2019. Содержание TARC (thymus and activation regulated chemokine, тимус-ассоциированный регуляторный хемокин), количество эозинофилов, уровни общего IgE и специфических IgE к 10 аллергенам определяли в сыворотке крови иммуноферментным методом. Выполнили тест активации базофилов с аллергеном Aspergillus fumigatus в условиях in vitro с использованием проточной цитометрии.
Результаты исследования: сенсибилизацию к Aspergillus выявили у 33 (35,4%) больных тяжелой БА. У больных БА с сенсибилизацией к Aspergillus течение заболевания было неконтролируемое, пациенты в этой группе достоверно чаще получали пероральные глюкокортикостероиды. Количество базофилов, активированных аллергеном A. fumigatus, и индекс стимуляции у больных БА с сенсибилизацией к Aspergillus были достоверно выше по сравнению с показателями больных БА (9,9 (6,0–24,0) % против 3,6 (2,0–5,4) % (p=0,000); 4,25 (2,49–9,30) против 0,94 (0,75–1,16) (p=0,000)). Получены значимые различия содержания TARC в группах больных тяжелой БА с сенсибилизацией к Aspergillus и больных БА (625,0 (418,4–875,0) пг/мг против 406,0 (210,0–561,0) пг/мг (p=0,001)). Выявлена отрицательная корреляционная связь между уровнями TARC и уменьшением объема форсированного выдоха за 1-ю секунду (ОФВ1) (r =-0,70, p<0,05) и положительная корреляционная связь с абсолютным числом эозинофилов (r=0,81, p<0,05), уровнем специфических IgE к Aspergillus (r=0,36, p<0,05).
Заключение: сенсибилизация к Aspergillus ассоциирована с неконтролируемым течением БА. Дополнительным методом диагностики микогенной сенсибилизации является тест активации базофилов. Концентрация TARC может служить в качестве биомаркера активной воспалительной реакции.
Ключевые слова: Aspergillus spp., тяжелая бронхиальная астма, микогенная сенсибилизация, тест активации базофилов, TARC.
Для цитирования: Козлова Я.И., Фролова Е.В., Учеваткина А.Е., Филиппова Л.В., Аак О.В., Кузнецов В.Д., Васильева Н.В., Климко Н.Н. Клинико-иммунологические характеристики тяжелой бронхиальной астмы с сенсибилизацией к грибам рода Aspergillus. РМЖ. Медицинское обозрение. 2021;5(1):10-16. DOI: 10.32364/2587-6821-2021-5-1-10-16.
Ya.I. Kozlova1, E.V. Frolova2, A.E. Uchevatkina2, L.V. Filippova2, O.V. Aak2,
V.D. Kuznetsov1, N.V. Vasilieva2, N.N. Klimko1
1I.I. Mechnikov North-Western State Medical University, Saint Petersburg,
Russian Federation
2P.N. Kashkin Research Institute of Medical Mycology, I.I. Mechnikov North-Western
State Medical University, Saint Petersburg, Russian Federation
Aim: to assess the clinical and immunological characteristics of patients with severe bronchial asthma (BA) with Aspergillus sensitization and to study the possibilities of applying basophil activation test (BAT) using flow cytometry to detect mycogenic sensitization.
Patients and Methods: 93 patients with severe BA were examined. Therapy had 4 or 5 steps according to GINA 2019 recommendations. TARC (thymus and activation-regulated chemokine) content, the number of eosinophils, the levels of total IgE and specific IgE to 10 allergens were determined in blood serum by enzyme immunoassay. BAT with Aspergillus fumigatus allergen was performed in vitro using flow cytometry.
Results: Aspergillus sensitization was detected in 33 (35.4%) patients with severe BA. In patients with BA and Aspergillus sensitization, the disease course was uncontrolled, and patients in this group were credibly more likely to receive oral glucocorticosteroids. The number of basophils (activated by the A. fumigatus allergen) and the stimulation index in patients with BA and Aspergillus sensitization were significantly higher than in patients with BA (9.9 (6.0–24.0) % vs. 3.6 (2.0–5.4) %; (p=0.000) and 4.25 (2.49–9.30) vs. 0.94 (0.75–1.16); (p=0.000)). Significant differences in TARC content were obtained in the groups of patients with severe BA and Aspergillus sensitization and patients with BA (625.0 (418.4–875.0) pg/mg versus 406.0 (210.0–561.0) pg/mg; p=0.001). A negative correlation was determined between TARC levels and a decrease in forced expiratory volume in 1 second (FEV1) (r=-0.70, p<0.05), and between positive correlation and absolute eosinophil count (r=0.81, p<0.05) and level of specific IgE to Aspergillus (r=0.36, p<0.05).
Conclusion: Aspergillus sensitization is associated with an uncontrolled BA course. An additional method for diagnosing mycogenic sensitization is the BAT. The TARC concentration can serve as a biomarker of an active inflammatory response.
Keywords: Aspergillus spp., severe bronchial asthma, mycogenic sensitization, basophil activation test, TARC.
For citation: Kozlova Ya.I., Frolova E.V., Uchevatkina A.E. et al. Clinical and immunological characteristics of severe bronchial asthma with Aspergillus sensitization. Russian Medical Inquiry. 2021;5(1):10–16. DOI: 10.32364/2587-6821-2021-5-1-10-16.
Введение
Бронхиальная астма (БА) — хроническое воспалительное заболевание дыхательных путей, которое в настоящее время является глобальной медико-социальной проблемой. БА рассматривают как гетерогенное заболевание, которое имеет высокую распространенность и вариабельность течения [1, 2]. С учетом триггерного фактора, возраста дебюта, сопутствующих заболеваний выделяют различные клинические фенотипы БА [3]. Персонифицированный подход с учетом фенотипа заболевания очень важен для оптимизации терапии.
Несмотря на то, что аллергическая БА остается наиболее распространенным и изученным клиническим фенотипом БА, существует множество противоречивых моментов, особенно в отношении роли сенсибилизирующих аллергенов для определения тяжести и прогноза заболевания. Важное место среди известных источников аэроаллергенов занимают микроскопические грибы (микромицеты). Плесневые грибы распространены повсеместно, и поэтому микогенная сенсибилизация может быть выявлена у людей во всем мире. По данным различных исследований, распространенность гиперчувствительности к плесневым грибам составляет от 3% до 10% среди населения в целом. Описаны взаимосвязи между сенсибилизацией к микромицетам и развитием тяжелой, жизнеугрожающей БА. Согласно результатам ряда исследований сенсибилизация к одному или нескольким грибковым аллергенам ассоциирована с более низкой функцией легких, а также высокой частотой обострений и госпитализаций [4–6].
Для того чтобы подчеркнуть важную роль микроскопических грибов в патогенезе БА, в 2006 г. предложен термин «тяжелая БА с микогенной сенсибилизацией» (ТБАМС). Для ТБАМС характерно неконтролируемое течение заболевания с большим количеством обострений. При аллергологическом обследовании in vivo и/или in vitro определяют сенсибилизацию к антигенам микромицетов. Наиболее значимыми источниками грибковых аллергенов являются Alternaria spp. и Aspergillus spp. Кроме того, в отличие от больных аллергическим бронхолегочным аспергиллезом, при ТБАМС не выявляют бронхоэктазы и скопления слизи, а уровень общего IgE в сыворотке крови составляет менее 1000 МЕ/мл [7]. Таким образом, это группа больных, заболевание у которых недостаточно контролируется, несмотря на максимальные дозы ингаляционных глюкокортикостероидов (ГКС), они могут нуждаться в противогрибковой терапии [8]. Однако данные об истинной распространенности ТБАМС и результатах лечения противоречивы.
Исследования, посвященные грибковой сенсибилизации при БА, неоднородны и на сегодняшний день включают данные о пациентах с заболеванием разной степени тяжести, в то время как особый интерес представляют именно больные тяжелой БА, рефрактерные к традиционной терапии. Для того чтобы снизить частоту обострений и добиться лучшего контроля над заболеванием, необходима дальнейшая характеристика фенотипа ТБАМС и разработка альтернативных вариантов терапии.
Цель исследования — оценить клинико-иммунологические характеристики больных тяжелой БА с сенсибилизацией к Aspergillus и изучить возможности применения теста активации базофилов с использованием проточной цитометрии для выявления микогенной сенсибилизации.
Материал и методы
В исследование включили 93 взрослых больных тяжелой БА. Все больные получали лечение, которое соответствовало 4-й или 5-й ступени по GINA (Global Initiative for Asthma — Глобальная инициатива по бронхиальной астме) [1].
Согласно международным критериям неконтролируемую БА определяли по наличию по крайней мере одного из следующих признаков [9]:
плохой контроль симптомов БА: Asthma Control Questionnaire ≥1,5; Asthma Control Test (ACT) <20;
частые, тяжелые обострения БА: 2 курса системных ГКС и более (продолжительностью более 3 дней каждый) в предыдущий год;
серьезные обострения: по крайней мере 1 госпитализация, пребывание в отделении интенсивной терапии или механическая вентиляция легких в предыдущий год;
ограничение бронхиальной проходимости: объем форсированного выдоха за 1-ю секунду (ОФВ1) <80% должного (в условиях редуцированного ОФВ1/ФЖЕЛ, определяемого как уровень меньше нижней границы нормальных значений) при соблюдении рекомендации относительно соответствующего перерыва после бронходилататоров.
Всем больным, включенным в исследование, методом иммуноферментного анализа определяли уровень общего IgE (ООО «Полигност», Россия) и специфических IgE (sIgE) к 10 аллергенам в сыворотке крови. Использовали панель биотинилированных аллергенов «Алкор Био» (Россия). Критерием микогенной сенсибилизации считали повышение уровня sIgE к грибковому аллергену в сыворотке крови выше ≥0,35 ME/мл [10].
Определение концентрации TARC (thymus and activation regulated chemokine, тимус-ассоциированный регуляторный хемокин) в сыворотке крови осуществляли с помощью иммуноферментных тест-систем (R&D Systems, США), концентрация аналита была рассчитана по стандартным кривым и выражена в пг/мл.
Для выполнения теста активации базофилов к образцам крови добавляли моноклональные антитела CD203c-РЕ, CD3-PC7, CRTH2-FITC, входящие в состав набора Allerginicity kit (Beckman Coulter, США). Пробу крови каждого субъекта инкубировали в течение 15 мин при 37 °C в темноте: с буферным раствором — отрицательный контроль; с моноклональными антителами к IgE — положительный контроль; с аллергеном Aspergillus fumigatus — опытный образец. Затем проводили лизис эритроцитов. Подсчет не менее чем 500 базофилов проводили на проточном цитометре Navios (Beckman Coulter, США). Активированные базофилы идентифицировали как клетки с высокой экспрессией CD203c.
Для оценки выраженности и обратимости бронхиальной обструкции всем включенным в исследование пациентам выполняли спирометрию и пробу с бронхолитическим препаратом.
Для субъективной оценки уровня контроля БА использовали опросник АСТ, который больные заполняли ежедневно в течение последних 4 нед. АСТ содержит 5 вопросов с 5-балльной оценкой ответов, сумма 25 баллов означает полный контроль заболевания.
Полученные в процессе исследования данные обрабатывали с помощью программной системы Statistica 10. Данные представляли в виде медианы и нижнего и верхнего квартилей (Ме (Q0,25–Q0,75)). Сопоставление частотных характеристик качественных показателей проводили с помощью непараметрических методов χ2 Пирсона с поправкой Йетса, двусторонний точный тест Фишера. Сравнение количественных параметров в исследуемых группах осуществляли с применением критериев Манна — Уитни. Корреляции были проверены с помощью теста Спирмена. Различия считали статистически значимыми при р<0,05.
Результаты исследования
В микологической клинике ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России обследованы 93 больных тяжелой БА. Медиана возраста составила 52 года (40–63), мужчин было 24, женщин — 69. Характеристики больных представлены в таблице 1.

Все пациенты для базисной терапии БА получали 2 и более препаратов. Из них 54 (58,0%) больных для контроля симптомов использовали 3 препарата, 8 (8,6%) — 4 и более.
Низкий балл при заполнении анкеты АСТ (<20 баллов) выявили у 65 больных. У 22 (23,7%) больных были серьезные обострения, которые потребовали ≥2 курсов системных ГКС в предыдущий год; у 16 (17,2%) больных была по крайней мере 1 госпитализация по поводу обострения БА в прошлом году, 41 (44,1%) больной имел ОФВ1<80% и ОФВ1/ФЖЕЛ <0,7 при тестировании функции легких. В целом у 65 (70%) пациентов был один или несколько из вышеперечисленных показателей неконтролируемой БА.
Микогенную сенсибилизацию к Aspergillus выявили у 33 больных БА, что составило 35,4% от общего числа обследованных. Уровень sIgE к Aspergillus варьировал от 0,35 МЕ/мл до 2,30 МЕ/мл.
На следующем этапе выделили группы больных тяжелой БА с сенсибилизацией к Aspergillus и без сенсибилизации к Aspergillus. Сравнили базовые характеристики у больных обследованных групп. Данные представлены в таблице 2.
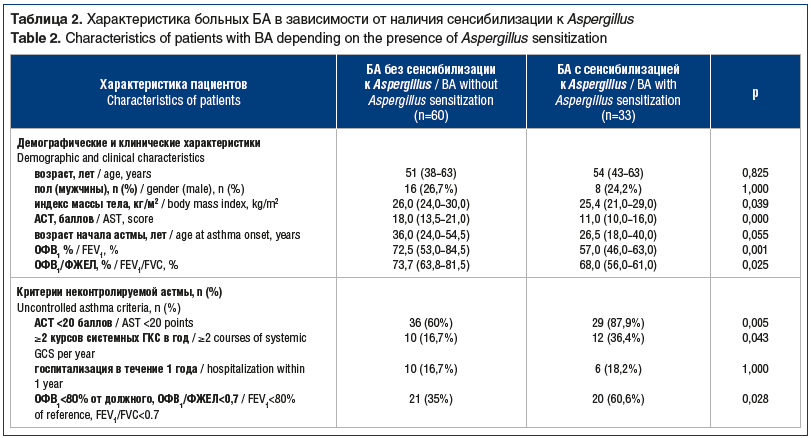
Группы не отличались между собой по полу и возрасту. Индекс массы тела у больных БА с сенсибилизацией к Aspergillus составил 25,4 (21,0–29,0) кг/м2 и был достоверно ниже, чем в группе сравнения (p=0,039).
При заполнении анкеты АСТ в группе больных с сенсибилизацией к Aspergillus зарегистрирован более низкий балл, который достоверно отличался от результатов больных БА без сенсибилизации к Aspergillus (11,0 (10,0–16,0) баллов против 18 (13,5–21,0) баллов; p=0,000). Кроме того, при исследовании функции внешнего дыхания больные БА с сенсибилизацией к Aspergillus демонстрировали достоверно более низкие показатели ОФВ1 (57,0 (46,0–63,0) % против 72,5 (53,0–84,5) %; p=0,001) и индекса Тиффно (68,0 (56,0–61,0) % против 73,7 (63,8–81,5) %; p=0,025).
Анализ критериев неконтролируемой БА выявил, что в группе БА с сенсибилизацией к Aspergillus преобладали больные, у которых был низкий балл (<20 баллов) при заполнении анкеты АСТ (87,9% против 60,0%; p=0,005), а также больные с худшими спирометрическими характеристиками (60,6% против 35,0%; p=0,028). Кроме того, в группе больных с микогенной сенсибилизацией для купирования тяжелых обострений чаще использовали курсы системных ГКС (36,4% против 16,7%; p=0,043). Между группами не установлено различий по частоте госпитализации в течение 1 года по поводу тяжелых обострений заболевания.
В целом у 28 (84,8%) больных с сенсибилизацией к Aspergillus был один или несколько показателей неконтролируемой БА по сравнению с 22 (36,0%) пациентами без сенсибилизации Aspergillus (p=0,001).
Кроме того, на следующем этапе для подтверждения IgE-опосредованного механизма гиперчувствительности к плесневым микромицетам провели дополнительное исследование. В настоящее время одним из наиболее перспективных направлений иммунодиагностики in vitro является проточная цитометрия. Больным тяжелой БА выполнили тест активации базофилов с аллергеном A. fumigatus с использованием метода проточной цитометрии.
Количество базофилов, активированных аллергеном A. fumigatus, у больных БА с сенсибилизацией к Aspergillus было 9,9 (6,0–24,0) %. Этот показатель достоверно отличался от значений в группе сравнения — 3,6 (2,0–5,4) %; p=0,000. В ходе исследования учитывали значение индекса стимуляции (ИС): отношение процента активированных базофилов в пробе с аллергеном к проценту их спонтанной активации в отрицательном контроле. ИС у больных БА с сенсибилизацией к Aspergillus составил 4,25 (2,49–9,30) и был достоверно выше, чем ИС больных БА, — 0,94 (0,75–1,16); p=0,000 (рис. 1).
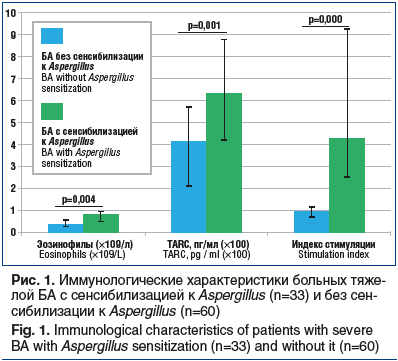
Известно, что вследствие продолжительной аллергенной стимуляции гуморального иммунного ответа у больных БА c микогенной сенсибилизацией содержание общего IgE в сыворотке крови может значительно повышаться. В ходе нашего исследования у больных БА с сенсибилизацией к Aspergillus установлено более высокое значение уровня общего IgE МЕ/мл по отношению к показателю группы сравнения (369,0 (40,0–804,0) МЕ/мл против 114,0 (10,0–565,0) МЕ/мл; p=0,122), но различия не были достоверны.
Абсолютное количество эозинофилов у больных БА с сенсибилизацией к Aspergillus было 0,78 (0,48–0,94) ×109/л. Эти показатели были достоверно выше по сравнению с показателями группы сравнения — 0,32 (0,23–0,53) ×109/л; p=0,004. При дальнейшем иммунологическом обследовании получены значимые различия содержания TARC в группе больных тяжелой БА с сенсибилизацией к Aspergillus и больных БА (625,0 (418,4–875,0) пг/мг против 406,0 (210,0–561,0) пг/мг; p=0,001).
Выявленные достоверные различия в иммунологических характеристиках больных тяжелой БА с сенсибилизацией к Aspergillus и без сенсибилизации к Aspergillus представлены на рисунке 1.
В ходе работы выявлена отрицательная корреляционная связь между уровнями TARC в сыворотке крови и снижением ОФВ1 (r=-0,70, p<0,05) и положительная корреляционная связь с абсолютным числом эозинофилов (r=0,81, p<0,05), уровнем sIgE к A. fumigatus (r=0,36, p<0,05). Полученные результаты свидетельствуют о важной патогенетической роли TARC в формировании ответа Т-хелперов 2 типа (Th2) у больных с микогенной сенсибилизацией и подтверждают взаимосвязь гиперчувствительности немедленного типа к грибам рода Aspergillus с тяжестью течения БА.
Обсуждение
Опубликованы данные, согласно которым частота микогенной сенсибилизации у больных БА варьирует в широких пределах. Результаты метаанализа 21 исследования свидетельствуют, что частота сенсибилизации к Aspergillus spp. у больных БА различной степени тяжести составляет около 28% [11].
Исследования, проведенные в группе тяжелой БА, немногочисленны. Результаты исследования в Северной Индии свидетельствуют о высокой частоте (50,9%) сенсибилизации к Aspergillus у пациентов с тяжелой БА. Однако эта работа включала только больных, поступивших в отделение интенсивной терапии, не учитывая другие критерии тяжелого течения заболевания [12].
В Великобритании получены данные о более высокой степени распространенности микогенной сенсибилизации. В исследовании O’Driscoll et al. 66% больных БА, которые находились на 4-й или 5-й ступени терапии по GINA, были сенсибилизированы к различным грибковым аллергенам [13].
В 2017 г. опубликованы результаты исследования J.G. Ken et al., проведенного в многоэтнической азиатской когорте больных тяжелой БА. Авторы проанализировали результаты кожных прик-тестов, на основании которых распространенность сенсибилизации к Asergillus составила 11,7%. Важно отметить, что именно сенсибилизация к Aspergillus, а не к другим аллергенам, была независимо связана с более низкими показателями функции внешнего дыхания и частыми обострениями БА [14].
Такие широкие расхождения в распространенности, вероятно, можно объяснить различными методологическими подходами. Британские исследователи применяли для диагностики как прик-тест, так и определение sIgE к различным грибам (Aspergillus, Candida, Alternaria) в сыворотке крови. Несмотря на это, распространенность сенсибилизации только к A. fumigatus составляла 45%. Также вероятно влияние генетических факторов и различий в окружающей среде. В азиатской когорте также были выявлены различия в частоте микогенной сенсибилизации среди разных этнических групп, хотя они не были статистически достоверны.
В проведенном исследовании частота сенсибилизации к Aspergillus у больных тяжелой БА составила 35,4%. Следует отметить, что наше исследование является одним из немногих, которые оценивают распространенность сенсибилизации к Aspergillus у больных тяжелой БА.
По мнению ряда экспертов, микогенная сенсибилизация ассоциирована с тяжелым, неконтролируемым течением БА. В исследовании R. Agarwal et al. описывают ассоциацию между сенсибилизацией к Aspergillus и низкими показателями функции внешнего дыхания у больных БА [15]. Кроме того, результаты ряда работ свидетельствуют о влиянии сенсибилизации к A. fumigatus на ухудшение функции легких и развитие бронхоэктазов у больных БА [16]. Также опубликованы данные о том, что сенсибилизация к A. fumigatus связана с более низкой функцией легких при некоторых хронических респираторных заболеваниях, включая муковисцидоз [17] и хроническую обструктивную болезнь легких [18].
Эти данные согласуются с полученными нами результатами. У обследованных больных выявлена взаимо-связь между сенсибилизацией к Aspergillus и неконтролируемым течением БА. У пациентов с сенсибилизацией к Aspergillus было зафиксировано большее количество обострений, требующих назначения пероральных ГКС, а также более выраженные обструктивные нарушения функции внешнего дыхания.
Известно, что диагностические грибковые аллергены для кожных проб в нашей стране, к сожалению, отсутствуют. Использование экстрактов плесневых грибов в определении sIgE может приводить как к ложноположительным результатам — из-за компонентов с перекрестной реактивностью, так и к ложноотрицательным результатам — из-за отсутствия мажорных белков в экстракте. Кроме того, выполнение провокационных исследований с плесневыми грибами связано с риском развития системных реакций. Поэтому поиск новых тестов для выявления микоаллергозов является актуальной задачей современной аллергологии.
Среди перспективных направлений лабораторной диагностики особое место занимает тест активации базофилов специфическими аллергенами с помощью проточной цитометрии. Проведение данного теста может быть рекомендовано как дополнение к традиционному подтверждению аллергических реакций 1-го типа, которое обычно включает определение sIgE в сыворотке крови и кожное тестирование.
По данным отечественных исследователей, применение теста активации базофилов возможно в диагностике инсектной, лекарственной аллергии, а также хронической крапивницы [19, 20]. Полученные в ходе нашей работы результаты свидетельствуют о том, что тест может быть использован в качестве дополнительного метода выявления сенсибилизации к плесневым грибам у больных БА.
Согласно современным представлениям тяжелая БА — это та астма, контроль которой может быть достигнут только на максимально высоком уровне терапии. В ряде случаев больные вынуждены принимать системные ГКС, что приводит к развитию большого количества побочных эффектов. Изучение роли различных иммунологических медиаторов в формировании хронического аллергического воспаления у больных тяжелой БА необходимо для определения оптимального терапевтического подхода и разработки новых иммунобиологических препаратов.
Распространено мнение, что патогенез тяжелой БА с микогенной сенсибилизацией связан с инициированием иммунного ответа при продолжительном или повторном воздействии грибковых спор [21]. Сходный патогенетический механизм описан у больных аллергическим бронхолегочным аспергиллезом (АБЛА), когда преобладает воспалительный ответ Th2 на антигены Aspergillus, колонизирующие дыхательные пути [22].
Известно, что TARC участвует в патогенезе аллергических заболеваний, привлекая Th2-клетки в очаг воспаления [23]. Важная роль TARC в возникновении гиперчувствительности немедленного типа к A. fumigates подтверждена на экспериментальных животных [24]. В клинических исследованиях показано, что TARC в отличие от других цитокинов и хемокинов является высокочувствительным и специфическим маркером АБЛА у больных муковисцидозом. Опубликованы результаты исследований, в которых высокие уровни TARC в сыворотке крови определяли у больных муковисцидозом еще до развития АБЛА. Повышение уровня этого хемокина было зафиксировано до нарастания уровня общего IgE. Авторы предложили использовать определение TARC для прогнозирования развития АБЛА у больных из групп риска [25, 26].
Концентрация TARC была достоверно выше у больных тяжелой БА с сенсибилизацией к Aspergillus, чем у больных тяжелой БА без сенсибилизации к Aspergillus. Полученные данные согласуются с нашей предыдущей работой, в которой концентрацию данного хемокина оценивали в группах больных АБЛА и БА с микогенной сенсибилизацией [27]. Таким образом, повышение содержания TARC у больных БА с сенсибилизацией к Aspergillus и его связь со степенью выраженности микогенной сенсибилизации и клиническими проявлениями заболевания позволяют рассматривать данный показатель в качестве биомаркера активной воспалительной реакции у этой категории больных.
В нашем исследовании среди пациентов с тяжелой БА была выделена группа больных с сенсибилизацией к грибам рода Aspergillus, у которых в дальнейшем для достижения контроля заболевания может быть рассмотрено применение антимикотической терапии и моноклональных антител.
Выводы
Частота сенсибилизации к Aspergillus больных тяжелой БА составила 35,4%.
Выявлена взаимосвязь между сенсибилизацией к Aspergillus и неконтролируемым течением БА. У больных тяжелой БА с сенсибилизацией к Aspergillus было зафиксировано большее количество обострений, требующих назначения системных ГКС, а также более выраженные обструктивные нарушения функции внешнего дыхания.
Перспективным методом лабораторной диагностики микогенной сенсибилизации у больных БА является тест активации базофилов с аллергенами A. fumigatus с использованием проточной цитометрии.
Концентрация TARC, повышенная в группе больных тяжелой БА с сенсибилизацией к Aspergillus, может использоваться в качестве биомаркера активной воспалительной реакции.
Сведения об авторах:
1Козлова Яна Игоревна — к.м.н., доцент, доцент кафедры клинической микологии, аллергологии и иммунологии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-4602-2438.
2Фролова Екатерина Васильевна — к.м.н., заведующая научно-исследовательской лаборатории иммунологии и аллергологии НИИ медицинской микологии им. П.Н. Кашкина, ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 194291, Россия, г. Санкт-Петербург, ул. Сантьяго-де-Куба, д. 1/28; ORCID iD 0000-0002-7696-2236.
2Учеваткина Александра Евгеньевна — к.м.н., старший научный сотрудник научно-исследовательской лаборатории иммунологии и аллергологии НИИ медицинской микологии им. П.Н. Кашкина, ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 194291, Россия, г. Санкт-Петербург, ул. Сантьяго-де-Куба, д. 1/28; ORCID iD 0000-0001-6688-7781.
2Филиппова Лариса Вячеславовна — к.м.н., старший научный сотрудник научно-исследовательской лаборатории иммунологии и аллергологии, НИИ медицинской микологии им. П.Н. Кашкина, ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 194291, Россия, г. Санкт-Петербург, ул. Сантьяго-де-Куба, д. 1/28; ORCID iD 0000-003-4167-7440.
2Аак Олег Владимирович — к.х.н., ведущий научный сотрудник научно-исследовательской лаборатории иммунологии и аллергологии, НИИ медицинской микологии им. П.Н. Кашкина, ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 194291, Россия, г. Санкт-Петербург, ул. Сантьяго-де-Куба, д. 1/28; ORCID iD 0000-0001-8130-7503.
1Кузнецов Валерий Дмитриевич — аспирант кафедры клинической микологии, аллергологии и иммунологии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0001-9439-4749.
2Васильева Наталья Всеволодовна — д.б.н., директор НИИ медицинской микологии им. П.Н. Кашкина; 194291, Россия, г. Санкт-Петербург, ул. Сантьяго-де-Куба, д. 1/28; ORCID iD 0000-0003-3693-5468.
1Климко Николай Николаевич — д.м.н., профессор, заведующий кафедрой клинической микологии, аллергологии и иммунологии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0001-6095-7531.
Контактная информация: Козлова Яна Игоревна, e-mail: kozlova510@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 06.04.2020, поступила после рецензирования 05.05.2020, принята в печать 28.05.2020.
About the authors:
1Yana I. Kozlova — Cand. of Sci. (Med.), Associate Professor, Associate Professor of the Department of Clinical Mycology, Allergology and Immunology, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0002-4602-2438.
2Ekaterina V. Frolova — Cand. of Sci. (Med.), Head of the Research Laboratory of Immunology and Allergology, P.N. Kashkin Research Institute of Medical Mycology, I.I. Mechnikov North-Western State Medical University; 1/28, Santiago-de-Cuba str., St. Petersburg, 194291, Russian Federation; ORCID iD 0000-0002-7696-2236.
2Alexandra E. Uchevatkina — Cand. of Sci. (Med.), Senior Researcher of the Research Laboratory of Immunology and Allergology, P.N. Kashkin Research Institute of Medical Mycology, I.I. Mechnikov North-Western State Medical University; 1/28, Santiago-de-Cuba str., St. Petersburg, 194291, Russian Federation; ORCID iD 0000-0001-6688-7781.
2Larisa V. Filippova — Cand. of Sci. (Med.), Senior Researcher of the Research Laboratory of Immunology and Allergology, P.N. Kashkin Research Institute of Medical Mycology, I.I. Mechnikov North-Western State Medical University; 1/28, Santiago-de-Cuba str., St. Petersburg, 194291, Russian Federation; ORCID iD 0000-003-4167-7440.
2Oleg V. Aak — Cand. of Sci. (Chemistry), Senior Researcher of the Research Laboratory of Immunology and Allergology, P.N. Kashkin Research Institute of Medical Mycology, I.I. Mechnikov North-Western State Medical University; 1/28, Santiago-de-Cuba str., St. Petersburg, 194291, Russian Federation; ORCID iD 0000-0001-8130-7503.
1Valery D. Kuznetsov — post-graduate student of the Department of Clinical Mycology, Allergology and Immunology, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0001-9439-4749.
2Natalia V. Vasileva — Dr. of Sci. (Biology), Director of the P.N. Kashkin Research Institute of Medical Mycology; 1/28, Santiago-de-Cuba str, St. Petersburg, 194291, Russia; ORCID iD 0000-0003-3693-5468.
1Nikolay N. Klimko — Dr. of Sci (Med.), Professor, Head of the Department of Clinical Mycology, Allergology and Immunology, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0001-6095-7531.
Contact information: Yana Kozlova, e-mail: kozlova510@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 06.04.2020, revised 05.05.2020, accepted 28.05.2020.
2. Murray C.J., Vos T., Lozano R. et al. Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21 regions, 1990–2010: a systematic analysis for the global burden of disease study 2010. Lancet. 2012;380:2197–2223. DOI: 10.1016/S0140-6736 (12) 61689-4.
3. Wenzel S. Asthma: defining of the persistent adult phenotypes. Lancet. 2006;368:804–813. DOI: 10.1016/S0140-6736 (06) 69290-8.
4. Bush R.K., Portnoy J.M., Saxon A. et al. The medical effects of mold exposure. J. Allergy Clin. Immunol. 2006;117:326–333. DOI: 10.1016/j.jaci.2005.12.001.
5. Knutsen A.P., Bush R.K., Demain J.G. et al. Fungi and allergic lower respiratory tract diseases. J. Allergy Clin. Immunol. 2012;129:280–291. DOI: 10.1016/j.jaci.2011.12.970.
6. Fairs A., Agbetile J., Hargadon B. et al. IgE sensitization to Aspergillus fumigatus is associated with reduced lung function in asthma. Am. J. Respir. Crit Care Med. 2010;182:1362–1368. DOI: 10.1164/rccm.201001-0087OC.
7. Denning D.W., Pashley C., Hartl D. et al. Fungal allergy in asthma–state of the art and research needs. Clin Transl Allergy. 2014;4:14. DOI: 10.1186/2045-7022-4-14.
8. Denning D.W., O’Driscoll B.R., Powell G. et al. Randomized controlled trial of oral antifungal treatment for severe asthma with fungal sensitization: The Fungal Asthma Sensitization Trial (FAST) study. Am. J. Respir. Crit Care Med. 2009;179:11–18. DOI: 10.1164/rccm.200805-737OC.
9. Chung K.P. et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur. Respir. J. 2014;43:343–373.
10. Agarwal R., Chakrabarti A., Shah D. et al. For the ABPA complicating asthma ISHAM working group 2013. Allergic bronchopulmonary aspergillosis: review of literature and proposal of new diagnostic and classification criteria. Clin Exp Allergy. 2013;43:850–873. DOI: 10.1111/cea.12141.
11. Agarwal R., Aggarwal A.N., Gupta D., Jindal S.K. Aspergillus hypersensitivity and allergic bronchopulmonary aspergillosis in patients with bronchial asthma: Systematic review and meta-analysis. Int. J. Tuberc. Lung Dis. 2009;13:936–944.
12. Agarwal R., Nath A., Aggarwal A.N. et al. Aspergillus hypersensitivity and allergic bronchopulmonary aspergillosis in patients with acute severe asthma in a respiratory intensive care unit in North India. Mycoses. 2010;53:138–143. DOI: 10.1111/j.1439-0507.2008.01680.x.
13. O’Driscoll B.R., Powell G., Chew F. et al. Comparison of skin prick tests with specific serum immunoglobulin e in the diagnosis of fungal sensitization in patients with severe asthma. Clin. Exp. Allergy. 2009;39:1677–1683. DOI: 10.1111/j.1365-2222.2009.03339.x.
14. Goh K.J., Yii A.C.A., Lapperreet T.S. et al. Sensitization to Aspergillus species is associated with frequent exacerbations in severe asthma. J Asthma Allergy. 2017;10:131–140. DOI: 10.2147/JAA.S130459.
15. Agarwal R., Noel V., Aggarwal A.N. et al. Clinical significance of Aspergillus sensitisation in bronchial asthma. Mycoses. 2011;54:531–539. DOI: 10.1111/j.1439-0507.2010.01971.x.
16. Menzies D., Holmes L., McCumesky G. et al. Aspergillus sensitization is associated with airflow limitation and bronchiectasis in severe asthma. Allergy Eur. J. Allergy Clin. Immunol. 2011;66:679–685. DOI: 10.1111/j.1398-9995.2010.02542.x.
17. Moss R.B. Allergic bronchopulmonary aspergillosis and Aspergillus infection in cystic fibrosis. Curr. Opin. Pulm. Med. 2010;16:598–603. DOI: 10.1097/MCP.0b013e32833e24a6.
18. Bafadhel M., McKenna S., Agbetile J. et al. Aspergillus fumigatus during stable state and exacerbations of COPD. Eur. Respir. J. 2014;43:64–71. DOI: 10.1183/09031936.00162912.
19. Шабанов Д.В., Лазаренко Л.Л., Федоскова Т.Г., Рыбникова Е.А. Особенности диагностики аллергии к яду перепончатокрылых насекомых. РМЖ. 2019;3:40–44. [Shabanov D.V., Lazarenko L.L., Fedoskova T.G., Rybnikova E.A. Diagnostics of Hymenoptera venom allergy. RMJ. 2019;3:40–44 (in Russ.)]. DOI: 10.15789/1563-0625-2015-1-39-46.
20. Синельникова Н.А., Бычкова Н.В., Калинина Н.М. Особенности иммунного ответа и активации базофилов у детей с хронической крапивницей. Медицинская иммунология. 2015;1:39–46. [Sinelnikova N.A., Bychkova N.V., Kalinina N.M. Features of immune response and basophil activation in children with chronic urticaria. Meditsinskaya immunologiya. 2015;17:39–46 (in Russ.)]. DOI: 10.15789/1563-0625-2015-1-39-46.
21. Agarwal R. Severe asthma with fungal sensitization. Curr. Allergy Asthma Rep. 2011;11:403–413. DOI: 10.1007/s11882-011-0217-4.
22. Chotirmall S.H., Al-Alawi M., Mirkovic B. et al. Aspergillus-associated airway disease, inflammation, and the innate immune response. Biomed Res. Int. 2013;2013:723129. DOI: 10.1155/2013/723129.
23. Becerra-Díaz M., Wills-Karp M., Heller N.M. New perspectives on the regulation of type II inflammation in asthma. F1000Res. 2017;6:1014.
24. Margalit A., Kavanagh K. The innate immune response to Aspergillus fumigatus at the alveolar surface. FEMS Microbiol. Rev. 2015;39:670–687. DOI: 10.1093/femsre/fuv018.
25. Hartl D., Latzin P., Zissel G. et al. Chemokines indicate allergic bronchopulmonary aspergillosis in patients with cystic fibrosis. Am. J. Respir. Crit Care Med. 2006;173:1370–1376. DOI: 10.1164/rccm.200508-1271OC.
26. Latzin P., Hartl D., Regamey N. et al. Comparison of serum markers for allergicbronchopulmonary aspergillosis in cystic fibrosis. Eur. Respir. J. 2008;31:36–42. DOI: 10.1183/09031936.00078107.
27. Козлова Я.И., Фролова Е.В., Филиппова Л.В. и др. Диагностические маркеры аллергического бронхолегочного аспергиллеза. Медицинская иммунология. 2018;4:561–570. [Kozlova Y.I., Frolova E.V., Filippova L.V. et al. Diagnostic markers of allergic bronchopulmonary aspergillosis in patients with bronchial asthma. Meditsinskaya immunologiya. 2018;4:561–570 (in Russ.)]. DOI: 10.15789/1563-0625-2018-4-561-570.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
