Течение и исходы многоплодной беременности при монохориальной моноамниотической двойне
DOI: 10.32364/2618-8430-2023-6-1-6-12
Цель исследования: оценить течение и исходы многоплодной беременности при монохориальной моноамниотической (МХМА) двойне.
Материал и методы: было проведено проспективное исследование, в ходе которого изучены течение беременности и перинатальные исходы у 34 пациенток с МХМА-двойней (средний возраст 31,8±4,3 года). Оценены сроки родоразрешения и тактика ведения беременных с МХМА-двойней, перинатальные исходы и перинатальная смертность. Беременные с переплетением петель пуповин находились под динамическим наблюдением начиная с 16-й недели гестации, включающим УЗИ каждые 2 нед., после 26–28 нед. — 2–3 раза в неделю в сочетании с кардиотокографическим исследованием плодов.
Результаты исследования: отмечена высокая частота истмико-цервикальной недостаточности, которую выявили у 10 (29,4%) беременных с МХМА-двойней в сроки от 18 до 28 нед. гестации. Переплетение пуповин было диагностировано у 16 (47,1%) пациенток, фето-фетальный трансфузионный синдром (ФФТС) — у 2 (5,9%) пациенток, синдром анемии-полицитемии (САП) — у 1 (2,9%) пациентки. Антенатальные потери составили 6 (8,8%) из 68 плодов. Перинатальные потери при МХМА-двойне составили 7 (10,3%) из 68. Антенатальные и перинатальные потери при МХМА-двойне были обусловлены специфическими осложнениями: ФФТС, переплетением петель пуповины и гипоксией вследствие селективной задержки роста плода. Родоразрешены преждевременно были 29 (85,2%) беременных с МХМА-двойней. У 5 (14,7%) пациенток осложнения отсутствовали, беременность удалось пролонгировать до 36 нед. Практически все беременные (33 (97,1%)) были родоразрешены путем кесарева сечения.
Заключение: антенатальные и перинатальные потери при МХМА-двойне обусловлены специфическими осложнениями, что подтверждает необходимость тщательного динамического наблюдения пациенток с осложненной МХМА-беременностью в условиях перинатальных центров 3-го уровня. У всех беременных с МХМА-двойней рекомендуется проведение планового кесарева сечения. Досрочное оперативное родоразрешение ближе к 35-й неделе гестации при наличии осложнений позволяет повысить выживаемость плодов и тем самым улучшить перинатальные исходы. При отсутствии осложнений возможно пролонгирование беременности МХМА-двойней до 36-й недели с целью улучшения состояния новорожденных при родоразрешении.
Ключевые слова: многоплодная беременность, беременность монохориальной моноамниотической двойней; переплетение петель пуповин; неонатальный исход, фето-фетальный трансфузионный синдром, задержка роста плода, синдром анемии.
Для цитирования: Калашников С.А., Коноплянников А.Г., Воскобоева К.Ю., Семенова Л.Р., Кулакова И.С. Течение и исходы многоплодной беременности при монохориальной моноамниотической двойне. РМЖ. Медицинское обозрение. 2023;6(1):6-12. DOI: 10.32364/2618-8430-2023-6-1-6-12.
S.A. Kalashnikov1, A.G. Konoplyannikov1, K.Yu. Voskoboeva1, L.R. Semenova1, I.S. Kulakova2
1Pirogov Russian National Research Medical University, Moscow, Russian Federation
2Bashkir State Medical University, Ufa, Russian Federation
Aim: to evaluate the course and outcomes of monochorial monoamniotic (MCMA) twin pregnancy.
Patients and Methods: this prospective study included 34 patients (a mean age 31.8±4.3 years) with MCMA twins for assessing the course of pregnancy and perinatal outcomes. The authors evaluated such criteria as the timing of delivery and the prenatal management of MCMA-twin pregnancy, as well as the perinatal outcomes and mortality. Monitoring of the pregnant women with umbilical cord entanglement was started at 16 weeks of gestation and included ultrasound examination every two weeks and after 26–28 weeks of gestation — two or three times a week coupled with cardiotocography for fetal assessment.
Results: the study demonstrated a high prevalence of cervical insufficiency which was found in 10 (29.4%) MCMA twin pregnancies at 18 to 28 weeks of gestation. The diagnosis of umbilical cord entanglement was established in 16 (47.1%) patients, twin-twin transfusion syndrome (TTTS) – in 2 (5.9%) patients, and twin anemia-polycythemia syndrome (TAPS) – in 1 (2.9%) patient. The reported antenatal losses were 6 of 68 (8.8%) of fetuses. There were 7 perinatal losses of 68 MCMA-twin pregnancies (10.3%).
The antenatal and perinatal losses in MCMA twins were caused by the following specific complications: TTTS, cord entanglement and hypoxia due to the selective intrauterine growth restriction (sIUGR). A preterm operative delivery was used in 29 (85.2%) patients with MCMA twins. Five (14.7%) patients did not have complications and it was possible to prolong the pregnancy to 36 weeks. Caesarean sections were carried out almost for all the pregnant women (33 (97.1%)).
Conclusion: the antenatal and perinatal losses in MCMA twins are caused by the specific complications. These findings prove that patients with complicated MCMA twin pregnancies need to have a careful monitoring in Level III perinatal centers. Planned caesarean sections are recommended for all MCMA twin pregnancies. If complications are detected, a preterm operative delivery closer to week 35 of gestation will enable to increase the fetal survival rates and thus to improve the perinatal outcomes. Uncomplicated MCMA twin pregnancies can be prolonged to week 36 for improving the condition of newborn babies at the time of delivery.
Keywords: multifetal pregnancy, monochorial monoamniotic twin pregnancy, umbilical cord entanglement, neonatal outcome, twin-twin transfusion syndrome, selective intrauterine growth restriction, twin anemia-polycythemia syndrome.
For citation: Kalashnikov S.A., Konoplyannikov A.G., Voskoboeva K.Yu. et al. The course and outcomes of monochorial monoamniotic twin pregnancy. Russian Journal of Woman and Child Health. 2023;6(1):6–12 (in Russ.). DOI: 10.32364/2618-8430-2023-6-1-6-12.
Введение
Проблема многоплодия в настоящее время является крайне актуальной в связи с увеличением его распространенности из-за широкого внедрения вспомогательных репродуктивных технологий (ВРТ) [1]. Частота наступления беременности монохориальной моноамниотической (МХМА) двойней составляет около 1% от всех многоплодных беременностей и 0,01% — от всех спонтанных беременностей [2–4]. Частота родов МХМА-двоен варьирует от 1 на 5000 до 1 на 25 000 родов [5, 6]. МХМА-двойни появляются вследствие деления бластоцисты на 9–12-й день после оплодотворения [2, 7].
При МХМА-двойне в одной амниотической полости развиваются два плода с единой плацентой [4]. Высокая частота антенатальной гибели МХМА-двоен, достигающая 8–42%, обусловлена как общими для всех монохориальных двоен специфическими осложнениями (фето-фетальный трансфузионный синдром (ФФТС), синдром обратной артериальной перфузии (СОАП), синдром анемии-полицитемии (САП), синдром селективной задержки роста плода (ЗРП )), так и высокой вероятностью переплетения петель пуповин и врожденных аномалий плодов [2, 3, 8–14]. Ввиду малого числа наблюдений в современных исследованиях отсутствует общепринятый алгоритм ведения беременности МХМА-двойней.
Цель исследования: оценить течение и исходы многоплодной беременности при МХМА-двойне.
Материал и методы
За период с 2012 по 2022 г. на базе ГБУЗ ЦПСиР ДЗМ (Москва) и Клинического госпиталя MD GROUP (АО «МД ПРОЕКТ 2000») нами было проведено проспективное исследование, в ходе которого изучены течение беременности и перинатальные исходы у 34 пациенток с МХМА-двойней в возрасте от 21 до 41 года (средний возраст 31,8±4,3 года). У 31 (91,2%) пациентки беременность наступила спонтанно; у 3 (8,8%) — после экстракорпорального оплодотворения (ЭКО). Все беременные подписывали информированное согласие на проведение обследования.
Критерии включения: беременность МХМА-двойней, наступившая как спонтанно, так и после ВРТ. Критерий невключения: «сиамские» (неразделившиеся) близнецы.
Диагностика МХМА-двойни в I триместре основывалась на визуализации двух плодных яиц и одного хориона, а также на отсутствии межамниотической перегородки по данным УЗИ. У всех 34 беременных при скрининговых исследованиях маркеры хромосомной патологии не выявлены.
Беременные с переплетением петель пуповин находились под тщательным динамическим наблюдением начиная с 16-й недели гестации, включающим УЗИ каждые 2 нед., после 26–28 нед. — УЗИ 2–3 раза в неделю в сочетании с кардиотокографическим (КТГ) исследованием плодов. УЗИ выполнялось с помощью приборов Acuson 128/10 ХР и Logic 500 (США). Для проведения КТГ использовался аппарат Sonicaid Team.
Для статистической обработки данных применяли пакет программ IBM SPSS Statistics 23.
Результаты исследования
Угроза прерывания беременности отмечалась у 21 (61,8%) беременной с МХМА-двойней: в I триместре — у 5 (14,7%), во II — у 16 (47,1%), что потребовало стационарного лечения 11 (68,8%) из 16 женщин. Железодефицитная анемия в I и II триместрах диагностирована у 12 (35,3%) и у 9 (26,4%) пациенток соответственно.
Обращала на себя внимание высокая частота истмико-цервикальной недостаточности (ИЦН), которую отмечали у 10 (29,4%) беременных с МХМА-двойней в сроки от 18 до 28 нед. гестации. У 8 (23,5%) беременных была выполнена коррекция (серкляж, акушерский пессарий, микронизированный вагинальный прогестерон), что позволило пролонгировать беременность в среднем на 9±4 нед. гестации.
Преэклампсия умеренной степени тяжести диагностирована у 1 (2,9%) беременной с МХМА-двойней, холестаз — у 2 (5,9%) беременных, гестационный сахарный диабет, не требующий инсулинотерапии, — у 3 (8,8%), многоводие — у 2 (5,9%), маловодие — у 4 (11,8%).
Задержка роста одного плода (снижение предполагаемой массы плода (ПМП)) менее 10-го перцентиля нормативов физического развития для многоплодной беременности) отмечена у 2 (5,9%) пациенток. Клинически значимый дискордантный рост плодов (разница в ПМП 20% и более) по данным фетометрии к моменту родоразрешения диагностирован у 3 (8,8%) беременных с МХМА-двойней, селективная ЗРП (разница в массе плодов более 25% при задержке роста одного плода с ПМП менее 10-го перцентиля, интермитентный кровоток в артерии пуповины плода с задержкой роста) — у 1 (2,9%) беременной.
В ходе исследования ФФТС был выявлен у 2 (5,9%) пациенток. При этом одна из двух беременных с ФФТС обратилась за специализированной помощью в наше учреждение в срок 28 нед. гестации с антенатально погибшим плодом. У другой пациентки с бесплодием в анамнезе и первой беременностью после ЭКО, сопровождавшейся угрозой прерывания и ИЦН (наложены швы на шейку матки), по данным УЗИ выявлена легкая степень ФФТС (I стадия по Quintero), что не потребовало фетоскопической коагуляции анастомозов. Несмотря на динамическое УЗ-наблюдение, у нее также произошла антенатальная гибель одного плода, причиной которой был не ФФТС, а острая гипоксия плода вследствие селективной ЗРП; околоплодные воды у пациентки были мекониальные; при морфологическом исследовании последа выявлен вариант промежуточных дифференцированных ворсин.
Синдром анемии-полицитемии был выявлен у 1 (2,9%) беременной с МХМА-двойней, лазерная коррекция синдрома не проводилась. Пациентка родоразрешена оперативно в срок 32 нед. гестации, оба ребенка выжили, масса тела новорожденных составила 1660 и 1960 г, уровень гемоглобина — 129 и 142 г/л соответственно.
У 1 беременной в срок 20 нед. гестации у одного плода из МХМА-двойни по данным УЗИ диагностированы множественные пороки развития. После консилиума врачей с привлечением детского хирурга и получения согласия родителей было принято решение о проведении фетоскопии с коагуляцией сосудов пуповины плода, после которой беременность вторым плодом была пролонгирована до 37 нед. гестации. Родился новорожденный массой 3400 г, погибший плод был аморфным.
Переплетение пуповин диагностировано в 16 (47,1%) наблюдениях. У 14 (87,5%) из 16 беременных с переплетением петель пуповин, родоразрешенных в сроки 32–35 нед. гестации путем кесарева сечения (КС), родились живые дети (см. рисунок). Несмотря на интенсивное наблюдение, антенатально погибли 3 плода у 2 пациенток (29 и 30 лет). В указанных случаях отмечали многократное переплетение между собой петель пуповины с образованием множества узлов. Беременности наступили после ЭКО, сопровождались угрозой прерывания на протяжении всего срока беременности и ИЦН (вводился акушерский пессарий). У 1 пациентки в срок 29 нед. гестации погибли оба плода, у другой в срок 36 нед. — один плод, так как в начале исследования (2012–2016 гг.) при переплетении петель пуповин мы пытались пролонгировать беременность до 36 нед. для достижения зрелости плодов.
Итого антенатальные потери в нашем исследовании, включая эвтаназию нежизнеспособного плода с множественными пороками развития, составили 8,8% (6 из 68).
Родоразрешены преждевременно были 29 (85,2%) беременных с МХМА-двойней. В сроки 32–34 нед. гестации были родоразрешены 11 (32,3%) женщин, в 34–36 нед. — 16 (47,1%). В срок 28 нед. оперативно родоразрешена поздно обратившаяся в стационар беременная с ФФТС, антенатально погибшим одним плодом и отслойкой нормально расположенной плаценты. В срок 29 нед. гестации была родоразрешена пациентка, у которой антенатально погибли оба плода.
Отдельно стоит выделить 5 (14,7%) пациенток с неосложненной беременностью МХМА-двойней (по данным УЗИ были исключены ФФТС и переплетение петель пуповин), которым на ранних этапах нашей работы (2012–2016 гг.) удалось пролонгировать беременность до 36 нед. Все 10 детей родились в удовлетворительном состоянии и не требовали реанимационных мероприятий, асфиксии и дыхательных расстройств не выявлено.
Практически все (33 (97,1%)) беременные были родоразрешены путем КС, кроме одной пациентки, у которой антенатально погибли оба плода. Пациентка была родоразрешена через естественные родовые пути (индуцирована родовая деятельность) в срок 29 нед. гестации.
Объем кровопотери в родах при МХМА-двойне варьировал от 500 до 1400 мл, в среднем составляя 661,4±173,7 мл. Гипотоническое кровотечение в объеме 1400 мл развилось после планового КС лишь у 1 (3%) первородящей пациентки с САП и наследственной тромбофилией, ей проведена реинфузия аутоэритроцитов (500 мл) с помощью аппарата Cell Saver.
По данным морфологического исследования последов у беременных с МХМА-двойней прикрепление пуповин было центральным или парацентральным, расстояние между пуповинами варьировало от 1 до 5 см.
Всего родились живыми 62 (91,2%) ребенка. В состоянии умеренной асфиксии родились 8 (12,9%) из 62 детей, практически все (7 из 8) — в сроки 28–35 нед. беременности. Дыхательные расстройства различной степени выраженности были выявлены у 29 (46,8%) детей из МХМА-двоен, 26 (89,7%) из 29 рождены в сроки 28–35 нед. гестации. В связи с дыхательной недостаточностью в искусственной вентиляции легких нуждались 10 (16,1%) новорожденных, во вспомогательной вентиляции с постоянным положительным давлением — 19 (30,6%); при этом 20 (68,9%) из 29 рождены в сроки 32–34 нед. Маловесными к сроку гестации родились 5 (8,1%) детей.
Гипоксически-ишемические поражения центральной нервной системы (ЦНС) обнаружены у 20 (32,3%) детей из МХМА-двоен, преимущественно у рожденных в 30–33 нед. гестации; внутрижелудочковые кровоизлияния (ВЖК) 2-й степени — у 1 (1,6%) ребенка, рожденного в срок 28 нед. гестации путем экстренного КС. Неонатальная желтуха выявлена у 10 (16,1%) из 62 новорож-денных, преходящая ишемия миокарда — у 7 (11,3%), анемия — у 4 (6,5%), а также некротизирующий энтероколит — у 4 (6,5%) детей с хронической внутриутробной гипоксией, рожденных в сроки 28–32 нед. гестации, что подтверждает целесообразность уточнения оптимальных сроков родоразрешения пациенток с МХМА-двойней.
У 7 (11,3%) из 62 детей были диагностированы врожденные пороки развития (дефект межжелудочковой перегородки, атрезия легочной артерии 2-го типа, мальпозиция магистральных сосудов, атрезия левого наружного слухового прохода).
Постнатально погиб 1 (1,6%) ребенок, рожденный на 35-й неделе гестации. Причиной смерти явились недоношенность, ЗРП, дыхательная недостаточность и внутриутробная инфекция. Перинатальные потери при МХМА-двойне составили 7 (10,3%) из 68.
Обсуждение
Известно, что многоплодная беременность МХМА-двойней характеризуется высокой частотой гестационных осложнений [3, 11–14]. При этом благодаря протективному действию артерио-артериальных анастомозов при МХМА-двойне частота такого специфического осложнения, как ФФТС, ниже, чем при монохориальной диамниотической двойне (2–6 и 9–15% соответственно) [2, 6, 8, 10, 15]. Низкая частота ФФТС при МХМА-двойне подтверждена и в нашей работе — 5,9% (2 из 34). Дискутабельной на сегодня остается проблема выбора тактики ведения беременных с МХМА-двойней и ФФТС, вопрос о необходимости коррекции ФФТС при МХМА-двойне все еще открыт.
В нашем исследовании коррекция ФФТС не проводилась ни в одном из двух наблюдений, так как одна беременная с ФФТС обратилась за специализированной помощью в срок 28 нед. гестации с антенатально погибшим плодом, у другой — по данным УЗИ выявлена легкая степень ФФТС (I стадия по Quintero), не требующая коррекции, а плод погиб от острой гипоксии вследствие селективной ЗРП.
Наши данные о неблагоприятных исходах беременности МХМА-двойней, осложненной ФФТС, не противоречат результатам, полученным D. Murgano et al. [16], согласно которым коррекция ФФТС не улучшает исход по сравнению с ее отсутствием (27 и 25% соответственно, р>0,05).
В то же время при развитии САП, по данным литературы, подтверждена возможность использования выжидательной тактики у беременных с МХМА-двойней [17]. Однако есть мнение, что исходы беременности, осложненной САП, как для доноров, так и для реципиентов, зависят исключительно от успешности лазерной коррекции синдрома [18]. В нашем исследовании у беременной с САП, которой лазерная коррекция синдрома не проводилась, исход оказался благоприятным — пациентка оперативно родоразрешена в срок 32 нед. гестации, оба ребенка выжили. Однако стоит отметить, что ограничением нашего исследования является оценка единичного случая.
Известно, что при осложненном течении беременности МХМА-двойней с наличием множественных врожденных пороков развития плода проводится лазерная коагуляция сосудов пуповины с целью эвтаназии нежизнеспособного плода [9, 16, 19–21]. В нашем исследовании у беременной в срок 20 нед. гестации у одного плода из МХМА-двойни по данным УЗИ диагностированы множественные пороки развития. Проведение фетоскопии с коагуляцией сосудов пуповины плода позволило пролонгировать беременность вторым плодом до 37-й недели гестации.
Одним из частых осложнений беременности МХМА-двойней является переплетение петель пуповин, что может привести к значительной компрессии сосудов и, как следствие, к внутриутробной гибели обоих плодов [6, 22]. По данным разных авторов, формирование узлов или переплетения пуповин плодов в первой половине беременности связано прежде всего с большой подвижностью плодов в общей амниотической полости [23–25]. Возможности УЗ-диагностики во второй половине беременности позволяют диагностировать две близко расположенные пуповины, не смещающиеся при движениях плодов и смене положения тела беременной, однако в первой половине беременности это осложнение выявить сложнее [23].
Переплетение петель пуповин в нашем исследовании диагностировано у 47,1% пациенток, частота антенатальной гибели плодов при этом осложнении — 9,4%, что согласуется с данными литературы — 42–95 и 8–42% соответственно [22, 24–25].
Итак, антенатальные потери при МХМА-двойне в нашей работе составили 8,8%, что не противоречит результатам других авторов — 3–12% [4, 26].
Еще одной обсуждаемой в литературе проблемой являются сроки родоразрешения при МХМА-двойне, но единого мнения по данному вопросу в настоящее время нет [26, 27]. Учитывая высокие риски антенатальных потерь, обусловленных переплетением петель пуповин, большинство специалистов у беременных с МХМА-двойней рекомендуют плановое оперативное родоразрешение в 32–34 нед. беременности после проведения курса антенатальной профилактики респираторного синдрома плодов [4, 28–30].
В нашей работе в 2012–2016 гг. с целью достижения зрелости плодов осуществлялась попытка пролонгировать беременность до 36 нед. гестации. Неблагоприятный исход отмечен у одной пациентки с переплетением петель пуповин, у которой в срок 36 нед. гестации антенатально погиб один плод. У других беременных с переплетением петель пуповин, родоразрешенных в сроки 32–35 нед. гестации путем КС (n=14), родились живые дети. Также благоприятный исход отмечен у всех 5 пациенток с неосложненной беременностью МХМА-двойней (не выявлено переплетения петель пуповин, ФФТС, САП, селективной ЗРП), родоразрешенных в 36 нед., — асфиксии и дыхательных расстройств у новорожденных не было.
Важной проблемой ведения беременности МХМА-двойней, помимо сроков, является метод родоразрешения. Из-за риска гибели плодов при переплетении петель пуповин во время родов и опасности развития острого интранатального ФФТС при выборе метода родоразрешения у большинства (97,1%) беременных с МХМА-двойней мы отдавали предпочтение операции КС. В этом вопросе наше мнение совпадает с мнением большинства авторов [7, 26, 27].
Следовательно, беременных с МХМА-двойней при отсутствии ФФТС и переплетения петель пуповин можно родоразрешать путем КС позже рекомендуемых сроков (32–34 нед.) и пролонгировать беременность до 36-й недели с целью улучшения состояния новорожденных. При переплетении петель пуповин родоразрешение целесообразно проводить оперативно досрочно, ближе к 35-й неделе гестации, что позволяет повысить выживаемость плодов и тем самым улучшить перинатальные исходы.
Известно, что новорожденные из МХМА-двоен по причине ранних сроков гестации при рождении характеризуются высокой частотой ВЖК, некротизирующего энтероколита, преходящей ишемии миокарда и гипоксически-ишемических поражений ЦНС — 14,5–24,9% [16, 27], что согласуется с нашими данными (1,6, 6,5, 11,3 и 32,3% соответственно) и подтверждает целесообразность уточнения оптимальных сроков родоразрешения пациенток с МХМА-двойней.
Врожденные пороки развития диагностированы нами у 11,3% детей, это реже, чем по данным литературы — 15,7–23,3% [13, 14, 26], и доказывает важность своевременного обследования беременных с МХМА-двойней с целью диагностики пороков развития плода.
Частота перинатальных потерь при МХМА-двойне в нашем исследовании (10,3%) соответствовала данным литературы (6,6–12,4%) [4, 26].
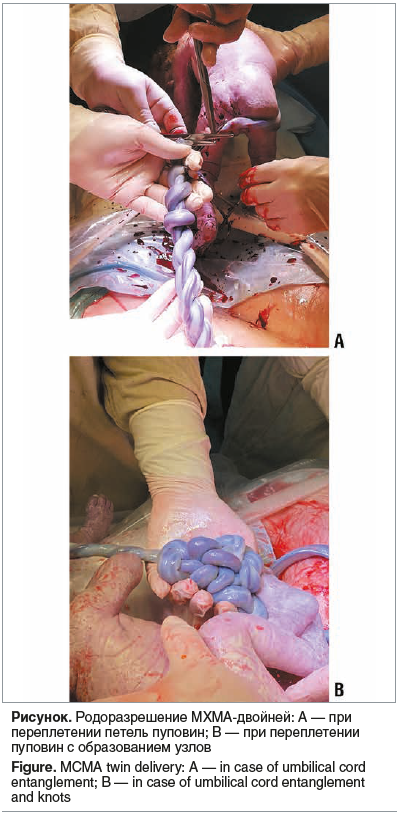
Заключение
Антенатальные и перинатальные потери (8,8 и 10,3% соответственно) при МХМА-двойне обусловлены в основ-ном специфическими осложнениями (ФФТС, переплетение петель пуповины и гипоксия вследствие селективной ЗРП), что подтверждает необходимость тщательного динамического наблюдения пациенток с осложненной МХМА-беременностью в условиях перинатальных центров 3-го уровня. Вопрос о применении лазерной коагуляции анастомозов при необходимости коррекции ФФТС и САП при МХМА-двойне требует дальнейшего изучения.
У всех беременных с МХМА-двойней рекомендуется проведение планового КС. Досрочное оперативное родоразрешение ближе к 35-й неделе гестации при наличии осложнений (переплетение петель пуповины, ФФТС, САП, селективная ЗРП) позволяет повысить выживаемость плодов и тем самым улучшить перинатальные исходы.
При отсутствии ФФТС, переплетения петель пуповин и других осложнений возможно пролонгирование беременности МХМА-двойней до 36-й недели с целью улучшения состояния новорожденных при родоразрешении.
Частота пороков развития у новорожденных из МХМА-двоен составляет 11,3%. При выявлении множественных пороков развития у одного из плодов целесообразно рассмотрение вопроса о проведении селективного фетоцида методом фетоскопии с коагуляцией сосудов пуповины, позволяющего пролонгировать беременность вторым плодом, однако эффективность и безопасность метода требуют дальнейшего изучения.
Сведения об авторах:
Калашников Сергей Аркадьевич — к.м.н., доцент кафедры акушерства и гинекологии педиатрического факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-2658-5417.
Коноплянников Александр Георгиевич — д.м.н., профессор кафедры акушерства и гинекологии педиатрического факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-9923-8833.
Воскобоева Ксения Юрьевна — клинический ординатор кафедры акушерства и гинекологии педиатрического факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-4484-2229.
Семенова Лейла Рамазановна — клинический ординатор кафедры акушерства и гинекологии педиатрического факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-4201-5588.
Кулакова Ираида Сахаветовна — клинический ординатор кафедры акушерства и гинекологии ФГБОУ ВО БГМУ Минздрава России; 450008, Россия, г. Уфа, ул. Ленина, д. 3; ORCID iD 0000-0002-2717-8218.
Контактная информация: Калашников Сергей Аркадьевич, e-mail: homeksa@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 16.12.2022.
Поступила после рецензирования 16.01.2023.
Принята в печать 30.01.2023.
About the authors:
Sergey A. Kalashnikov — C. Sc. (Med.), associate professor of the Department of Obstetrics and Gynecology of the Pediatric Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-2658-5417.
Aleksandr G. Konoplyannikov — Dr. Sc. (Med.), Professor of the Department of Obstetrics and Gynecology of the Pediatric Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0001-9923-8833.
Kseniya Yu. Voskoboeva — resident of the Department of Obstetrics and Gynecology of the Pediatric Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-4484-2229.
Leila R. Semenova — resident of the Department of Obstetrics and Gynecology of the Pediatric Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-4201-5588.
Iraida S. Kulakova — resident of the Department of Obstetrics and Gynecology, Bashkir State Medical University; 3, Lenin str., Ufa, 450008, Russian Federation; ORCID iD 0000-0002-2717-8218.
Contact information: Sergey A. Kalashnikov, e-mail: homeksa@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 16.12.2022.
Revised 16.01.2023.
Accepted 30.01.2023.
2. Айтов А.Э., Башмакова Н.В., Третьякова Т.Б. и др. Полиморфизм генов ангиогенеза и сосудистого тонуса у женщин с монохориальной многоплодной беременностью, осложненной фето-фетальным трансфузионным синдромом. Российский вестник акушера-гинеколога. 2018;4(18):16–20. DOI: 10.17116/rosakush201818416.
3. Прибушеня О.В., Лазаревич А.А. Монохориальная тройня с синдромом обратной артериальной перфузии близнецов. Акушерство и гинекология. 2021;11:278–285. DOI: 10.18565/aig.2021.11.278-285.
4. D'Antonio F., Odibo A., Berghella V. et al. Perinatal mortality, timing of delivery and prenatal management of monoamniotic twin pregnancy: systematic review and meta-analysis. Ultrasound Obstet Gynecol. 2019;53(2):166–174. DOI: 10.1002/uog.20100.
5. Ярыгина Т.А., Классен А.А., Трифонова Е.В., Батаева Р.С. Монохориальная двойня с близким прикреплением пуповин к плаценте (обзор литературы и клинические наблюдения). Ультразвуковая и функциональная диагностика. 2017;2:25–32.
6. Романовский А.Н., Михайлов А.В., Каштанова Т.А. и др. Монохориальное моноамниотическое многоплодие — основные осложнения и подходы к ведению беременности. Акушерство и гинекология Санкт-Петербурга. 2019;1:14–16.
7. Zhang C.Y., Wei Y., Zhao Y.Y. Clinical characteristics and outcomes of monochorionic monoamniotic twin pregnancy. Zhonghua Fu Chan Ke Za Zhi. 2020;55(9):627–632 (in Chinese). DOI: 10.3760/cma.j.cn112141-20200531-00462.
8. Маркова Т.В., Косовцова Н.В., Куклин Е.С. и др. Современные представления о синдроме анемии-полицитемии при монохориальном многоплодии (TAPS). Акушерство и гинекология. 2019;7:24–29. DOI: I0.18565/aig.2019.7.24-29.
9. Косовцова Н.В., Поспелова Я.Ю., Павличенко М.В. и др. Опыт хирургической коррекции синдрома фето-фетальной трансфузии при беременности моноамниотической двойней. Российский вестник акушера-гинеколога. 2022;22(1):85–88. DOI: 10.17116/rosakush20222201185.
10. Некрасова Е.С. Стандартизация ультразвукового исследования при монохориальной двойне в центрах первого и второго уровней. Журнал акушерства и женских болезней. 2017;66(3):105–109. DOI: 10.17816/JOWD663105-109.
11. Кузнецов А.А., Халиков А.Д., Семенова М.Д. и др. Магнитно-резонансная томография в диагностике и оценке состояния выжившего плода при синдроме гибели одного плода из монохориальной двойни. Трансляционная медицина. 2020;7(4):61–73. DOI: 10.18705/2311-4495-2020-7-4-61-73.
12. Костюков К.В., Гладкова К.А. Перинатальные исходы при монохориальной многоплодной беременности, осложненной синдромом селективной задержки роста плода. Акушерство и гинекология. 2020;6:50–58. DOI: 10.18565/aig.2020.6.50-58.
13. Shields L.B.E., Peppas D.S., Rosenberg E. Cloacal Anomalies in Monoamniotic, Monochorionic Twins with Complete Urinary Tract Obstruction. Urol Int. 2019;103(3):369–371. DOI: 10.1159/000494566.
14. Abreu-Ramírez M.G., García-Gutiérrez I., Seoane-Reula M.E., Infante S. Food protein-induced enterocolitis syndrome in monochorial monoamniotic twins. Ann Allergy Asthma Immunol. 2021;127(2):274–275. DOI: 10.1016/j.anai.2021.05.006.
15. Jha P., Morgan T.A., Kennedy A. US Evaluation of twin pregnancies: Importance of Chorionicity and Amnionicity. Radiographics. 2019;39(7):2146–2166. DOI: 10.1148/rg.2019190042.
16. Murgano D., Khalil A., Prefumo F. et al. Outcome of twin-to-twin transfusion syndrome in monochorionic monoamniotic twin pregnancy: systematic review and meta-analysis. Ultrasound Obstet Gynecol. 2020;55(3):310–317. DOI: 10.1002/uog.21889.
17. Hill K.M., Masoudian P., Fung-Kee-Fung K., El Demellawy D. Intrauterine Interventions for the Treatment of Twin Anemia-Polycythemia Sequence: A Systematic Review. J Obstet Gynaecol Can. 2019;41(7):981–991. DOI: 10.1016/j.jogc.2018.04.005.
18. Bahtiyar M.O., Ekmekci E., Demirel E. et al. In utero Partial Exchange Transfusion Combined with in utero Blood Transfusion for Prenatal Management of Twin Anemia-Polycythemia Sequence. Fetal Diagn Ther. 2019;45(1):28–35. DOI: 10.1159/000486198.
19. Косовцова Н.В., Башмакова Н.В., Маркова Т.В., Потапов Н.Н. Селективный фетоцид при осложненном течении беременности монохориальной двойней или дихориальной тройней с использованием лазерной коагуляции сосудов пуповины. Российский вестник акушера-гинеколога. 2016;16(1):45–50. DOI: 10.17116/rosakush201616145-50.
20. Sung C.A., Lin T.Y., Lee H.N. et al. Maternal outcome of selective feticide due to fetal anomaly in late trimester: A retrospective 10 years' experience in Taiwan. J Chin Med Assoc. 2022;85(2):212–215. DOI: 10.1097/JCMA.0000000000000610.
21. Wu T., Chen Z., Yin X. et al. Perinatal outcomes after selective feticide via umbilical cord occlusion in complicated monochorionic pregnancies: A systematic review and meta-analysis. Prenat Diagn. 2022;42(1):37–48. DOI: 10.1002/pd.6064.
22. Whittum M., Ros S.T. Umbilical Cord Entanglement. Neoreviews. 2022;23(3):e216–e220. DOI: 10.1542/neo.23-3-e216.
23. Шелаева Е.В., Прохорова В.С., Аржанова О.Н. и др. Переплетение пуповин при монохориальной моноамниотической двойне. Журнал акушерства и женских болезней. 2016;65(3):75–78. DOI: 10.17816/JOWD65375-78.
24. Sherer D.M., Roach C., Soyemi S., Dalloul M. Current Perspectives of Prenatal Sonographic Diagnosis and Clinical Management Challenges of Complex Umbilical Cord Entanglement. Int J Womens Health. 2021;13:247–256. DOI: 10.2147/IJWH.S285860.
25. Nkwabong E., Njikam F., Kalla G. Outcome of pregnancies with marginal umbilical cord insertion. J Matern Fetal Neonatal Med. 2021;34(7):1133–1137. DOI: 10.1080/14767058.2019.1628206.
26. Van Mieghem T., Abbasi N., Shinar S. et al. Monochorionic monoamniotic twin pregnancies. Am J Obstet Gynecol MFM. 2022;4(2S):100520. DOI: 10.1016/j.ajogmf.2021.100520.
27. Segal N.L. The 16th International Twin Congress: Highlights from Madrid/Twin Research: Twin Study of Partner Aggression; ABO Incompatibility in Dizygotic Twins; Growth Discordance in a Monoamniotic Twin Pair; Quick Note on Twin Implantation/In the Media: Long-Lost Twins Found; NASA Twin Experiment; Twin Brothers and the Las Vegas Attack; Retired Twin Airline Pilots; Twin Film Clips. Twin Res Hum Genet. 2018;21(1):67–72. DOI: 10.1017/thg.2017.70.
28. Многоплодная беременность. Клинические рекомендации. 2021. (Electronic resource.) URL: https://roag-portal.ru/recommendations_obstetrics?ysclid=lafkti0845523483691 (дата обращения: 14.11.2022).
29. Bibbo C., Easter S.R., Saadeh M. et al. Timing of Antenatal Corticosteroid Administration in Monoamniotic Twins. AJP Rep. 2019;9(2):e153–e159. DOI: 10.1055/s-0039-1687872.
30. MONOMONO Working Group. Inpatient vs outpatient management and timing of delivery of uncomplicated monochorionic monoamniotic twin pregnancy: the MONOMONO study. Ultrasound Obstet Gynecol. 2019;53(2):175–183. DOI: 10.1002/uog.19179.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
